修回日期: 2011-03-27
接受日期: 2011-04-11
在线出版日期: 2011-04-28
目的: 初步探讨皮下注射一种新的酸性成纤维细胞生长因子(acidic fibroblast growth factor, aFGF)片段-[Ala]16-aFGF(1-29)对慢传输型便秘(slow transit constipation, STC)模型小鼠便秘的治疗作用及其可能的作用途径.
方法: 60只ICR小鼠随机分为实验组(n = 30)和对照组(n = 30), 通过皮下注射盐酸吗啡[2.5 mg/(kg•d), 45 d]的方法建立肠道STC模型. 成模后各组剩余小鼠再随机分为两组, 记为实验1组、实验2组、对照1组及对照2组(各组12只), 其中实验1组及对照1组小鼠予皮下注射[Ala]16-aFGF(1-29)(300 μg/kg, 每周2次, 共8 wk), 实验2组及对照2组则予等量的溶解液同样处理, 实验过程及结束后观察各组小鼠粪便性状变化并测定肠道推进率. 处死后的小鼠取结肠组织, 以免疫组织化学染色及Western blot检测对照组及实验组药物干预前后结肠组织肌间丛神经元特异性烯醇化酶(neuron specific enolase, NSE)的表达.
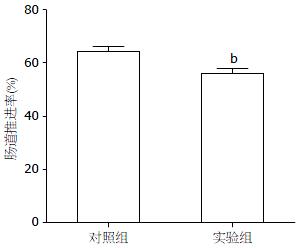
结果: 实验第45天, 实验组小鼠粪便较对照组明显干硬; 且肠道推进率和NSE表达水平均较对照组明显减少(63.422%±1.791% vs 55.702%±1.806%; NSE mRNA: 1.18800±0.03176 vs 0.88730±0.03554; NSE蛋白: 0.90520±0.02268 vs 0.71300±0.01654, 均P<0.05或0.01), 判定STC模型建立. 药物干预8 wk后, 实验1组小鼠粪便渐变为类似于对照组的香肠样软便; 肠道推进率及结肠组织NSE的表达均较实验2组明显改善(62.250%±5.283% vs 57.190%±4.291%; NSE mRNA: 0.6543±0.0069 vs 0.4193±0.0158; NSE蛋白: 0.5823±0.0190 vs 0.5171±0.0124, 均P<0.05), 但与对照组之间无显著统计学差异.
结论: [Ala]16-aFGF(1-29)慢性皮下注射可明显改善STC小鼠的便秘症状及肠道推进率, 其对肠神经系统的修复保护作用可能是其作用机制之一.
引文著录: 胡小丹, 李学良, 沙杰, 张爱青, 林琳. [Ala]16-aFGF(1-29)对慢传输型便秘小鼠的治疗作用. 世界华人消化杂志 2011; 19(12): 1251-1256
Revised: March 27, 2011
Accepted: April 11, 2011
Published online: April 28, 2011
AIM: To investigate the potential therapeutical effect of a new acidic fibroblast growth factor (aFGF) fragment - [Ala]16-aFGF(1-29) against slow transit constipation (STC) in mice and to explore possible mechanisms involved.
METHODS: Sixty ICR mice were divided randomly and equally into test group and control group. A mouse model of STC was established by subcutaneous injection (SC) of morphine [2.5 mg/(kg•d)] for 45 days. The control group was treated with normal saline for the same duration. The fecal character was observed according to the Bristol Stool Form Scale (BSFS), and only mice producing stools conforming to BSFS 1 and 2 were used as STC models. On day 45, six mice were chosen randomly from each group and used to confirm if STC was successfully induced by charcoal propulsion test. The rest mice in each group were divided into test group 1, test group 2, control group 1, and control group 2 (n = 12 each). The test group 1 and control group 1 were treated with [Ala]16-aFGF(1-29) (300 µg/kg each time, SC) twice per week for 8 weeks, while the test group 2 and control group 2 were treated with the same volume of vehicle. Fecal character was observed in all mice. Eight weeks later, the intestinal propulsion rate (IPR) in mice of each group was measured and the expression of neuron-specific enolase (NSE, a neuronal maker) in the colon was detected by immunohistochemistry and Western blot.
RESULTS: On day 45, the feces in the test group was drier and harder (BSFS 1 and 2) than the control group (BSFS 4 and 5). Both the IPR and expression level of NSE in the test group were significantly lower than those in the control group (63.422% ± 1.791% vs 55.702% ± 1.806%, 1.18800 ± 0.03176 vs 0.88730 ± 0.03554, 0.90520 ± 0.02268 vs 0.71300 ± 0.01654, all P < 0.05 or 0.01). Eight weeks after treatment, the feces in the test group 1 gradually became as smooth and soft (BSFS 4 and 5) as that in the control groups 1 and 2; the IPR and expression level of NSE in colonic tissue in the test group 1 were obviously improved compared to the test group 2 (62.250% ± 5.283% vs 57.190% ± 4.291%, 0.6543 ± 0.0069 vs 0.4193 ± 0.0158, 0.5823 ± 0.019 vs 0.5171 ± 0.0124, all P < 0.05) but showed no significant difference with those in the control groups 1 and 2.
CONCLUSION: Treatment with [Ala]16-aFGF (1-29) improved constipation symptoms and IPR in STC mice at least partially by protection of the enteric nervous system.
- Citation: Hu XD, Li XL, Sha J, Zhang AQ, Lin L. Effect of subcutaneous injection of [Ala]16-aFGF(1-29) on slow transit constipation in mice. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1251-1256
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1251.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1251
慢传输型便秘(slow transit constipation, STC)是以结肠动力减弱为特征的顽固性便秘, 其病因复杂, 发病机制尚不清楚, 在治疗方面长期依赖各种泻剂的使用, 效果不佳[1-3]. 肠神经系统(enteric nervous system, ENS)病变与STC的形成及进展密切相关[4-6]. 酸性成纤维细胞生长因子(acidic fibroblast growth factor, aFGF)是一种由154个氨基酸组成的具有促进纤维细胞生长的活性多肽, 具有营养及促进神经修复的功能[7,8], 研究亦发现其可能在结肠神经系统发挥着某些重要生理功能[9-11]. 因此, 我们推测该物质可能对STC的神经病变具有一定的治疗作用. [Ala]16-aFGF(1-29)是一种新的aFGF活性片段, 本课题组前期的实验结果显示他与aFGF大分子具有相同的生物活性[12], 但其分子量小, 易于合成, 在给以生物体用药时更易被吸收利用, 并大大减少不良反应, 具有更实际的临床应用前景. 本研究初步探讨了该物质对STC小鼠的治疗作用及其可能的作用途径.
60只清洁级ICR小鼠购自上海斯莱克实验动物中心. 盐酸吗啡购自沈阳第一制药厂. [Ala]16-aFGF(1-29)粉剂购自Peptide Institute Inc(Osaka Japan). NSE兔抗小鼠多克隆抗体购自Abcam生物技术公司. 辣根过氧化物酶标记的二抗购自晶美生物工程有限公司.
1.2.1 分组及造模: 将60只清洁级ICR小鼠随机分为实验组和对照组(n = 30), 实验组皮下注射盐酸吗啡2.5 mg/(kg•d), 共45 d, 建立STC模型[13-15]; 对照组以等量生理盐水同样处理. 测定肠道推进率(每组随机取6只小鼠), 若实验组小鼠肠道推进率较对照组降低且有统计学差异, 则认为实验组小鼠肠道传输功能降低, 符合STC的临床诊断标准, 模型复制成功. 剩余小鼠在各组内随机再分为2组, 即实验1组、实验2组、对照1组及对照2组(均n = 12), 其中实验1组、对照1组皮下注射[Ala]16-aFGF(1-29) 300 μg/kg, 2次/wk, 共8 wk, 实验2组、对照2组给予等量的溶解液同样处理.
1.2.2 小鼠粪便性状评估: 依据Bristol粪便性状分级(BSFS)[16], 分离的硬团状或团块状粪便(BSFS 1, 2), 符合STC的粪便性状改变标准; 香肠状或团块状光滑软便(BSFS 4, 5), 符合正常小鼠的粪便性状.
1.2.3 肠道推进率: 禁食24 h的小鼠经口灌入炭末混悬液0.5 mL, 30 min后颈椎脱臼法处死, 剖腹取出幽门到直肠末端全部肠道, 在无张力状态下测量肠道全长及炭末在肠道的推进距离, 计算炭末推进距离占肠道全长的百分比. 肠道推进率 = 炭末推进距离/肠道全长×100%.
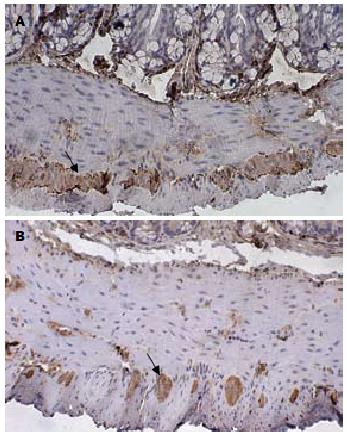
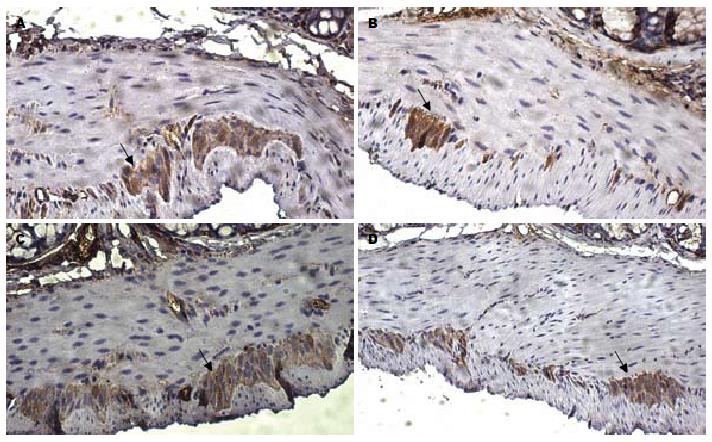
1.2.4 免疫组织化学检测肠道肌间丛神经元特异性烯醇化酶[17,18]分布及表达量: 常规固定、包埋、切片、梯度脱蜡、染色. 加一抗4 ℃孵育过夜, 苏木素复染胞核, PBS代替一抗作为阴性对照. 显微镜下胞质染色呈棕黄色片状或颗粒状物为阳性反应. 每张切片选5个高倍视野(×400倍), 应用IPP(Image-Pro Plus)图像分析系统进行分析, 以平均吸光度(A)值表示蛋白的相对表达量.
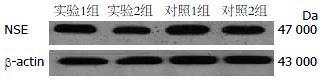
1.2.5 Western blot检测各组小鼠结肠组织中神经元特异性烯醇化酶的表达: 提取40 μg蛋白样品, SDS-PAGE凝胶电泳分离, 250 mA电转膜, 蛋白转至PVDF膜, 50 g/L脱脂奶粉于室温封闭2 h, 加1:800稀释的神经元特异性烯醇化酶, 4 ℃孵育过夜, TBST洗膜, 加1:4 000 HRP标记羊抗兔单克隆抗体, 室温孵育1 h, TBST洗膜, 化学发光剂曝光、显影. 所获X光片扫描入计算机, 用天能GIS凝胶图像处理系统软件对目标条带及β-actin条带进行A值分析.
统计学处理 实验数据采用mean±SD表示, 运用SPSS11.0统计软件进行统计分析, 各组间比较采用单因素方差分析、组内则应用两样本均数t检验, P<0.05为有统计学差异.
实验组小鼠粪便(BSFS 1, 2)较对照组(BSFS 4, 5)明显干硬; 实验组小鼠肠道推进率较对照组减低且差异具有统计学意义(63.422%±1.791% vs 55.702%±1.806%, P<0.01, 图1). STC动物模型成功建立.
2.2.1 免疫组织化学检测NSE的表达: 实验组及对照组小鼠肌间丛均可见棕色片状或颗粒状物, 实验组NSE的平均A值较对照组明显减低, 且差异具有统计学意义(1.188±0.03176 vs 0.8873±0.03554, P<0.05, 图2).
2.2.2 Western blot检测NSE的表达: 实验组小鼠结肠组织中NSE的表达水平(A值)较对照组明显减低且差异具有统计学意义(0.9052±0.02268 vs 0.7130±0.01654, P<0.05, 图3).
给予[Ala]16-aFGF(1-29)皮下注射8 wk后, 实验1组小鼠粪便性状渐变为光滑软便(BSFS 4, 5)且类似于对照组, 给予溶解液处理的实验2组小鼠粪便仍以干硬便为主(BSFS 1, 2); 实验1组肠道推进率较实验2组明显增加(62.25%±5.283% vs 57.19%±4.291%, P<0.05), 且与对照1、2组(60.74%±4.231%, 59.83%±4.977%)之间的差异无统计学意义(P>0.05).
2.4.1 免疫组织化学检测NSE的表达: 实验1组小鼠结肠肌间丛的NSE表达量(平均A值为0.6543±0.0069)较实验2组(平均A值为0.4193±0.0158)明显增加(P<0.05), 且与对照1、2组(平均A值分别为0.7960±0.0132, 0.7887±0.0145)之间的差异无统计学意义(均P>0.05, 图4).
2.4.2 Western blot检测NSE的表达: 实验1组小鼠结肠组织中NSE的表达水平(A值为0.5823±0.019)较实验2组(A值为0.5171±0.0124)明显升高(P<0.05), 且与对照1、2组(A值分别为0.5772±0.0225, 0.5676±0.0171)之间表达的差异无统计学意义(P>0.05, 图5).
功能性便秘(functional constipation, FC)又称为慢性便秘、特发性便秘, 是临床常见的消化系症状, 与肠癌、乳腺癌、肝性脑病等疾病的形成与进展相关, 还是心脑血管疾病(心肌梗死、脑血管意外等)致残、致死的诱因之一[19]. STC是FC的常见类型, 约占FC的45.5%[20], 其主要临床特点是结肠传输运动减慢、肠内容物通过延迟, 无便意、排便次数减少, 结肠传输试验可明确诊断. 目前临床上治疗便秘主要通过各种类型泻剂对症处理, 远期疗效不明显且长期用药易导致人体水、电解质紊乱, 并最终需要外科手术解决问题, 治疗比较棘手.
国内外学者观察到临床应用吗啡等阿片类镇痛药缓解癌症晚期疼痛常伴发严重、持久的便秘, 并成功建立了相关的便秘动物模型[13-15]. 本研究亦采用吗啡诱导建立小鼠结肠慢传输运动模型, 实验组小鼠粪便粪质变硬, 肠道推进率减低, 符合STC的临床特征, 成功复制动物模型. STC发病的病理生理学基础尚未明确, 但肠道动力异常是其中的重要环节, 大量的研究表明STC患者肠道组织中神经元及Cajal间质细胞数量较对照组显著减少[21,22], 国内学者亦发现在吗啡诱导的STC小鼠肠道存在结肠Cajal间质细胞数量的减少、抑制性神经递质表达增加[23,24], 本研究中免疫组织化学及Western blot结果均提示模型小鼠结肠组织中神经元的数量较对照组明显减少, 进一步证实STC时结肠存在神经元的改变.
aFGF是成纤维细胞因子家族中的一员, 最初发现并分离自牛脑及脑垂体. aFGF可通过促分裂及非促分裂效应对来源于中胚层和神经外胚层的细胞如间充质细胞、内分泌细胞、神经细胞等产生广泛的生物学效应, 如促进创伤愈合、组织修复、保护缺血再灌注引起的细胞损伤[25-27]. 在神经系统aFGF的作用主要表现为营养神经、促进损伤神经元的修复和再生, 临床及动物实验研究均显示外周神经损伤后, 手术修复的同时给予aFGF治疗可易化神经纤维的再生, 疗效较对照组明显提高[28,29]. Capetandes等研究证实大肠神经系统的肌间丛亦存在该物质[16], 这些研究结果提示aFGF可能在肠道神经系统有重要的作用.
aFGF作为人体的微量活性物质, 难以在体液或组织中提取, 主要通过生物工程方法人工合成获得, 但aFGF含有154个氨基酸, 其合成复杂、价格昂贵且易产生不良反应, 临床应用受到了限制. 用丙氨酸替换aFGF氨基端1-29片段中的第16位半胱氨酸残基得到的[Ala]16-aFGF(1-29), 与大分子aFGF具有同样的生物活性[12]. 基于STC的病理生理改变及aFGF的广泛生理活性和神经保护作用, 我们推测[Ala]16-aFGF(1-29)可能对STC有治疗作用. 本研究在成功建立STC动物模型的基础上外源性给予[Ala]16-aFGF(1-29)治疗8 wk, 发现治疗后的STC小鼠粪便性状趋向于BSFS 4, 5, 肠道推进率亦明显增加, 免疫组织化学及Western blot结果均显示起结肠组织神经元的表达量较给予溶解液处理的STC小鼠明显增加. 近年的研究认为aFGF可能通过以下机制促进神经损伤的修复: (1)抑制因损伤直接或间接诱导的神经元凋亡或坏死; (2)促进损伤近邻区域神经元的增殖, 代偿性修复神经损伤; (3)诱导神经干细胞或外周多能干细胞分化成神经元和胶质神经细胞, 从而修复神经损伤[30-33]. 本研究证实STC模型小鼠肠道组织神经元表达量减少, 给予aFGF活性片段干预后其表达量明显增加, 此效应是否通过前述机制中的一种或几种实现是下一步的研究方向.
总之, 外源性给予[Ala]16-aFGF(1-29)治疗STC小鼠, 可显著改善其便秘症状和肠道推进率; 且根据治疗后STC小鼠肠道神经元表达量较给予溶解液的对照组增加, 我们推测[Ala]16-aFGF(1-29)可能通过保护及修复ENS, 从而改善STC小鼠便秘症状及肠道推进率. 但该效应的具体途径不明, 有待进一步研究.
STC的具体病因及机制不明, 临床治疗不易, 严重影响现代人的生活质量. 近年来研究表明肠神经系统的病变是便秘发生的重要病理生理学基础, 因此保护肠神经系统功能从而改善便秘症状, 是探索临床治疗便秘的有效途径之一.
刘宝林, 教授, 中国医科大学附属盛京医院普通外科
国内学者亦发现在吗啡诱导的STC小鼠肠道存在结肠Cajal间质细胞数量的减少、抑制性神经递质表达增加.
本研究首次应用[Ala]16-aFGF (1-29)治疗STC小鼠, 并观察到小鼠便秘症状及肠道神经元的表达量均较对照组有明显的改善.
本研究应用[Ala]16-aFGF(1- 29)成功治疗STC模型动物, 为探索便秘的新疗法提供了动物实验依据.
本文设计合理, 方法科学, 数据可靠, 对传输性便秘的治疗奠定了实验基础.
编辑: 曹丽鸥 电编:何基才
| 1. | Müller-Lissner SA, Kamm MA, Scarpignato C, Wald A. Myths and misconceptions about chronic constipation. Am J Gastroenterol. 2005;100:232-242. [PubMed] [DOI] |
| 2. | Wald A. Is chronic use of stimulant laxatives harmful to the colon? J Clin Gastroenterol. 2003;36:386-389. [PubMed] [DOI] |
| 3. | O'Dea CJ, Brookes JH, Wattchow DA. The efficacy of treatment of patients with severe constipation or recurrent pseudo-obstruction with pyridostigmine. Colorectal Dis. 2010;12:540-548. [PubMed] [DOI] |
| 5. | Rossi E, Villanacci V, Fisogni S, Morelli A, Salerni B, Grigolato P, Bassotti G. Chromosomal study of enteric glial cells and neurons by fluorescence in situ hybridization in slow transit constipation. Neurogastroenterol Motil. 2007;19:578-584. [PubMed] [DOI] |
| 6. | Törnblom H, Lang B, Clover L, Knowles CH, Vincent A, Lindberg G. Autoantibodies in patients with gut motility disorders and enteric neuropathy. Scand J Gastroenterol. 2007;42:1289-1293. [PubMed] [DOI] |
| 7. | Lee YS, Lin CY, Robertson RT, Yu J, Deng X, Hsiao I, Lin VW. Re-growth of catecholaminergic fibers and protection of cholinergic spinal cord neurons in spinal repaired rats. Eur J Neurosci. 2006;23:693-702. [PubMed] [DOI] |
| 8. | Huang JY, Hong YT, Chuang JI. Fibroblast growth factor prevents MPP+-induced death of dopaminergic neurons and is involved in melatonin neuroprotection in vivo and in vitro. J Neurochem. 2009;109:1400-1412. [PubMed] [DOI] |
| 9. | Capetandes A, Di Salvo J, Ronan JJ, Thomas KA. Acidic fibroblast growth factor is present in the enteric nervous system of the large intestine. J Histochem Cytochem. 2000;48:407-414. [PubMed] [DOI] |
| 10. | Chen W, Fu XB, Ge SL, Sun TZ, Zhou G, Han B, Du YR, Li HH, Sheng ZY. Intravenous acid fibroblast growth factor protects intestinal mucosal cells against ischemia-reperfusion injury via regulating Bcl-2/Bax expression. World J Gastroenterol. 2005;11:3419-3425. [PubMed] |
| 11. | Chen W, Fu XB, Ge SL, Sun TZ, Li WJ, Sheng ZY. Acid fibroblast growth factor reduces rat intestinal mucosal damage caused by ischemia-reperfusion insult. World J Gastroenterol. 2005;11:6477-6482. [PubMed] |
| 13. | Ise Y, Katayama S, Hirano M, Aoki T, Narita M, Suzuki T. Effects of fluvoxamine on morphine-induced inhibition of gastrointestinal transit, antinociception and hyperlocomotion in mice. Neurosci Lett. 2001;29:29-32. [PubMed] [DOI] |
| 14. | Friedman JD, Dello Buono FA. Opioid antagonists in the treatment of opioid-induced constipation and pruritus. Ann Pharmacother. 2001;35:85-91. [PubMed] [DOI] |
| 16. | O'Donnell LJ, Virjee J, Heaton KW. Detection of pseudodiarrhoea by simple clinical assessment of intestinal transit rate. BMJ. 1990;300:439-440. [PubMed] [DOI] |
| 17. | Bassotti G, Villanacci V. Slow transit constipation: a functional disorder becomes an enteric neuropathy. World J Gastroenterol. 2006;12:4609-4613. [PubMed] |
| 18. | Bassotti G, Villanacci V, Maurer CA, Fisogni S, Di Fabio F, Cadei M, Morelli A, Panagiotis T, Cathomas G, Salerni B. The role of glial cells and apoptosis of enteric neurones in the neuropathology of intractable slow transit constipation. Gut. 2006;55:41-46. [PubMed] [DOI] |
| 21. | Geramizadeh B, Hayati K, Rahsaz M, Hosseini SV. Assessing the interstitial cells of Cajal, cells of enteric nervous system and neurotransmitters in slow transit constipation, using immunohistochemistry for CD117, PGP .5 and serotonin. Hepatogastroenterology. 2009;56:1670-1674. [PubMed] |
| 22. | Lee JI, Park H, Kamm MA, Talbot IC. Decreased density of interstitial cells of Cajal and neuronal cells in patients with slow-transit constipation and acquired megacolon. J Gastroenterol Hepatol. 2005;20:1292-1298. [PubMed] [DOI] |
| 24. | 姜 柳琴, 林 琳, 张 红杰, 胡 哗东, 林 征, 王 美峰. 血红素氧合酶2在吗啡诱导的结肠慢传输型便秘小鼠结肠中的表达及意义. 世界华人消化杂志. 2008;16:422-425. [DOI] |
| 25. | Hidai C, Masako O, Ikeda H, Nagashima H, Matsuoka R, Quertermous T, Kasanuki H, Kokubun S, Kawana M. FGF-1 enhanced cardiogenesis in differentiating embryonal carcinoma cell cultures, which was opposite to the effect of FGF-2. J Mol Cell Cardiol. 2003;35:421-425. [PubMed] [DOI] |
| 26. | Forough R, Wang X, Martinez-Lemus LA, Thomas D, Sun Z, Motamed K, Parker JL, Meininger GA. Cell-based and direct gene transfer-induced angiogenesis via a secreted chimeric fibroblast growth factor-1 (sp-FGF-1) in the chick chorioallantoic membrane (CAM). Angiogenesis. 2003;6:47-54. [PubMed] [DOI] |
| 27. | Angulo J, Ojeda R, de Paz JL, Lucas R, Nieto PM, Lozano RM, Redondo-Horcajo M, Giménez-Gallego G, Martín-Lomas M. The activation of fibroblast growth factors (FGFs) by glycosaminoglycans: influence of the sulfation pattern on the biological activity of FGF-1. Chembiochem. 2004;5:55-61. [PubMed] [DOI] |
| 28. | Tsai PY, Cheng H, Huang WC, Huang MC, Chiu FY, Chang YC, Chuang TY. Outcomes of common peroneal nerve lesions after surgical repair with acidic fibroblast growth factor. J Trauma. 2009;66:1379-1384. [PubMed] [DOI] |
| 29. | Tsai MC, Shen LF, Kuo HS, Cheng H, Chak KF. Involvement of acidic fibroblast growth factor in spinal cord injury repair processes revealed by a proteomics approach. Mol Cell Proteomics. 2008;7:1668-1687. [PubMed] [DOI] |
| 30. | Jin K, LaFevre-Bernt M, Sun Y, Chen S, Gafni J, Crippen D, Logvinova A, Ross CA, Greenberg DA, Ellerby LM. FGF-2 promotes neurogenesis and neuroprotection and prolongs survival in a transgenic mouse model of Huntington's disease. Proc Natl Acad Sci U S A. 2005;102:18189-18194. [PubMed] [DOI] |
| 31. | La Spada AR. Huntington's disease and neurogenesis: FGF-2 to the rescue? Proc Natl Acad Sci U S A. 2005;102:17889-17890. [PubMed] [DOI] |
| 32. | Andrade MS, Mendonça LM, Chadi G. Treadmill running protects spinal cord contusion from secondary degeneration. Brain Res. 2010;1346:266-278. [PubMed] [DOI] |
| 33. | Fu XB, Li XK, Wang T, Cheng B, Sheng ZY. Enhanced anti-apoptosis and gut epithelium protection function of acidic fibroblast growth factor after cancelling of its mitogenic activity. World J Gastroenterol. 2004;10:3590-3596. [PubMed] |