修回日期: 2011-03-24
接受日期: 2011-04-11
在线出版日期: 2011-04-18
目的: 探讨膜联蛋白2(ANXA2)、血管内皮生长因子(VEGF)促进HepG2肝癌细胞系转移的作用.
方法: 应用Transwell 、RT-PCR、Western blot, 检测在不同5-氟尿嘧啶(5-FU)剂量(50、100、200、400 mg/L)干扰下, ANXA2、VEGF的表达及其促进HepG2肝癌细胞系转移的作用.
结果: Transwell方法检测HepG2肝癌细胞随着5-FU剂量的增加侵袭力较对照组明显降低, 各剂量组间差异具有明显统计学意义(22±5, 25±4, 13±2, 12±2 vs 39±7, 均P<0.05); RT-PCR、Western blot方法检测HepG2肝癌细胞中ANXA2、VEGF mRNA、蛋白的表达量随着5-FU剂量的增加逐渐下降, 与对照组间的差异具有显著统计学意义(ANXA2 mRNA: 0.527±0.008, 0.419±0.046, 0.213±0.007, 0.176±0.007 vs 0.718±0.008; ANXA2蛋白: 0.669±0.055, 0.484±0.072, 0.180±0.034, 0.099±0.009 vs 1.236±0.102; VEGF mRNA: 0.818±0.016, 0.558±0.101, 0.386±0.009, 0.352±0.017 vs 1.176±0.035; VEGF蛋白: 0.960±0.085, 0.962±0.056, 0.376±0.069, 0.219±0.008 vs 1.124±0.170, 均P = 0.000), 且两者具有相关性(rp = 0.900, rw = 0.856).
结论: 随着5-FU剂量的逐渐增加, HepG2肝癌细胞侵袭率及ANXA2、VEGF表达量逐渐下降, 两者呈显著正相关, 提示两者在肝癌细胞的侵袭转移机制中可能起重要作用.
引文著录: 曲艳红, 杨家梅, 樊青霞, 周悦. ANXA2、VEGF对HepG2肝癌细胞系转移的促进作用. 世界华人消化杂志 2011; 19(11): 1174-1178
Revised: March 24, 2011
Accepted: April 11, 2011
Published online: April 18, 2011
AIM: To investigate the role of annexin-2 (ANXA-2) and vascular endothelial growth factor (VEGF) in promoting invasiveness of human liver cancer HepG2 cells .
METHODS: After HepG2 cells were treated with different doses of 5-fluorouracil, cell invasiveness was detected by Transwell assay, and the mRNA and protein expression of ANXA-2 and VEGF was detected by RT-PCR and Western blot, respectively.
RESULTS: The invasiveness of HepG2 cells decreased with the increase in the dose of 5-fluorouracil, with significant differences among cells treated with different doses of 5-fluorouracil (22 ± 5, 25 ± 4, 13 ± 2, 12 ± 2 vs 39 ± 7, all P < 0.05). The mRNA and protein expression of ANXA2 and VEGF in HepG2 cells decreased gradually with the increase in the dose of 5-fluorouracil (ANXA2 mRNA: 0.527 ± 0.008, 0.419 ± 0.046, 0.213 ± 0.007, 0.176 ± 0.007 vs 0.718 ± 0.008; ANXA2 protein: 0.669 ± 0.055, 0.484 ± 0.072, 0.180 ± 0.034, 0.099 ± 0.009 vs 1.236 ± 0.102; VEGF mRNA: 0.818 ± 0.016, 0.558 ± 0.101, 0.386 ± 0.009, 0.352 ± 0.017 vs 1.176 ± 0.035; VEGF protein: 0.960 ± 0.085, 0.962 ± 0.056, 0.376 ± 0.069, 0.219 ± 0.008 vs 1.124 ± 0.170, all P < 0.001). There were significant correlations between the mRNA and protein expression of ANXA2 and VEGF (rp = 0.900, rw = 0.856).
CONCLUSION: The expression of ANXA2 and VEGF in HepG2 cells decreased gradually with the increase in the dose of 5-fluorouracil. ANXA2 and VEGF may play an important role in the invasion and metastasis of hepatocellular carcinoma.
- Citation: Qu YH, Yang JM, Fan QX, Zhou Y. ANXA-2 and VEGF promote invasiveness of human liver cancer HepG2 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1174-1178
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1174.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1174
肝癌为我国常见恶性肿瘤之一, 继甲胎蛋白以后, 尚未发现更好的指标指导临床肝癌早期诊断, 因此寻找特异性更高的肝癌早期临床诊断指标具有重要的临床意义. 很多研究表明膜联蛋白(annexin, ANXA)和血管内皮生长因子(vascular endothelial growth factor, VEGF)在肿瘤的发展及远处转移中发挥重要作用, ANXA2是膜联蛋白家族中重要成员, 其在诸多肿瘤(大肠癌、肺癌、胃癌、食管癌、前列腺癌、白血病、多发性骨髓瘤、宫颈癌、甲状腺癌)的侵袭转移机制中发挥重要作用, 但是目前关于ANXA2在肝癌中表达的研究甚少. VEGF是体内最强的一种血管生成因子, 直接参与诱导肿瘤血管生成. VEGF及其受体VEGFR在肝癌癌组织中较正常肝组织表达明显增强, 在肝癌的生长、转移、复发中具有重要作用. 本文通过对ANXA2、VEGF在HepG2肝癌细胞系表达的研究, 探讨两者在肝细胞性肝癌中表达的相关性及意义.
HepG2肝癌细胞系、Hyclone胎牛血清、高糖DMEM(Gibco)、5-FU、Transwell相关试剂、RT-PCR试剂盒、Western blot相关试剂.
1.2.1 Transwell检测细胞侵袭力: 24孔培养板中不同5-FU剂量(50、100、200、400 mg/L)干预培养, 每孔加入100 μL无血清培养液稀释的Matrigel, 4 ℃过夜; 饥饿12 h后消化细胞, 离心弃培养基, PBS清洗后无血清培养基重悬, 调至3×108个/L; 以无血清培养基水化小室; 吸取400 μL细胞悬液加入上室; 下室加入小鼠成纤维细胞NIH3T3培养液600 μL趋化; 培养48 h; 4%多聚甲醛固定, 漂洗后HE染色、观察计数. 每个滤膜随机选取5个400倍视野, 计数, 按公式: 抑制率(%) = 对照组细胞数-干扰组细胞数/对照组细胞数×100%.
1.2.2 RT-PCR检测ANXA2和VEGF mRNA表达: 以5×107/L接种细胞常规培养, 完全贴壁后不同剂量5-FU干预48 h后分别提取各组细胞总mRNA, 然后逆转录继而PCR扩增, 扩增产物经琼脂糖凝胶电泳, 在紫外线投射分析仪下观察结果. D-140图像记录分析系统进行记录, Quantity One软件分析, 目的基因表达量以目的基因的DNA条带和β-actin的DNA条带灰度值比值表示.
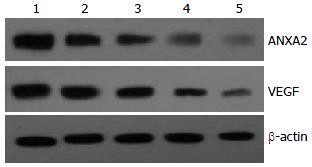
1.2.3 Western blot检测ANXA2和VEGF蛋白表达: 收集不同5-FU剂量组细胞, 蛋白质提取, 制备SDS-PAGE, 加样、电泳、转膜. 封闭, 一抗、二抗孵育(第二抗体为羊抗兔), ECL显色、定影、拍照. 以β-actin作为内对照. 胶片扫描后用Bandscan5.0软件进行灰度分析.
统计学处理 SPSS17.0统计软件进行统计学分析处理, 数据采用mean±SD表示. 多组均数比较若满足正态性和方差齐性采用单因素方差分析, 若不满足采用非参数检验, 相关性分析若符合正态及残差正态采用Pearson相关, 若不符合采用Spearman相关. P<0.05为差异有统计学意义.
随着5-FU剂量的逐渐增加, 细胞侵袭数逐渐下降, 各剂量组细胞侵袭数差异具有统计学意义(39±7 vs 22±5, 25±4, 13±2, 12±2; Hc = 33.676, P = 0.000).
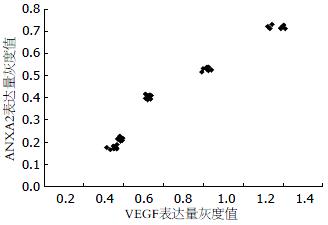
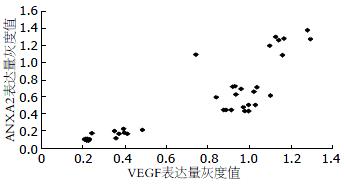
5-FU各剂量组的VEGF表达量及ANXA2表达量, 各剂量组间ANXA2表达量的差异具有明显统计学意义(Hc = 36.895, P = 0.000), 各剂量组间VEGF表达量的差异具有明显统计学意义(Hc = 36.713, P = 0.000, 表1). ANXA2的表达量与VEGF的表达量之间是完全正相关性(rp = 0.975, 图1, 2).
| 分组 | ANXA2表达量 | VEGF表达量 |
| 对照组 | 0.718±0.008 | 1.176±0.035 |
| 50 mg/L | 0.527±0.008 | 0.818±0.016 |
| 100 mg/L | 0.419±0.046 | 0.558±0.101 |
| 200 mg/L | 0.213±0.007 | 0.386±0.009 |
| 400 mg/L | 0.176±0.007 | 0.352±0.017 |
5-FU各剂量组的VEGF表达量及ANXA2表达量, 各剂量组间ANXA2表达量的差异具有明显统计学意义(Hc = 10.500, P = 0.000), 各剂量组间VEGF表达量的差异具有明显统计学意义(Hc = 33.003, P = 0.000, 表2). ANXA2与VEGF的表达量之间是完全正相关性(rw = 0.856, 图3, 4).
| 分组 | ANXA2表达量 | VEGF表达量 |
| 对照组 | 1.236±0.102 | 1.124±0.170 |
| 50 mg/L | 0.669±0.055 | 0.960±0.085 |
| 100 mg/L | 0.484±0.072 | 0.962±0.056 |
| 200 mg/L | 0.180±0.034 | 0.376±0.069 |
| 400 mg/L | 0.099±0.009 | 0.219±0.008 |
ANXA家族是一类钙依赖性膜磷脂结合蛋白, 参与膜转运及膜表面一系列依赖于钙调蛋白的活动, 包括钙离子通道的形成、调控炎症反应、纤溶、胞吐、胞吞、细胞增殖、DNA修复合成、细胞分化与凋亡、细胞骨架活动、成骨细胞的形成和骨的重吸收、膜功能区的形成、信号转导等[1]. 广泛存在于核内、胞质、细胞质膜下、储Ca2+细胞器附近及细胞外基质中, 约占细胞总蛋白的2%. ANXA2又名P36、LIP2、LPC2等, 是家族中的一个重要成员, 具有Ca2+依赖性的RNA结合特性, 主要表达在人体内皮细胞、单核/巨噬细胞、神经细胞、骨髓细胞和某些肿瘤细胞中, 在细胞中的表达水平受细胞周期的调控.
1990年, Frohlich首次报道ANXA2表达增高与肝癌发生有关, 且能促进肝癌的侵袭转移[2,3], 其在肝癌(包括肝细胞性和胆管型)[4]、胃癌、乳腺癌、胰腺癌[5,6]、肾细胞癌[7]、肺癌、结肠癌[8]、人类神经胶质瘤[9,10]、甲状腺癌[11,12]、宫颈癌、头颈部鳞状细胞癌[13]、脑癌、幽门螺杆菌感染患者[14]、多发性骨髓瘤[15]及排卵过程[16]表达明显上调, 且与淋巴结、远处转移相关; 而在前列腺癌、食管癌及头颈部鳞状细胞癌组织中表达下调, 在前列腺癌中去甲基药物作用可恢复其mRNA表达, 故高甲基化可能是基因沉默的原因, 但其对前列腺癌仍然具有促进作用[17].
ANXA2在胞外的主要作用是作为纤溶受体, ANXA2与S100家族成员[18](S100A10、S100A4)、纤溶酶原(plasminogen, PLG)、组织型纤溶酶原激活物(tissue plasminogen activator, tPA)、腱生蛋白C(抗黏附作用)、组织蛋白酶B、VEGF等相互作用, 使他们在肿瘤细胞表面共区域化, 介导tPA依赖的纤溶酶的产生, 激活蛋白酶前体, 活化基质金属蛋白酶、细胞外基质的重塑及蛋白质水解、新血管形成, 促进肿瘤细胞浸润转移[19-21].
VEGF是目前发现唯一特异性作用于血管内皮细胞的生长因子, 直接参与诱导肿瘤血管生成[22], 可以激活血管内皮细胞基因, 增强尿激酶型纤溶酶原激活物(urine plasminogen activator, uPA)和tPA的表达, 进而诱导蛋白水解酶、间质胶原酶和组织因子的产生来促进血管的形成. 用VEGF处理人脐静脉内皮细胞后, ANXA2的表达量升高[23], 这一相关性提示ANXA2可能参与了VEGF的血管形成机制.
本实验在各剂量组中, 随着5-FU剂量的增加, HepG2肝癌细胞的侵袭力及ANXA2、VEGF的表达逐渐下降且两者具有明显正相关性, 在肝细胞癌中ANXA2、VEGF可能对肝癌细胞的侵袭转移起着协同促进作用, 提示5-FU抑制肝癌细胞, 可能是通过ANXA2、VEGF发挥作用, 与MMP家族、S100家族、PLG、tPA、uPA、组织蛋白酶B、腱生蛋白C等相互作用, 共同促进肿瘤新血管的生成及肿瘤的转移. 总之, 推测ANXA2在肝细胞癌中可能起着中心调节或者关键角色, 为阐明肿瘤侵袭转移分子机制、分子靶向治疗及预后评估方面, 提供了新思路, 有望成为判断肝癌临床分期及预后的新指标, 对指导临床诊治具有深远意义. 我们将在以后的研究中用重组ANXA2、VEGF或者慢病毒转染及基因沉默等方法进一步研究ANXA2、VEGF高表达或者低表达对肝癌细胞转移能力的影响, 进而使肿瘤转移的分子机制更加明确.
Annexin家族是一类钙依赖性膜磷脂结合蛋白, 主要参与膜表面一系列依赖于钙调蛋白的活动; VEGF是目前发现唯一特异性作用于血管内皮细胞的生长因子, 直接参与诱导肿瘤血管生成, 两者在肿瘤的侵袭转移中发挥重要作用.
李旭, 副教授, 广东省广州市南方医院急诊科
肿瘤细胞转移机制是目前肿瘤学研究的热点, ANXA2是ANXA家族中研究比较深入的重要成员, 在胞外的主要作用是作为纤溶受体, 在多种肿瘤细胞的转移机制中扮演重要的角色, 但是目前ANXA2在肿瘤细胞转移中的具体分子机制尚未明了.
目前国内外关于ANXA2在肝癌中表达的研究甚少, 本研究通过Transwell、RT-PCR、Western blot等研究方法, 从细胞侵袭力、mRNA、蛋白质表达等方面分析讨论ANXA2、VEGF在肿瘤转移机制中的作用.
随着5-FU剂量的逐渐增加, HepG2肝癌细胞侵袭率及ANXA2、VEGF表达量逐渐下降, 两者呈显著正相关, 提示两者在肝癌细胞的侵袭转移机制中可能起重要作用.
本文选题较好, 设计合理, 为肝癌的治疗奠定实验基础.
编辑: 李薇 电编:何基才
| 1. | Chasserot-Golaz S, Vitale N, Umbrecht-Jenck E, Knight D, Gerke V, Bader MF. Annexin 2 promotes the formation of lipid microdomains required for calcium-regulated exocytosis of dense-core vesicles. Mol Biol Cell. 2005;16:1108-1119. [PubMed] [DOI] |
| 2. | Zhao P, Zhang W, Tang J, Ma XK, Dai JY, Li Y, Jiang JL, Zhang SH, Chen ZN. Annexin II promotes invasion and migration of human hepatocellular carcinoma cells in vitro via its interaction with HAb18G/CD147. Cancer Sci. 2010;101:387-395. [PubMed] [DOI] |
| 3. | Chakravarthy A, Chen LC, Mehta D, Hamburger AW. Modulation of epidermal growth factor receptors by gamma interferon in a breast cancer cell line. Anticancer Res. 1991;11:347-351. [PubMed] |
| 4. | Yonglitthipagon P, Pairojkul C, Chamgramol Y, Mulvenna J, Sripa B. Up-regulation of annexin A2 in cholangiocarcinoma caused by Opisthorchis viverrini and its implication as a prognostic marker. Int J Parasitol. 2010;40:1203-1212. [PubMed] [DOI] |
| 5. | Ortiz-Zapater E, Peiró S, Roda O, Corominas JM, Aguilar S, Ampurdanés C, Real FX, Navarro P. Tissue plasminogen activator induces pancreatic cancer cell proliferation by a non-catalytic mechanism that requires extracellular signal-regulated kinase 1/2 activation through epidermal growth factor receptor and annexin A2. Am J Pathol. 2007;170:1573-1584. [PubMed] [DOI] |
| 6. | Nedjadi T, Kitteringham N, Campbell F, Jenkins RE, Park BK, Navarro P, Ashcroft F, Tepikin A, Neoptolemos JP, Costello E. S100A6 binds to annexin 2 in pancreatic cancer cells and promotes pancreatic cancer cell motility. Br J Cancer. 2009;101:1145-1154. [PubMed] [DOI] |
| 7. | Domoto T, Miyama Y, Suzuki H, Teratani T, Arai K, Sugiyama T, Takayama T, Mugiya S, Ozono S, Nozawa R. Evaluation of S100A10, annexin II and B-FABP expression as markers for renal cell carcinoma. Cancer Sci. 2007;98:77-82. [PubMed] [DOI] |
| 8. | Chen JS, Chou YP, Chen KT, Hung RP, Yu JS, Chang YS, Chan EC. Detection of annexin A autoantibodies in sera from colorectal cancer patients. J Clin Gastroenterol. 2011;45:125-132. [PubMed] [DOI] |
| 9. | Tatenhorst L, Rescher U, Gerke V, Paulus W. Knockdown of annexin 2 decreases migration of human glioma cells in vitro. Neuropathol Appl Neurobiol. 2006;32:271-277. [PubMed] [DOI] |
| 10. | Lu ZQ, Gao YL, Lu JX. [The expression and significance of ANXA2 in human glioma]. Xibao Yu Fenzi Mianyixue Zazhi. 2010;26:787-789. [PubMed] |
| 11. | Musholt TJ, Hanack J, Brehm C, von Wasielewski R, Musholt PB. Searching for non-RET molecular alterations in medullary thyroid carcinoma: expression analysis by mRNA differential display. World J Surg. 2005;29:472-482. [PubMed] [DOI] |
| 12. | Ito Y, Arai K, Nozawa R, Yoshida H, Higashiyama T, Takamura Y, Miya A, Kobayashi K, Kuma K, Miyauchi A. S100A10 expression in thyroid neoplasms originating from the follicular epithelium: contribution to the aggressive characteristic of anaplastic carcinoma. Anticancer Res. 2007;27:2679-2683. [PubMed] |
| 13. | Rodrigo Tapia JP, Pena Alonso E, García-Pedrero JM, Florentino Fresno M, Suárez Nieto C, Owen Morgan R, Fernández MP. [Annexin A2 expression in head and neck squamous cell carcinoma]. Acta Otorrinolaringol Esp. 2007;58:257-262. [PubMed] [DOI] |
| 14. | Das S, Sierra JC, Soman KV, Suarez G, Mohammad AA, Dang TA, Luxon BA, Reyes VE. Differential protein expression profiles of gastric epithelial cells following Helicobacter pylori infection using ProteinChips. J Proteome Res. 2005;4:920-930. [PubMed] [DOI] |
| 15. | Bao H, Jiang M, Zhu M, Sheng F, Ruan J, Ruan C. Overexpression of Annexin II affects the proliferation, apoptosis, invasion and production of proangiogenic factors in multiple myeloma. Int J Hematol. 2009;90:177-185. [PubMed] [DOI] |
| 16. | Bae SM, Lee CH, Cho YL, Nam KH, Kim YW, Kim CK, Han BD, Lee YJ, Chun HJ, Ahn WS. Two-dimensional gel analysis of protein expression profile in squamous cervical cancer patients. Gynecol Oncol. 2005;99:26-35. [PubMed] [DOI] |
| 17. | Inokuchi J, Narula N, Yee DS, Skarecky DW, Lau A, Ornstein DK, Tyson DR. Annexin A2 positively contributes to the malignant phenotype and secretion of IL-6 in DU145 prostate cancer cells. Int J Cancer. 2009;124:68-74. [PubMed] [DOI] |
| 18. | Hou Y, Yang L, Mou M, Hou Y, Zhang A, Pan N, Qiang R, Wei L, Zhang N. Annexin A2 regulates the levels of plasmin, S100A10 and Fascin in L5178Y cells. Cancer Invest. 2008;26:809-815. [PubMed] [DOI] |
| 20. | Semov A, Moreno MJ, Onichtchenko A, Abulrob A, Ball M, Ekiel I, Pietrzynski G, Stanimirovic D, Alakhov V. Metastasis-associated protein S100A4 induces angiogenesis through interaction with Annexin II and accelerated plasmin formation. J Biol Chem. 2005;280:20833-20841. [PubMed] [DOI] |
| 21. | Mackie EJ. Molecules in focus: tenascin-C. Int J Biochem Cell Biol. 1997;29:1133-1137. [PubMed] [DOI] |
| 22. | 李 晓娟, 纪 淑红. VEGF结构特征及生物学功能. 中华临床医学研究杂志. 2007;1:388. |
| 23. | Katanasaka Y, Asai T, Naitou H, Ohashi N, Oku N. Proteomic characterization of angiogenic endothelial cells stimulated with cancer cell-conditioned medium. Biol Pharm Bull. 2007;30:2300-2307. [PubMed] [DOI] |