修回日期: 2011-03-14
接受日期: 2011-03-23
在线出版日期: 2011-04-18
目的: 研究全长脂联素真核表达质粒对体外培养人类肝星状细胞株(LX-2)细胞, Ⅰ型胶原(collagen Ⅰ, COL-Ⅰ)基因及蛋白的影响, 探讨全长脂联素对细胞凋亡的作用及其调节COL-Ⅰ表达的作用机制.
方法: 实验分为对照组、空质粒组、全长脂联素真核表达质粒组, 各组转染48 h后Real-time PCR方法检测COL-Ⅰ mRNA的表达, ELISA法检测COL-Ⅰ蛋白水平的表达, MTT检测细胞存活率变化, AnnexinV-FITC检测细胞凋亡率变化, Western blot检测细胞凋亡蛋白caspase-3的变化.
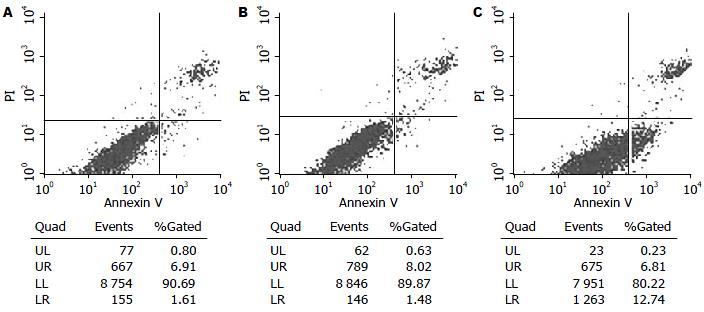
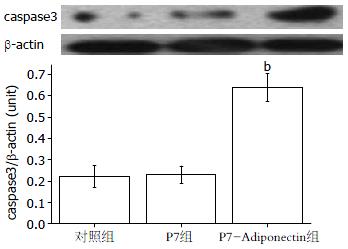
结果: 与空质粒组及对照组相比, 全长脂联素真核表达质粒组COL-Ⅰ mRNA及蛋白的表达下降(179.00 ng/L±16.83 ng/L vs 532.30 ng/L±27.52 ng/L, 570.00 ng/L±16.12 ng/L, 均P<0.01), 细胞存活率下降(65.70%±1.56% vs 93.15%±1.90%, 95.82%±2.52%, 均P<0.01), 凋亡率增加(14.70%±2.34% vs 1.60%±0.23%, 1.80%±0.15%, 均P<0.01), caspase-3活性蛋白的表达增加(0.62±0.09 vs 0.21±0.04, 0.22±0.07, 均P<0.01).
结论: 脂联素可下调LX-2细胞COL-Ⅰ表达而抑制肝纤维化, 其机制可能是通过抑制LX-2细胞增殖及增加caspase-3蛋白的途径促进其凋亡.
引文著录: 刘殿刚, 张育先, 李非, 刘家峰, 孙家邦. 脂联素对LX-2细胞COL-Ⅰ表达的调节及其机制. 世界华人消化杂志 2011; 19(11): 1169-1173
Revised: March 14, 2011
Accepted: March 23, 2011
Published online: April 18, 2011
AIM: To observe the effect of transfection of full-length adiponectin cDNA on the expression of collagen I (COL-I) in human hepatic stellate cells (LX-2) and to explore possible mechanisms involved.
METHODS: LX-2 cells were transfected with the empty plasmid (P7) or the recombinant plasmid carrying the full-length adiponectin cDNA. Forty-eight hours later, the expression of COL-I mRNA and protein was detected by real-time PCR and ELISA; cell survival was detected by MTT assay; apoptosis was detected by annexin V-FITC staining; and the changes in caspase-3 protein expression were detected by Western blot.
RESULTS: Compared to cells transfected with the empty plasmid and untransfected cells, the expression of COL-I mRNA and protein (179.00 ng/L ± 16.83 ng/L vs 532.30 ng/L ± 27.52 ng/L, 570.00 ng/L ± 16.12 ng/L, both P < 0.01) were significantly down-regulated, cell viability decreased (65.70% ± 1.56% vs 93.15% ± 1.90%, 95.82% ± 2.52%, both P < 0.01), apoptosis rate increased (14.70% ± 2.34% vs 1.60% ± 0.23%, 1.80% ± 0.15%, both P < 0.01), and the expression of caspase-3 was up-regulated (0.62 ± 0.09 vs 0.21 ± 0.04, 0.22 ± 0.07, both P < 0.01) in cells transfected with the recombinant plasmid.
CONCLUSION: Adiponectin can down-regulate COL-I expression, inhibit cell proliferation, induce caspase-3-mediated apoptosis, and thus restrain liver fibrosis.
- Citation: Liu DG, Zhang YX, Li F, Liu JF, Sun JB. Adiponectin down-regulates COL-I expression in human hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1169-1173
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1169
脂联素是由脂肪组织分泌的具有生物活性的一种蛋白因子, 具有调节糖脂代谢、炎症及免疫反应的作用[1,2]. 近年来有研究发现血浆脂联素水平与肝纤维化有关[3]. 肝星状细胞(hepatic stellate cell, HSC)表达脂联素受体[4,5], 脂联素能维持HSC的静息状态, 抑制血小板源性生长因子(platelet-derived growth factor, PDGF)诱导的HSC的迁移和增殖, 减少转化生长因子的基因表达, 显示其潜在的抗纤维化作用[6]. 本研究观察脂联素对HSC细胞株LX-2, Ⅰ型胶原(collagenⅠ, COL-Ⅰ)表达的影响, 并对其机制进行探讨, 以进一步阐明脂联素在肝纤维化中的作用.
LX-2由美国旧金山总医院肝病研究中心Friedman教授惠赠. 质粒pCAGGSP7由首都医科大学病原生物学系微生物教研室安静教授惠赠. 脂联素购自Cayman公司, ELISA试剂盒购自ALD公司, caspase3一抗为兔抗人IgG抗体, 购自北京环亚泰克生物技术有限公司, 小鼠抗兔二抗购自北京中杉金桥生物技术公司. AnnexinV-FITC试剂盒购自北京宝赛生物技术有限公司, 荧光定量PCR仪(ABI, 7300).
1.2.1 质粒的构建、鉴定及细胞培养: 脂联素真核表达质粒的构建、鉴定及细胞培养、转染根据我们前期工作基础[7]. 实验分组为对照组, 空质粒组(P7组), 脂联素质粒组(P7-Adiponectin组).
1.2.2 Real-time PCR检测转染48 h后各组COL-Ⅰ基因表达: TRIzol法抽提RNA, 逆转录. 采用SYBR green染料法进行相对定量检测. 引物序列: β-actin正义链5'-AGCAAGCAGGAGTATGACG-3, 反义链5'-AAAGGGTGTAACGCAACTAA-3', 产物89 bp; COL-Ⅰ正义链 5'-GACTGGTGAGACCTGCGTGTA-3', 反义链5'-GCCTCTTGTCCTTGGGGTT-3', 产物86 bp, 采用20 μL的反应体系, 其中反应液采用Syber Green Mixtrue 10 μL, 上下游引物各取1 μL, cDNA产物1 μL, 去离子水补充体积到20 μL. 各扩增产物反应参数均为: 94 ℃预变性5 min, 94 ℃变性30 s, 60 ℃退火延伸1 min, 共40个循环. 溶解曲线检测二聚体保证试验结果可靠性, 每个样本6瓶重复, 样本3孔重复, 实验重复3次. 本方法为相对定量, ABI 7300荧光定量PCR仪器读出Ct值, 计算出2-ΔΔCt, 并行统计学比较.
1.2.3 Western blot检测caspase3表达: 细胞转染48 h后, 胰酶消化收集细胞, 蛋白裂解液处理并制备蛋白样品, 将蛋白样品行15%聚丙烯酰胺凝胶电泳后, 用湿转方法转移到硝酸纤维膜上, 膜以封闭液(50 mmol/L Tris, pH8.0, 2 mmol/L CaCl2, 0.01% Antifoam A, 0.05% Tween-20, 5% NaN3, Carnation脱脂奶粉), 室温振荡封闭2 h, 加入以封闭液稀释的一抗(1:400)4 ℃冰箱过夜, TTBS洗涤每次10 min, 1:4 000稀释的二抗于室温孵育2 h, TTBS洗涤每次10 min加发光液进行化学发光显影. 用凝胶成像系统照相, 并用Quantity One软件对X胶片进行灰度扫描, 读取灰度值(A值).
1.2.4 MTT检测细胞存活率: 对数生长期的LX-2细胞, 胰酶消化, 以含10% FCS的DMEM培养液均匀种于96孔培养板中, 待细胞生长至60%融合, 转染质粒并培养48 h. 各孔加入200 μL浓度为0.05%的MTT, 37 ℃培养4 h后, 弃上清液, 各孔加入200 μL DMSO裂解细胞, 混匀, 酶标仪检测A值(492 nm). 计算细胞存活率 = 药物组A值/对照组A值×100%.
1.2.5 ELISA法检测细胞培养上清液中COL-Ⅰ蛋白的含量: 按试剂盒推荐方法操作.
1.2.6 AnnexinV-FITC检测细胞凋亡率变化: 按试剂盒推荐方法操作.
统计学处理 应用SPSS11.5软件, 数据以mean±SD表示, 先进行数据的正态性检验、方差齐性检验, 符合上述条件者行单因素方差分析(One-way ANOVA)及q检验. P<0.05为差异有统计学意义.
P7-Adiponectin组COL-Ⅰ基因表达明显下降, 较P7组及对照组的下降约64%, 差异有统计学意义(P<0.01), 而对照组及P7组表达Ⅰ型胶原差异无统计学意义(表1).
P7-Adiponectin组COL-Ⅰ蛋白分泌明显下降, 较P7组及对照组相比下降约60%, 差异有统计学意义(179.00 ng/L±16.83 ng/L vs 532.30 ng/L±27.52 ng/L, 570.00 ng/L±16.12 ng/L, P<0.01), 而对照组及P7组表达COL-Ⅰ差异无统计学意义.
P7-Adiponectin组细胞存活率为65.70%±1.56%, 较P7组(93.15%±1.90%)及对照组(95.82%±2.52%)明显下降, 差异有统计学意义(P<0.01).
P7-Adiponectin组细胞凋亡率为14.70%±2.34%, 较P7组(1.60%±0.23%)及对照组(1.80%±0.15%)相比明显升高, 差异有统计学意义(P<0.01), 而对照组及P7组凋亡率变化差异无统计学意义(图1).
P7-Adiponectin组caspase3活性蛋白灰度值为0.62±0.09, 较P7组caspase3活性蛋白灰度值(0.21±0.04)及对照组caspase3活性蛋白灰度值(0.22±0.07)相比差异有统计学意义(P<0.01), 而对照组及P7组caspase3活性蛋白表达差异无显著统计学意义(图2).
脂联素是一种脂肪组织分泌的活性蛋白, 1995年由Scherer等[8]首先报道, 在正常人血浆中含量丰富[9]. 脂联素有AdipoR1和AdipoR2两种受体[10], 脂联素与其结合而发挥调节糖脂代谢、抗炎、抗动脉粥样硬化等作用. Tietge等[11]研究发现肝硬化时血清脂联素水平升高与肝纤维化临床分级正相关, 肝硬化Child A级的患者脂联素水平明显低于B和C级的患者; 血清脂联素水平仅与肝功能下降和肝的血流动力学有关. Kaser等[12]认为循环中脂联素水平仅反映肝脏病变的严重程度, 而不反映胰岛素的抵抗程度, 并认为脂联素水平升高是慢性肝病时机体一种抗炎机制的反映. 在CCl4诱导下, 脂联素基因敲除小鼠较野生小鼠更易发生纤维化, 脂联素也可以抑制转化生长因子和结缔组织生长因子的表达, 表明脂联素对预防肝纤维化有一定作用[13]. 有研究者发现, 静息状态的HSC可以表达脂联素mRNA, 合成脂联素蛋白; 活化的HSC几乎不表达脂联素; 通过转染使脂联素在活化的HSC中过表达, 发现HSC增殖减少, 凋亡增加, α-肌动蛋白(α-smooth muscle aorta, α-SMA)和增殖细胞核抗原表达均减少, 研究者认为脂联素可能通过维持HSC的静息状态以及诱导活化的HSC凋亡等途径, 抑制肝纤维化的发生[4]. 以上研究表明脂联素在肝纤维化中发挥重要作用.
而脂联素是否参与调节细胞外基质(extracellular matrix, ECM)、哪种ECM成分及作用机制, 还需要进一步研究. 肝纤维化是各种病因引起的慢性肝损伤所共有的病理改变, 特征是以胶原为主的ECM合成增多, 降解相对不足而在肝内沉积[14]. 正常肝组织间质的胶原为Ⅰ型及Ⅲ型胶原, 只分布在汇管区和肝小叶中央静脉周围. 随肝纤维化进展, 两者的含量明显增加, 尤以Ⅰ型增加更为明显. 我们前期研究发现外源性可抑制原代HSC的增殖, 增加MMP-13基因及蛋白表达而参与调节肝纤维化[15]. 但是脂联素是否影响其他ECM成分, 特别是Ⅰ型胶原以及作用机制还需要进一步研究. 因此本研究观察全长脂联素对LX-2细胞的COL-Ⅰ作用及作用机制, 进一步揭示脂联素在肝纤维化中的作用. 本研究发现全长脂素可以抑制LX-2细胞COL-Ⅰ基因及蛋白表达, 可以抑制LX-2细胞增殖, 促进其凋亡. 推测全长脂联素可能通过抑制LX-2细胞增殖及促进其凋亡, 而下调COL-Ⅰ基因及蛋白表达. 一般来说HSC可以从以下方面增加ECM合成, 增加单个细胞合成功能, 增加细胞数目(原位增殖或迁移), 细胞凋亡增加, 因而不能除外脂联素可直接抑制HSC合成分泌COL-Ⅰ, 其机制尚待进一步研究. 此外本研究只探讨脂联素与COL-Ⅰ的作用, 脂联素是否通过其他机制, 特别是与调节ECM合成降解关系密切的MMP13与TIMP1的合成与表达而发挥抗纤维化作用, 还需要进一步研究. 脂联素抑制HSC增殖机制可能是通过达AdipoR1/AdipoR2, AMPK途径[16]. caspase3(又称CPP3, 2Yama, apopain)被认为是各种凋亡刺激因子激活的caspase家族中的关键蛋白酶. 为验证脂联素诱导HSC凋亡机制, 我们检测caspase3蛋白表达, 结果显示P7-Adiponectin组caspase3活性蛋白形式明显升高. 因此可以推测脂联素可以通过caspase3的激活诱导HSC的凋亡. 然而具体的凋亡信号通路本研究未进行深入阐述. 一般认为, 细胞凋亡存在3条主要通: 线粒体通路、内质网通路和死亡受体通路, 各通路间互相联系, 共同调节细胞凋亡[17]. 至于脂联素通过那条途径诱导HSC凋亡有待深入研究. 近来研究表明线粒体是细胞生命活动的控制中心也是细胞凋亡的调控中心, 线粒体信号通路在是否参与脂联素调节HSC凋亡有待深入探讨.
总之, 脂联素在肝纤维化的形成中发挥重要作用, 深入研究其作用及作用机制, 可为肝纤维化的治疗提供新的靶点及理论基础. 外源性脂联素及其激动剂有望应用于肝纤维化及其并发症的治疗.
脂联素是由脂肪组织分泌的具有生物活性的一种蛋白因子, 具有调节糖脂代谢、炎症及免疫反应的作用. 近来研究发现脂联素能维持肝星状细胞的静息状态, 抑制其的迁移和增殖, 减少转化生长因子的基因表达, 显示其潜在的抗纤维化作用.
秦成勇, 教授, 山东省立医院消化内科; 谢敏, 主任医师, 南京大学医学院附属鼓楼医院普外科
Tietge等研究发现肝硬化时血清脂联素水平升高与肝纤维化临床分级正相关, 肝硬化Child A级的患者脂联素水平明显低于B和C级的患者; 血清脂联素水平仅与肝功能下降和肝的血流动力学有关.
胶原是细胞外基质的最重要成分. 肝纤维化和肝硬化时, 胶原蛋白显著增加, 以Ⅰ、 Ⅲ胶原为主, 肝纤维化早期以Ⅲ型为主, 后期以Ⅰ型为主. 脂联素对I型胶原的作用国内外研究尚少, 其机制国内外尚未见研究报道.
脂联素可以促进Ⅰ型胶原降解, 抑制HSC增殖, 促进其凋亡, 在慢性肝病及肝纤维化中发挥保护作用. 推测给予外源性脂联素及其激动剂, 在肝纤维化治疗中具有潜在应用价值.
本文设计合理, 方法得当, 具有一定的临床借鉴意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Tilg H, Moschen AR. Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nat Rev Immunol. 2006;6:772-783. [PubMed] [DOI] |
| 2. | Matsuzawa Y, Funahashi T, Kihara S, Shimomura I. Adiponectin and metabolic syndrome. Arterioscler Thromb Vasc Biol. 2004;24:29-33. [PubMed] [DOI] |
| 3. | Handy JA, Saxena NK, Fu P, Lin S, Mells JE, Gupta NA, Anania FA. Adiponectin activation of AMPK disrupts leptin-mediated hepatic fibrosis via suppressors of cytokine signaling (SOCS-3). J Cell Biochem. 2010;110:1195-1207. [PubMed] [DOI] |
| 4. | Ding X, Saxena NK, Lin S, Xu A, Srinivasan S, Anania FA. The roles of leptin and adiponectin: a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol. 2005;166:1655-1669. [PubMed] [DOI] |
| 5. | Potter JJ, Mezey E. Acetaldehyde increases endogenous adiponectin and fibrogenesis in hepatic stellate cells but exogenous adiponectin inhibits fibrogenesis. Alcohol Clin Exp Res. 2007;31:2092-2100. [PubMed] [DOI] |
| 6. | Adachi M, Brenner DA. High molecular weight adiponectin inhibits proliferation of hepatic stellate cells via activation of adenosine monophosphate-activated protein kinase. Hepatology. 2008;47:677-685. [PubMed] [DOI] |
| 8. | Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem. 1995;270:26746-26749. [PubMed] [DOI] |
| 9. | Maeda K, Okubo K, Shimomura I, Funahashi T, Matsuzawa Y, Matsubara K. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (AdiPose Most abundant Gene transcript 1). Biochem Biophys Res Commun. 1996;221:286-289. [PubMed] [DOI] |
| 10. | Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature. 2003;423:762-769. [PubMed] [DOI] |
| 11. | Tietge UJ, Böker KH, Manns MP, Bahr MJ. Elevated circulating adiponectin levels in liver cirrhosis are associated with reduced liver function and altered hepatic hemodynamics. Am J Physiol Endocrinol Metab. 2004;287:E82-E89. [PubMed] [DOI] |
| 12. | Kaser S, Moschen A, Kaser A, Ludwiczek O, Ebenbichler CF, Vogel W, Jaschke W, Patsch JR, Tilg H. Circulating adiponectin reflects severity of liver disease but not insulin sensitivity in liver cirrhosis. J Intern Med. 2005;258:274-280. [PubMed] [DOI] |
| 13. | Kamada Y, Tamura S, Kiso S, Matsumoto H, Saji Y, Yoshida Y, Fukui K, Maeda N, Nishizawa H, Nagaretani H. Enhanced carbon tetrachloride-induced liver fibrosis in mice lacking adiponectin. Gastroenterology. 2003;125:1796-1807. [PubMed] [DOI] |
| 15. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 16. | Caligiuri A, Bertolani C, Guerra CT, Aleffi S, Galastri S, Trappoliere M, Vizzutti F, Gelmini S, Laffi G, Pinzani M. Adenosine monophosphate-activated protein kinase modulates the activated phenotype of hepatic stellate cells. Hepatology. 2008;47:668-676. [PubMed] [DOI] |