修回日期: 2011-03-25
接受日期: 2011-04-11
在线出版日期: 2011-04-18
目的: 研究在体外条件下从大鼠胰腺导管分离的干细胞向胰岛素分泌细胞分化的产物细胞的形态、表型及功能.
方法: 采用胶原酶原位消化法消化大鼠胰腺, 差异贴壁法培养出胰腺导管来源干细胞(PDSCs), 对其进行形态学与表型鉴定. 采用无血清培养基, 添加Matrigel、exendin-4诱导干细胞向胰岛素分泌细胞分化, 鉴定产物细胞的形态、表型及功能.
结果: PDSCs在塑料培养皿内贴壁生长, 在含血清的培养基内高度增殖, 形态学上呈索形或纺锤形的成纤维样细胞, 表型上是一种表达PDX-1和nestin的间充质干细胞; 经无血清诱导培养, 其可分化为胰岛样细胞团并释放胰岛素, 但其胰岛素释放指数(SI)为1.35±0.27, 明显弱于新鲜分离的胰岛, 尚难满足胰岛移植的要求. 血清可以促进PDSCs的增殖但抑制其分化, Matrigel与exendin-4对其分化具有促进作用.
结论: PDSCs是一种表达PDX-1和nestin的间充质干细胞, 可在体外向胰岛素分泌细胞分化, 是一种潜在的新的胰岛来源.
引文著录: 金博, 王海江, 王琦三, 刘永锋, 程颖. 大鼠胰腺导管来源干细胞向胰岛素分泌细胞分化的体外培养. 世界华人消化杂志 2011; 19(11): 1130-1137
Revised: March 25, 2011
Accepted: April 11, 2011
Published online: April 18, 2011
AIM: To isolate and identify rat pancreatic duct-derived stem cells (PDSCs) and to induce their differentiation into insulin-secreting cells in vitro.
METHODS: The pancreas of rats underwent in situ collagenase digestion, and PDSCs were obtained by adherent cultivation. The morphology and phenotypes of PDSCs were characterized. PDSCs were then cultured in serum-free medium containing Matrigel and exendin-4 to induce their differentiation into insulin-secreting cells. The morphology, phenotypes, and functions of the obtained insulin-secreting cells were then characterized.
RESULTS: Rat PDSCs had a typical fibroblast-like shape, grew rapidly in an adherent manner in serum-containing medium, and belonged to mesenchymal stem cells (MSCs) which expressed PDX-1 and nestin. Serum-free cultivation could induce PDSCs to differentiate into islet-like cell clusters (ICCs) that possessed the capability of secreting insulin.
CONCLUSION: Rat PDSCs belong to MSCs which express PDX-1 and nestin and could differentiate into insulin-secreting cells in vitro.
- Citation: Jin B, Wang HJ, Wang QS, Liu YF, Cheng Y. Differentiation of rat pancreatic duct-derived stem cells into insulin-secreting cells in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1130-1137
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1130.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1130
糖尿病是严重威胁人类健康的疾病之一, 目前全球的糖尿病患者超过2亿, 我国有4 000多万. 胰岛移植被公认为治疗糖尿病的有效手段之一, 且与胰腺移植相比, 具有手术损伤性小、并发症少、可重复性好、住院时间短等优势[1]. 但供体短缺在很大程度上限制了胰岛移植的临床应用, 成为限制胰岛移植发展的"瓶颈". 据统计, 目前全球每年所进行的胰腺移植手术可达1 800例, 而胰岛移植手术还不足200例[2]. 这使新的胰岛来源的开发成为亟待解决的问题.
干细胞具有自我更新、高度增殖及多向分化潜能等特性, 可被大量扩增并诱导分化为能释放胰岛素的内分泌细胞, 故有望成为一种新的胰岛来源. 因此, 近年来干细胞逐渐成为糖尿病治疗的研究热点. 胰腺干细胞(pancreatic stem cell, PSC)被认为具有广阔的应用前景. 与胚胎干细胞相比, 成体PSC基本无成瘤性, 且不涉及伦理问题. 但至今, 关于PSC的起源、鉴定标准及向胰岛细胞定向分化的机制等问题仍未明确. 目前认为, PSC主要存在于胰腺导管和胰岛内部[3,4]. 其中, 胰腺导管来源干细胞(pancreatic duct-derived stem cell, PDSC)被认为有着更为广阔的应用前景. 临床所应用的胰岛需要与胰腺导管细胞进行分离, 而分离后的胰腺导管细胞则作为"废物"完全被丢弃. 因此, 胰腺导管细胞的回收利用可能为扩大胰岛来源开辟新的领域.
本研究拟以PDSC为研究对象, 对其进行体外培养与表型鉴定, 并诱导其向胰岛素分泌细胞分化, 确定产物细胞的形态、表型及功能.
成年♂Wistar大鼠, 体质量200-300 g, 由新疆医科大学实验动物中心提供. 胶原酶Ⅴ型(Sigma公司); Ficoll 400(Sigma公司); 胎牛血清(fetal bovine serum, FBS)(Hyclone公司); FITC标记的抗大鼠CD34、CD45、CD90(eBioscience公司)、CD105(Invitrogen公司); 流式细胞仪(FACSCalibur, BD Biosciences公司); TRIzol试剂(Bio Basic公司); RT-PCR试剂盒(Applied Biosystems公司); PCR仪(TC-XP-G, Bioer公司); Matrigel(BD Bioscience公司); exendin-4(Sigma公司); 全自动化学发光免疫分析仪(雅培AXSYM, 美国).
1.2.1 大鼠PDSC的分离与扩增培养: 采用胶原酶原位消化法(明尼苏达大学改良法)[5], 分离胰腺导管细胞. 成年♂Wistar大鼠, 麻醉后开腹, 靠近十二指肠结扎胰胆管(鼠类无独立胰管, 其胆管穿过胰腺收集胰液, 称胰胆管). 在肝门胆管分叉处逆行胰胆管插管, 缓慢(1 mL/min)灌注含冷却(4 ℃)胶原酶(胶原酶V型, 1.5 g/L)的Hank's缓冲液(HBSS)10-12 mL. 待整个胰腺膨胀后, 完整切取胰腺, 37 ℃消化12-15 min. 低温离心(8 ℃, 800 r/min, 2 min), 弃上清, HBSS清洗2次. 以600 μm不锈钢筛网过滤. 然后进行不连续密度梯度离心, 介质为浓度分别为25.0%、23.0%、20.5%、11.0%的Ficoll 400, 2 400 r/min, 10 min. 收集离心管底的细胞, RPMI 1640培养液稀释备用.
采用差异贴壁培养法[3], 将收集的细胞培养于含100 mL/L FBS的RPMI 1640培养基内, 其内还添加2 mmol/L谷氨酰胺, 10 mmol/L HEPES, 以及抗生素(100 kU/L青霉素、100 kU/L链霉素). 以无血清组为对照组. 培养瓶为未处理型(直接贴壁法), 12.5 cm2. 接种密度2 500/cm2. 每3-4 d换液1次. 采用消化法进行传代培养. 待贴壁的细胞生长至80%-90%融合时, 加入0.25 g/L胰酶+0.04% EDTA(1:1)消化, 按1:2的比例连续传代.
1.2.2 体外诱导PDSC向胰岛素分泌细胞分化: 取3代以后的PDSC按2×108/L的密度接种于6孔板中. 覆盖Matrigel基质胶(BD Bioscience), 50 μL/cm2, 37 ℃, 1 h. 添加诱导培养液: DMEM/F12(1:1)(HyClone), 10 mmol/L尼克酰胺(Sigma), 2 g/L小牛血清白蛋白(Solarbio), 10 μg/L角朊细胞生长因子(keratinocyte growth factor, KGF, Roche), 20 μg/L碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF, Peprotech), 10 nmol/L exendin-4(Sigma). 每3-4 d换液1次.
1.2.3 流式细胞术: 第5代PDSC生长至90%融合时, 0.1%Ⅰ型胶原酶消化脱壁. PBS洗涤2次, 分装入1.5 mL EP管, 1×105/管, 重悬于20 μL PBS. 分别加入FITC或PE标记的抗大鼠CD34、CD45、CD90、CD105(BD Biosciences). 4 ℃孵育30 min, FACSCalibur流式细胞仪上机检测, CellQuest软件分析结果.
1.2.4 免疫细胞化学: 采用SABC法. 原代和传代PDSC制作细胞爬片, 培养前的细胞团及诱导培养后的胰岛样细胞团(islet-like cell cluster, ICC)制作石蜡切片. 染色方法: 4%多聚甲醛固定1 h, 3% H2O2作用10 min, 以消除内源性过氧化物酶. 滴加5% BSA封闭液, 室温20 min. 滴加适当稀释的一抗(兔多克隆抗CK-19, 1:100; 兔单克隆抗大鼠PDX-1(1:200); 兔单克隆抗大鼠胰岛素, 1:100)(Boster), 37 ℃, 1 h. 滴加生物素化山羊抗兔IgG, 37 ℃, 20 min. 滴加试剂SABC, 37 ℃, 20 min. DAB显色, 苏木素复染, 显微镜观察.
1.2.5 RT-PCR的鉴定: 取培养前细胞、第5代PDSC及诱导培养14 d的ICC进行鉴定. 细胞溶于1 mL TRIzol试剂(Bio Basic), 取1 μg总RNA, 以TaqMan逆转录试剂(Applied Biosystems)合成cDNA. 按试剂盒说明书进行PCR, 鉴定CK-19、PDX-1、巢蛋白(nestin)、胰岛素的表达. 利用Primer 5软件设计基因引物, 大连宝生物工程有限公司合成, 引物序列如下: CK-19, (f)5'-CTG GGT GGC AAT GAG AAG AT-3', (r)5'-TCA AAC TTG GTC CGG AAG TC-3'; PDX-1, (f)5'-GGT GCC AGA GTT CAG TGC TAA-3', (r)5'-CCA GTC TCG GTT CCA TTC G-3'; nestin, (f)5'-GAGTGGGGTAGATGGGGATT-3', (r)5'-CAGGGAGGAAGAGAGGAACA-3'; 胰岛素, (f)5'-CCG TCG TGA AGT GGA G-3', (r)5'-CAG TTG GTA GAG GGA GCA G-3'; β-actin, (f)5'-AGA ACA TCA TCC CTG CAT CC-3', (r)5'-ACC CTG TTG CTG TAG CCA TA-3'.
1.2.6 双硫腙染色: 收集诱导培养2 wk的ICC, 置于诱导培养基内, 每1 mL培养基加10 μL双硫腙(Dithizone, DTZ)原液(20 mg DTZ:6 mL无水乙醇:100 μL浓缩型氨水), 37 ℃孵育15 min, 倒置显微镜下观察细胞着色情况.
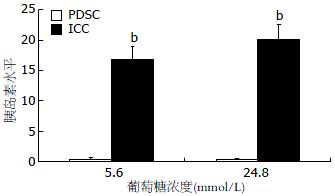
1.2.7 放射免疫化学发光法测定胰岛素水平: 测定细胞外液与细胞裂解后液体上清的胰岛素水平, 对诱导培养2 wk的ICC进行测定. 以未诱导PDSC的培养液作对照. 收集悬浮细胞, 离心后置于12孔板内. 添加低糖(5.6 mmol/L)DMEM培养基, 37 ℃孵育4 h. 收集上清, -70 ℃保存. 培养基更换为高糖(24.8 mmol/L)DMEM培养基, 37 ℃孵育4 h. 收集上清, -70 ℃保存. 全自动化学发光免疫分析仪(雅培AXSYM)测定细胞外液胰岛素水平. 收集悬浮细胞, 加入酸乙醇溶液(细胞裂解液), 于冰上裂解30 min. 测定上清胰岛素水平(细胞内液). 采用BCA法(试剂盒购自Pierce公司)测定细胞总蛋白浓度.
统计学处理 所有数据以mean±SD表示, 进行独立样本t检验与单因素方差分析, 以P<0.05为有统计学差异. 以SPSS12.0软件进行统计学处理.
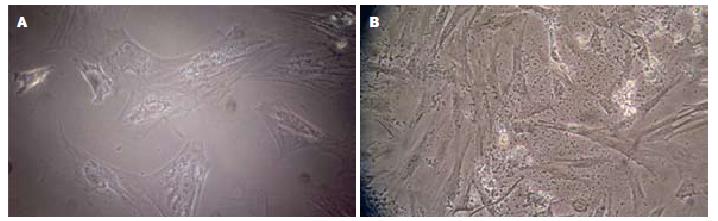
原代培养2-3 d后, 含血清组培养皿内的贴壁细胞清晰可见, 贴壁的PDSC体积较大, 多为单个核. 光镜下细胞呈纺锤形或梭形, 类似成纤维样细胞(图1A). 而对照组几乎无细胞贴壁. 细胞呈单层贴壁生长(图1B), 原代培养10 d左右, 细胞生长接近融合. 传代以后贴壁的PDSC的形态更为均一, 且不同代数的细胞在形态上无显著差异. 细胞增殖速度较快, 每5-7 d即可传一代. 细胞连续传至10代, 未见明显衰老征象(如细胞体积增大, 形态不均一, 细胞内颗粒增多, 细胞增殖速度减慢等).
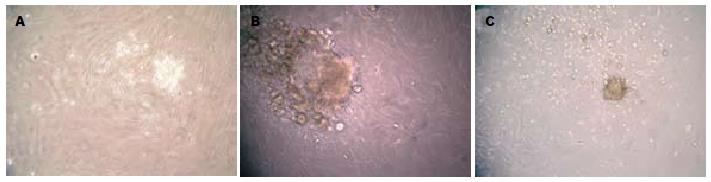
融合后的PDSC覆盖Matrigel基质胶后第3天, 可见贴壁细胞的生长出现极性, 开始相互聚集(图2A). 第5天, 可见细胞聚集形成的细胞团的轮廓出现. 第10天, 可见立体的3D球状结构ICC形成, 直径50-350 μm不等(图2B). 诱导培养12-14 d, 部分体积较大的ICC开始脱壁, 呈悬浮生长, 与新鲜分离的胰岛相似, ICC周围可见很多小的圆形细胞, 呈悬浮生长, 与贴壁的PDSC有较大差异(图2C). 在含血清组, 覆盖Matrigel后, 可见部分贴壁细胞形状变圆, 但未见明显的聚集趋势; 诱导培养2 wk, 无细胞团样结构形成.
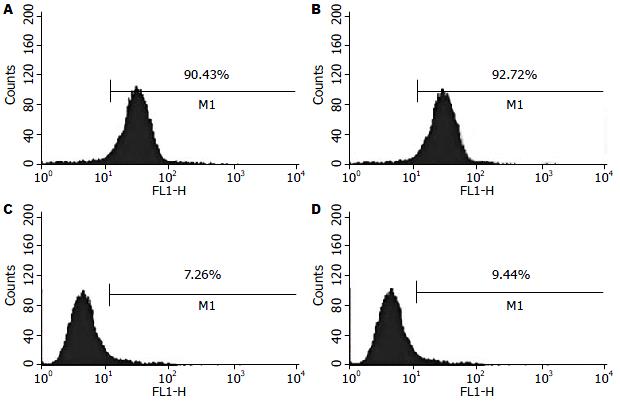
对第5代PDSC的检测结果显示, PDSC呈CD90阳性(90.43%)、CD105阳性(92.72%); CD34阴性(7.26%)、CD45阴性(9.44%)(图3). 提示PDSC表达CD90、CD105, 不表达CD34、CD45.
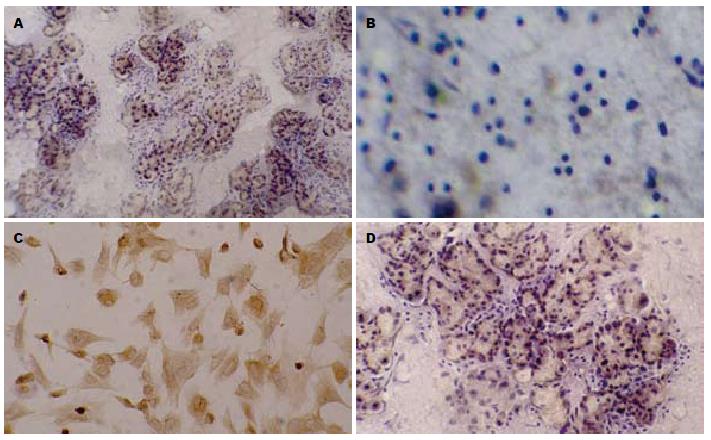
在培养前的细胞团内, CK-19阳性细胞在数量上占有绝对优势(图4A). 但传代后, 贴壁细胞呈CK-19阴性(图4B). 第3代PDSC呈PDX-1阳性, 胞质与胞核均着色(图4C). 诱导分化培养2 wk后, ICC内可见胰岛素阳性细胞分布(图4D).
PDX-1与nestin在mRNA水平的表达贯穿体外培养的全程, 在培养前细胞团、传代PDSC、分化培养2 wk的ICC均有表达. 而CK-19、胰岛素的表达, 则分别局限于培养前细胞团、分化产物ICC内(图5).
在低糖环境(5.6 mmol/L)和高糖环境(24.8 mmol/L)下, 诱导培养2 wk ICC的孵育液上清胰岛素水平均明显高于未诱导PDSC的孵育液上清胰岛素水平(低糖: 16.71± 2.21 vs 0.37±0.17, P<0.01; 高糖: 20.20±2.40 vs 0.30±0.14, P<0.01, 图7), 但ICC的胰岛素释放指数明显低于新鲜分离的胰岛(1.35±0.27 vs 3.41±0.69, P<0.01). 细胞裂解后测得培养液上清胰岛素水平, 除以细胞总蛋白进行标准化处理, 获得标准化数值. 未诱导PDSC蛋白为0.13 ng/mg±0.02 ng/mg, 诱导培养2 wk ICC蛋白为11.12 ng/mg±2.01 ng/mg, 二者存在显著性差异(P<0.01).
据报道, 1型糖尿病和2型糖尿病的胰岛失功率分别为0%-98%、0%-65%[6], 这成为细胞替代治疗即胰岛移植的病理生理学基础. 但遗体供胰缺乏的问题日益突出, 使新的胰岛来源的开发成为亟待解决的问题. 干细胞的发现为扩大胰岛来源提供了新的思路, 其中PSC, 尤其是PDSC, 凭借其广阔的应用前景, 正逐渐成为研究的热点.
间充质干细胞(mesenchymal stem cell, MSC)作为一种成体干细胞, 存在于多种组织内, 如骨髓、脂肪、真皮、肌肉、外周血、密质骨等[7-9]. 2006年, 国际细胞治疗协会(international society for cellular therapy, ISCT)确定MSC的鉴定标准为[7,10]: (1)在塑料培养皿内, 贴壁生长, 在含血清的培养基内, 高度增殖; (2)表达CD105、CD73、CD90, 不表达CD45、CD34、CD14或CD11β、CD79α或CD19; (3)在体外可以分化为成骨细胞、脂肪细胞、软骨细胞. 根据本研究的结果, 鉴于PDSC在塑料培养皿内贴壁生长, 在含血清培养基内迅速增殖; 表达CD90、CD105, 不表达CD34、CD45. 故PDSC在生长行为和表型上符合MSC的鉴定标准, 支持PDSC是一种MSC, 与Seeberger等的研究结果相一致[11,12]. 另一方面, 据报道, 胰岛来源前体/干细胞(islet-derived precursor cell, IPC)也是一种MSC[13]. 因此, 目前的研究结果提示, PSC(包括PDSC与IPC)是一种MSC.
至今, 胰腺组织来源的MSC的起源仍未明确. 上皮向间质转化(epithelial-to-mesenchymal transition, EMT)常被用于对成体干细胞及肿瘤细胞的发生进行解释. 成体的上皮细胞可能通过EMT的方式, 由上皮细胞表型去分化为间质细胞表型, 从而获得高度增殖能力和多向分化潜能, 以实现细胞的大量扩增, 并根据细胞外微环境重新编程而向不同细胞分化, 甚至跨谱系转分化[14]. 在本研究, 培养过程中的细胞由培养前和原代的CK-19阳性, 至传代培养后的CK-19阴性MSC, 提示PDSC可能经历了由导管上皮细胞表型(CK-19阳性)向间充质细胞表型(CK-19阴性MSC)的去分化, 符合EMT的机制. 因此, PDSC作为一种MSC, 可能以EMT的方式起源于胰腺导管上皮细胞. 而关于IPC的起源, 起初认为可能由胰岛β细胞以EMT的方式生成. 但到目前为止, 仍未找到β细胞发生EMT的确凿证据[15-17], 提示IPC可能起源于胰岛内的非β细胞. 而另一方面, 鉴于以目前的胰岛分离纯化技术, 无法获得纯胰岛组织, 纯度至多不超过90%, 故尚难以排除IPC起源于混杂的非胰岛细胞, 尤其是胰腺导管上皮细胞的可能性, 即所谓的IPC可能也是PDSC.
PDX-1作为一种同源域蛋白, 是在胰腺发育早期即开始表达的一个转录因子. 自腹胰芽和背胰芽形成后, PDX-1即在胰腺导管及胰岛内部表达, 在胃窦和十二指肠上皮中亦有表达. PDX-1在胰岛细胞发育、成熟过程中持续高表达. 他是胚胎胰腺内分泌组织发育的关键转录因子, 是β细胞在胰腺内聚集和发育的必要条件, 并作为β细胞特异性的葡萄糖反应性基因转录调节子而参与Langerhans胰岛的发育与成熟[18]. 如果缺乏PDX-1, 胰腺不能正常发育并无法与其他器官分界. 敲除PDX-1基因的脊椎动物, 出生以后根本无胰腺形成[19]. 成体胰腺中PDX-1的表达与胰腺的再生关系密切. 胰腺切除90%后, 24 h即可出现PDX-1阳性的细胞, 72 h后大量上皮细胞丧失阳性成体细胞的特征, 表现为PDX-1阳性的细胞[20]. 急性坏死性胰腺炎胰腺细胞再生过程中也发现大量表达PDX-1的细胞[21]. 将PDX-1基因转染入肝细胞后, 肝细胞亦可以表达胰岛素基因[22]. 故目前认为, 表达PDX-1的细胞具有干细胞或前体细胞特性, 具有向胰岛β分化的潜能. 本研究中, PDX-1在mRNA水平的表达贯穿体外培养的全程, 在传代PDSC呈明显强表达. 提示培养前的细胞团内即有PDX-1阳性细胞存在, 可能是细胞分离过程中的损伤诱导了PDX-1的表达. PDX-1在传代PDSC的强表达, 反应了PDSC的干细胞特性. 而PDX-1在诱导培养后细胞内的表达, 则反应了产物细胞的未成熟性. 因此, PDSC应表达PDX-1, 但由于PDX-1广泛表达于不同分化程度的细胞内, 其单独表达尚不足以鉴定PDSC.
nestin是一种表达于神经干细胞的中间丝蛋白, 近年也被视为内分泌前体细胞的标志. 在胚胎发育过程中, nestin主要在干细胞迁移和增殖过程中表达; 在成体组织中, nestin主要局限于再生组织. 尽管哪些因素调节nestin尚不清楚, 但可以肯定, nestin的表达意味着细胞具有向多系分化和再生的潜能[23]. 从成年大鼠胰岛组织中分离出nestin阳性的细胞进行培养, 可诱导其表达各种胰岛激素, 并在一定条件下分化为胰腺的内、外分泌细胞以及肝细胞. Abraham等[24]将由人胰腺导管上皮和胰岛中分离出的nestin阳性细胞称为NIP细胞(nestin-positive islet-derived precursor cells). NIP细胞不表达导管细胞标志CK-19, 也不表达成熟胰岛细胞的标志, 但可以共表达胰岛细胞早期分化标志PDX-1. 而Suzuki等的研究发现在成体胰腺的内皮细胞中亦有nestin表达, 提示nestin抗原表达于广泛的前体细胞亚群, 包括已分化细胞[4]. 而在胰腺内, nestin是否特异性表达于PSC尚存在争议. 故作为PSC的分子标志, nestin的特异性不如PDX-1, 但nestin与PDX-1的同时表达被认为与干细胞向胰岛β细胞的分化潜能密切相关[12].
本研究结果显示PDSC可在体外长期培养, 并维持高度增殖能力. 但在无血清培养基内, 几乎无细胞贴壁. 提示血清对于PDSC的贴壁和增殖是必需的. 血清的主要成分包括: (1)营养物质: 氨基酸、脂类、核酸衍生物、维生素、矿物质等; (2)激素: 胰岛素、肾上腺皮质激素、类固醇激素等; (3)生长因子: 碱性成纤维细胞生长因子、上皮生长因子、血小板生长因子等; (4)结合蛋白: 白蛋白、转铁蛋白等; (5)促连接与延伸因子: 在细胞贴壁和集落形成过程中发挥重要作用. 因此, 血清可以为细胞的生长增殖提供适宜的微环境, 几乎被应用于所有干细胞或前体细胞的扩增培养. 本研究, 在诱导培养基内添加血清后, 未见细胞聚集及ICC形成, 提示血清抑制了PDSC的分化. 目前已知各种激素、生长因子及结合蛋白均促进干细胞的分化, 故推测促连接与延伸因子可能是血清内抑制干细胞分化的物质. 目前认为, PSC在体内的扩增和分化需要在不同的微环境内实现, 即含血清与不含血清, 亦或血清内的某种因子活化与失活的不同微环境. 本研究提升, PDSC的体外扩增为血清依赖性, 而PDSC的体外分化需在无血清条件下实现.
经RT-PCR、免疫细胞化学及DTZ染色结果证实, 诱导培养2 wk的产物细胞ICC在mRNA及蛋白分子水平皆表达胰岛素. 而ICC在细胞内胰岛素含量上明显高于未诱导PDSC, 提示PDSC经过诱导培养后, 获得了合成胰岛素的功能. 另一方面, ICC在细胞外液胰岛素水平上亦明显高于未诱导PDSC, 提示ICC具备将细胞内的胰岛素释放至细胞外的功能. 因此, ICC是一种胰岛素分泌细胞. 但葡萄糖刺激下胰岛素释放试验的结果显示, ICC的释放指数(SI)为1.35±0.27, 明显弱于新鲜分离的胰岛(3.41±0.69), 提示ICC仍是未成熟细胞, 其功能仍难以满足细胞替代治疗的要求.
此外, 本研究提示Matrigel与exendin-4对PDSC向ICC分化具有良好的促进作用. Matrigel是一种细胞外基质, 其主要成分为层粘连蛋白, 同时还含有Ⅳ型胶原、硫酸乙酰肝素、内功素, 以及多种生长因子, 如TGF-β、上皮生长因子、胰岛素样生长因子、成纤维细胞生长因子、组织纤维蛋白溶酶原激活子等. 他可以促进各种细胞贴壁, 包括上皮样细胞、神经元、肝细胞、血管内皮细胞等; 还可以促进细胞相互聚集并形成立体空间结构, 为细胞分化提供适宜的微环境. 胰高血糖素样肽(glucagon-like peptide-1, GLP-1), 一种来源于胰高血糖素原的肠促胰岛素, 由肠道L细胞分泌, 可以与胰岛β细胞的GLP-1受体结合, 而发挥促进胰岛β细胞释放胰岛素的功能, 从而参与胰腺内分泌微环境的调节. 在成体胰腺内, GLP-1通过上调PDX-1的表达而诱导IPC向β细胞分化, 从而促进胰岛β细胞的再生[25-29]. exendin-4是GLP-1的一种长效异构体, 在功效上优于GLP-1, 目前被认为对糖尿病具有潜在的治疗作用[30].
胰岛移植所取得的成绩是有目共睹的. 目前, 胰岛移植面临着供体短缺、排斥反应等难题. 干细胞凭借其高度增殖性及多向分化潜能, 为扩大胰岛来源开辟了新的领域. 而干细胞工程的不断发展, 将可能实现成体干细胞系及干细胞库的建立, 从而实现胰岛移植供、受体间配型的优化, 继而减轻甚至避免排斥反应. PDSC可在体外大量扩增, 经诱导培养后, 分化为胰岛素分泌细胞, 表达并释放胰岛素. 因此, PDSC是一种潜在的新的胰岛来源. 然而, 至今仍无可靠标准用于PDSC的筛选分离, 且诱导培养的效果始终不理想. 但随着干细胞研究的逐步深入, PDSC鉴定体系的建立与完善, 诱导培养方法的不断改进, 如基因工程技术的革新, 动力性三维培养的应用, 体内胎胰微环境的模拟等, 必将为胰岛移植彻底治愈糖尿病带来新的希望.
胰岛移植治疗糖尿病的有效性要以充足的胰岛移植量为前提. 以目前的胰岛分离纯化技术, 2-3个供胰提取的胰岛才能满足1个受体的需求. 供体短缺问题的持续存在在很大程度上限制了胰岛移植的临床应用, 使新的胰岛来源的开发成为亟待解决的问题. 干细胞可能成为一种新的胰岛来源. 目前, 临床所应用的胰岛需要与胰腺导管细胞进行分离, 而分离后的胰腺导管细胞则作为"废物"完全被丢弃. 因此胰腺导管来源干细胞(PDSC)有着非常广阔的应用前景.
王志刚, 副主任医师, 上海市第六人民医院普外科
干细胞的发现为扩大胰岛来源提供了新的思路, 其中PSC, 尤其是PDSC, 凭借其广阔的应用前景, 正逐渐成为研究的热点.
Suzuki等的研究发现在成体胰腺的内皮细胞中亦有nestin表达, 提示nestin抗原表达于广泛的前体细胞亚群, 包括已分化细胞.
本研究结果显示: 大鼠胰腺导管来源干细胞是一种表达PDX-1和nestin的间充质干细胞, 可被体外诱导分化为葡萄糖反应性胰岛素分泌细胞, 血清为其增殖所必需但抑制其分化, Matrigel与exendin-4促进其分化.
本文证明可从大鼠胰腺导管分离培养出干细胞并体外诱导其向胰岛素分泌细胞分化, 为扩大胰岛来源指出了方向; 提出大鼠胰腺导管来源干细胞是一种表达PDX-1和nestin的间充质干细胞, 为其鉴定提供了实验资料; 提出血清对其增殖及分化的影响, 对体外培养方法具有指导意义; 本研究提出大鼠胰腺导管来源干细胞可向胰岛素分泌细胞分化, 但产物细胞尚难满足胰岛移植的要求, 其培养方法尚有待进一步改善.
本文设计合理, 方法可靠, 结果可信, 有一定的学术价值.
编辑: 李薇 电编:何基才
| 1. | Shapiro AM, Ricordi C, Hering BJ, Auchincloss H, Lindblad R, Robertson RP, Secchi A, Brendel MD, Berney T, Brennan DC. International trial of the Edmonton protocol for islet transplantation. N Engl J Med. 2006;355:1318-1330. [PubMed] [DOI] |
| 2. | Bonner-Weir S, Weir GC. New sources of pancreatic beta-cells. Nat Biotechnol. 2005;23:857-861. [PubMed] [DOI] |
| 3. | Lechner A, Habener JF. Stem/progenitor cells derived from adult tissues: potential for the treatment of diabetes mellitus. Am J Physiol Endocrinol Metab. 2003;284:E259-E266. [PubMed] |
| 4. | Humphrey RK, Bucay N, Beattie GM, Lopez A, Messam CA, Cirulli V, Hayek A. Characterization and isolation of promoter-defined nestin-positive cells from the human fetal pancreas. Diabetes. 2003;52:2519-2525. [PubMed] [DOI] |
| 5. | Deltour L, Leduque P, Paldi A, Ripoche MA, Dubois P, Jami J. Polyclonal origin of pancreatic islets in aggregation mouse chimaeras. Development. 1991;112:1115-1121. [PubMed] |
| 6. | Butler AE, Huang A, Rao PN, Bhushan A, Hogan WJ, Rizza RA, Butler PC. Hematopoietic stem cells derived from adult donors are not a source of pancreatic beta-cells in adult nondiabetic humans. Diabetes. 2007;56:1810-1816. [PubMed] [DOI] |
| 7. | Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, Alfonso ZC, Fraser JK, Benhaim P, Hedrick MH. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002;13:4279-4295. [PubMed] [DOI] |
| 8. | De Ugarte DA, Alfonso Z, Zuk PA, Elbarbary A, Zhu M, Ashjian P, Benhaim P, Hedrick MH, Fraser JK. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow. Immunol Lett. 2003;89:267-270. [PubMed] [DOI] |
| 9. | Javazon EH, Beggs KJ, Flake AW. Mesenchymal stem cells: paradoxes of passaging. Exp Hematol. 2004;32:414-425. [PubMed] [DOI] |
| 10. | Danner S, Kajahn J, Geismann C, Klink E, Kruse C. Derivation of oocyte-like cells from a clonal pancreatic stem cell line. Mol Hum Reprod. 2007;13:11-20. [PubMed] [DOI] |
| 11. | Seeberger KL, Dufour JM, Shapiro AM, Lakey JR, Rajotte RV, Korbutt GS. Expansion of mesenchymal stem cells from human pancreatic ductal epithelium. Lab Invest. 2006;86:141-153. [PubMed] [DOI] |
| 12. | Lin HT, Chiou SH, Kao CL, Shyr YM, Hsu CJ, Tarng YW, Ho LL, Kwok CF, Ku HH. Characterization of pancreatic stem cells derived from adult human pancreas ducts by fluorescence activated cell sorting. World J Gastroenterol. 2006;12:4529-4535. [PubMed] |
| 13. | Davani B, Ikonomou L, Raaka BM, Geras-Raaka E, Morton RA, Marcus-Samuels B, Gershengorn MC. Human islet-derived precursor cells are mesenchymal stromal cells that differentiate and mature to hormone-expressing cells in vivo. Stem Cells. 2007;25:3215-3222. [PubMed] [DOI] |
| 14. | Gershengorn MC, Hardikar AA, Wei C, Geras-Raaka E, Marcus-Samuels B, Raaka BM. Epithelial-to-mesenchymal transition generates proliferative human islet precursor cells. Science. 2004;306:2261-2264. [PubMed] [DOI] |
| 15. | Chase LG, Ulloa-Montoya F, Kidder BL, Verfaillie CM. Islet-derived fibroblast-like cells are not derived via epithelial-mesenchymal transition from Pdx-1 or insulin-positive cells. Diabetes. 2007;56:3-7. [PubMed] [DOI] |
| 16. | Atouf F, Park CH, Pechhold K, Ta M, Choi Y, Lumelsky NL. No evidence for mouse pancreatic beta-cell epithelial-mesenchymal transition in vitro. Diabetes. 2007;56:699-700. [PubMed] [DOI] |
| 17. | Weinberg N, Ouziel-Yahalom L, Knoller S, Efrat S, Dor Y. Lineage tracing evidence for in vitro dedifferentiation but rare proliferation of mouse pancreatic beta-cells. Diabetes. 2007;56:1299-1304. [PubMed] [DOI] |
| 18. | Madsen OD. Pancreas phylogeny and ontogeny in relation to a 'pancreatic stem cell'. C R Biol. 2007;330:534-537. [PubMed] [DOI] |
| 19. | Offield MF, Jetton TL, Labosky PA, Ray M, Stein RW, Magnuson MA, Hogan BL, Wright CV. PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum. Development. 1996;122:983-995. [PubMed] |
| 20. | Liu T, Wang C, Wan C, Xiong J, Xu Y, Zhou F. PDX-1 expression in pancreatic ductal cells after partial pancreatectomy in adult rats. J Huazhong Univ Sci Technolog Med Sci. 2004;24:464-466. [PubMed] [DOI] |
| 21. | Kodama S, Toyonaga T, Kondo T, Matsumoto K, Tsuruzoe K, Kawashima J, Goto H, Kume K, Kume S, Sakakida M. Enhanced expression of PDX-1 and Ngn3 by exendin-4 during beta cell regeneration in STZ-treated mice. Biochem Biophys Res Commun. 2005;327:1170-1178. [PubMed] [DOI] |
| 22. | Ferber S, Halkin A, Cohen H, Ber I, Einav Y, Goldberg I, Barshack I, Seijffers R, Kopolovic J, Kaiser N. Pancreatic and duodenal homeobox gene 1 induces expression of insulin genes in liver and ameliorates streptozotocin-induced hyperglycemia. Nat Med. 2000;6:568-572. [PubMed] [DOI] |
| 23. | Zhang L, Hong TP, Hu J, Liu YN, Wu YH, Li LS. Nestin-positive progenitor cells isolated from human fetal pancreas have phenotypic markers identical to mesenchymal stem cells. World J Gastroenterol. 2005;11:2906-2911. [PubMed] |
| 24. | Abraham EJ, Leech CA, Lin JC, Zulewski H, Habener JF. Insulinotropic hormone glucagon-like peptide-1 differentiation of human pancreatic islet-derived progenitor cells into insulin-producing cells. Endocrinology. 2002;143:3152-3161. [PubMed] [DOI] |
| 25. | Hui H, Wright C, Perfetti R. Glucagon-like peptide 1 induces differentiation of islet duodenal homeobox-1-positive pancreatic ductal cells into insulin-secreting cells. Diabetes. 2001;50:785-796. [PubMed] [DOI] |
| 26. | Stoffers DA, Kieffer TJ, Hussain MA, Drucker DJ, Bonner-Weir S, Habener JF, Egan JM. Insulinotropic glucagon-like peptide 1 agonists stimulate expression of homeodomain protein IDX-1 and increase islet size in mouse pancreas. Diabetes. 2000;49:741-748. [PubMed] [DOI] |
| 27. | Xu G, Stoffers DA, Habener JF, Bonner-Weir S. Exendin-4 stimulates both beta-cell replication and neogenesis, resulting in increased beta-cell mass and improved glucose tolerance in diabetic rats. Diabetes. 1999;48:2270-2276. [PubMed] [DOI] |
| 28. | Zhou J, Wang X, Pineyro MA, Egan JM. Glucagon-like peptide 1 and exendin-4 convert pancreatic AR42J cells into glucagon- and insulin-producing cells. Diabetes. 1999;48:2358-2366. [PubMed] [DOI] |
| 29. | Greig NH, Holloway HW, De Ore KA, Jani D, Wang Y, Zhou J, Garant MJ, Egan JM. Once daily injection of exendin-4 to diabetic mice achieves long-term beneficial effects on blood glucose concentrations. Diabetologia. 1999;42:45-50. [PubMed] [DOI] |
| 30. | Gutniak MK, Svartberg J, Hellström PM, Holst JJ, Adner N, Ahrén B. Antidiabetogenic action of glucagon-like peptide-1 related to administration relative to meal intake in subjects with type 2 diabetes. J Intern Med. 2001;250:81-87. [PubMed] [DOI] |