修回日期: 2011-03-12
接受日期: 2011-03-23
在线出版日期: 2011-04-18
目的: 研究胃癌细胞来源的Exosome对同源肿瘤细胞增殖的影响, 初步探讨PI3K/Akt和MAPK/ERK信号转导通路在此过程中的作用.
方法: 采用离心超滤和蔗糖密度梯度离心的方法从胃癌MGC803细胞的上清液中分离出胃癌细胞来源的Exosome. 应用透射电子显微镜观察Exosome的形态, MTT检测细胞活力, Western blot检测蛋白的表达.
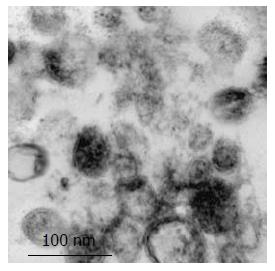
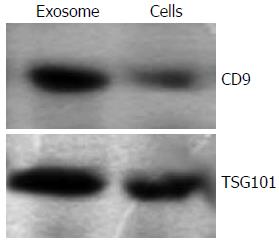
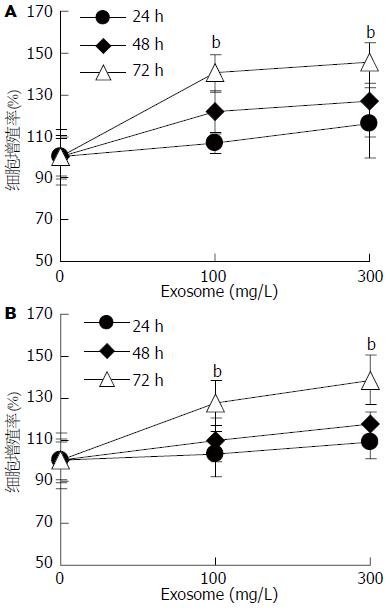
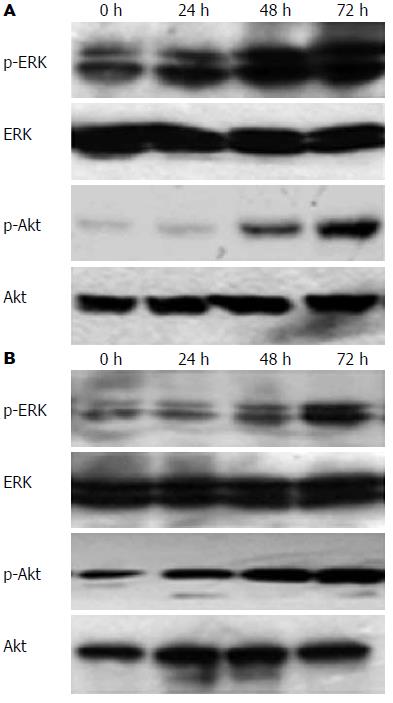
结果: 透射电子显微镜下观察胃癌MGC803细胞来源的Exosome具有特征性的盘状结构, 由双层膜构成, 他们的直径在30-100 nm. Western blot结果显示Exosome表面富含CD9和TSG101分子. Exosome能以时间和剂量依赖性的方式促进MGC803和其同源肿瘤细胞SGC7901细胞的增殖, 在此过程中伴随有磷酸化Akt和磷酸化ERK表达的上调.
结论: 胃癌细胞来源的Exosome能促进同源肿瘤细胞的增殖, 其机制可能与激活PI3K/Akt和MAPK/ERK信号转导通路有关.
引文著录: 曲晶磊, 张文, 刘云鹏, 曲秀娟, 侯科佐, 姜又红, 杨向红. PI3K/Akt和MAPK/ERK信号通路在胃癌细胞来源的Exosome促进同源肿瘤细胞增殖中的作用. 世界华人消化杂志 2011; 19(11): 1109-1114
Revised: March 12, 2011
Accepted: March 23, 2011
Published online: April 18, 2011
AIM: To investigate the effect of gastric cancer exosomes on homologous tumor cell proliferation and to evaluate the role of PI3K/Akt and MAPK/ERK pathways in this process.
METHODS: Exosomes were isolated and purified from human gastric cancer MGC803 cells by serial centrifugation and sucrose gradient ultracentrifugation and observed by electron microscopy. Cell proliferation was measured by MTT assay, and protein expression was assayed by Western blot.
RESULTS: Gastric cancer exosomes had a characteristic saucer-like shape that was limited by a lipid bilayer, and their diameter ranged from 30 to 100 nm. CD9 and TSG101 were abundantly distributed on the surface of exosomes. Gastric cancer exosomes significantly increased MGC803 and SGC7901 cell proliferation in a time- and dose-dependent manner. Treatment with exosomes up-regulated the expression of phosphorylated Akt and ERK in a time-dependent manner.
CONCLUSION: Gastric cancer exosomes promote homologous tumor cell proliferation possibly by activating the PI3K/Akt and MAPK/ERK pathways.
- Citation: Qu JL, Zhang W, Liu YP, Qu XJ, Hou KZ, Jiang YH, Yang XH. Role of PI3K/Akt and MAPK/ERK pathways in gastric cancer exosome-mediated promotion of tumor cell proliferation. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1109-1114
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1109
Exosome是由细胞分泌至胞外的膜性小囊泡, 起源于内吞途径中的多泡体, 通过多泡体与质膜融合释放至细胞外[1-3]. Exosome含有大量与其来源和功能密切相关的蛋白质和脂质成分[4-7], 作为细胞功能的使者, 参与多种病理生理过程[8-10]. 最近研究发现很多类型的细胞都能释放Exosome[11-13], 但是大多数研究集中在免疫细胞和肿瘤细胞释放的Exosome[14-18]. 关于肿瘤来源的Exosome的生物学功能, 国外和我们的研究均已证实: 肿瘤细胞分泌的Exosome和其来源的肿瘤细胞共同培养时, 能促进肿瘤细胞的增殖[19,20], 但对其他同源肿瘤细胞增殖的影响不清楚. 本研究以胃癌MGC803细胞为模型, 探讨胃癌细胞来源的Exosome对其分泌细胞和同源肿瘤细胞增殖的影响及PI3K/Akt和MAPK/ERK信号通路在此过程中的作用, 为进一步阐明Exosome的生物学功能提供理论依据.
RPMI 1640培养基购自Gibco公司, 胎牛血清购自天津血液病研究所. 100 000 Da MWCO Amicon超滤管购自美国Millipore公司, 重水购自美国Sigma公司. 鼠抗人CD9抗体和TSG101抗体购自Santa Cruz公司; 兔抗人p-Akt、Akt抗体和兔抗人p-ERK、ERK抗体购自Cell Signaling 公司; 辣根过氧化物酶标记的羊抗鼠二抗购自北京中杉金桥生物技术有限公司; ECL试剂盒购自Pierce公司.
1.2.1 细胞培养: 人低分化胃腺癌细胞株MGC803和SGC7901细胞为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清、12 kU/L庆大霉素的RPMI 1640培养液中, 于37 ℃、50 mL/L CO2、饱和湿度的培养箱内培养, 2.5 g/L胰酶消化液消化传代, 2-3 d传代1次. 所有实验均采用对数生长期细胞. 血清来源的Exosome去除采用两步法分离, 即10 000 g 30 min, 100 000 g l h.
1.2.2 Exosome的制备: 胃癌MGC803细胞培养48 h后收集细胞上清液用于Exosome的制备. 首先, 收集的上清液通过一系列离心去除细胞及碎片: 4 ℃, 300 g 10 min, 1 200 g 30 min, 10 000 g 30 min. 然后将上清液移入100 000 Da MWCO Amicon 50 mL超滤离心管中, 4 ℃离心, 1 000 g 30 min, 取浓缩液. 将超滤后液体移至含有30%蔗糖/重水垫的15 mL超速离心管中, 4 ℃ 100 000 g超速离心1 h. 收集底部含有Exosome的缓冲垫, 用至少5倍体积的PBS稀释后, 置于100 000 Da MWCO Amicon超滤离心管中, 4 ℃ 1 000 g离心30 min, 重复3次. 得到的浓缩液即为Exosome, 0.22 μm滤膜过滤除菌, Bradford法检测蛋白浓度, 分装备用, -80 ℃保存.
1.2.3 电镜: 将Exosome超速离心成沉淀后, 经固定液(2%多聚甲醛, 0.25%戊二醛)4 ℃固定1 h, PBS洗涤3次(15 min/次), 1%锇酸固定1.5 h, PBS洗涤3次(15 min/次), 梯度酒精脱水, 环氧树脂浸透过夜、包埋, 于35 ℃、45 ℃、60 ℃聚合24 h, 经超薄切片、铅铀染色后透射电镜下观察摄片.
1.2.4 MTT法检测细胞活力: 取对数生长期的MGC803和SGC7901细胞, 常规胰酶消化制成单细胞悬液, 将细胞浓度调至2.5×107/L接种于96孔板, 每孔180 μL, 培养12 h后分别加入终浓度为50、100、200和400 mg/L的Exosome. 设置空白、正常对照组(空白组除不加细胞外, 正常对照组除不加Exosome外, 其余均与Exosome实验组同样处理), 每组设4个复孔, 每孔终体积为200 μL. 分别培养48和72 h后每孔加入MTT溶液(5 g/L)20 μL, 继续孵育4 h后吸弃上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长条件下测定吸光度(A)值. 按下列公式计算细胞增殖率: 增殖率(%) = (处理组平均A值-空白组平均A值)/(对照组平均A值-空白组平均A值)×100%.
1.2.5 Western blot检测蛋白表达: 分别收集正常对照组和Exosome实验组细胞, 将其裂解于200 μL含有蛋白酶抑制剂(100 mg/L PMSF, 2 mg/L Aprotinin)的裂解液中[1% Triton X-100, 50 mmol/L Tris-HCl(pH7.4), 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4], 4 ℃裂解40 min, 15 000 r/min离心20 min, 取上清, Bradford法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 将样品在10%的SDS-聚丙烯凝胶中进行电泳3 h, 然后转印至硝酸纤维素膜上. 用5%脱脂牛奶封闭1 h后, 分别加入一抗, 4 ℃过夜. TTBS洗4次后加入辣根过氧化物酶标记的二抗, 室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示. 采用SPSS13.0统计软件进行统计学分析. 两组之间比较采用t检验, P<0.05有统计学意义.
胃癌MGC803细胞的上清液中分离出肿瘤来源的Exosome具有特征性的盘状结构, 由双层膜构成, 他们的直径为30-100 nm(图1).
Exosome以时间和剂量依赖性的方式促进MGC803和SGC7901细胞增殖, 100 mg/L和300 mg/L的Exosome处理MGC803细胞72 h, 细胞的增殖比率分别是正常对照组的139%(P<0.001)和145%(P<0.001, 图3A); 处理SGC7901细胞72 h, 细胞的增殖比率分别是正常对照组的127%(P<0.001)和138%(P<0.001, 图3B).
Exosome以时间依赖性的方式上调MGC803和SGC7901细胞中p-Akt和p-ERK的表达(图4).
Exosome作为一种亚细胞结构, 其独特的生物学特征已引起了人们极大的兴趣. 由于Exosome的膜性结构能阻止血清中的蛋白酶对其携带的蛋白分子如细胞因子等的降解[21,22], 所以Exosome可作为体内细胞之间信息传递的载体, 通过自分泌或旁分泌的方式作用于自身或远隔的靶细胞并调节其功能[23-25]. 目前越来越多的证据表明肿瘤来源的Exosome在肿瘤细胞的恶性增殖方面发挥着重要的作用[26-28]. Koga等[19]报道人乳腺癌BT-474细胞分泌的Exosome和BT-474细胞共同培养时, Exosome能附着在细胞表面并能促进BT-474细胞的增殖. 国外最新研究显示[29], 表达EGFRvⅢ的神经胶质瘤细胞能通过分泌的Exosome把自身携带的EGFRvⅢ转运给不表达EGFRvⅢ的胶质瘤细胞并促进其恶性增殖. 这些结果提示Exosome可能是肿瘤细胞之间传递恶性增殖信号的重要载体.
基于上述研究结果, 我们以胃癌MGC803细胞为模型, 采用离心超滤和蔗糖密度梯度离心的方法分离中肿瘤细胞来源的Exosome, 并从形态学和分子表达两方面进行了鉴定. 研究发现, 当胃癌MGC803细胞来源的Exosome与MGC803细胞在体外共同培养时, Exosome能以时间和剂量依赖性的方式促进MGC803细胞的增殖; 作用于胃癌SGC7901细胞, 同样能促进SGC7901细胞的增殖. 结果提示肿瘤来源的Exosome可能通过肿瘤细胞所共有的某些分子促进分泌细胞和同源肿瘤细胞的增殖, 进一步的研究发现在此过程中均存在PI3K/Akt和MAPK/ERK信号转导通路的持续活化.
细胞的存活主要取决于增殖和凋亡信号的平衡. PI3K/Akt和MAPK/ERK信号转导通路是细胞内两条重要的促增殖和抗凋亡通路[30,31], 通过影响下游细胞周期调节蛋白、凋亡相关蛋白等效应分子的活性, 在肿瘤细胞恶性增殖方面中起着重要的作用[32-34]. 我们既往研究表明, 胃癌SGC7901细胞来源的Exosome在促进SGC7901细胞增殖过程中激活了PI3K/Akt和MAPK/ERK通路, 抑制信号通路的活性能部分逆转Exosome促进肿瘤细胞增殖的作用[35]. 本研究中我们进一步探讨了胃癌MGC803细胞来源的Exosome在促进MGC803和SGC7901增殖过程中PI3K/Akt和MAPK/ERK信号通路的活性, 结果显示MGC803细胞来源的Exosome作用于上述两种胃癌细胞系均伴有PI3K/Akt和MAPK/ERK信号通路的活化, 提示Exosome可能通过上调PI3K/Akt和MAPK/ERK信号通路的活性而发挥促进肿瘤细胞增殖的作用.
总之, 本研究报道了胃癌细胞来源的Exosome不仅能促进分泌细胞的增殖, 而且能促进同源肿瘤细胞的增殖; 且在此过程中均伴有PI3K/Akt和MAPK/ERK信号通路的活化. 研究提示PI3K/Akt和MAPK/ERK通路可能是Exosome促进肿瘤细胞增殖的机制之一. 进一步研究胃癌细胞来源的Exosome促进胃癌细胞增殖的机制, 对阐明胃癌细胞自我调控的增殖机制和寻找治疗胃癌的新的靶分子具有重要的科学意义和潜在的临床应用价值.
肿瘤细胞分泌的Exosome能促进其分泌细胞的增殖, 但对其他同源肿瘤细胞增殖的影响不清楚.
田字彬, 教授, 青岛大学医学院附属医院消化内科
Koga等报道人乳腺癌BT-474细胞分泌的Exosome和BT-474细胞共同培养时, Exosome能附着在细胞表面并能促进BT-474细胞的增殖.
本研究首次报道了胃癌MGC803细胞来源的Exosome能促进自身和其同源肿瘤细胞的增殖, 且在此过程中均伴有PI3K/Akt和MAPK/ERK信号通路的活化.
本研究提示PI3K/Akt和MAPK/ERK通路可能是Exosome促进肿瘤细胞增殖的机制之一, 为深入研究胃癌细胞恶性增殖的分子机制提供了理论依据.
本文选题较好, 设计合理, 具有一定的科学和临床价值.
编辑: 李军亮 电编:何基才
| 1. | Lykke-Andersen S, Brodersen DE, Jensen TH. Origins and activities of the eukaryotic exosome. J Cell Sci. 2009;122:1487-1494. [PubMed] [DOI] |
| 2. | Fader CM, Savina A, Sánchez D, Colombo MI. Exosome secretion and red cell maturation: Exploring molecular components involved in the docking and fusion of multivesicular bodies in K562 cells. Blood Cells Mol Dis. 2005;35:153-157. [PubMed] [DOI] |
| 3. | Vidal M. Exosomes in erythropoiesis. Transfus Clin Biol. 2010;17:131-137. [PubMed] [DOI] |
| 4. | Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2:569-579. [PubMed] |
| 5. | Simpson RJ, Lim JW, Moritz RL, Mathivanan S. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics. 2009;6:267-283. [PubMed] [DOI] |
| 6. | Raimondo F, Morosi L, Chinello C, Magni F, Pitto M. Advances in membranous vesicle and exosome proteomics improving biological understanding and biomarker discovery. Proteomics. 2011;11:709-720. [PubMed] [DOI] |
| 7. | Ogawa Y, Miura Y, Harazono A, Kanai-Azuma M, Akimoto Y, Kawakami H, Yamaguchi T, Toda T, Endo T, Tsubuki M. Proteomic analysis of two types of exosomes in human whole saliva. Biol Pharm Bull. 2011;34:13-23. [PubMed] [DOI] |
| 8. | Ashiru O, Boutet P, Fernández-Messina L, Agüera-González S, Skepper JN, Valés-Gómez M, Reyburn HT. Natural killer cell cytotoxicity is suppressed by exposure to the human NKG2D ligand MICA*008 that is shed by tumor cells in exosomes. Cancer Res. 2010;70:481-489. [PubMed] [DOI] |
| 9. | Lai RC, Arslan F, Lee MM, Sze NS, Choo A, Chen TS, Salto-Tellez M, Timmers L, Lee CN, El Oakley RM. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010;4:214-222. [PubMed] [DOI] |
| 10. | Nazarenko I, Rana S, Baumann A, McAlear J, Hellwig A, Trendelenburg M, Lochnit G, Preissner KT, Zöller M. Cell surface tetraspanin Tspan8 contributes to molecular pathways of exosome-induced endothelial cell activation. Cancer Res. 2010;70:1668-1678. [PubMed] [DOI] |
| 11. | Merchant ML, Powell DW, Wilkey DW, Cummins TD, Deegens JK, Rood IM, McAfee KJ, Fleischer C, Klein E, Klein JB. Microfiltration isolation of human urinary exosomes for characterization by MS. Proteomics Clin Appl. 2010;4:84-96. [PubMed] [DOI] |
| 12. | Lachenal G, Pernet-Gallay K, Chivet M, Hemming FJ, Belly A, Bodon G, Blot B, Haase G, Goldberg Y, Sadoul R. Release of exosomes from differentiated neurons and its regulation by synaptic glutamatergic activity. Mol Cell Neurosci. 2011;46:409-418. [PubMed] [DOI] |
| 13. | Masyuk AI, Huang BQ, Ward CJ, Gradilone SA, Banales JM, Masyuk TV, Radtke B, Splinter PL, LaRusso NF. Biliary exosomes influence cholangiocyte regulatory mechanisms and proliferation through interaction with primary cilia. Am J Physiol Gastrointest Liver Physiol. 2010;299:G990-G999. [PubMed] [DOI] |
| 14. | Xie Y, Zhang H, Li W, Deng Y, Munegowda MA, Chibbar R, Qureshi M, Xiang J. Dendritic cells recruit T cell exosomes via exosomal LFA-1 leading to inhibition of CD8+ CTL responses through downregulation of peptide/MHC class I and Fas ligand-mediated cytotoxicity. J Immunol. 2010;185:5268-5278. [PubMed] [DOI] |
| 15. | Hao S, Bai O, Yuan J, Qureshi M, Xiang J. Dendritic cell-derived exosomes stimulate stronger CD8+ CTL responses and antitumor immunity than tumor cell-derived exosomes. Cell Mol Immunol. 2006;3:205-211. [PubMed] |
| 16. | Peng P, Yan Y, Keng S. Exosomes in the ascites of ovarian cancer patients: origin and effects on anti-tumor immunity. Oncol Rep. 2011;25:749-762. [PubMed] |
| 17. | Clayton A, Mitchell JP, Court J, Mason MD, Tabi Z. Human tumor-derived exosomes selectively impair lymphocyte responses to interleukin-2. Cancer Res. 2007;67:7458-7466. [PubMed] [DOI] |
| 18. | 曲 晶磊, 赵 明芳, 曲 秀娟, 侯 科佐, 姜 又红, 杨 向红, 刘 云鹏. MAPK/ERK信号通路在胃癌细胞来源的外来体诱导Jurkat T细胞凋亡中的作用. 世界华人消化杂志. 2010;18:1969-1973. [DOI] |
| 19. | Koga K, Matsumoto K, Akiyoshi T, Kubo M, Yamanaka N, Tasaki A, Nakashima H, Nakamura M, Kuroki S, Tanaka M. Purification, characterization and biological significance of tumor-derived exosomes. Anticancer Res. 2005;25:3703-3707. [PubMed] |
| 21. | Zeelenberg IS, Ostrowski M, Krumeich S, Bobrie A, Jancic C, Boissonnas A, Delcayre A, Le Pecq JB, Combadière B, Amigorena S. Targeting tumor antigens to secreted membrane vesicles in vivo induces efficient antitumor immune responses. Cancer Res. 2008;68:1228-1235. [PubMed] [DOI] |
| 22. | Chalmin F, Ladoire S, Mignot G, Vincent J, Bruchard M, Remy-Martin JP, Boireau W, Rouleau A, Simon B, Lanneau D. Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells. J Clin Invest. 2010;120:457-471. [PubMed] |
| 23. | Meckes DG Jr, Shair KH, Marquitz AR, Kung CP, Edwards RH, Raab-Traub N. Human tumor virus utilizes exosomes for intercellular communication. Proc Natl Acad Sci U S A. 2010;107:20370-20375. [PubMed] [DOI] |
| 24. | Camussi G, Deregibus MC, Bruno S, Cantaluppi V, Biancone L. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney Int. 2010;78:838-848. [PubMed] [DOI] |
| 25. | Park JE, Tan HS, Datta A, Lai RC, Zhang H, Meng W, Lim SK, Sze SK. Hypoxic tumor cell modulates its microenvironment to enhance angiogenic and metastatic potential by secretion of proteins and exosomes. Mol Cell Proteomics. 2010;9:1085-1099. [PubMed] [DOI] |
| 26. | Liu C, Yu S, Zinn K, Wang J, Zhang L, Jia Y, Kappes JC, Barnes S, Kimberly RP, Grizzle WE. Murine mammary carcinoma exosomes promote tumor growth by suppression of NK cell function. J Immunol. 2006;176:1375-1385. [PubMed] |
| 27. | Skog J, Würdinger T, van Rijn S, Meijer DH, Gainche L, Sena-Esteves M, Curry WT Jr, Carter BS, Krichevsky AM, Breakefield XO. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat Cell Biol. 2008;10:1470-1476. [PubMed] [DOI] |
| 28. | Hong BS, Cho JH, Kim H, Choi EJ, Rho S, Kim J, Kim JH, Choi DS, Kim YK, Hwang D. Colorectal cancer cell-derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells. BMC Genomics. 2009;10:556. [PubMed] [DOI] |
| 29. | Al-Nedawi K, Meehan B, Micallef J, Lhotak V, May L, Guha A, Rak J. Intercellular transfer of the oncogenic receptor EGFRvIII by microvesicles derived from tumour cells. Nat Cell Biol. 2008;10:619-624. [PubMed] [DOI] |
| 30. | Arafa el-SA, Zhu Q, Barakat BM, Wani G, Zhao Q, El-Mahdy MA, Wani AA. Tangeretin sensitizes cisplatin-resistant human ovarian cancer cells through downregulation of phosphoinositide 3-kinase/Akt signaling pathway. Cancer Res. 2009;69:8910-8917. [PubMed] |
| 31. | Sun CK, Man K, Ng KT, Ho JW, Lim ZX, Cheng Q, Lo CM, Poon RT, Fan ST. Proline-rich tyrosine kinase 2 (Pyk2) promotes proliferation and invasiveness of hepatocellular carcinoma cells through c-Src/ERK activation. Carcinogenesis. 2008;29:2096-2105. [PubMed] [DOI] |
| 33. | Zhang Y, Song M, Cui ZS, Li CY, Xue XX, Yu M, Lu Y, Zhang SY, Wang EH, Wen YY. Down-regulation of TSG101 by small interfering RNA inhibits the proliferation of breast cancer cells through the MAPK/ERK signal pathway. Histol Histopathol. 2011;26:87-94. [PubMed] |
| 34. | Brzezianska E, Pastuszak-Lewandoska D. A minireview: the role of MAPK/ERK and PI3K/Akt pathways in thyroid follicular cell-derived neoplasm. Front Biosci. 2011;16:422-439. [PubMed] [DOI] |
| 35. | Qu JL, Qu XJ, Zhao MF, Teng YE, Zhang Y, Hou KZ, Jiang YH, Yang XH, Liu YP. Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation. Dig Liver Dis. 2009;41:875-880. [PubMed] [DOI] |