修回日期: 2011-03-09
接受日期: 2011-03-16
在线出版日期: 2011-04-08
目的: 探讨在正常氧分压和缺氧条件下, 食管癌细胞中上皮细胞激酶A2(EphA2)表达变化及其对体外三维培养的影响.
方法: 正常氧分压及缺氧条件下培养食管癌Eca109及TE13细胞, RT-PCR及Western blot分别监测细胞中EphA2表达的变化; EphA2 miRNA干扰质粒转染Eca109和TE13细胞后, 采用Matrigel体外三维培养观察正常氧分压和缺氧条件下, Eca109及TE13细胞在抑制EphA2表达前后管腔形成数量的变化.
结果: 缺氧条件下Eca109和TE13细胞中EphA2表达明显增加(P<0.05). Matrigel体外培养中, 缺氧条件下其管腔形成数量明显高于正常氧分压下(P<0.05). miRNA有效抑制EphA2表达后, 在正常氧分压和缺氧条件下, 管腔数量明显下降, 但常氧条件下数量减少更为明显(P<0.01).
结论: 缺氧环境能诱导肿瘤细胞EphA2高表达, 并导致体外三维培养模型中管腔数量增加, 抑制EphA2表达能够阻断此现象的发生, 提示EphA2在缺氧条件下血管生成拟态形成过程中发挥重要作用.
引文著录: 王频, 王璐, 丁宗励, 曾楷峰, 金海林, 朱宏, 施瑞华. EphA2在缺氧条件下的表达及其对食管癌细胞体外三维培养的影响. 世界华人消化杂志 2011; 19(10): 996-1000
Revised: March 9, 2011
Accepted: March 16, 2011
Published online: April 8, 2011
AIM: To investigate the effect of expression of Eph receptor tyrosine kinase A2 (EphA2) under normoxia and hypoxia on vasculogenic mimicry in esophageal squamous cell carcinoma cells.
METHODS: The expression of EphA2 mRNA and protein was measured by RT-PCR and Western blot in two esophageal cancer cell lines Eca109 and TE13 incubated under normoxia and hypoxia. Eca109 and TE13 cells were then transfected with a plasmid harboring small interfering RNA (siRNA) targeting EphA2. Tubular network formation in Eca109 and TE13 cells before and after siRNA transfection was analyzed using the three-dimensional Matrigel culture system under normoxia and hypoxia.
RESULTS: The expression of EphA2 in Eca109 and TE13 cells was obviously enhanced under hypoxia (P < 0.05). The numbers of tubular networks remarkably increased in both Eca109 and TE13 cells under hypoxia (P < 0.05). Although the numbers of tubules obviously increased under both hypoxia and normoxia, the increase was more significant under hypoxia (P < 0.01). Tubule-forming ability of cells transfected with a plasmid harboring small interfering RNA targeting EphA2 was significantly reduced.
CONCLUSION: Enhanced expression of EphA2 under hypoxia can increase the numbers of tubular networks in esophageal squamous cell carcinoma cells. Tubule-forming ability of cells transfected with a plasmid harboring siRNA targeting EphA2 was significantly inhibited. EphA2 may play an essential role in the formation of vasculogenic mimicry under hypoxia.
- Citation: Wang P, Wang L, Ding ZL, Zeng KF, Jin HL, Zhu H, Shi RH. Expression of EphA2 under hypoxia promotes vasculogenic mimicry in esophageal squamous cell carcinoma cells. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 996-1000
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/996.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.996
近年来研究发现, 在部分恶性程度较高的肿瘤组织内存在一种由PAS染色阳性的细胞外基质包绕, 肿瘤细胞相互连接形成规律的袢环状结构网络. 在这种血管样结构中可以见到大量红细胞, 称为血管生成拟态(vasculogenic mimicry, VM)[1]. 研究提示VM在肿瘤组织微循环中发挥重要作用, 他的发生与上皮细胞激酶A2(Eph tyrosine kinases A2, EphA2)、血管上皮钙黏附素(VE-cadherin)、黏附斑激酶(focal adhesion kinase, FAK)、蛋白酪氨酸激酶(tyrosine kinase, TrK)等活化有关[2-4]. 我们前期研究发现食管癌及胃癌中也存在VM现象, 并与肿瘤内部缺氧环境有关[5]. 本研究拟采用VM的体外实验模型-体外三维培养, 观察在缺氧条件下调控EphA2基因表达对三维培养系统中细胞管腔结构形成的影响.
人食管鳞癌细胞株Eca109和TE13购自中科院上海细胞所. EphA2的pcDNATM6.2-GW/EmGFPmiR miRNA及阴性对照质粒(Invitrogen), DMEM(Gibco), LipofectamineTM2000(Invitrogen), 克隆环(Sigma), 小鼠抗人EphA2 mAb(R&D), 鼠抗人的Tubulin-α mAb(Sigma), HRP标记羊抗小鼠二抗(Rockland), BCA蛋白定量试剂盒、化学发光试剂盒(Pierce), 蛋白电泳及转膜系统(Bio-Rad), 细胞培养箱(Thermo)以及人工基质Matrigel(BD公司).
1.2.1 细胞培养: 细胞复苏后于含100 mL/L的胎牛血清的DMEM培养液中, 37 ℃, 50 mL/L CO2条件下培养, 或于37 ℃, 10 mL/L O2(50 mL/L CO2、940 mL/L N2)的缺氧条件下培养.
1.2.2 细胞转染: 转染前1 d取对数生长期的Eca109和TE13, 细胞2.0×105个接种于35 mm培养皿, 培养于不含抗生素的DMEM培养液, 次日观察细胞长至约90%聚合开始转染. 取EphA2干扰质粒4 µg和LipofectamineTM2000 10 µL分别稀释于250 µL不含抗生素的DMEM培养液, 5 min内混匀, 室温孵育20 min后加入培养皿. 6 h后更换新鲜的含100 mL/L胎牛血清DMEM培养液. 其后每2-3 d换液. 细胞转染后24 h按1:12的比例传代, 48 h后开始用含6 mg/L的杀稻瘟菌素Blasticidin(筛选浓度在转染前制杀伤曲线后获得)的选择性培养液进行筛选, 约4 wk后挑取克隆在6 mg/L的杀稻瘟菌素Blasticidin培养液中继续传代, 扩大培养. 同步转染阴性对照质粒. RT-PCR、Western blot鉴定干扰效果.
1.2.3 Western blot: 常规制备总蛋白, 超声破碎后4 ℃, 12 000 r/min, 离心10 min, 取上清, 采用BCA法定量蛋白浓度. 取总蛋白40 µg于100 ℃加热变性5 min后上样, 行120 V恒压SDS-PAGE电泳, 250 mA恒流冰浴电转至PVDF膜, 5%脱脂奶粉室温封闭1 h后, TBST漂洗5 min×3, 加入适当浓度一抗(EphA2 1:300, Tubulin-α 1:5 000) 4 ℃孵育过夜. 次日TBST漂洗5 min×3后再加HRP标记的二抗(羊抗鼠1:4 000)室温孵育1 h, TBST漂洗5 min×3. ECL化学发光法显影.
1.2.4 半定量RT-PCR: TRIzol一步法提取细胞总RNA, 按RNA逆转录试剂盒行逆转录合成cDNA. 引物以Primer 5软件自行设计, 交由上海申能博彩公司合成, EphA2上游引物5'-CTCACACACCCGTATGGCAAAG-3', 下游引物5'-TCCTGGTCGCCAGACATCAC-3', 扩增片段长度104 bp. 扩增结束后取PCR产物上样, 2%琼脂糖凝胶电泳, EB染色, Tanon凝胶成像系统摄片并分析结果.
1.2.5 体外三维培养: 取24孔培养板每孔加入300 μL Matrigel原液(以上操作在冰浴上进行), 37 ℃培养箱内孵育30 min待其凝固后, 再往每孔内添加1 mL浓度为5×108/L的各组细胞悬液, 继续分别在常规环境氧浓度或于10 mL/L O2(50 mL/L CO2、940 mL/L N2)的缺氧条件下培养12 h, 观察各组食管癌细胞的管状结构排列情况及完整程度. 随机于倒置显微镜下(×200), 取上、下、左、右、中心5个视野, 计数管状结构数量, 取每个视野的平均值, 重复实验3次.
统计学处理 采用SPSS11.0统计软件处理数据. Tanon Gis软件对感光胶片条带进行灰度值分析, 以目的条带与内参照条带的比值代表目的基因蛋白的表达水平. P<0.05为有统计学意义.
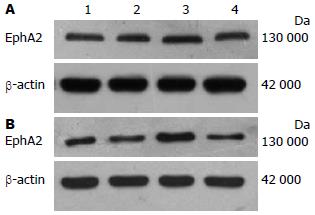
缺氧条件下Eca109和TE13中EphA2 mRNA和蛋白表达随着缺氧时间的延长逐步增加, 到缺氧12 h达顶峰, 后逐渐减弱. 选定以缺氧12 h作为后续实验缺氧时间(图1).
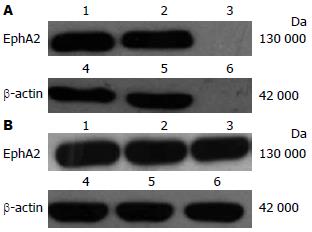
Eca109/7、TE13/6转染效率高, RT-PCR及Western blot证实EphA2 mRNA及蛋白表达均被显著抑制(P<0.01, 图2, 3), 转染阴性对照质粒的细胞EphA2 mRNA和蛋白水平表达与未转染的细胞无明显差异.
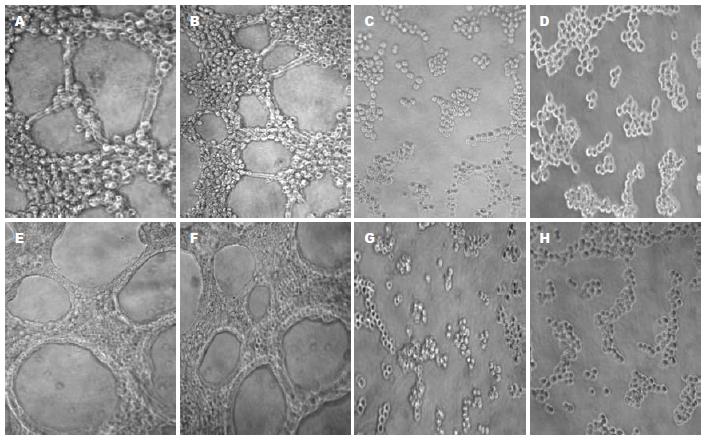
常氧情况下, Eca109、TE13及空载体组细胞在Matrigel上均能模拟血管内皮细胞的特性并相互连接, 约12 h后形成典型的血管网状样结构, 呈单个环状或多个环相连的网格状. 缺氧后细胞变形能力加强, 形成管状结构数目较常氧时明显增加(P<0.05). 转染组细胞在常氧和缺氧情况下下体外管道形成能力均被显著抑制, 环状结构断裂, 多为不完全封闭环形及线状结构, 管状结构数目明显少于对照组(P<0.05, 图4).
恶性肿瘤组织内部的缺氧环境是肿瘤内环境的一大特点, 同时也是促使肿瘤血管生成、侵袭、转移、耐药等恶性行为的诱因. 实体恶性肿瘤为了维持上述恶性行为必须获得血液供应. 人们长期认为血管发生是肿瘤获得血液供应的唯一途径, 直到1999年, Maniotis等[1]在对眼葡萄膜色素瘤及转移性皮肤黑色素瘤的研究中发现一种全新的肿瘤微循环方式-VM. 相继研究发现, 肝癌、卵巢癌、结肠癌、骨肉瘤等多种恶性肿瘤中均存在VM现象[6-11]. 缺氧环境能够显著促进VM发生. Hendrix等[12,13]在人皮肤黑色素瘤的裸鼠移植瘤模型中通过诱导移植瘤的缺氧环境, 发现VM现象明显增加. 缺氧环境似乎可以诱导高侵袭性的黑色素瘤细胞及其他能形成VM的恶性细胞基因型发生改变, 选择性表达某些血管内皮相关细胞基因, 从而能够作为血管内皮细胞样细胞参与VM. 我们通过改变细胞培养的环境氧浓度, 也证实低氧环境能够促进三维培养中食管癌细胞形成管腔趋势[14].
目前认为参与VM的基因包括EphA2、VE-cadherin、FAK、TrK等[15-18]. 其中EphA2又称上皮细胞激酶(epithelium cell kinase, ECK), 是Eph受体酪氨酸激酶家族中的一员, 他最先由Scavelli等[9]化上皮细胞cDNA文库中筛选得到. 正常低表达时, EphA2与其配体ephrin-A结合, 通过Eph-ephrin信号转导机制负调节细胞的灶状黏附和增殖[20]; 而当EphA2过表达或功能异常时, 可以引起细胞恶变, 促进肿瘤细胞的迁移、侵袭和周围基质的重塑, 最终导致某些高度恶性肿瘤血管内皮细胞形成毛细血管样结构以及肿瘤细胞形成VM[21-25]. 研究发现食管癌中存在EphA2异常表达[26], 本研究应用RNAi技术有效抑制EphA2表达后, 发现食管癌细胞体外管道形成能力显著抑制, 提示食管癌中VM形成可能与EphA2表达有有关. 这与Margaryan等的研究结论一致[27-30].
本研究发现缺氧能够同时促进EphA2表达和VM的形成. 为了明确在缺氧条件下EphA2表达增强是作为VM增加的始动因素还是伴随现象, 我们设计了EphA2 miRNA干扰质粒并成功转染食管癌细胞中. 发现在有效抑制EphA2表达后, 无论在正常还是缺氧条件下, 肿瘤细胞管腔形成能力均受到影响. 而且食管癌细胞在抑制EphA2表达后进行缺氧培养, 亦不能阻止VM形成能力的减弱. 这进一步证实EphA2表达是食管癌VM的重要环节, 而且EphA2可能涉及到缺氧环境促进食管癌VM形成的信号途径.
缺氧诱导因子-1(hypoxia-inducible factors, HIF-1)是目前机体适应低氧环境的关键信号分子, 在大多数肿瘤细胞包括食管癌中表达增加[31-33]. 本研究组前期研究发现[34], 缺氧条件下食管癌细胞株中HIF-1α和EphA2同时升高; 而在针对HIF-1α的稳定干扰株中, 缺氧亦不能使EphA2表达增加. Vihanto等[35]的研究也支持这一结果, 提示缺氧条件下EphA2的表达受HIF-1α的调控. 结合本次研究结果, 提示缺氧诱导肿瘤细胞VM形成过程中, HIF-1α-EphA2通路可能发挥了关键作用. 这一结果为进一步阐明食管癌VM形成机制提供了实验依据.
EphA2可以通过一系列信号转导途径促进肿瘤细胞的迁移、侵袭和周围基质的重塑, 最终导致某些高度恶性肿瘤细胞形成血管生成拟态. 这种独特的血液供应方式现已成为恶性肿瘤治疗的研究热点之一, 但通过分子生物学手段探讨EphA2在食管鳞癌细胞血管生成拟态过程中的研究并不多见.
欧希龙, 副教授, 东南大学中大医院消化科
本文通过基因干扰技术调控EphA2表达, 进而观察EphA2表达变化对缺氧条件下食管癌血管生成拟态的影响, 证实EphA2是这一过程的重要环节.
EphA2对于肿瘤转移及血管生成拟态均具有重要意义, 阐明他在肿瘤发病中的作用机制, 将有助于发现针对肿瘤转移和血管生成拟态的治疗新靶点.
本文选题恰当, 设计合理, 具有较好的创新性.
编辑: 李军亮 电编:何基才
| 1. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] [DOI] |
| 2. | Hess AR, Seftor EA, Gardner LM, Carles-Kinch K, Schneider GB, Seftor RE, Kinch MS, Hendrix MJ. Molecular regulation of tumor cell vasculogenic mimicry by tyrosine phosphorylation: role of epithelial cell kinase (Eck/EphA2). Cancer Res. 2001;61:3250-3255. [PubMed] |
| 3. | Baeten CI, Hillen F, Pauwels P, de Bruine AP, Baeten CG. Prognostic role of vasculogenic mimicry in colorectal cancer. Dis Colon Rectum. 2009;52:2028-2035. [PubMed] [DOI] |
| 4. | Pasquale EB. Journal club. A biologist is gratified to find reconciliation for a conflicted receptor. Nature. 2009;461:149. [PubMed] [DOI] |
| 5. | 华 杰, 施 瑞华, 张 红杰, 于 莲珍, 朱 宏, 肖 斌, 张 国新, 郝 波. RNA干扰HIF-1α对血管生成拟态相关基因表达的影响. 世界华人消化杂志. 2009;17:1913-1918. [DOI] |
| 6. | Sun T, Zhao N, Zhao XL, Gu Q, Zhang SW, Che N, Wang XH, Du J, Liu YX, Sun BC. Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry. Hepatology. 2010;51:545-556. [PubMed] |
| 7. | Kuwai T, Kitadai Y, Tanaka S, Onogawa S, Matsutani N, Kaio E, Ito M, Chayama K. Expression of hypoxia-inducible factor-1alpha is associated with tumor vascularization in human colorectal carcinoma. Int J Cancer. 2003;105:176-181. [PubMed] [DOI] |
| 8. | Millimaggi D, Mari M, D' Ascenzo S, Giusti I, Pavan A, Dolo V. Vasculogenic mimicry of human ovarian cancer cells: role of CD147. Int J Oncol. 2009;35:1423-1428. [PubMed] |
| 9. | Scavelli C, Nico B, Cirulli T, Ria R, Di Pietro G, Mangieri D, Bacigalupo A, Mangialardi G, Coluccia AM, Caravita T. Vasculogenic mimicry by bone marrow macrophages in patients with multiple myeloma. Oncogene. 2008;27:663-674. [PubMed] [DOI] |
| 10. | Cai XS, Jia YW, Mei J, Tang RY. Tumor blood vessels formation in osteosarcoma: vasculogenesis mimicry. Chin Med J (Engl). 2004;117:94-98. [PubMed] |
| 11. | 袁 禧先, 马 晓颖, 王 凤荣, 王 哲, 王 晓, 王 树鸿. 骨桥蛋白与缺氧诱导因子-1在大肠腺瘤及癌组织中的表达及意义. 世界华人消化杂志. 2009;17:3174-3179. [DOI] |
| 12. | Hendrix MJ, Seftor RE, Seftor EA, Gruman LM, Lee LM, Nickoloff BJ, Miele L, Sheriff DD, Schatteman GC. Transendothelial function of human metastatic melanoma cells: role of the microenvironment in cell-fate determination. Cancer Res. 2002;62:665-668. [PubMed] |
| 13. | Hendrix MJ, Seftor EA, Kirschmann DA, Quaranta V, Seftor RE. Remodeling of the microenvironment by aggressive melanoma tumor cells. Ann N Y Acad Sci. 2003;995:151-161. [PubMed] [DOI] |
| 15. | Hess AR, Seftor EA, Gruman LM, Kinch MS, Seftor RE, Hendrix MJ. VE-cadherin regulates EphA2 in aggressive melanoma cells through a novel signaling pathway: implications for vasculogenic mimicry. Cancer Biol Ther. 2006;5:228-233. [PubMed] [DOI] |
| 16. | Margaryan NV, Strizzi L, Abbott DE, Seftor EA, Rao MS, Hendrix MJ, Hess AR. EphA2 as a promoter of melanoma tumorigenicity. Cancer Biol Ther. 2009;8:279-288. [PubMed] [DOI] |
| 17. | Hess AR, Hendrix MJ. Focal adhesion kinase signaling and the aggressive melanoma phenotype. Cell Cycle. 2006;5:478-480. [PubMed] [DOI] |
| 18. | Paulis YW, Soetekouw PM, Verheul HM, Tjan-Heijnen VC, Griffioen AW. Signalling pathways in vasculogenic mimicry. Biochim Biophys Acta. 2010;1806:18-28. [PubMed] |
| 19. | Lindberg RA, Hunter T. cDNA cloning and characterization of eck, an epithelial cell receptor protein-tyrosine kinase in the eph/elk family of protein kinases. Mol Cell Biol. 1990;10:6316-6324. [PubMed] |
| 20. | Miao H, Wei BR, Peehl DM, Li Q, Alexandrou T, Schelling JR, Rhim JS, Sedor JR, Burnett E, Wang B. Activation of EphA receptor tyrosine kinase inhibits the Ras/MAPK pathway. Nat Cell Biol. 2001;3:527-530. [PubMed] [DOI] |
| 21. | Mitra S, Duggineni S, Koolpe M, Zhu X, Huang Z, Pasquale EB. Structure-activity relationship analysis of peptides targeting the EphA2 receptor. Biochemistry. 2010;49:6687-6695. [PubMed] [DOI] |
| 22. | Himanen JP, Goldgur Y, Miao H, Myshkin E, Guo H, Buck M, Nguyen M, Rajashankar KR, Wang B, Nikolov DB. Ligand recognition by A-class Eph receptors: crystal structures of the EphA2 ligand-binding domain and the EphA2/ephrin-A1 complex. EMBO Rep. 2009;10:722-728. [PubMed] [DOI] |
| 23. | Miao H, Li DQ, Mukherjee A, Guo H, Petty A, Cutter J, Basilion JP, Sedor J, Wu J, Danielpour D. EphA2 mediates ligand-dependent inhibition and ligand-independent promotion of cell migration and invasion via a reciprocal regulatory loop with Akt. Cancer Cell. 2009;16:9-20. [PubMed] [DOI] |
| 24. | Salaita K, Nair PM, Petit RS, Neve RM, Das D, Gray JW, Groves JT. Restriction of receptor movement alters cellular response: physical force sensing by EphA2. Science. 2010;327:1380-1385. [PubMed] [DOI] |
| 25. | Trinidad EM, Zapata AG, Alonso-Colmenar LM. Eph-ephrin bidirectional signaling comes into the context of lymphocyte transendothelial migration. Cell Adh Migr. 2010;4:363-367. [PubMed] [DOI] |
| 26. | 叶 骉飞, 李 惠武, 庞 作良, 李 卉, 田 勍, 陈 艳, 郭 文佳, 李 秀梅, 王 洪江. EphA2、hMLH1、hMSH2 mRNA在新疆维吾尔及汉族食管鳞癌中的表达及意义. 世界华人消化杂志. 2009;17:3635-3639. [DOI] |
| 27. | Merritt WM, Kamat AA, Hwang JY, Bottsford-Miller J, Lu C, Lin YG, Coffey D, Spannuth WA, Nugent E, Han LY. Clinical and biological impact of EphA2 overexpression and angiogenesis in endometrial cancer. Cancer Biol Ther. 2011;10:1306-1314. [PubMed] [DOI] |
| 28. | Lee JW, Stone RL, Lee SJ, Nam EJ, Roh JW, Nick AM, Han HD, Shahzad MM, Kim HS, Mangala LS. EphA2 targeted chemotherapy using an antibody drug conjugate in endometrial carcinoma. Clin Cancer Res. 2010;16:2562-2570. [PubMed] [DOI] |
| 29. | Kung B, Zhao H, Hicks SL, Tang XX, Ikegaki N. Biological significance of EPHA2 expression in neuroblastoma. Int J Oncol. 2009;35:845-850. [PubMed] |
| 30. | Henze AT, Acker T. Feedback regulators of hypoxia-inducible factors and their role in cancer biology. Cell Cycle. 2010;9:2749-2763. [PubMed] [DOI] |
| 31. | Seeber LM, Horrée N, van der Groep P, van der Wall E, Verheijen RH, van Diest PJ. Necrosis related HIF-1alpha expression predicts prognosis in patients with endometrioid endometrial carcinoma. BMC Cancer. 2010;10:307. [PubMed] |
| 32. | Tzao C, Lee SC, Tung HJ, Hsu HS, Hsu WH, Sun GH, Yu CP, Jin JS, Cheng YL. Expression of hypoxia-inducible factor (HIF)-1alpha and vascular endothelial growth factor (VEGF)-D as outcome predictors in resected esophageal squamous cell carcinoma. Dis Markers. 2008;25:141-148. [PubMed] |