修回日期: 2011-03-14
接受日期: 2011-03-23
在线出版日期: 2011-04-08
目的: 研究miRNA干扰质粒对胰岛素样生长因子Ⅱ(IGF-Ⅱ)在肝细胞癌表达的抑制作用, 探讨IGF-Ⅱ在肝细胞癌治疗中的价值.
方法: 以人IGF-Ⅱ基因序列设计并合成4条miRNA, 将miRNA插入质粒构建pcDNATM6.2-GW/EmGFP miR 1-4干扰载体; 筛选、转染HepG2细胞, 以荧光定量PCR分析靶向肝癌IGF-Ⅱ基因表达的干扰效果; 以ELISA法比较转染前后IGF-Ⅱ蛋白表达水平.
结果: 测序证实, 成功构建了真核IGF-Ⅱ干扰质粒MR-IGF-Ⅱ-1-4, 将干扰质粒转染至HepG2细胞, 镜下显示转染效率50%; 经荧光定量PCR扩增, 沉默IGF-Ⅱ基因表达效率MR-IGF-Ⅱ-1为33%、MR-IGF-Ⅱ-2为43%、MR-IGF-Ⅱ-3为0%、MR-IGF-Ⅱ-4为3%. 将其中MR-IGF-Ⅱ-2转染至HepG2细胞, 在转录和蛋白水平上对IGF-Ⅱ具有较高干扰效率, 分别达43.0%和43.5%.
结论: 成功构建了人miRNA干扰质粒, 他能有效抑制HepG2细胞IGF-Ⅱ的表达.
引文著录: 姚宁华, 姚登福, 钱静, 董志珍, 邱历伟, 蔚丹丹. miRNA干扰质粒的构建及其对肝癌HepG2细胞IGF-Ⅱ表达的抑制作用. 世界华人消化杂志 2011; 19(10): 1015-1021
Revised: March 14, 2011
Accepted: March 23, 2011
Published online: April 8, 2011
AIM: To investigate inhibitory effect of transfection of eukaryotic expression plasmids carrying specific microRNA (miRNA) on insulin-like growth factor II (IGF-II) gene and protein expression in human HepG2 cells.
METHODS: Four miRNAs targeting the IGF-II gene were synthesized and inserted into the pcDNATM6.2-GW/EmGFPmiR vector. The recombinant plasmids were identified and transiently transfected into HepG2 cells. Their inhibitory efficiency on IGF-II expression was determined at gene level by real time-PCR and at protein level by ELISA.
RESULTS: Four eukaryotic expression plasmids carrying miRNA targeting IGF-II were constructed successfully and confirmed by sequencing. HepG2 cells were then transfected with these plasmids (MR-IGF-II-1 to 4). The highest transfection efficiency was up to 50%. The reduced rates of IGF-II gene expression were 33%, 43%, 0% and 3% in cells transfected with MR-IGF-II-1 to 4, respectively. Transfection of the MR-IGF-II-2 plasmid for 72 h reduced IGF-II protein expression by 44% in HepG2 cells.
CONCLUSION: The expression plasmids carrying miRNA targeting IGF-II have been successfully constructed. Transfection of these plamsids can efficiently inhibit IGF-II expression in HepG2 cells.
- Citation: Yao NH, Yao DF, Qian J, Dong ZZ, Qiu LW, Yu DD. Construction of expression plasmids carrying miRNA targeting IGF-II and detection of their inhibitory effect on IGF-II expression in human HepG2 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1015-1021
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1015
肝细胞癌(hepatocellular carcinoma, HCC)的发生、发展是多病因、多步骤及多因子协同的复杂过程, 其中多种基因的调控和表达与HCC密切相关[1-3]. 胰岛素样生长因子(insulin-like growth factors, IGFs)家族异常表达与多种肿瘤的发生相关. IGFs中的配体IGF-Ⅰ(insulin-like growth factor 1)和IGF-Ⅱ(insulin-like growth factor 2)氨基酸序列有62%同源性, 均可与细胞表面的胰岛素样生长因子Ⅰ受体(the type Ⅰ insulin-like growth factor, IGF-1R)结合, 发挥促有丝分裂作用, 促进正常细胞增殖, 参与肿瘤细胞增生及分化. IGF-Ⅰ、IGF-Ⅱ和IGF-1R在多种肿瘤中分别或共同高表达, HCC组织中则发现IGF-Ⅱ异常表达, 且与肝细胞持续性增殖、异常生长、分化及癌变密切相关[4,5]. IGF-Ⅱ基因在胎肝和新生儿肝脏中大量表达, 成人肝中不表达, 在肝细胞发生癌变时IGF-Ⅱ呈胚胎性过量表达[6,7]. 本文构建IGF-Ⅱ表达干扰质粒, 经筛选将有效干扰质粒转染肝癌细胞(HepG2), 观察对HCC细胞IGF-Ⅱ的表达干扰和抑制效果.
人HCC HepG2细胞株购自南京凯基生物科技发展有限公司; BLOCK-iTTM Pol II miR RNAi Expression Vector Kit with EmGFP(No. K4936-00)、质粒载体pcDNATM6.2-GW/EmGFPmiR、TRIzol、感受态细胞DH5α、超纯水及基因扩增引物合成等均来自Invitrogen公司; T4快速连接酶试剂盒(Promega); 胰化蛋白胨、酵母提取物(OXOID); 壮观霉素(Sigma); FuGENE® HD Transfection Reagent(Roche); RIPA裂解液(强)、PMSF、BCA蛋白浓度测定试剂盒、DEPC、Hoechst 33342、琼脂糖及高纯度质粒抽提试剂盒(碧云天); Cell culture RNA提取试剂盒(富士); cDNA合成试剂盒(Fermentas); SYBR® Premix Ex TaqTM II(TaKaRa)购自大连宝生物工程有限公司; 人IGF-Ⅱ ELISA试剂盒(武汉华美)购自南京生兴生物科技有限公司.
1.2.1 靶向IGF-Ⅱ miRNA干扰载体的构建: 根据IGF-Ⅱ基因序列(NM_000612)设计并合成4条miRNA寡聚核苷酸单链DNA及阴性对照核苷酸单链DNA(Invitrogen), 序列见表1.
| 名称 | 寡聚核苷酸单链DNA序列 |
| MR122-1 | F: 5'-TGCTGCAGCAATGCAGCACGAGGCGAGTTTTGGCCACTGACTGACTCGCCTCGCTGCATTGCTG-3' |
| R: 5'-CCTGCAGCAATGCAGCGAGGCGAGTCAGTCAGTGGCCAAAACTCGCCTCGTGCTGCATTGCTGC-3' | |
| MR122-2 | F: 5'-TGCTGTAAGCAGCAATGCAGCACGAGGTTTTGGCCACTGACTGACCTCGTGCTATTGCTGCTTA-3' |
| R: 5'-CCTGTAAGCAGCAATAGCACGAGGTCAGTCAGTGGCCAAAACCTCGTGCTGCATTGCTGCTTAC-3' | |
| MR122-3 | F: 5'-TGCTGTGCGACGGCTCACACGGCTTGGTTTTGGCCACTGACTGACCAAGCCGTGAGCCGTCGCA-3' |
| R: 5'-CCTGTGCGACGGCTCACGGCTTGGTCAGTCAGTGGCCAAAACCAAGCCGTGTGAGCCGTCGCAC-3' | |
| MR122-4 | F: 5'-TGCTGTCAACGATGCCACGGCTGCGAGTTTTGGCCACTGACTGACTCGCAGCCGGCATCGTTGA-3' |
| R: 5'-CCTGTCAACGATGCCGGCTGCGAGTCAGTCAGTGGCCAAAACTCGCAGCCGTGGCATCGTTGAC-3' | |
| 阴性 | F: 5'-TGCTGAAATGTACTGCGCGTGGAGACGTTTTGGCCATGACTGACGTCTCCACGCAGTACATTT-3' |
| R: 5'-CCTGAAATGTACTGCGTGGAGACGTCAGTCAGTGGCCAAAACGTCTCCACGCGCAGTACATTTC-3' |
将4对Oligo各自退火成双链, 用三蒸水溶解成100 μmol/L, 互补单链各5 μL两两混合, 总体积20 μL(100 μmol/L top strand Oligo 5 μL, 100 μmol/L bottom strand Oligo 5 μL, 10×Oligo annealing buffer 2 μL, 三蒸水8 μL)在95 ℃加热5分钟, 然后放置室温自然冷却20 min, 形成双链Oligo. 然后用载体构建试剂盒BLOCK-iTTM Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP 进行重组克隆, 将双链的miRNA Oligo各自插入到miRNA表达载体pcDNATM6.2-GW/EmGFPmiR中, 构建miRNA质粒.
1.2.2 干扰载体转化与测序分析: 将退火的双链Oligo稀释成10 nmol/L浓度, 在室温连接30 min, 总体积20 µL, 含5×Ligation Buffer 4 µL, pcDNA6.2-GW/EmGFP 2 µL, ds Oligo(10 nmol/L) 4 µL, T4 DNA Ligase(106 U/L)1 µL, 双蒸水9 µL. 构建质粒, 转化入DH5α. 每个转化平板分别挑取4个克隆, 用载体通用引物进行菌落PCR筛选. 筛选得到的阳性克隆进行测序验证重组克隆中插入序列, 扩增质粒. pcDNATM6.2-GW/EmGFPmiR反向测序引物5'-CTCTAGATCAACCACTTTGT -3', 针对靶基因IGF-Ⅱ构建的4个干扰质粒pcDNATM 6.2-GW/EmGFPmi-1-4.
1.2.3 靶向IGF-Ⅱ miRNA干扰载体的筛选: 制备LB培养基含壮观霉素(50 g/L), 37 ℃增菌15 h后, 提取质粒. 将处对数生长期HepG2细胞以2.5 g/L胰酶消化, 用完培悬浮细胞, 计数后按照每孔5×105个细胞种板, 过夜. 在细胞覆盖率90%时, 常规消化收集细胞, 分别以90 µL DMEM高糖基培稀释10 µL干扰质粒及阴性对照质粒Neg(200 µg/L), 92 µL DMEM高糖基培稀释高效转染试剂8 µL, 总体积100 µL, 混匀, 室温12 min; 用200 µL含转染试剂-质粒复合物DMEM高糖基培重悬细胞, 37 ℃, 50 mL/L CO2中静置20 min; 加RPMI 1640完培后种板, 37 ℃, 50 mL/L CO2培养; 8 h更换培养液. 在所设定时间点, 以荧光显微镜观察转染效率.
1.2.4 IGF-Ⅱ cDNA合成: 使用Quickgene-81自动提取仪(富士)制备细胞总RNA. 预冷管中加入总RNA 1 μg和1 μL随机引物[Oligo-dT(18), 0.5 g/L], 加DEPC处理水至12 μL, 离心5 s, 70 ℃ 5 min, 离心5 s; 将EP管冰浴, 加4 μL 5×反应缓冲液; 1 μL核酸酶抑制物(2×107 U/L)和2 μL dNTP(10 mmol/L), 离心5 s, 37 ℃ 5 min; 加1 μL逆转录酶(2×107 U/L), 终体积20 μL, 42 ℃ 60 min, 70 ℃ 10 min, 备用.
1.2.5 引物合成与定量PCR扩增: 引物设计: IGF-Ⅱ-F1: 5'-CGTGGCATCGTTGA GGAGTG-3' (942-961 nt)和IGF-II-R1: 5'-CTGAACGCCTCGAGCTCCTT-3'(1 182-1 201 nt), 片段260 bp; 内参引物: GAPDH-F: 5'-CACTGGCGTCTTCACCACCA T-3'(396-416 nt)和GAPDH-R: 5'-GTGCAGGAGGCATTGCTGAT-3'(541-560 nt), 片段165 bp. 体系25 μL: 双蒸水9.5 μL, 上游引物(10 μmol/L)0.5 μL, SYBR® Premix Ex TaqTM II 12.5 μL; 下游引物(10 μmol/L)0.5 μL; 模板2.0 μL. 反应条件: 95 ℃ 2 min后, 以95 ℃ 10 s; 60 ℃ 30 s; 70 ℃ 45 s, 重复40个循环.
1.2.6 IGF-Ⅱ沉默效率: 经定量PCR检测细胞IGF-Ⅱ和内参基因表达, 根据PCR反应曲线得到各样品IGF-Ⅱ和GAPDH基因Ct值(threshold cycle number), 以ΔΔCt法相对定量. 以转染阴性干扰载体为对照, 比较各转染干扰载体组IGF-Ⅱ基因表达. 靶向IGF-Ⅱ基因干扰效果计算: ΔΔCt = (待测IGF-Ⅱ基因Ct平均值-待测GAPDH基因Ct平均)-(对照IGF-Ⅱ基因Ct平均值-对照GAPDH基因Ct平均值)基因表达量F = 2-ΔΔCt, IGF-Ⅱ基因沉默效率为1-2-ΔΔCt.
1.2.7 IGF-Ⅱ蛋白测定: 分别在24、48和72 h收集细胞, 以RIPA裂解液(含1/100 PMSF)与冰上裂解细胞, 10 min后收集裂解产物, 12 000 g 4 min离心收集上清, 以BCA法测定总蛋白和ELISA法测IGF-Ⅱ蛋白水平.
统计学处理 数据以mean±SD表示. 以Sigma Stat 2.0软件行配对t检验或单因素方差分析, 以P<0.05表示差异显著.
将真核表达质粒约5.7 kb; IGF-Ⅱ片段真核表达质粒pcDNATM6.2-GW/EmGFPmiR经测序和比对, 重组克隆中插入片段序列与设计的Oligo序列完全一致, IGF-Ⅱ miRNA干扰载体构建成功.
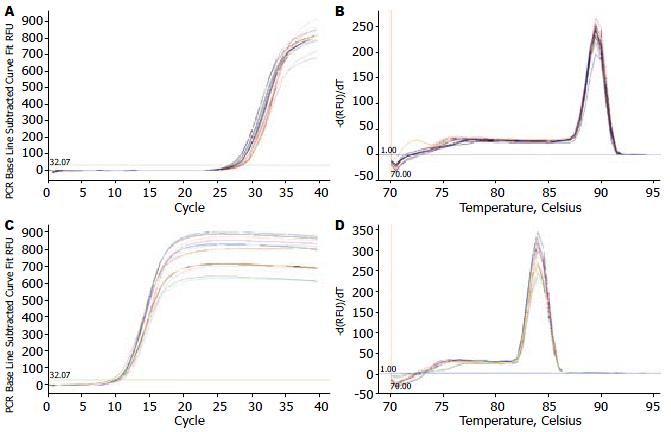
以4种构建的干扰载体转染HepG2细胞, 瞬时转染48 h后收集样品, 定量PCR分析IGF-Ⅱ基因的表达(图1)及实际对IGF-Ⅱ的沉默效果. MR-IGF-Ⅱ-1和MR-IGF-Ⅱ-2均可沉默IGF-Ⅱ, 以MR-IGF-Ⅱ-2对IGF-Ⅱ基因的沉默效果最佳, 干扰效率为43%. 而MR-IGF-Ⅱ-3和MR-IGF-Ⅱ-4对IGF-Ⅱ基因几乎无沉默效果(表2).
| 分组 | IGF-ⅡCt值 | ΔCt | ΔΔCt | 2ΔΔCt | 沉默效率(1-2ΔΔCt) |
| MR-IGF-Ⅱ-1组 | 28.42±0.19 | 17.70 | 0.58 | 0.67 | 0.33 |
| MR-IGF-Ⅱ-2组 | 28.09±0.26 | 17.92 | 0.80 | 0.57 | 0.43 |
| MR-IGF-Ⅱ-3组 | 27.23±0.22 | 16.98 | -0.14 | 1.10 | 0.00 |
| MR-IGF-Ⅱ-4组 | 27.60±0.13 | 17.17 | 0.05 | 0.97 | 0.03 |
| 阴性组 | 26.74±0.13 | 17.12 | 0.00 | 1.00 | 0.00 |
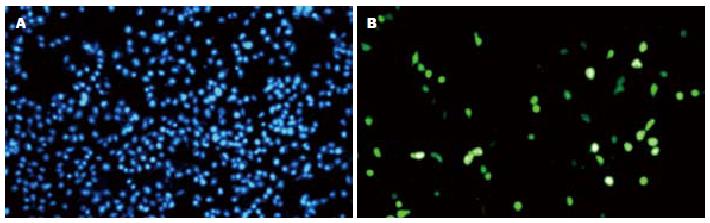
pcDNATM6.2-GW/EmGFP miRNA重组质粒转染HepG2细胞48 h后, 使用倒置荧光显微镜观察转染效果, 转染效率50%(图2).
以MR-IGF-Ⅱ-2进行种板、转染, 分别在第24、48和72 h提取RNA及合成IGF-Ⅱ cDNA, 再以定量PCR分析HepG2细胞IGF-Ⅱ mRNA表达程度. 对IGF-Ⅱ基因表达的实际沉默效率34%、44%和42%(表3).
| 分组 | GAPDH Ct | IGF-II Ct | ΔCt | ΔΔCt | 2ΔΔCt | 沉默效率(1-2ΔΔCt) |
| 24 h | ||||||
| 正常组 | 10.07±0.12 | 20.97±0.12 | 10.90 | |||
| 阴性组 | 9.97±0.12 | 20.90±0.17 | 10.93 | 0.03 | 0.979 | 0.02 |
| 干扰组 | 9.87±0.12 | 21.37±0.38 | 11.50 | 0.60 | 0.659 | 0.34 |
| 48 h | ||||||
| 正常组 | 10.93±0.15 | 25.43±0.72 | 14.50 | |||
| 阴性组 | 10.83±0.12 | 25.35±0.50 | 14.52 | 0.02 | 0.986 | 0.01 |
| 干扰组 | 10.50±0.35 | 25.83±0.21 | 15.33 | 0.83 | 0.562 | 0.44 |
| 72 h | ||||||
| 正常组 | 9.73±0.15 | 23.47±0.46 | 13.74 | |||
| 阴性组 | 9.67±0.06 | 23.43±0.23 | 13.76 | 0.02 | 0.986 | 0.01 |
| 干扰组 | 9.70±0.10 | 24.23±0.25 | 14.53 | 0.79 | 0.578 | 0.42 |
以MR-IGF-Ⅱ-2进行种板、转染, 分别在第24、48和72 h收集、裂解细胞, 提取总蛋白, 以ELISA法测定HepG2细胞中IGF-Ⅱ蛋白水平, 以蛋白比浓度(每g总蛋白中IGF-Ⅱ mg数)表示, 正常组与阴性组的差别未见明显的统计学意义, 但对干扰组不同时间的IGF-Ⅱ表达抑制分别为35.80%、43.18%和43.58%, 组间差异显著(均P<0.01, 表4).
HCC的发生是多中心、多病因、多阶段的发展过程[8,9]. HCC癌变和胎肝组织中IGF-Ⅱ呈过量表达, 并受胚胎型启动子调控. 以前的肝癌模型动态证实IGF-Ⅱ异常表达与肝细胞癌变关系十分密切, 且为肝细胞癌变的早期事件[7,10]. miRNA是21-23个碱基的小分子RNA, 存在于真核生物中. miRNA可通过部分互补或者完全互补结合到目的靶mRNA, 以诱发蛋白质翻译抑制(翻译抑制子)或者介导目的mRNA的降解调节基因表达, 包括细胞分化、生物发育、疾病的发生、发展, 与病毒的复制和癌症等有关[11]. 肝癌治疗以手术为主, 因肝癌细胞对放疗、化疗不敏感, 重组DNA技术使肝癌基因治疗成为可能, 以肝癌发生机制制定的基因治疗已成为肿瘤治疗的热点[12,13]. 本文利用分子克隆手段, 成功构建人源性真核IGF-Ⅱ表达干扰质粒, 从基因转录和蛋白表达水平上, 观察对HepG2细胞IGF-Ⅱ的表达抑制, 为肝癌基因治疗奠定基础.
肝癌发展是由遗传学和表观遗传学改变引起的原癌基因的活化和抑癌基因的失活, 而表遗传修饰主要包括DNA甲基化、组蛋白乙酰化状态异常以及染色体结构改变等, IGF-Ⅱ表达异常与肝癌发生密切相关, 不同肝组织中该基因启动子的甲基化状态的研究已有报道[14,15]. 肝癌动物模型动态观察肝细胞癌变过程中IGF-Ⅱ基因P2 CpG岛的甲基化状态改变, 同时观察了不同肝脏组织中IGF-Ⅱ基因P3 CpG岛的甲基化状态的差异. 该基因启动子区域CpG岛甲基化状态改变在肝癌形成中起重要作用[16,17]. 本研究中IGF-Ⅱ miRNA重组质粒的成功构建, 并将该质粒及阴性质粒分别转染HepG2细胞株, 经抗生素筛选后成功建立稳定表达miRNA质粒的HepG2细胞株. 非编码RNA(miRNA)是体内的RNA干扰触发器, 可通过在经典的RNA干扰途径降解靶基因mRNA、也可直接抑制靶基因的蛋白翻译、还可经快速脱腺苷化降解mRNA, 被看做体内固有的基因调控子中最大家族.
以真核表达载体构建了IGF-Ⅱ表达干扰载体, 模拟天然miRNA构建表达miRNA质粒, 以调控相关基因IGF-Ⅱ表达, 先以调控目标基因的miRNA表达质粒的构建和有效质粒筛选, 确定针对IGF-Ⅱ基因的miRNA的有效作用位点, 观察构建的候选质粒对肝癌中IGF-Ⅱ靶基因的调控效应, 针对IGF-Ⅱ基因分别构建了4个质粒, 筛选出了2个有效质粒, 选用最有效的MR-IGF-Ⅱ-2用于体外研究; 并确定了2 035-2 055为IGF-Ⅱ有效位点; 将有效质粒瞬时转染HepG2细胞后, 观察到miRNA使肝癌细胞中IGF-Ⅱ表达在转录水平和蛋白水平上都明显下调; 并使肝癌细胞增殖受抑制, 最高抑制率可达到51.1%, 表现为细胞周期改变, 癌细胞增殖受阻于G0-G1期, 癌细胞凋亡率增加, 进一步证实了IGF-Ⅱ异常表达与肝癌发生的密切关系[15,18,19].
IGF-Ⅱ在胎肝和新生儿肝脏中基因有大量表达, 成人肝中未见表达. 肝细胞在恶性转化过程中, IGF-Ⅱ呈胚胎性过量表达, 并具有强烈的致有丝分裂剂作用, 促进细胞增殖分化, 参与肿瘤细胞增生及分化. IGF-Ⅱ在HCC组织中异常表达, 与肝细胞持续性增殖、异常生长、分化及癌变密切相关[20-22]. 针对IGF-II表达的相关信号通路的基因治疗或改变IGF-Ⅱ基因启动子P3的甲基化状态, 纠正IGF-Ⅱ基因异常, 可成为基因治疗新靶点[15,23,24]. 研究结果将会为今后研究肝癌的发生机制及生物治疗提供有价值的基础研究信息和实验依据[25,26].
肝癌发展是由遗传学和表观遗传学改变引起的原癌基因的活化和抑癌基因的失活, 而表遗传修饰主要包括DNA甲基化、组蛋白乙酰化状态异常以及染色体结构改变等, IGF-Ⅱ表达异常与肝癌发生密切相关.
田字彬, 教授, 青岛大学医学院附属医院消化内科
重组DNA技术使肝癌基因治疗成为可能, 以肝癌发生机制制定的基因治疗已成为肿瘤治疗的热点.
肝癌动物模型动态观察肝细胞癌变过程中IGF-Ⅱ基因P2 CpG岛的甲基化状态改变, 同时观察了不同肝脏组织中IGF-Ⅱ基因P3 CpG岛的甲基化状态的差异. 该基因启动子区域CpG岛甲基化状态改变在肝癌形成中起重要作用.
本实验构建了人源性真核IGF-Ⅱ表达干扰质粒, 从基因转录和蛋白表达水平上观察对HepG2细胞IGF-Ⅱ的表达抑制, 这为今后的肝癌基因治疗奠定基础.
本研究将有效质粒瞬时转染HepG2细胞后, miRNA使肝癌细胞IGF-Ⅱ在转录水平和蛋白水平上都明显下调, 肝癌细胞增殖受抑制, 其结果将会为今后研究肝癌的发生机制及生物治疗提供有价值的基础研究信息和实验依据.
本文科学性和可读性较好, 为肝癌基因治疗奠定基础.
编辑: 李薇 电编:何基才
| 1. | Tovar V, Alsinet C, Villanueva A, Hoshida Y, Chiang DY, Solé M, Thung S, Moyano S, Toffanin S, Mínguez B. IGF activation in a molecular subclass of hepatocellular carcinoma and pre-clinical efficacy of IGF-1R blockage. J Hepatol. 2010;52:550-559. [PubMed] [DOI] |
| 2. | Spangenberg HC, Thimme R, Blum HE. Evolving therapies in the treatment of hepatocellular carcinoma. Biologics. 2008;2:453-462. [PubMed] |
| 3. | Jia HL, Ye QH, Qin LX, Budhu A, Forgues M, Chen Y, Liu YK, Sun HC, Wang L, Lu HZ. Gene expression profiling reveals potential biomarkers of human hepatocellular carcinoma. Clin Cancer Res. 2007;13:1133-1139. [PubMed] [DOI] |
| 4. | Weng CJ, Hsieh YH, Tsai CM, Chu YH, Ueng KC, Liu YF, Yeh YH, Su SC, Chen YC, Chen MK. Relationship of insulin-like growth factors system gene polymorphisms with the susceptibility and pathological development of hepatocellular carcinoma. Ann Surg Oncol. 2010;17:1808-1815. [PubMed] [DOI] |
| 5. | Qian J, Yao D, Dong Z, Wu W, Qiu L, Yao N, Li S, Bian Y, Wang Z, Shi G. Characteristics of hepatic igf-ii expression and monitored levels of circulating igf-ii mRNA in metastasis of hepatocellular carcinoma. Am J Clin Pathol. 2010;134:799-806. [PubMed] [DOI] |
| 6. | Ubagai T, Kikuchi T, Fukusato T, Ono Y. Aflatoxin B1 modulates the insulin-like growth factor-2 dependent signaling axis. Toxicol In Vitro. 2010;24:783-789. [PubMed] [DOI] |
| 7. | Qiu LW, Yao DF, Zong L, Lu YY, Huang H, Wu W, Wu XH. Abnormal expression of insulin-like growth factor-II and its dynamic quantitative analysis at different stages of hepatocellular carcinoma development. Hepatobiliary Pancreat Dis Int. 2008;7:406-411. [PubMed] |
| 8. | Lee JS, Thorgeirsson SS. Genetic profiling of human hepatocellular carcinoma. Semin Liver Dis. 2005;25:125-132. [PubMed] [DOI] |
| 9. | Thorgeirsson SS, Lee JS, Grisham JW. Molecular prognostication of liver cancer: end of the beginning. J Hepatol. 2006;44:798-805. [PubMed] [DOI] |
| 10. | Nussbaum T, Samarin J, Ehemann V, Bissinger M, Ryschich E, Khamidjanov A, Yu X, Gretz N, Schirmacher P, Breuhahn K. Autocrine insulin-like growth factor-II stimulation of tumor cell migration is a progression step in human hepatocarcinogenesis. Hepatology. 2008;48:146-156. [PubMed] [DOI] |
| 11. | Elyakim E, Sitbon E, Faerman A, Tabak S, Montia E, Belanis L, Dov A, Marcusson EG, Bennett CF, Chajut A. hsa-miR-191 is a candidate oncogene target for hepatocellular carcinoma therapy. Cancer Res. 2010;70:8077-8087. [PubMed] [DOI] |
| 12. | Zhang J, Yang Y, Yang T, Liu Y, Li A, Fu S, Wu M, Pan Z, Zhou W. microRNA-22, downregulated in hepatocellular carcinoma and correlated with prognosis, suppresses cell proliferation and tumourigenicity. Br J Cancer. 2010;103:1215-1220. [PubMed] [DOI] |
| 13. | Lachenmayer A, Alsinet C, Chang CY, Llovet JM. Molecular approaches to treatment of hepatocellular carcinoma. Dig Liver Dis. 2010;42 Suppl 3:S264-S272. [PubMed] [DOI] |
| 14. | Zhou HK, Yang DH, Tang SH, Huang W, Lu XH. [Construction of a plasmid vector of fused protein genes driven by human insulin-like growth factor II P3 promoter]. Zhonghua Yixue Zazhi. 2006;86:106-110. [PubMed] |
| 15. | Yao X, Hu JF, Daniels M, Shiran H, Zhou X, Yan H, Lu H, Zeng Z, Wang Q, Li T. A methylated oligonucleotide inhibits IGF2 expression and enhances survival in a model of hepatocellular carcinoma. J Clin Invest. 2003;111:265-273. [PubMed] |
| 16. | Tang SH, Yang DH, Huang W, Zhou M, Zhou HK, Lu XH, Ye G. Differential promoter usage for insulin-like growth factor-II gene in Chinese hepatocellular carcinoma with hepatitis B virus infection. Cancer Detect Prev. 2006;30:192-203. [PubMed] [DOI] |
| 17. | Tang SH, Yang DH, Huang W, Zhou HK, Lu XH, Ye G. Hypomethylated P4 promoter induces expression of the insulin-like growth factor-II gene in hepatocellular carcinoma in a Chinese population. Clin Cancer Res. 2006;12:4171-4177. [PubMed] [DOI] |
| 18. | Wu J, Qin Y, Li B, He WZ, Sun ZL. Hypomethylated and hypermethylated profiles of H19DMR are associated with the aberrant imprinting of IGF2 and H19 in human hepatocellular carcinoma. Genomics. 2008;91:443-450. [PubMed] [DOI] |
| 19. | Sakatani T, Kaneda A, Iacobuzio-Donahue CA, Carter MG, de Boom Witzel S, Okano H, Ko MS, Ohlsson R, Longo DL, Feinberg AP. Loss of imprinting of Igf2 alters intestinal maturation and tumorigenesis in mice. Science. 2005;307:1976-1978. [PubMed] [DOI] |
| 20. | Eichenmüller M, von Schweinitz D, Kappler R. Betulinic acid treatment promotes apoptosis in hepatoblastoma cells. Int J Oncol. 2009;35:873-879. [PubMed] |
| 21. | Cheng W, Tseng CJ, Lin TT, Cheng I, Pan HW, Hsu HC, Lee YM. Glypican-3-mediated oncogenesis involves the Insulin-like growth factor-signaling pathway. Carcinogenesis. 2008;29:1319-1326. [PubMed] [DOI] |
| 22. | Dong ZZ, Yao DF, Yao DB, Wu XH, Wu W, Qiu LW, Jiang DR, Zhu JH, Meng XY. Expression and alteration of insulin-like growth factor II-messenger RNA in hepatoma tissues and peripheral blood of patients with hepatocellular carcinoma. World J Gastroenterol. 2005;11:4655-4660. [PubMed] |
| 23. | Nussbaum T, Samarin J, Schirmacher P, Breuhahn K. [Insulin-like growth factor (IGF)-signalling pathway components are potential therapeutic targets in the treatment of human hepatocellular carcinoma]. Verh Dtsch Ges Pathol. 2007;91:278-285. [PubMed] |
| 24. | Chen YW, Boyartchuk V, Lewis BC. Differential roles of insulin-like growth factor receptor- and insulin receptor-mediated signaling in the phenotypes of hepatocellular carcinoma cells. Neoplasia. 2009;11:835-845. [PubMed] |
| 25. | Jeng YM, Chang CC, Hu FC, Chou HY, Kao HL, Wang TH, Hsu HC. RNA-binding protein insulin-like growth factor II mRNA-binding protein 3 expression promotes tumor invasion and predicts early recurrence and poor prognosis in hepatocellular carcinoma. Hepatology. 2008;48:1118-1127. [PubMed] [DOI] |
| 26. | Morisawa T, Marusawa H, Ueda Y, Iwai A, Okazaki IM, Honjo T, Chiba T. Organ-specific profiles of genetic changes in cancers caused by activation-induced cytidine deaminase expression. Int J Cancer. 2008;123:2735-2740. [PubMed] [DOI] |