修回日期: 2010-11-18
接受日期: 2010-11-23
在线出版日期: 2011-01-08
目的: 探讨k-ras基因第12密码子突变的定量检测在胰腺疾病鉴别诊断中的价值及其意义.
方法: 应用肽核酸钳制实时荧光定量PCR方法检测143例胰腺癌、110例慢性胰腺炎以及28名正常人的血液中k-ras基因第12密码子的突变量, 并分析其与相关临床指标的关系.
结果: 胰腺癌、慢性胰腺炎和正常人血液中k-ras基因的突变阳性率分别为51.75%、37.27%和7.14%. k-ras基因的突变比例分别为0.821%±0.287%、0.200%±0.064%和0.080%±0.056%. 慢性胰腺炎和正常人即使存在k-ras突变, 其突变比例通常也较胰腺癌低. 胰腺癌患者血液的k-ras突变情况与性别、年龄、吸烟、饮酒、肿瘤TNM分期与临床分期无明显相关.
结论: 肽核酸钳制实时荧光定量PCR方法可用于胰腺疾病的鉴别诊断.
引文著录: 顾俊骏, 高军, 路华, 李兆申. k-ras基因突变的定量检测在胰腺疾病诊断中的应用. 世界华人消化杂志 2011; 19(1): 94-97
Revised: November 18, 2010
Accepted: November 23, 2010
Published online: January 8, 2011
AIM: To evaluate the value of quantitative detection of a k-ras gene mutation at codon 12 in the diagnosis of pancreatic diseases.
METHODS: k-ras codon 12 mutation was quantitatively detected by peptide nucleic acid-mediated real-time PCR clamping in blood samples from 143 patients with pancreatic cancer, 110 patients with chronic pancreatitis, and 28 disease-free people. The results were analyzed using SPSS 18.0.
RESULTS: The positive rates of k-ras codon 12 mutation in patients with pancreatic cancer, those with chronic pancreatitis and normal disease-free people were 51.75%, 37.27% and 7.14%, respectively. The percentages of k-ras gene mutation in the above three groups of patients were 0.821% ± 0.287%, 0.200% ± 0.064% and 0.080% ± 0.056%, respectively. k-ras codon 12 mutation had no significant correlation with gender, age, smoking, alcohol, TNM stage, and clinical stage in patients with pancreatic cancer.
CONCLUSION: Quantitative detection of k-ras codon 12 mutation can be used to distinguish different pancreatic diseases.
- Citation: Gu JJ, Gao J, Lu H, Li ZS. Quantitative detection of k-ras codon 12 mutation in pancreatic diseases. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 94-97
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/94.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.94
k-ras作为一种癌基因是目前人类研究最为关注的肿瘤相关基因之一. k-ras基因突变常见于胰腺癌、结直肠和肺癌等疾病, 其通常发生于第12、13和61密码子. 在胰腺癌中k-ras基因的突变>90%[1-3], 并且集中于第12密码子, 突变类型中GAT、GTT和CGT 3种突变类型更是占所有第12密码子突变的99%以上. 而k-ras基因的突变通常被认为是胰腺癌发生的早期事件[4], 并且k-ras基因的突变率从正常胰腺导管细胞、慢性胰腺炎的扁平或者乳头状异性增生到胰腺癌, 其突变率逐步升高[5,6]. 因此, 单纯的k-ras基因突变定性检测对于胰腺疾病的诊断并不是十分准确, 而k-ras基因突变的定量检测的结果可能揭示即使同时存在k-ras基因突变, 其突变比例的高低不同, 可能更加有用于对胰腺疾病的鉴别诊断.
收集中国人民解放军第二军医大学附属长海医院消化内科2008-07/2010-08有完整病例资料的胰腺癌患者143例、慢性胰腺炎110例以及正常志愿者28例的外周血. 所有病例均经病史、临床表现、实验室及影像学检查确诊.
1.2.1 血液样本DNA的抽提: 抗凝全血1 mL加入500-700 μL TT缓冲液, 剧烈振荡后, 低温离心机12 000 r/min, 离心5 min; 收集沉淀加入200 μL PCR裂解液A; 37 ℃水浴过夜. 抽取PCR裂解物(约200 μL), 加入200 μL酚氯仿, 充分混匀后, 12 000 r/min, 离心20 min; 取上清, 加入200 μL氯仿充分混匀, 12 000 r/min, 离心10 min; 取上清, 加入100 μL乙酸铵及2倍体积无水乙醇(约700 μL)充分混匀, 静置1 min后, 12 000 r/min, 离心10 min. 弃上清加入1 mL 70%乙醇洗涤, 12 000 r/min, 离心5 min; 弃上清, 自然风干, 用100 μL TE液溶解沉淀, 应用NanoDrop ND-1000全波长紫外/可见光扫描分光光度计测出浓度. 分装于-80 ℃保存.
1.2.2 k-ras基因第12密码子突变的检测: 肽核酸钳制实时荧光定量PCR法检测突变. PNA是针对野生型k-ras基因第12、13密码子设计的PNA, 由韩国Panagene公司合成, 其组成为: NH2-CCTACGCCACCAGCTCC-COOH. k-ras-FAM TagMan MGB探针由美国Applied Biosystems公司合成, 其组成分别为野生型k-ras探针GGT: FAM-CTACGCCACCAGCTCCAACT-MGB; 突变型k-ras探针GAT: FAM-CTACGCCATCAGCTCCAACT-MGB; GTT: FAM-CTACGCCAACAGCTCCAACT-MGB; CGT: FAM-CTACGCCACGAGCTCCAACT-MGB. PCR引物由美国Applied Biosystems公司合成. 上游引物F: 5'-AGGCCTGCTGAAAATGACTGAAT-3'; 下游引物R: 5'-TTAGCTGTATCGTCAAGGCACTCT-3'. TaqMan Gene Expression Master Mix购买于美国Applied Biosystems公司. k-ras基因野生型标准品GGT和k-ras基因突变型标准品GAT、GCT、GTT、AGT、CGT、TGT由上海Invitrogen公司合成, 将模板倍比稀释为106、105、104、103、102、101、0拷贝, 作为标准品模板. 仪器选用ABI公司的7500型实时定量PCR仪. 反应体系包括: TaqMan Gene Expression Master Mix 12.5 μL, 上下游引物各0.5 μL(5 μmol/L), PNA 1 μL(10 μmol/L), MGB探针各0.3 μL(10 μmol/L), DNA标准品模板为106、105、104、103、102、101、0拷贝, 用无菌双蒸水定容至25 μL. PCR反应条件: 95 ℃预变性10 min, 之后95 ℃变性15 s, 76 ℃ PNA结合15 s, 60 ℃退火60 s, 共50个循环.
1.2.3 k-ras基因第12密码子突变定量的分析: 采用标准品绝对定量PCR的方法得到每个样本的k-ras野生型和k-ras突变型的量. k-ras基因突变比例定义为k-ras突变型/(k-ras野生型+k-ras突变型). 通过数据转化可以得到每个样本所对应的k-ras基因突变比例, 以用于统计学分析.
统计学处理 采用SPSS18.0医学统计软件进行统计分析. 计量资料用mean±SD表示. 各组目的基因的突变量的比较采用Mann-Whitney U检验. P<0.05为差异有统计学意义.
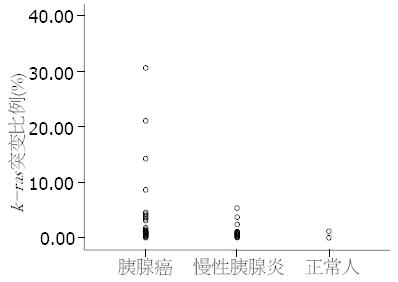
胰腺癌、慢性胰腺炎和正常人血液中k-ras基因的突变阳性率分别为51.75%、37.27%和7.14%. k-ras基因的突变比例分别为0.821%±0.287%、0.200%±0.064%和0.080%±0.056%(表1). 胰腺癌的k-ras基因的突变比例明显高于慢性胰腺炎和正常人, 其各组之间均有显著差异(P<0.05, 图1). 慢性胰腺炎和正常人即使存在k-ras突变, 其突变比例也较胰腺癌低.
| 疾病分类 | n | k-ras基因突变阳性率n(%) | k-ras基因突变比例(%) |
| 胰腺癌 | 143 | 74(51.75) | 0.821±0.287 |
| 慢性胰腺炎 | 110 | 41(37.27) | 0.200±0.064 |
| 正常人群 | 28 | 2(7.14) | 0.080±0.056 |
胰腺癌患者血液的k-ras突变比例与性别、年龄、吸烟、饮酒、肿瘤TNM分期与临床分期无明显相关(表2).
| 临床病例参数 | 突变比例(%) | P值 |
| 性别 | 0.480 | |
| 男性 | 1.000±0.411 | |
| 女性 | 0.430±0.205 | |
| 年龄(岁) | 0.828 | |
| ≥60 | 0.696±0.369 | |
| <60 | 0.850±0.564 | |
| 吸烟 | 0.908 | |
| 是 | 1.696±0.991 | |
| 否 | 0.334±0.095 | |
| 饮酒 | 0.614 | |
| 是 | 3.186±2.759 | |
| 否 | 0.504±0.203 | |
| 肿瘤大小(cm) | 0.484 | |
| ≥2 | 0.117 ±0.050 | |
| <2 | 0.837±0.035 | |
| 淋巴血管侵犯 | 0.313 | |
| 是 | 1.102±0.656 | |
| 否 | 0.444±0.137 | |
| 临床分期 | 0.248 | |
| Ⅰ+Ⅱ期 | 0.278±0.117 | |
| Ⅲ+Ⅳ期 | 0.901±0.409 |
近年来, 许多研究表明恶性肿瘤细胞内的DNA会出现在血清或者血浆之中. Leon[7]及Shapiro等[8]检测了正常人及消化系良、恶性疾病患者的血浆游离DNA水平, 正常人血浆DNA含量平均是13 μg/L, 良、恶性疾病患者分别是118 μg/L和412 μg/L, 胰腺癌患者可高达650 μg/L. 血浆中突变的基因多与原发灶的突变类型一致, 猜测可能是血循环中破碎的肿瘤细胞释放的DNA[9]. 因此, 通过检测外周血DNA的基因型或者突变来诊断肿瘤是一个值得探讨的领域.
在本研究中, 我们联合应用了肽核酸钳制技术和实时定量荧光PCR技术来定量检测胰腺癌、慢性胰腺炎和正常人的k-ras第12密码子突变量及其突变比例. 在进行肽核酸钳制实时定量PCR时, 选用了针对k-ras基因第12密码子的TaqMan探针作为荧光显示物. 他具有高特异性的特点, 每一种探针只能检测第12密码子的一种类型突变. 我们在实验中设计了针对于GAT、GTT以及CGT 3种最为常见的突变类型. 既往研究证实[10], k-ras基因第12密码子突变类型多, 同一肿瘤标本或者不同的肿瘤标本中也可能同时存在多种的k-ras第12密码子的突变, 不可避免的减少了检测的敏感性.
Tada等[11]用采用k-ras基因定量检测胰腺疾病EUS-FNA标本提示胰腺癌的k-ras基因突变高于慢性胰腺炎, 而其在良性胰腺病变中, k-ras基因即使存在突变, 其突变比例也较低. 并且, 通过联合k-ras基因突变和细胞学检查有助于提高胰腺癌的准确诊断率.
Shi等[12]在研究胰腺癌和慢性胰腺炎胰液中的k-ras基因的定量检测中, 发现k-ras的突变比例在胰腺癌组中明显高于慢性胰腺炎组, 并且所有胰腺癌组中胰液的k-ras突变类型与原发肿瘤相一致. 在胰腺组中k-ras突变比例比慢性胰腺炎组中k-ras突变比例要高出很多(0.05%-82.00% vs 0.00%-0.70%). 因此, k-ras基因突变的定量检测, 尤其是对于通过血液、胰液、粪便等非创伤检测有望成为胰腺癌筛查的有效手段.
当然, 在临床上以单一的分子生物学指标来确诊胰腺癌是不够的. 除了k-ras基因, p53、p16、DPC4等基因也常用于胰腺癌的诊断[13,14]. 近年来, 基因甲基化和microRNA的众多研究为胰腺癌的联合诊断提供了有利条件. 虽然本实验研究结果提示k-ras基因在胰腺癌和慢性胰腺炎患者的血液中的突变比例不同, 其结果可能有助于通过不同的突变量来区分胰腺疾病, 并且可能对于胰腺癌的预后有提示. 但是由于本实验的样本量较少, 胰腺癌患者的临床资料缺乏有效的生存时间. 因此, 我们需要更多的样本和临床资料来完善这一结果.
单纯的k-ras基因突变定性检测对于胰腺疾病的诊断并不是十分准确, 而k-ras基因突变的定量检测的结果可能揭示即使同时存在k-ras基因突变, 其突变比例的高低不同, 可能更加有用于对胰腺疾病的鉴别诊断.
韩天权, 教授, 上海交通大学医学院附属瑞金医院外科、上海消化外科研究所
Shi等在研究胰腺癌和慢性胰腺炎胰液中的k-ras基因的定量检测中, 发现k-ras的突变比例在胰腺癌组中明显高于慢性胰腺炎组, 并且所有胰腺癌组中胰液的k-ras突变类型与原发肿瘤相一致.
本研究揭示了即使以往的定性检测实验提示k-ras基因突变的存在, 其突变比例的也存在高低不同, 可能更加适用于对胰腺疾病的鉴别诊断、治疗和预后.
本实验研究结果提示k-ras基因在胰腺癌和慢性胰腺炎患者的血液中的突变比例不同, 其结果可能有助于通过不同的突变量来区分胰腺疾病, 并且可能对于胰腺癌的预后有提示.
k-ras基因突变比例: 为k-ras突变型/(k-ras野生型+k-ras突变型). 肽核酸(PNA)是一种DNA类似物, 其将正常DNA的磷酸二酯骨架由2-氨乙基-甘氨酸所取代. PNA较之传统的探针具有许多优点, 且可运用于实时定量PCR检测.
本文选题较好, 具有一定的学术价值, 对胰腺疾病的鉴别诊断有重要的临床意义.
编辑: 李薇 电编:李薇
| 1. | Almoguera C, Shibata D, Forrester K, Martin J, Arnheim N, Perucho M. Most human carcinomas of the exocrine pancreas contain mutant c-K-ras genes. Cell. 1988;53:549-554. [PubMed] |
| 2. | Hruban RH, van Mansfeld AD, Offerhaus GJ, van Weering DH, Allison DC, Goodman SN, Kensler TW, Bose KK, Cameron JL, Bos JL. K-ras oncogene activation in adenocarcinoma of the human pancreas. A study of 82 carcinomas using a combination of mutant-enriched polymerase chain reaction analysis and allele-specific oligonucleotide hybridization. Am J Pathol. 1993;143:545-554. [PubMed] |
| 3. | Hruban RH, Wilentz RE, Kern SE. Genetic progression in the pancreatic ducts. Am J Pathol. 2000;156:1821-1825. [PubMed] |
| 4. | Takaori K, Hruban RH, Maitra A, Tanigawa N. Pancreatic intraepithelial neoplasia. Pancreas. 2004;28:257-262. [PubMed] [DOI] |
| 5. | van Laethem JL. Ki-ras oncogene mutations in chronic pancreatitis: which discriminating ability for malignant potential? Ann N Y Acad Sci. 1999;880:210-218. [PubMed] [DOI] |
| 6. | Queneau PE, Adessi GL, Thibault P, Cléau D, Heyd B, Mantion G, Carayon P. Early detection of pancreatic cancer in patients with chronic pancreatitis: diagnostic utility of a K-ras point mutation in the pancreatic juice. Am J Gastroenterol. 2001;96:700-704. [PubMed] [DOI] |
| 7. | Leon SA, Shapiro B, Sklaroff DM, Yaros MJ. Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res. 1977;37:646-650. [PubMed] |
| 8. | Shapiro B, Chakrabarty M, Cohn EM, Leon SA. Determination of circulating DNA levels in patients with benign or malignant gastrointestinal disease. Cancer. 1983;51:2116-2120. [PubMed] [DOI] |
| 9. | Castells A, Puig P, Móra J, Boadas J, Boix L, Urgell E, Solé M, Capellà G, Lluís F, Fernández-Cruz L. K-ras mutations in DNA extracted from the plasma of patients with pancreatic carcinoma: diagnostic utility and prognostic significance. J Clin Oncol. 1999;17:578-584. [PubMed] |
| 10. | Däbritz J, Hänfler J, Preston R, Stieler J, Oettle H. Detection of Ki-ras mutations in tissue and plasma samples of patients with pancreatic cancer using PNA-mediated PCR clamping and hybridisation probes. Br J Cancer. 2005;92:405-412. [PubMed] |
| 11. | Tada M, Komatsu Y, Kawabe T, Sasahira N, Isayama H, Toda N, Shiratori Y, Omata M. Quantitative analysis of K-ras gene mutation in pancreatic tissue obtained by endoscopic ultrasonography-guided fine needle aspiration: clinical utility for diagnosis of pancreatic tumor. Am J Gastroenterol. 2002;97:2263-2270. [PubMed] [DOI] |
| 12. | Shi C, Fukushima N, Abe T, Bian Y, Hua L, Wendelburg BJ, Yeo CJ, Hruban RH, Goggins MG, Eshleman JR. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biol Ther. 2008;7:353-360. [PubMed] [DOI] |
| 13. | Rozenblum E, Schutte M, Goggins M, Hahn SA, Panzer S, Zahurak M, Goodman SN, Sohn TA, Hruban RH, Yeo CJ. Tumor-suppressive pathways in pancreatic carcinoma. Cancer Res. 1997;57:1731-1734. [PubMed] |
| 14. | Eskelinen MJ, Haglund UH. Prognosis of human pancreatic adenocarcinoma: review of clinical and histopathological variables and possible uses of new molecular methods. Eur J Surg. 1999;165:292-306. [PubMed] [DOI] |