修回日期: 2010-11-13
接受日期: 2010-11-17
在线出版日期: 2011-01-08
目的: 观察嗜酸乳杆菌BCW和DNA对实验性结肠炎的治疗作用.
方法: 40只♀BABL/c小鼠随机分为正常组、嗜酸乳杆菌BCW组、嗜酸乳杆菌DNA组和生理盐水组, 除正常组小鼠外, 其余各组自由饮用1.5% DSS 7 d建立小鼠结肠炎模型, 从实验第1天开始, 给予嗜酸乳杆菌BCW(20 μg/10 g)、嗜酸乳杆菌DNA(0.2 μg/10 g)和生理盐水(0.2 mL/10 g)灌肠7 d, 观察小鼠每天的体质量变化/粪便性状和粪便隐血情况; 实验结束时处死动物, 观察结肠大体观, 测量全段结肠长度并称其质量; HE染色观测结肠炎症情况, 评价嗜酸乳杆菌BCW和DNA对小鼠急性结肠炎的影响.
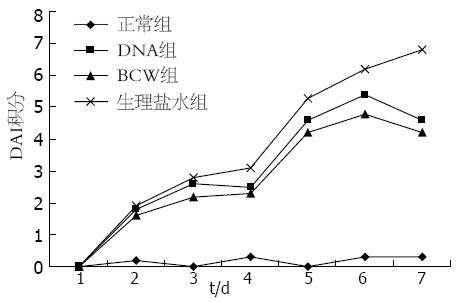
结果: 饮用DSS小鼠体质量逐渐下降, DAI积分增高, 结肠黏膜出现糜烂或溃疡, 腺体破坏, 大量炎性细胞浸润. 与生理盐水组比较, 嗜酸乳杆菌BCW和DNA能减缓小鼠体质量的下降(2.94 g±0.78 g, 3.37 g±1.08 g vs 6.96 g±1.39 g, P<0.05), 降低小鼠DAI积分(4.27±0.41, 4.62±0.56 vs 6.85±0.94, P<0.05), 在组织学方面能阻止DSS导致的结肠缩短(8.62 cm±1.31 cm, 8.15 cm±0.97 cm vs 6.63 cm±1.38 cm, P<0.05)及肠质量指数的增加(1.63%±0.27%, 1.68%±0.29% vs 2.12%±0.22%, P<0.05), 减轻黏膜损伤, 恢复腺体及绒毛的排列, 减轻炎性细胞的浸润.
结论: 嗜酸乳杆菌BCW和DNA能有效地缓解小鼠急性结肠炎炎症, 减轻组织损伤.
引文著录: 练光辉, 陈旻湖, 彭侠彪, 阮巍山. 嗜酸乳杆菌胞壁粗提物及DNA对溃疡性结肠炎小鼠模型的作用. 世界华人消化杂志 2011; 19(1): 78-83
Revised: November 13, 2010
Accepted: November 17, 2010
Published online: January 8, 2011
AIM: To investigate the effect of treatment with Lactobacillus acidophilus (L.acidophilus) cell wall extract (BCW) and DNA on experimental colitis in mice.
METHODS: Forty 6-8-wk-old specific pathogen-free female BALB/c mice were randomly divided into four groups: normal group, L.acidophilus BCW-treated group, L.acidophilus DNA-treated group, and control group. Except the normal group, other groups of mice were subjected to induction of experimental colitis with 1.5% DSS in drinking water for 7 d and then treated with L.acidophilus BCW (20 μg/10 g), L.acidophilus DNA (0.2 μg/10 g), and physiological saline (0.2 mL/10 g), respectively. The changes in body weight, fecal traits, and faecal occult bleeding were recorded each day. All animals were killed on day 8 to isolate the whole colon for examination of length and wet weight. Hematoxylin and eosin staining of colonic sections was performed. The effect of treatment with L.acidophilus BCW and DNA on experimental colitis was then evaluated.
RESULTS: Compared with the control group, weight loss was significantly improved (2.94 g ± 0.78 g, 3.37 g ± 1.08 g vs 6.96 g ± 1.39 g, both P < 0.05) and DAI score was significantly decreased (4.27 ± 0.41, 4.62 ± 0.56 vs 6.85 ± 0.94, both P < 0.05) in mice treated with both L.acidophilus BCW and DNA. Treatment with L.acidophilus BCW and DNA prevented the shortening of colon length (8.62 cm ± 1.31 cm, 8.15 cm ± 0.97 cm vs 6.63 cm ± 1.38 cm, both P < 0.05), increased the colon/body weight index (1.63% ± 0.27%, 1.68% ± 0.29% vs 2.12% ± 0.22%, both P < 0.05), improved mucosal damage and inflammatory infiltration, and protected mucosal glands and villi.
CONCLUSION: Treatment with L.acidophilus cell wall extract and DNA can improve DSS-induced experimental colitis in mice.
- Citation: Lian GH, Chen MH, Peng XB, Ruan WS. Treatment with Lactobacillus acidophilus cell wall extract and DNA improves experimental acute colitis in mice. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 78-83
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/78.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.78
溃疡性结肠炎(ulcerative colitis, UC)是一种多因素的慢性疾病, 具有慢性、反复、迁延的特点. 随着我国人们生活环境及饮食结构的变化, 该病的发病在我国特别是发达地区呈上升态势. 近年来对UC病因研究的深入, 人们发现肠道微生态系统的失衡是结肠炎发病及迁延的重要一环.
据此研究人员给予补充外源性的益生菌, 如双歧杆菌属、乳酸杆菌属、非致病性大肠杆菌、枯草杆菌等均获得了良好的效果. 其作用机制普遍认为与益生菌黏附肠黏膜细胞、竞争性抑制、代谢物作用、直接抑杀致病菌及刺激机体产生β-防御素等[1-3], 这些口服的益生菌在通过胃酸及胆汁的作用后, 只有极少的部位能到达回结肠, 部分使用的益生菌亦非肠道固有菌群, 在肠黏膜上不能定植生长, 所以通过活菌产生的作用大打折扣. 而且所谓的"益生菌"在某些情况下进入血液引起的菌血症、感染性心内膜炎及肺脓肿在全球也有散发报道[4-6], 这使得人们在应用益生菌活菌进行治疗的时候也变得小心翼翼. 近年来, 研究发现除了益生菌活菌外, 其菌体成分如胞壁成分、DNA等均有免疫调节、抗肿瘤、抗衰老甚至有直接抑杀致病菌的作用, 因此这些益生菌的菌体成分能否因免疫调节、抗炎等作用而成为下一个UC治疗的研究重点值得期待.
本研究通过7 d DSS饮用诱导出急性期UC模型, 综合观察疾病活动、结肠组织损伤等情况, 分析嗜酸乳杆菌DNA以及细菌胞壁提取物(bacterial cell wall, BCW)对小鼠模型疾病发展和转归的影响, 评价嗜酸乳杆菌细菌成分对DSS诱导的UC急性期动物模型的治疗价值.
DSS分子量36 000-50 000 Da, 购自Sigma公司, 用生理盐水配制成1.5%浓度, 嗜酸乳杆菌为湖南康哲中南医药研究有限公司提供, ♀Balb/c小鼠40只, 6-8 wk龄, 体质量20.0 g±2.0 g, 购于湖南农业大学东创实验动物科技服务部, 饲养于清洁级动物房.
1.2.1 分组: 40只Balb/c小鼠, 随机分成4组, 每组10只. 生理盐水组: DSS造模+无菌生理盐水灌肠; BCW组: DSS造模+BCW (100 mg/L)灌肠; DNA组: DSS造模+DNA(1 mg/L)灌肠; 正常组: 正常饮食; 采用自由饮水7 d造模.
1.2.2 抽提细菌DNA: 通过常规的苯酚-氯仿抽提法对嗜酸乳杆菌基因组DNA进行抽提.
1.2.3 BCW提取: 常规超声离心法提取嗜酸乳杆菌BCW, 冷冻干燥后保存备用.
1.2.4 动物的处理: 实验期间每日观察小鼠进食、饮水、活动等一般情况, 称量体质量, 观察粪便性状及粪便隐血、便血情况, 计算疾病活力指数积分(disease active index, DAI), 评估结肠炎严重程度. 实验动物第8天颈椎脱臼处死小鼠, 游离结肠和远端回肠, 取出肛门至盲肠末端的整个结肠和直肠段, 观察各组小鼠结肠的大体改变、测量整个结肠长度及湿质量, 并根据如下公式计算肠质量指数, 肠质量指数 = 结肠质量/体质量×100%. 用预冷无菌生理盐水将结肠冲洗干净, 分别于结肠末端(距肛门1 cm)处剪取0.5 cm长结肠, 甲醛浸泡, 石蜡包埋、切片, 做病理检查.
饮用DSS使小鼠精神萎靡, 活动及进食减少, 并出现大便松散不成形、肛周血迹甚至血水便, 从第2天开始出现体质量下降, 至实验结束时生理盐水组小鼠体质量减轻累积达到6.96 g±1.39 g; DNA组体质量减轻也达到3.37 g±1.08 g, BCW组体质量下降最少(2.94 g±0.78 g), 较生理盐水组有显著差异(P<0.05). 而正常小鼠在实验期间体质量缓慢增加, 至实验结束时体质量增加了1.21 g±0.46 g.
小鼠饮用DSS后DAI呈逐渐上升趋势, 第7天生理盐水组的DAI高达6.85±0.94. 用嗜酸乳杆菌DNA、BCW干扰饮用DSS的小鼠后, DAI的变化趋势在前6 d均呈上升趋势, 与生理盐水组无明显差异, 至第7天接受BCW和细菌DNA灌肠小鼠由于大便基本成型, 粪便隐血大部分消失, DAI积分较生理盐水组小鼠明显降低(4.27±0.41, 4.62±0.56), 与生理盐水组比较有明显差异(P<0.05, 图1). 图中结果表明, 饮用DSS的小鼠DAI逐渐增加, 用生理盐水不能阻止病情的发展. 随着实验进程, 嗜酸乳杆菌DNA、BCW能有效阻止症状加重.
DSS造模小鼠结肠长度均有不同程度的缩短, 嗜酸乳杆菌DNA、BCW组小鼠结肠缩短均小于生理盐水组小鼠(P<0.05), 肠质量指数在饮用DSS后有不同程度的增加, 说明小鼠结肠发生炎症水肿、充血、局部有所增厚, 生理盐水不能阻止这种变化, 嗜酸乳杆菌DNA、BCW能减少肠质量指数的增加, 与生理盐水组比较差异有显著意义(P<0.05, 表1).
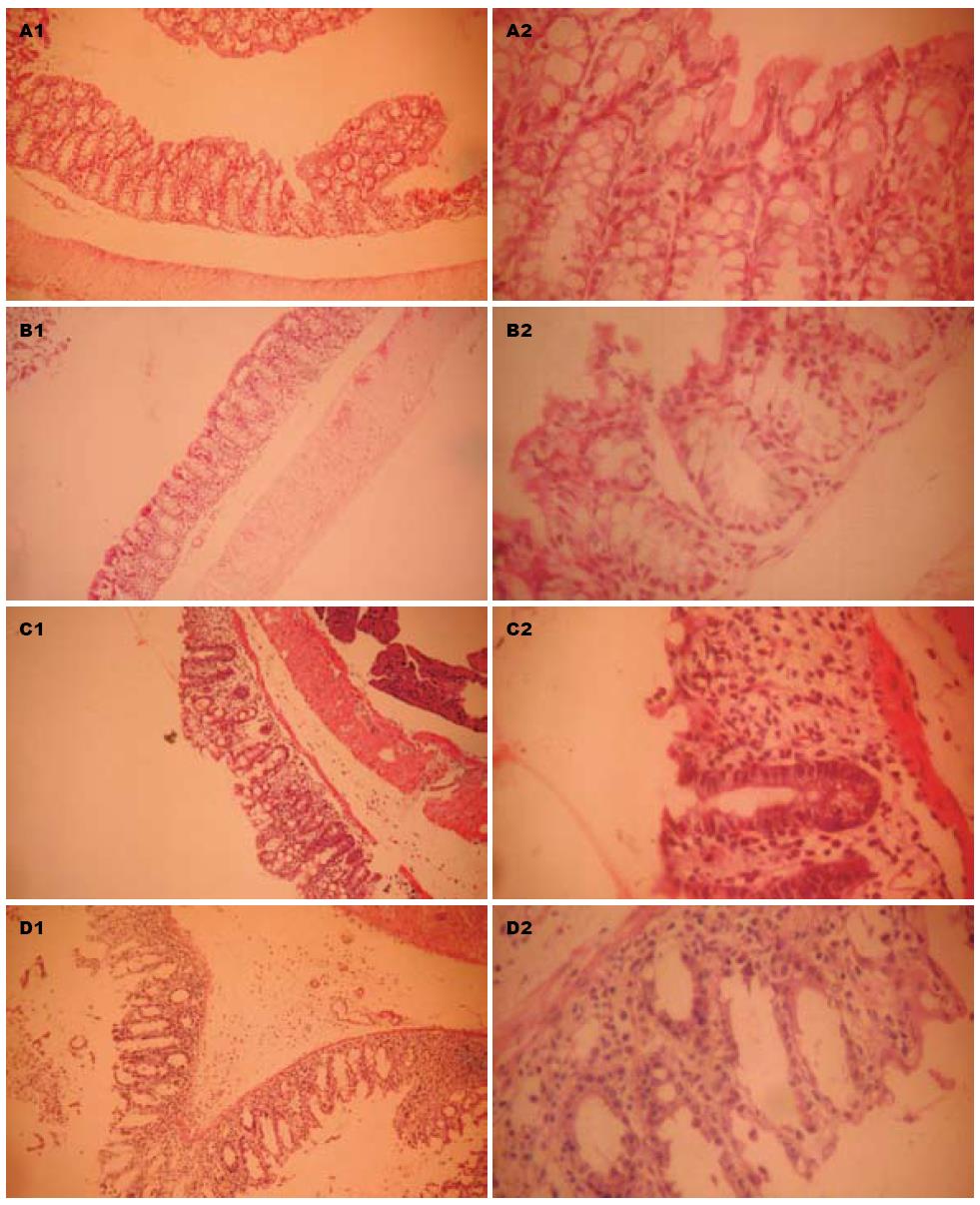
正常组小鼠直结肠组织黏膜结构及绒毛完整, 腺体排列整齐, 隐窝正常, 杯状细胞无减少, 未见黏膜糜烂, 出血, 无炎性细胞浸润(图2A), BCW组小鼠结肠黏膜轻度破坏, 呈糜烂状, 可见局部充血, 腺体减少, 隐窝部有炎性细胞的浸润(图2B), DNA组小鼠结肠有溃疡形成, 局部黏膜缺失, 腺体减少, 绒毛基本消失, 底部有较多的炎性细胞浸润(图2C); 生理盐水组小鼠结肠黏膜可见大片溃疡, 绒毛及腺体消失, 炎症累及全层, 大量炎性细胞浸润(图2D). 以上结果可以看出, 嗜酸乳杆菌BCW、DNA均能减轻DSS造成的黏膜损伤, 恢复腺体及绒毛排列, 减轻炎性细胞浸润, 而生理盐水并无此效果. 在组织学评分方面, 正常小鼠分值基本为零, 生理盐水组分值远远高于嗜酸乳杆菌BCW、DNA处理组, 说明嗜酸乳杆菌BCW、DNA能改善小鼠组织学损伤.
UC是一种难治性、复发性疾病, 其病因还不甚清楚, 研究普遍认为与肠道微生物的基因易感性、黏膜免疫及肠道菌群有很重要的关系. UC好发的结肠是肠道菌群最为集中的部位, 此前的研究发现艰难梭菌、致病性大肠杆菌、沙门氏菌和弯曲杆菌等多种细菌感染与UC有关, 其治疗研究从传统的氨基水杨酸、激素甚至免疫抑制剂到近年来的生物疗法, 其中通过口服长双歧杆菌、乳酸杆菌、VSL#3及E.coli Nissle 1 917等多种益生菌均报道获得了满意的效果[7-9], 而且通过其依从性好, 不良反应小, 经济等优点获得了临床工作人员的青睐. 然而Elmer等[10]发现口服乳酸杆菌和双歧杆菌大部分都被胃酸和胆汁灭活, 只有所服用的1.5%乳酸杆菌和37.5%双歧杆菌能到达回肠末端, 如此少的益生菌达到回结肠部, 能够黏附定植下来的数量可能就更少, 而这些益生菌的治疗UC的机制普遍认为与活菌黏附、竞争性抑制及其分泌的代谢产物有密切关系.
研究人员比较了被认为是与UC发病有很强相关性的几种细菌变形梭杆菌、梭形梭杆菌、拟杆菌、大肠埃希氏菌和保级利亚乳杆菌、德氏乳杆菌对SW-480和HT-29细胞的黏附作用却发现两种乳杆菌对肠黏膜的黏附作用似乎没有预想的好, 远低于这些致病菌对细胞的黏附[11], 这就更加使得外源性补充的益生菌可能不能在相应部位定植而成为过路菌. 如此少量的益生菌到达病灶部位定植是否能与数量庞大的致病菌产生竞争性抑制或者产生足够的代谢产物抑制致病菌的生长值得一定的怀疑. 甚至在刑咏梅等[12]的研究认为德氏乳杆菌和肠球菌的灭活状态较活菌状态对肠黏膜上皮细胞的黏附性显著增高. 对于益生菌的代谢产物, 有些研究认为益生菌代谢物可以通过丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)等途径调节机体的免疫[13], 有些研究认为细菌的代谢物根本没有免疫调节功能, 可能只是所产生的酸性物质起作用[14], Miyazaki等[15]检测了乳杆菌属、双歧杆菌属、肠球菌属等9种益生菌代谢物对凝聚性大肠杆菌的抑杀作用发现, 双歧杆菌属及粪肠球菌培养上清对凝聚性大肠杆菌没有作用, 而干酪乳杆菌干酪亚种和鼠李糖亚种的抑杀作用通过中和上清以后消失. 因此我们认为在益生菌替代疗法中其作用机理可能不完全是由于活菌黏附定植, 而益生菌被消化破碎以后的菌体成分也可能是起效的重要因素.
本研究使用的嗜酸乳杆菌是从健康人体分离出来的, 在之前的研究中发现口服活菌对于轻、中度UC小鼠有一定的治疗作用. 采用超声破碎嗜酸乳杆菌提取BCW、常规苯酚-氯仿抽提法提取嗜酸乳杆菌DNA, 通过灌肠干预DSS诱导的结肠炎小鼠, 观察这两种成分是否对急性活动性结肠炎小鼠有治疗效果. 结果显示, 无论是嗜酸乳杆菌的BCW还是DNA均可以缓解结肠炎的症状, 虽然饮用DSS后各组小鼠的体质量均逐渐下降, 然而嗜酸乳杆菌BCW及DNA对体质量下降的保护明显好于生理盐水; 从DAI积分来说亦是如此, 予以嗜酸乳杆菌BCW及DNA以后, 小鼠的大便性状、隐血/血便情况明显好转, 加之体质量减轻较少, 使得反映结肠炎临床症状的DAI积分明显较生理盐水组小鼠低. 通过结肠组织学来看, 饮用DSS后小鼠结肠缩短、肠质量指数增加, 说明结肠不单有充血、水肿质量的相对增加, 还有结肠糜烂、溃疡所致长度缩短, 而嗜酸乳杆菌BCW及DNA能缓解结肠炎症, 降低肠质量指数, 从显微镜下观察, 结肠上皮的损伤及炎性细胞浸润也较生理盐水组小鼠轻, 但嗜酸乳杆菌两种菌体成分在这些作用中没有差异.
通过本研究可以发现, 嗜酸乳杆BCW及DNA可以缓解小鼠急性UC, 但这些益生菌的细菌成分与活菌之间作用是否有差别、联用是否有叠加效果及其作用机制尚需深入研究.
嗜酸乳杆菌等益生菌是肠道内的正常菌群, 可以维护肠道正常的结构及功能, 其胞壁部分及核酸认为具有免疫调节、抗感染、抗衰老、抗肿瘤等作用, 应用益生菌的胞壁及核酸进行肠道疾病的治疗的研究已经在日本等国家逐渐开展, 而溃疡性结肠炎是一种包括免疫异常、感染等因素在内的多因素疾病, 研究嗜酸乳杆菌胞壁及核酸对溃疡性结肠炎的作用可以开发出成分较为单一、毒不良反应更小、能更快进入临床的药物.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
Miyazaki等检测了乳杆菌属、双歧杆菌属、肠球菌属等9种益生菌代谢物对凝聚性大肠杆菌的抑杀作用发现, 双歧杆菌属及粪肠球菌培养上清对凝聚性大肠杆菌没有作用, 而干酪乳杆菌干酪亚种和鼠李糖亚种的抑杀作用通过中和上清以后消失.
使用嗜酸乳杆菌胞壁及核酸对溃疡性结肠炎进行治疗, 既保存了益生菌的有效性, 又避免细菌易位的发生, 而且成分更加单一, 容易分析.
胞壁粗提物: 采用超声波将细菌菌体破碎以后, 去除胞质、胞核及大部分蛋白质后所保留的细菌细胞壁成分.
本文选题恰当, 具有一定的临床参考意义和实用价值.
编辑: 李薇 电编:李薇
| 1. | Liu C, Zhang ZY, Dong K, Guo XK. Adhesion and immunomodulatory effects of Bifidobacterium lactis HN019 on intestinal epithelial cells INT-407. World J Gastroenterol. 2010;16:2283-2290. [PubMed] [DOI] |
| 2. | Watanabe T, Nishio H, Tanigawa T, Yamagami H, Okazaki H, Watanabe K, Tominaga K, Fujiwara Y, Oshitani N, Asahara T. Probiotic Lactobacillus casei strain Shirota prevents indomethacin-induced small intestinal injury: involvement of lactic acid. Am J Physiol Gastrointest Liver Physiol. 2009;297:G506-G513. [PubMed] [DOI] |
| 3. | Schlee M, Wehkamp J, Altenhoefer A, Oelschlaeger TA, Stange EF, Fellermann K. Induction of human beta-defensin 2 by the probiotic Escherichia coli Nissle 1917 is mediated through flagellin. Infect Immun. 2007;75:2399-2407. [PubMed] [DOI] |
| 4. | Alberte A, de La Fuente R, Avellaneda C, Pascual PP. [Post-ERCP bacteriemia due to Lactobacillus casei: a case history]. Enferm Infecc Microbiol Clin. 2003;21:215. [PubMed] [DOI] |
| 5. | Salvana EM, Frank M. Lactobacillus endocarditis: case report and review of cases reported since 1992. J Infect. 2006;53:e5-e10. [PubMed] [DOI] |
| 6. | Koch S, Hufnagel M, Huebner J. Treatment and prevention of enterococcal infections--alternative and experimental approaches. Expert Opin Biol Ther. 2004;4:1519-1531. [PubMed] [DOI] |
| 7. | Furrie E, Macfarlane S, Kennedy A, Cummings JH, Walsh SV, O'neil DA, Macfarlane GT. Synbiotic therapy (Bifidobacterium longum/Synergy 1) initiates resolution of inflammation in patients with active ulcerative colitis: a randomised controlled pilot trial. Gut. 2005;54:242-249. [PubMed] |
| 8. | Helwig U, Lammers KM, Rizzello F, Brigidi P, Rohleder V, Caramelli E, Gionchetti P, Schrezenmeir J, Foelsch UR, Schreiber S. Lactobacilli, bifidobacteria and E. coli nissle induce pro- and anti-inflammatory cytokines in peripheral blood mononuclear cells. World J Gastroenterol. 2006;12:5978-5986. [PubMed] |
| 9. | Bibiloni R, Fedorak RN, Tannock GW, Madsen KL, Gionchetti P, Campieri M, De Simone C, Sartor RB. VSL#3 probiotic-mixture induces remission in patients with active ulcerative colitis. Am J Gastroenterol. 2005;100:1539-1546. [PubMed] [DOI] |
| 10. | Elmer GW, Surawicz CM, McFarland LV. Biotherapeutic agents. A neglected modality for the treatment and prevention of selected intestinal and vaginal infections. JAMA. 1996;275:870-876. [PubMed] |
| 11. | Ohkusa T, Yoshida T, Sato N, Watanabe S, Tajiri H, Okayasu I. Commensal bacteria can enter colonic epithelial cells and induce proinflammatory cytokine secretion: a possible pathogenic mechanism of ulcerative colitis. J Med Microbiol. 2009;58:535-545. [PubMed] [DOI] |
| 13. | Hoarau C, Martin L, Faugaret D, Baron C, Dauba A, Aubert-Jacquin C, Velge-Roussel F, Lebranchu Y. Supernatant from bifidobacterium differentially modulates transduction signaling pathways for biological functions of human dendritic cells. PLoS One. 2008;3:e2753. [PubMed] [DOI] |
| 14. | Söderling EM, Marttinen AM, Haukioja AL. Probiotic Lactobacilli Interfere with Streptococcus mutans Biofilm Formation In Vitro. Curr Microbiol. 2010;61:618-622. [PubMed] [DOI] |
| 15. | Miyazaki Y, Kamiya S, Hanawa T, Fukuda M, Kawakami H, Takahashi H, Yokota H. Effect of probiotic bacterial strains of Lactobacillus, Bifidobacterium, and Enterococcus on enteroaggregative Escherichia coli. J Infect Chemother. 2010;16:10-18. [PubMed] [DOI] |