修回日期: 2010-10-25
接受日期: 2010-11-02
在线出版日期: 2011-01-08
目的: 研究转染GKLF基因对人胃癌SGC-7901细胞裸鼠皮下移植瘤的作用, 探讨GKLF在胃癌中可能的作用机制.
方法: 将外源性重组真核质粒pcDNA3.1-GKLF转染到人胃癌细胞株SGC-7901内, 经G418筛选并建立高表达GKLF的稳定转染细胞株. 稳定表达该基因的细胞为SGC7901-pcDNA3.1-GKLF组, 转染空质粒细胞及未处理细胞为对照组(SGC7901-pcDNA3.1组和SGC-7901组), 建立裸鼠荷瘤模型. 监测肿瘤生长状况、成瘤潜伏期, HE染色观察肿瘤病理学变化, 免疫组织化学法检测裸鼠皮下移植瘤组织内GKLF、Ki-67蛋白的表达.
结果: 与SGC-7901组和SGC7901-pcDNA3.1组相比, SGC7901-pcDNA3.1-GKLF组成瘤潜伏期延长, 差异具有统计学意义(14.67 d±3.08 d vs 8.33 d±1.03 d, 8.67 d±1.03 d, 均P<0.05). SGC7901-pcDNA3.1-GKLF组皮下移植瘤质量低于SGC-7901组和SGC7901-pcDNA3.1组, 移植瘤生长受抑, 差异具有统计学意义(4.46 g±0.92 g vs 8.05 g±1.66 g, 7.82 g±1.14 g, 均P<0.05). SGC7901-pcDNA3.1-GKLF组中移植瘤细胞分化较SGC-7901组和SGC7901-pcDNA3.1组好, 皮下移植瘤组织内GKLF蛋白阳性表达比例升高(4/6 vs 2/6, 2/6)、Ki-67蛋白阳性表达比例降低(1/6 vs 4/6, 4/6).
结论: GKLF基因可能通过下调Ki-67的表达而抑制胃癌SGC-7901细胞裸鼠皮下移植瘤的生长, 以GKLF为靶点的基因治疗有潜在临床应用前景.
引文著录: 严辉, 陈卫昌, 岑建农, 沈宏杰, 郭凌川, 顾冬梅, 谢学顺. 转染GKLF基因对人胃癌细胞SGC-7901裸鼠移植瘤的抑制作用. 世界华人消化杂志 2011; 19(1): 7-12
Revised: October 25, 2010
Accepted: November 2, 2010
Published online: January 8, 2011
AIM: To investigate the effects of transfection of the gut-enriched Krüppel-like factor (GKLF) gene on the growth of xenograft tumors derived from human gastric carcinoma cell line SGC-7901 in nude mice and to explore the potential role of the GKLF gene in gastric carcinogenesis.
METHODS: A recombinant plasmid carrying the GKLF gene (pcDNA3.1-GKLF) was transfected into SGC-7901 cells by lipofectin-mediated method. Cells stably expressing the GKLF gene were selected using G418. SGC-7901 cells untransfected and those transfected with empty pcDNA3.1 plasmid were used as controls. A xenograft tumor model was then established. Tumor growth was monitored. Tumor histopathological changes were determined by hematoxylin and eosin (HE) staining. The expression of GKLF and Ki-67 proteins in xenograft tissue was detected by immunohistochemistry.
RESULTS: Compared with the SGC7901-pcDNA3.1 and SGC-7901 groups, the period of latency was significantly lengthened in the SGC7901-pcDNA3.1-GKLF group (14.67 d ± 3.08 d vs 8.33 d ± 1.03 d, 8.67 d ± 1.03 d, both P < 0.05). The weight of xenograft tumors in the SGC7901-pcDNA3.1-GKLF group was significantly lower than that in the SGC7901-pcDNA3.1 and SGC-7901 groups (4.46 g ± 0.92 g vs 8.05 g ± 1.66 g, 7.82 g ± 1.14 g, both P < 0.05). The degree of tumor differentiation in the SGC7901-pcDNA3.1-GKLF group was better than that in the other two groups. Furthermore, the positive proportion of GKLF protein expression in xenograft tissue was increased while that of Ki-67 protein expression was decreased in the SGC7901-pcDNA3.1-GKLF group when compared with the other two groups (4/6 vs 2/6, 2/6; 1/6 vs 4/6, 4/6).
CONCLUSION: Transfection of the GKLF gene inhibits the growth of subcutaneous xenograft tumors derived from SGC-7901 cell line in nude mice by down-regulating the expression of Ki-67. The GKLF gene is a potential target for gene therapy of gastric carcinoma.
- Citation: Yan H, Chen WC, Cen JN, Shen HJ, Guo LC, Gu DM, Xie XS. GKLF transfection inhibits the growth of xenograft tumors derived from human gastric carcinoma cell line SGC-7901 in nude mice. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 7-12
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/7.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.7
转录因子是一类具有重要功能的序列特异性DNA结合蛋白, 他们通过激活或抑制其目标基因的转录来调控基因的时相性及细胞和组织的特异性表达, 而在细胞生长、分化、凋亡等生理过程的调节中担任重要角色. 胃肠富集Krüppel样因子(gut-enriched Krüppel-like factor, GKLF)是Krüppel样转录因子家族的成员, GKLF与肿瘤间的关系是近年来研究的热点. 本研究将GKLF基因转染到人胃癌细胞株SGC-7901内, 建立了高表达GKLF蛋白的稳定转染细胞株, 然后将不同组的细胞接种于裸鼠皮下成瘤, 观察移植瘤生长状况和病理学变化, 检测移植瘤组织内GKLF、Ki-67蛋白表达, 初步探讨GKLF基因在胃癌中可能的作用机制, 为今后以GKLF为靶点的基因治疗提供实验依据.
人胃癌细胞株SGC-7901购于中科院上海细胞生物研究所, pcDNA3.1空质粒及pcDNA3.1-GKLF质粒由中国医学科学院肿瘤研究所、分子肿瘤学国家重点实验室刘芝华教授惠赠. LipofectamineTM2000购自美国Invitrogen公司, RPMI 1640购自美国Gibco BRL公司, GKLF一抗购自美国R&D公司, Ki-67一抗及SP试剂盒均购自福建迈新生物公司.
1.2.1 细胞转染与克隆化培养: 取对数生长期的SGC-7901细胞2×105重悬于含血清的RPMI 1640中, 转种于6孔板, 常规培养使细胞达80%-90%融合. 采用脂质体介导法将pcDNA3.1-GKLF质粒及pcDNA3.1空质粒各4 μg分别转染SGC-7901细胞, 加入1.0 g/L的G418筛选, 同时用未转染的SGC-7901细胞作对照. 当对照细胞大部分死亡时, 再换0.6 g/L的G418筛选. 当对照细胞大部分死亡后, 挑取实验细胞的阳性克隆并扩大培养, 分别获得SGC7901-pcDNA3.1-GKLF和SGC7901-pcDNA3.1细胞.
1.2.2 荷瘤实验与分组: 健康纯种4-5周龄的BALB/C-nu/nu♀裸鼠, 体质量16-20 g, 购自上海斯莱克实验动物有限公司, 在苏州大学无特定病原体级动物实验中心分笼饲养. 裸鼠18只, 各随机分成3组, 用安尔碘消毒裸鼠右胁腹前肢皮肤, 将3组细胞悬液(SGC-7901、SGC7901-pcDNA3.1和SGC7901-pcDNA3.1-GKLF)以每只1×1011个/L接种于裸鼠, 每6只裸鼠接种同一组细胞.
1.2.3 裸鼠的一般情况和成瘤观察: 每天观察3组裸鼠的一般情况、摄食、活动能力. 每周用游标卡尺测量移植瘤的最大径(a)和最小径(b), 按公式V(mm3) = a×b2/2计算肿瘤的近似体积, 绘制裸鼠的移植瘤生长曲线. 分别记录裸鼠皮下移植瘤结节达Φ2 mm的时间, 即成瘤潜伏期. 连续观察6 wk后, 采用颈椎脱位法处死裸鼠, 解剖并完整取出瘤块, 称瘤质量.
1.2.4 免疫组织化学法检测移植瘤组织中GKLF、Ki-67蛋白表达: 用40 g/L甲醛固定瘤块, 石蜡包埋、切片行HE染色. 免疫组织化学(immunohistochemistry, IHC)法步骤按说明书进行, PBS代替一抗作阴性对照, 胞核或胞质内有清晰棕色细颗粒为阳性细胞. 光镜下每例随机观察5个高倍视野, 每个视野计数100个细胞, 计数其中的阳性细胞. GKLF阳性判断标准采用半定量计分法[1]: 依阳性细胞平均染色程度: 0分-无染色, 1分-淡黄色, 2分-棕色, 3分-深棕色; 依阳性细胞占总细胞的百分数: <10%为0分, 10%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; 两组评分相乘, ≤3分为阴性, ≥4分即为阳性. Ki-67染色阳性判断标准参照郑金锋等[2]的方法, 依染色细胞数及强弱分类: (1)阴性(-): 阳性细胞数<25%, 染色较淡; (2)阳性(+-++): 阳性细胞数≥25%, 染色较强、清晰.
统计学处理 用医用SAS8.0统计软件进行分析、处理. 数据以mean±SD表示. 组间均数的比较采用单因素方差分析. 行*列表资料的率差别采用χ2检验. P<0.05为差异有统计学意义.
SGC-7901组和SGC7901-pcDNA3.1组动物摄食少, 行动迟缓, 精神萎靡, 双眼微闭, 体型较瘦, 皮下脂肪减少; SGC7901-pcDNA3.1-GKLF组动物上述症状较前两组轻. 本实验中, 无一只动物出现自然死亡.
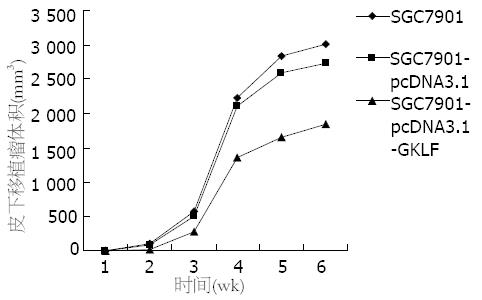
在接种后的前2 wk, 皮下移植瘤的生长无明显差别; 2 wk以后差别逐渐明显, SGC-7901组和SGC7901-pcDNA3.1组皮下移植瘤生长较迅速, 肿瘤体积较大, SGC7901-pcDNA3.1-GKLF组皮下移植瘤生长较缓慢, 肿瘤体积相对较小, SGC7901-pcDNA3.1-GKLF组皮下移植瘤的体积增长明显滞后于SGC-7901组和SGC7901-pcDNA3.1组, 差异有统计学意义(P<0.05, 图1).
SGC7901-pcDNA3.1-GKLF组成瘤潜伏期较SGC-7901组和SGC7901-pcDNA3.1组长(14.67 d±3.08 d vs 8.33 d±1.03 d, 8.67 d±1.03 d), SGC7901-pcDNA3.1-GKLF组成瘤时间被明显推迟(F = 10.78, P = 0.0039).
连续观察6 wk后处死裸鼠, 取出瘤块, 称瘤质量. SGC7901-pcDNA3.1-GKLF组瘤质量较SGC-7901组和SGC7901-pcDNA3.1组轻, 差异有统计学意义(4.46 g±0.92 g vs 8.05 g±1.66 g, 7.82 g±1.14 g, F = 19.14, P = 0.0005).
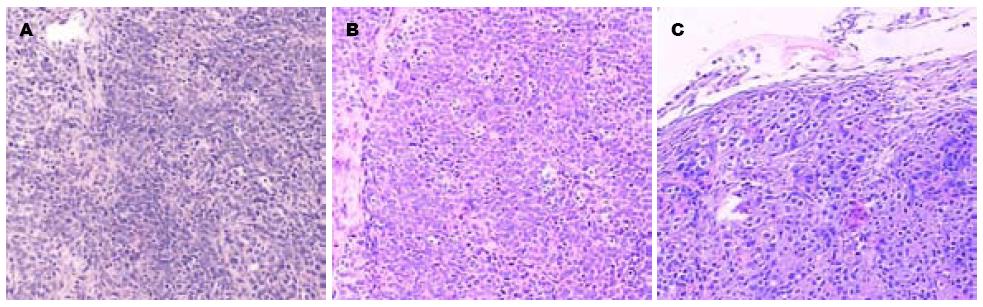
SGC-7901组和SGC7901-pcDNA3.1组: 癌细胞呈巢状、弥漫分布、间质稀少、血窦丰富、极性丧失、分化差、胞质丰富、核分裂易见、核仁明显、可见1-2个中位核仁. SGC7901-pcDNA3.1-GKLF组: 癌细胞呈岛状、腺泡样排列、间质丰富、血窦稀少、分化较好、胞质空淡、核分裂可见、小核仁或部分核仁不明显(图2).
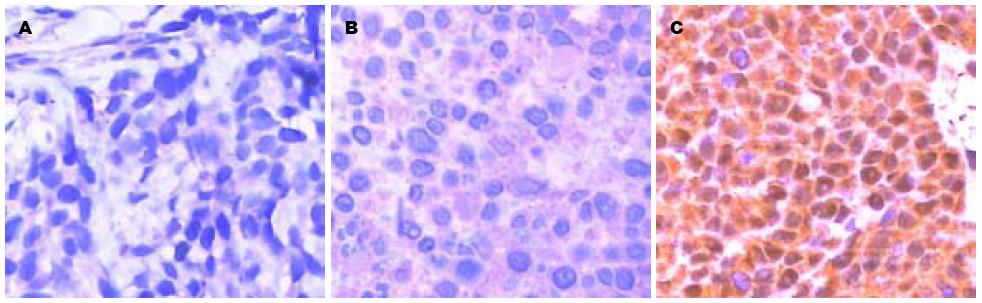
GKLF阳性染色定位于胞核或胞质, SGC-7901和SGC7901-pcDNA3.1组阳性细胞分布较稀且染色淡, SGC7901-pcDNA3.1-GKLF组阳性细胞分布较密集, 染色深(图3). SGC7901-pcDNA3.1-GKLF组GKLF阳性表达比例高于SGC-7901组和SGC7901-pcDNA3.1组(4/6、2/6、2/6).
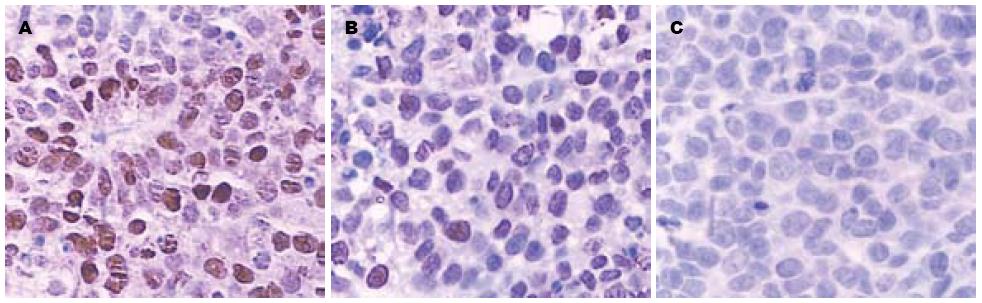
Ki-67阳性染色定位于胞核, SGC-7901和SGC7901-pcDNA3.1组阳性细胞分布较广且染色较深, 而SGC7901-pcDNA3.1-GKLF组阳性细胞分布相对比较散在, 且染色也比较淡(图4). SGC7901-pcDNA3.1-GKLF组中Ki-67蛋白阳性表达比例低于SGC-7901组和SGC7901-pcDNA3.1组(1/6、4/6、4/6).
胃癌发病率占消化系统恶性肿瘤的首位, 传统的治疗方法有手术、化放疗等, 但由于放化疗不良反应大、肿瘤多药耐药等问题, 且这些疗法对患者的免疫系统产生不同程度的打击和损害, 疗效不理想. 随着分子遗传学和分子生物学的不断发展, 以及基因工程技术的不断进步, 应用基因方法或以基因作为靶点来防治胃癌亦成为众多研究者关注的热点[3].
Krüppel样因子(Krüppel-like factor, KLF)是一类结合DNA的锌指转录因子, 该家族蛋白的独特之处是含3个高度保守的锌指, 每两个锌指之间含有残基, KLF识别并结合"GC"盒或"CACCC元素", 因此他们行为的特异性取决于不同的氨基末端和/或组织特异性表达. 迄今已发现17种哺乳类KLF, 按发现先后分别命名为KLF1-KLF17[4]. KLF中各成员分布不同, 结构存在一定的差异, 功能也各异.
GKLF是KLF的成员之一, 在其家族中亦被称为KLF4, 在细胞的正常生长分化和恶性肿瘤形成过程中具有重要作用. 人类GKLF于1998年通过DNA探针, 该探针含人胚胎红细胞Krüppel样因子(EKLF, KLF1)锌指区域, 从人脐静脉内皮细胞cDNA 文库中被发现.人GKLF基因定位于染色体9q31, 涵盖6.3 kb的区域, 含有5个外显子, 对人脐静脉内皮细胞和其他细胞RNA行Northen blot分析显示GKLF转录区域长约3.5 kb[5-9]. 其cDNA编码区长度为1 413 bp, 编码1个由470个氨基酸残基组成的多肽[5]. GKLF主要表达在胃肠道和皮肤分化层中, 故得名为GKLF[10]. GKLF在皮肤、肺、胃肠道等上皮性来源的组织中含量丰富, 尤其在正常上皮的上层分化细胞中表达高, 而在基底层快速生长的细胞中表达很低, 在上皮各层形成GKLF表达梯度, 表明其参与上皮细胞的分化[11].
近年研究发现GKLF与肿瘤的发生密切相关, 其在肿瘤中的表达具有类型特异性: 如在食道鳞癌、结直肠癌、肝癌、膀胱癌、肺癌中GKLF的表达明显下调[12-16], 而在口腔鳞癌和乳腺癌中表达却是上升的[17,18]. 在乳腺癌细胞生长抑制试验中, 发现GKLF的表达加强了原癌基因c-myc的转录表达, 这可能是乳腺癌细胞生长和进程的重要因素[19]. GKLF的细胞核定位与乳腺癌早期侵袭性有关[20]. GKLF在子宫内膜癌中表达下调, 子宫内膜癌的病理分期愈晚, 其GKLF表达强度愈低; 随着病理分级的增高, GKLF的表达强度逐渐下降, GKLF的表达与子宫内膜癌的侵袭转移和预后有关[21]. GKLF在肝癌中的表达程度与其病理分级亦呈负相关[14].
肿瘤组织中GKLF表达下调的具体机制尚不清楚. 有研究发现手术切除的结肠直肠癌标本和结肠直肠癌细胞株中, 部分标本GKLF的开放读码框有点突变及5'非翻译区甲基化导致GKLF的表达下降[22]. 也有学者认为GKLF基因的甲基化并非引起GKLF下调的原因, 同源异型盒转录因子2(caudal type homeo box transcription factor 2, CDX2)的异常表达和腺瘤样结肠息肉易感基因(adenomatous polyposis coli, APC)可能参与GKLF的下调[23], APC诱导GKLF的表达, 这种诱导依赖于有功能的CDX2对GKLF启动子激活的能力, 而以前的研究已证实CDX2是受APC激活的. 因此, 推测这3个蛋白可能构成一个肠细胞特异的肿瘤抑制通路的一部分: APC→CDX2→GKLF→抑制DNA合成→细胞周期阻滞→生长抑制. GKLF通过激活或抑制其下游目的基因的转录表达, 参与细胞增殖、分化及生长周期的调控[24-27], 该调控作用与肿瘤的发生和进展关系密切.
我们的前期实验研究显示: 胃癌组织和胃癌细胞株中存在GKLF基因的表达显著下调[28,29]. 在此基础上, 我们采用阳离子脂质体LipofectamineTM2000将外源性重组真核质粒pcDNA3.1-GKLF转染到人胃癌细胞株SGC-7901内, 并建立了稳定转染的细胞株. 结果显示: 转染GKLF基因可延缓裸鼠皮下移植瘤的形成时间、降低移植瘤生长速度和规模、降低肿瘤的恶性度. 通过进一步检测皮下移植瘤组织中GKLF、Ki-67蛋白表达水平发现: 转染GKLF基因使Ki-67的表达下调. 而Ki-67抗原是存在于增殖细胞核的一种非组蛋白性核蛋白, 是与细胞增殖相关的核抗原[30]. 由此我们推测Ki-67可能是GKLF基因的下游基因, GKLF基因可能通过下调Ki-67的表达来抑制肿瘤生长. 但GKLF基因具体作用的分子生物学机制及信号传导途径尚有待深入研究. GKLF可以作为胃癌基因治疗的一种新靶向基因, 在将来的临床应用中发挥一定作用.
转录因子是一类具有重要功能的序列特异性DNA结合蛋白, 他们通过激活或抑制其目标基因的转录来调控基因的时相性及细胞和组织的特异性表达, 而在细胞生长、分化、凋亡等生理过程的调节中担任重要角色.
郑鹏远, 教授, 郑州大学第二附属医院消化科
胃肠富集Krüppel样因子(GKLF)是Krüppel样转录因子家族的成员, GKLF与肿瘤间的关系是近年来研究的热点. 应用基因方法或以基因作为靶点来防治胃癌亦成为众多研究者关注的热点.
国内外研究表明, 结直肠癌、肝癌、膀胱癌中GKLF的表达明显下调, GKLF蛋白的表达程度与肿瘤病理分级呈负相关.
目前有关GKLF基因与胃癌间的研究报道少见, 国内研究多局限于其与临床病理间的关系. 本实验将重组质粒pcDNA3.1-GKLF转染到人胃癌细胞株SGC-7901中, 并建立了高表达GKLF的稳定转染细胞株, 同时观察GKLF基因转染对人胃癌裸鼠皮下移植瘤生长、转移的影响, 国内未见报道.
GKLF基因可能通过下调Ki-67的表达而抑制胃癌SGC-7901细胞裸鼠皮下移植瘤的生长, 以GKLF为靶点的基因治疗有潜在临床应用前景.
本文设计合理, 为胃癌的基因治疗提供新思路, 具有潜在的临床应用前景.
编辑: 李薇 电编:李薇
| 1. | Wang L, Wei D, Huang S, Peng Z, Le X, Wu TT, Yao J, Ajani J, Xie K. Transcription factor Sp1 expression is a significant predictor of survival in human gastric cancer. Clin Cancer Res. 2003;9:6371-6380. [PubMed] |
| 2. | 郑 金锋, 曹 永成, 耿 明, 刘 莹. 钙粘素、Ki67和p16在人脑胶质瘤中的表达及意义. 中国临床神经外科杂志. 2006;11:473-475. |
| 3. | Carneiro F, Oliveira C, Leite M, Seruca R. Molecular targets and biological modifiers in gastric cancer. Semin Diagn Pathol. 2008;25:274-287. [PubMed] [DOI] |
| 4. | van Vliet J, Crofts LA, Quinlan KG, Czolij R, Perkins AC, Crossley M. Human KLF17 is a new member of the Sp/KLF family of transcription factors. Genomics. 2006;87:474-482. [PubMed] [DOI] |
| 5. | Yet SF, McA'Nulty MM, Folta SC, Yen HW, Yoshizumi M, Hsieh CM, Layne MD, Chin MT, Wang H, Perrella MA. Human EZF, a Krüppel-like zinc finger protein, is expressed in vascular endothelial cells and contains transcriptional activation and repression domains. J Biol Chem. 1998;273:1026-1031. [PubMed] [DOI] |
| 6. | Jenkins TD, Opitz OG, Okano J, Rustgi AK. Transactivation of the human keratin 4 and Epstein-Barr virus ED-L2 promoters by gut-enriched Krüppel-like factor. J Biol Chem. 1998;273:10747-10754. [PubMed] [DOI] |
| 7. | Shie JL, Chen ZY, O'Brien MJ, Pestell RG, Lee ME, Tseng CC. Role of gut-enriched Krüppel-like factor in colonic cell growth and differentiation. Am J Physiol Gastrointest Liver Physiol. 2000;279:G806-G814. [PubMed] |
| 8. | Shields JM, Christy RJ, Yang VW. Identification and characterization of a gene encoding a gut-enriched Krüppel-like factor expressed during growth arrest. J Biol Chem. 1996;271:20009-20017. [PubMed] [DOI] |
| 9. | Song A, Patel A, Thamatrakoln K, Liu C, Feng D, Clayberger C, Krensky AM. Functional domains and DNA-binding sequences of RFLAT-1/KLF13, a Krüppel-like transcription factor of activated T lymphocytes. J Biol Chem. 2002;277:30055-30065. [PubMed] [DOI] |
| 10. | Garrett-Sinha LA, Eberspaecher H, Seldin MF, de Crombrugghe B. A gene for a novel zinc-finger protein expressed in differentiated epithelial cells and transiently in certain mesenchymal cells. J Biol Chem. 1996;271:31384-31390. [PubMed] [DOI] |
| 11. | Wei D, Gong W, Kanai M, Schlunk C, Wang L, Yao JC, Wu TT, Huang S, Xie K. Drastic down-regulation of Krüppel-like factor 4 expression is critical in human gastric cancer development and progression. Cancer Res. 2005;65:2746-2754. [PubMed] [DOI] |
| 12. | Luo A, Kong J, Hu G, Liew CC, Xiong M, Wang X, Ji J, Wang T, Zhi H, Wu M. Discovery of Ca2+-relevant and differentiation-associated genes downregulated in esophageal squamous cell carcinoma using cDNA microarray. Oncogene. 2004;23:1291-1299. [PubMed] [DOI] |
| 13. | Xu J, Lü B, Xu F, Gu H, Fang Y, Huang Q, Lai M. Dynamic down-regulation of Krüppel-like factor 4 in colorectal adenoma-carcinoma sequence. J Cancer Res Clin Oncol. 2008;134:891-898. [PubMed] [DOI] |
| 15. | Ohnishi S, Ohnami S, Laub F, Aoki K, Suzuki K, Kanai Y, Haga K, Asaka M, Ramirez F, Yoshida T. Downregulation and growth inhibitory effect of epithelial-type Krüppel-like transcription factor KLF4, but not KLF5, in bladder cancer. Biochem Biophys Res Commun. 2003;308:251-256. [PubMed] [DOI] |
| 16. | Bianchi F, Hu J, Pelosi G, Cirincione R, Ferguson M, Ratcliffe C, Di Fiore PP, Gatter K, Pezzella F, Pastorino U. Lung cancers detected by screening with spiral computed tomography have a malignant phenotype when analyzed by cDNA microarray. Clin Cancer Res. 2004;10:6023-6028. [PubMed] [DOI] |
| 17. | Huang CC, Liu Z, Li X, Bailey SK, Nail CD, Foster KW, Frost AR, Ruppert JM, Lobo-Ruppert SM. KLF4 and PCNA identify stages of tumor initiation in a conditional model of cutaneous squamous epithelial neoplasia. Cancer Biol Ther. 2005;4:1401-1408. [PubMed] [DOI] |
| 18. | Foster KW, Frost AR, McKie-Bell P, Lin CY, Engler JA, Grizzle WE, Ruppert JM. Increase of GKLF messenger RNA and protein expression during progression of breast cancer. Cancer Res. 2000;60:6488-6495. [PubMed] |
| 19. | Zhang L, Wali A, Ramana CV, Rishi AK. Cell growth inhibition by okadaic acid involves gut-enriched Kruppel-like factor mediated enhanced expression of c-Myc. Cancer Res. 2007;67:10198-10206. [PubMed] [DOI] |
| 20. | Pandya AY, Talley LI, Frost AR, Fitzgerald TJ, Trivedi V, Chakravarthy M, Chhieng DC, Grizzle WE, Engler JA, Krontiras H. Nuclear localization of KLF4 is associated with an aggressive phenotype in early-stage breast cancer. Clin Cancer Res. 2004;10:2709-2719. [PubMed] [DOI] |
| 22. | Zhao W, Hisamuddin IM, Nandan MO, Babbin BA, Lamb NE, Yang VW. Identification of Krüppel-like factor 4 as a potential tumor suppressor gene in colorectal cancer. Oncogene. 2004;23:395-402. [PubMed] [DOI] |
| 23. | Ghaleb AM, McConnell BB, Nandan MO, Katz JP, Kaestner KH, Yang VW. Haploinsufficiency of Krüppel-like factor 4 promotes adenomatous polyposis coli dependent intestinal tumorigenesis. Cancer Res. 2007;67:7147-7154. [PubMed] [DOI] |
| 24. | Shie JL, Chen ZY, Fu M, Pestell RG, Tseng CC. Gut-enriched Krüppel-like factor represses cyclin D1 promoter activity through Sp1 motif. Nucleic Acids Res. 2000;28:2969-2976. [PubMed] [DOI] |
| 25. | Brembeck FH, Rustgi AK. The tissue-dependent keratin 19 gene transcription is regulated by GKLF/KLF4 and Sp1. J Biol Chem. 2000;275:28230-28239. [PubMed] |
| 26. | Feinberg MW, Wara AK, Cao Z, Lebedeva MA, Rosenbauer F, Iwasaki H, Hirai H, Katz JP, Haspel RL, Gray S. The Kruppel-like factor KLF4 is a critical regulator of monocyte differentiation. EMBO J. 2007;26:4138-4148. [PubMed] [DOI] |
| 27. | Rowland BD, Bernards R, Peeper DS. The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene. Nat Cell Biol. 2005;7:1074-1082. [PubMed] [DOI] |
| 30. | Okimura A, Hirano H, Nishigami T, Ueyama S, Tachibana S, Fukuda Y, Yamanegi K, Ohyama H, Terada N, Nakasho K. Immunohistochemical analyses of E-cadherin, beta-catenin, CD44s, and CD44v6 expressions, and Ki-67 labeling index in intraductal papillary mucinous neoplasms of the pancreas and associated invasive carcinomas. Med Mol Morphol. 2009;42:222-229. [PubMed] [DOI] |