修回日期: 2010-12-04
接受日期: 2010-12-07
在线出版日期: 2011-01-08
准确的胃癌术前分期是胃癌综合治疗方案实施的需要. 早期胃癌, 特别是黏膜内癌, 可以行内镜下切除以避免不必要的外科手术; 为了获得局部进展期胃癌R0切除, 新辅助治疗备受关注并已展开探索. 随着内镜超声检查(endoscopic ultrasonography, EUS)、经腹超声检查(transabdominal ultrasonography, TAUS)、多层螺旋CT(multi-slice spiral CT, MSCT)、磁共振成像(magnetic resonance imaging, MRI)、正电子发射型断层成像(positron emission tomography, PET)、PET-CT和腹腔镜探查分期等影像学技术的发展, 胃癌临床分期的准确率已得到明显改善. 本文旨在对胃癌术前分期的研究现状作一综述.
引文著录: 仲海, 严超, 燕敏, 朱正纲. 胃癌术前分期的研究现状. 世界华人消化杂志 2011; 19(1): 48-56
Revised: December 4, 2010
Accepted: December 7, 2010
Published online: January 8, 2011
A more differentiated therapy regimen for gastric carcinoma requires more precise preoperative staging. In patients with early gastric cancer (EGC), especially in cases with carcinoma confined to mucosa, endoscopic resection (ER) is usually performed to avoid unnecessary surgical procedures. To achieve R0 resection for locally advanced gastric cancer (AGC), neoadjuvant treatments have been investigated. Clinical staging of gastric cancer has been greatly improved by advances in imaging techniques, such as endoscopic ultrasonography (EUS), transabdominal ultrasonography (TAUS), multi-slice spiral CT (MSCT), magnetic resonance imaging (MRI), positron emission tomography (PET), combined PET-CT scans, and laparoscopic staging. This paper aims to summarize the recent advances in preoperative staging of gastric cancer.
- Citation: Zhong H, Yan C, Yan M, Zhu ZG. Recent advances in preoperative staging of gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 48-56
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/48.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.48
准确的胃癌术前分期对选择合理的治疗方案、评价预后等具有重要的指导意义, 特别是随着经内镜、腹腔镜治疗及术前辅助化疗等新技术的开展, 准确的术前分期显得尤为重要. 传统的胃癌术前检查方法包括胃镜、X线对比检查等, 但其在术前分期方面存在明显的局限性, 而随着内镜超声检查(endoscopic ultrasonography, EUS)、经腹超声检查(transabdominal ultrasonography, TAUS)、多层螺旋CT(multi-slice spiral CT, MSCT)、磁共振成像(magnetic resonance imaging, MRI)、正电子发射型断层成像(positron emission tomography, PET)、PET-CT、腹腔镜和腹腔镜超声检查(laparoscopic ultrasonography, LUS)等影像学技术的发展及其检查方法的改进, 胃癌术前分期的准确率得到明显提高, 从而基本满足了胃癌综合治疗方案实施的需要. 本文将就胃癌术前分期的临床意义及各种检查方法的临床应用价值作一阐述.
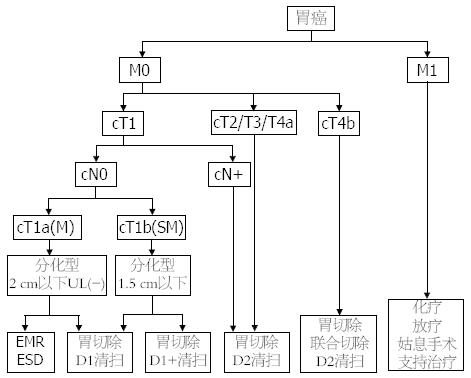
胃癌术前分期是实施胃癌综合治疗方案的需要, 在胃癌术前评估的基础上, 不同分期可选择相应的治疗方案. 日本《胃癌治疗指南》(第3版)[1]中根据胃癌的临床分期确定如下治疗方案: 部分胃黏膜癌因其淋巴结转移率极低可行局限性切除术, 如内镜下黏膜切除术(endoscopic mucosal resection, EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)等; 部分胃黏膜癌和黏膜下癌可行D1或D1+淋巴结清扫; 对于进展期胃癌或术前判断为有淋巴结转移的早期胃癌均需行D2淋巴结清扫; 对于临床分期为M1期(有远处转移)的胃癌仅行姑息性治疗(图1). 此外, 部分局部进展期胃癌, 单纯手术往往难以达到根治的目的, 常存在肉眼或镜下残留灶, 所以多为姑息性切除且不能明显改善预后, 对于这部分病例有必要行新辅助化疗等术前治疗, 待肿瘤体积或转移灶得以适当控制后再考虑手术[2,3]. 新近一项由英国医学研究委员会主持的术前化疗Ⅲ期临床研究(MAGIC研究)表明, 以ECF(表柔比星、顺铂和5-FU)方案进行围手术期化疗可以显著改善可切除胃癌的无进展生存和总生存, 从而奠定了围手术期化疗在可切除胃癌患者中的标准治疗地位[4]. 2010年《NCCN胃癌临床实践指南(中国版)》中确定, 对于术前判断为进展期或伴有淋巴结转移(无远处转移)的可切除胃癌患者, 除行手术治疗外, 可考虑选择术前化疗或放化疗后再手术. 对于无远处转移、肿瘤无法切除的局部晚期胃癌可选择45.0-50.4 Gy放疗+同时予以氟尿嘧啶类(5-FU、卡培他滨)为基础的放疗增敏剂或化疗, 治疗后重新分期, 如达到完全缓解或明显缓解, 适当时可行手术治疗. 从上述两个胃癌治疗指南不难看出, 准确的术前分期对选择合理的治疗方案至关重要, 研究精准、合理的胃癌术前分期方案将是目前胃癌研究领域的一个热点.
需要指出的是, 国际抗癌联盟(Union for International Cancer Control, UICC)/美国癌症联合委员会(American Joint Committee on Cancer, AJCC)新近发布了第7版胃癌TNM分期系统, 并正式应用于临床实践; 2010-03的新版日本《胃癌处理规约》(第14版)[5]在胃癌N分期上放弃了第13版中按解剖学的群(站)分类法, 采用了UICC/AJCC的新版分期法, 从而在世界范围内首次实现了胃癌分期系统的统一, 为横向评价胃癌疗效提供了权威的标准, 对促进胃癌的临床研究具有不可估量的作用. 上述两个胃癌治疗指南中应用的即为新版胃癌TNM分期法. 但目前尚无基于胃癌新版分期系统的术前分期研究报道, 既往研究采用的多为UICC第4、5或6版TNM分期系统, 故下述胃癌术前分期方法中提及的分期准确率均基于旧版分期系统.
EUS具备内镜和超声的双重功能, 一般正常胃壁在EUS图像上呈5层结构, 由内至外依次为: 高回声层(相应于黏膜界面层)、低回声层(相应于黏膜固有层)、高回声层(相应于黏膜下层)、低回声层(相应于固有肌层)、高回声层(相应于浆膜层和浆膜下层), EUS可根据最深破坏层次判断胃癌浸润深度; 同时EUS可以通过淋巴结的形状、回声密度等判断其有无转移, 文献报道EUS对胃癌术前T、N分期的准确率可分别达70%-88%和65%-77%[6-8], 并且其为目前唯一能比较准确鉴别黏膜和黏膜下癌的检查方法. 我们研究显示EUS对胃癌T分期的判断准确率为80.3%, 其鉴别胃黏膜和黏膜下癌的准确率为63.6%, 并且EUS对临床病理特征符合EMR等微创手术指征的早期胃癌(隆起型、平坦型或不伴溃疡或溃疡疤痕的凹陷型; 组织学分化型; 直径<2 cm)浸润深度的判断准确率较高[9]; EUS对胃癌N分期的判断准确率为65.1%, 其中N0 89.4%, N1 64.3%, N2 29.0%[10].
但EUS对T4期胃癌的判断准确率相对较低, 主要由于EUS受到探头主体扫描范围的限制, 有时对较大的T4期肿瘤外边界显示欠清, 并无法明确胃周脏器的具体浸润情况. 新近, EUS对早期胃癌浸润深度判断的临床应用价值亦受到质疑, 比较研究显示EUS对胃黏膜癌和黏膜下癌的鉴别准确率与单纯运用胃镜相比并无优势(67.4%-78.9% vs 73.7%-81.4%)[11,12]. 同时, EUS对胃癌转移淋巴结的检出率仍受其部位和大小的影响, 多数腹腔动脉周围的转移淋巴结离超声探头较远而难以被EUS检出. 此外, EUS受到超声束穿透距离的限制(7.5 MHz, 最大穿透距离为5-7 cm), 一般肝右叶大部, 腹腔内肠系膜上血管以下的后腹膜和肠系膜淋巴结等均不能被EUS探及, 所以EUS对于胃癌N和M分期存在一定的局限性, 特别是对M分期不能提供结论性诊断. 所以, 单独运用EUS不能满足实施胃癌综合治疗方案的需要, 有必要联合螺旋CT和腹腔镜等检查以进一步提高胃癌术前分期的准确率. 2010年《NCCN胃癌临床实践指南》[13]中仅将EUS列为术前可选择检查项目.
TAUS操作简便、经济且无创, 近年来, 随着其仪器性能和检查方法的改进, 对胃癌术前分期的判断准确率亦有所提高. 经腹超声检查时正常胃壁亦可呈5层结构, 尽管其总体清晰度可能不及EUS, 但仍是其准确判断胃癌T分期的基础, 有研究显示其对胃癌术前T分期的判断准确率亦达78.6%-81.0%[14-16], 而肿瘤与胰腺间"滑动征"阴性有助于判断胃癌胰腺浸润[17]. 同时, 其对胃癌腹腔动脉周围淋巴结转移的敏感度和对该区域转移淋巴结的检出率分别达74%和73.9%[18]. 此外, TAUS还有助于胃癌远处转移病灶的检出, 特别是肝脏转移. 有研究显示胃癌病灶的彩色多普勒血管指数(color doppler vascularity index, CDVI)与胃癌微血管密度(microvessel density, MVD)呈线性相关, 并且是胃癌患者的独立预后因素[19].
但是, 由于受肋骨和胃底气体的干扰, 超声对胃底肿瘤的探测常不够理想, 并且, 胃体上部和胃底部癌由于其和胰尾在腹腔内特定的解剖位置关系, 滑动征的运用受到明显限制, 我们研究显示TAUS对胃癌术前T分期的准确率仅56%, 对胃癌N分期的判断准确率为57.1%, 其中N0 100%、N1 16.7%、N2 35.3%. 并且TAUS对胃癌综合TNM分期判断的临床应用价值相对有限. 所以, 尽管TAUS对胃癌术前T、N和M分期均具一定的临床实用价值, 并且其通过彩色多普勒超声检测的胃癌CDVI能较好的反映肿瘤血管生成的情况, 2010年《NCCN胃癌临床实践指南》中并未将其列入术前检查项目. 但是, 根据我国国情, 我们认为TAUS可作为胃癌患者术前的一项常规检查, 特别是在经济欠发达地区[20].
长期以来, CT一直作为胃癌患者检出远处转移的主要检查方法. 随着CT扫描技术的改进, 特别是MSCT的临床应用, 由于其扫描速度快, 能完成对靶器官的多期扫描, 同时可对容积扫描数据进行多层面重建(multiplanar reconstruction, MPR), 甚至可实现CT仿真胃镜(CT virtual gastroscopy, CTVG), 使得CT对胃癌原发灶的检出率和TNM分期的准确率均得到明显提高. 在MSCT图像上, 正常胃壁厚度一般在5 mm以下, 在CT增强扫描图像上可呈1-3层结构. 其3层结构对应关系为: (1)明显增强的内层(相应于黏膜层和黏膜肌层); (2)中间低密度层(相应于黏膜下层, 包含脂肪和结缔组织); (3)外层轻微增强(相应于固有肌层和浆膜层). 胃癌则表现为胃壁增厚和(或)胃壁异常增强, MSCT判断其浸润深度的标准见表1. 早年(1997-2001年)的文献报道显示, 动态或螺旋CT对胃癌T分期的判断准确率可达60.6%-87%, 其中T1 40%-100%, T2 35.9%-88%, T3 50%-100%, T4 33.3%-100%[21,22]; 综合各组的数据显示, CT对胃癌T分期的准确率为75.7%(376/497), 其中T1 84.4%(130/154), T2 65.9%(110/167), T3 76.3%(87/114), T4 79%(49/62). 近年(2004-2007年)的文献报道显示, MSCT对胃癌T分期的判断准确率达77.9%(380/488), 其中T1 72.7%(129/179), T2 83.5%(81/97), T3 82.4%(103/125), T4 76.5%(13/17); MSCT对胃癌淋巴结转移判断的敏感度、特异度和准确率分别为84.6%(132/156)、73.9%(119/161)和79.2%(251/317)[23].
| 分期 | MSCT诊断标准 | |
| 正常胃壁呈单层结构 | 正常胃壁呈多层结构 | |
| T1 | 非透壁性明显增强并伴胃壁局灶性增厚, 或仅明显 增强而无胃壁增厚, 或未检出病灶 | 胃壁增厚且明显增强, 但不伴中、外层的突然消失, 或未 检出病灶 |
| T2 | 胃壁透壁性增强并伴局灶性增厚, 并且其外边界光整 和(或)病灶周围脂肪层清晰 | 胃壁异常增强并伴中、外层的突然消失, 并且其外边界 光整和(或)病灶周围脂肪层清晰 |
| T3 | 增厚胃壁外边界不规则或呈条索状高密度影, 和(或) 病灶周围脂肪层模糊 | 增厚胃壁外边界不规则或呈条索状高密度影, 和(或)病灶 周围脂肪层模糊 |
| T4 | 胃癌与邻近脏器间的脂肪层消失, 同时伴有邻近脏器 内CT值的改变 | 胃癌与邻近脏器间的脂肪层消失, 同时伴有邻近脏器内 CT值的改变 |
我们的一项大宗病例研究显示, MSCT对胃癌术前T分期的总体判断准确率较高(73.8%), 特别是对T3和T4期胃癌的判断准确率分别达86.5%和85.8%[23]. 同时, 尽管MSCT对早期胃癌的检出率偏低, 但被MSCT检出的早期胃癌由于其淋巴结转移率高、肿瘤较大以及黏膜下癌比例高, 不宜行EMR或ESD等治疗[23]. 值得指出的是, 三期扫描对胃癌浸润深度的判断具有较大的价值, 因为部分胃癌具有从黏膜层到浆膜层渐进性强化的特点, Takao等[24]的研究亦显示有28%的进展期胃癌从动脉期到平衡期呈渐进性强化, 而此类胃癌多半为硬癌. MSCT对胃癌N分期的判断准确率为75.2%, 其中N0 76.2%, N1 68.8%, N2 80.6%[23].
早期的比较研究显示CT对胃癌术前T、N分期的准确率仅分别为42%-43%和49%-51%, 而EUS则分别达71%-86%和65%-74%[25,26], 因此EUS被认为是胃癌术前分期的首选方法. 但近期的比较研究亦显示MSCT对胃癌术前T、N分期的准确率(76%-83.3%, 62.8%-75%)与EUS(74.7%-87.5%, 66%-90%)无明显差别[27-29]. 我们的一项比较研究显示, MSCT较之EUS在N分期上有一定的优势, 且对胃周脏器浸润的判断准确率较高, 并鉴于MSCT目前为诊断胃癌远处转移的主要常用检查方法, 所以其作为一项"全合一"检查, 可以代替EUS成为胃癌术前分期的首选方法[30-32]. 2010年《NCCN胃癌临床实践指南》中已将腹部CT列为术前必须检查项目, 并将EUS列为可选择检查项目.
此外, CTVG对提高早期胃癌的检出率和进展期胃癌大体分型的鉴别准确率有一定的价值[33]. 术前通过MSCT行3D-CTA明确胃周血管的解剖关系有助于腹腔镜胃癌手术的实施[34,35]. MSCT图像上胃癌强化程度和瘤周低密度带厚度有助于对胃癌组织学类型的判断, 且瘤周低密度带厚度还有助于对淋巴结转移的判断[36]. MSCT灌注成像技术可获得反映胃癌血管通透性的量化值(表面通透性值), 并有助于对胃癌TNM分期和组织学类型等的预测[37,38]. 胃肝样腺癌、EB病毒相关性胃癌及胃黏液腺癌等均有其相对特异的MSCT征象[39-41]. 通过MSCT检测的胃癌患者腹部形态有助于判断其术后短期结局[42]; 并且对于可切除性胃癌, MSCT评估的临床分期有助于对其预后的判断[43]. 另外, CT是目前评估胃癌化疗等治疗方法疗效和随访的最为常用的影像学方法, 新近有研究利用MSCT后处理工作站提供的容积测量工具得到胃原发灶的体积数据, 通过计算得到体积退缩率, 发现其与胃癌新辅动化疗后病理缓解分级的相关性优于淋巴结及癌肿厚度退缩率, 甚至优于PET-CT检测的标准摄取值(standard uptake value, SUV)[44]. 所以, 随着影像技术的进展, CT对于胃癌患者已突破单一的"诊断+分期"模式, 逐步形成涵盖精确分期、疗效评价、预后评估和术后并发症检测及随访为一体的影像学评价体系[45].
尽管CT对胃癌术前TNM分期的判断准确率已得到明显提高, 且对术前T分期的研究结果已趋一致, 新近研究显示采用血管探针重建技术可进一步将T分期的准确率提高至94%[46]; 但对于胃癌术前N分期还存在较多的分歧和不足. 我们前期研究和文献报道均显示, MSCT对N分期的预测如采用新版分期系统(淋巴结转移数目)及现有以淋巴结大小为主的鉴别淋巴结转移与否的诊断标准将产生不足分期的趋势[43,47,48]. 目前亟待进一步建立和优化鉴别淋巴结转移与否的综合诊断标准以提高胃癌术前N分期的诊断准确率, 以满足新版分期在临床实践中的需求. 有报道显示胃癌患者最大转移淋巴结直径与其淋巴结转移数目呈线性相关[49], 我们研究显示MSCT检出的最大淋巴结的直径对胃癌淋巴结转移数目和N分期术前预测有一定的价值, 其准确率与采用检出转移淋巴结计数的方法基本一致, 并可避免不足分期的趋势, 有望作为该传统方法的有益补充[47]. 此外, 尽管MSCT对胃癌远处转移已具较高的诊断准确率, 但其对胃癌腹膜转移的敏感度仍较低, 仅为51%, 所以必须联合腹腔镜检查以提高对胃癌腹膜转移判断的准确率[50]. 2010年《NCCN胃癌临床实践指南》中推荐对每位MSCT等检查未检出远处转移的胃癌患者进行腹腔镜探查分期, 但这将导致许多患者接受无谓的腹腔镜检查以及医疗费用的增加, 所以目前亟待建立适应我国国情的胃癌患者行腹腔镜探查分期的指征.
目前由于快速MRI技术的发展, 不仅提高了图像清晰度, 而且由于成像速度快, 可进行动态增强扫描, 从而为胃癌术前分期提供了与CT相当的图像质量. MRI在扰相位梯度回波成像时, 胃壁及胃周脂肪间由于化学位移和相位抹消伪影产生一低信号带, 该低信号带对胃癌浆膜层浸润的判断具有较大的价值. 文献报道MRI对胃癌T分期的判断准确率可达73.3%-88%, 其中T1 75%-100%, T2 63%-80%, T3 78.6%-96%, T4 40%-100%[22]. 综合各组的数据显示, MRI对胃癌T分期的准确率为82.7%(182/220), 其中T1 84.6%(11/13), T2 72.4%(42/58), T3 89.5%(102/114), T4 77.1%(27/35). 并且其对淋巴结和肝脏转移的判断准确率亦较高.
Kim等[51]研究显示, MRI对胃癌术前T分期的判断准确率显著高于螺旋CT(81% vs 73%); Sohn等[52]研究亦显示, MRI胃癌T分期的判断准确率稍优于螺旋CT(73.3% vs 66.7%); 新近的一项比较研究显示MRI与MSCT对胃癌术前T分期的准确率基本一致(74.4% vs 76.7%)[53]. 两项比较研究显示, MRI对胃癌术前N分期的判断准确率稍低于螺旋CT(55%-65% vs 58.6%-73.0%), 但无统计学差异[51,52]. 我们研究显示MRI和MSCT对胃癌术前T分期的判断准确率基本相当, 但MRI对于胃癌术前N分期的判断准确率和对淋巴结转移的敏感度低于MSCT, 所以MRI目前尚不能完全取代MSCT在胃癌术前分期中的应用[54]. 2010年《NCCN胃癌临床实践指南》中未将MRI列入术前检查项目.
目前普遍认为, 在非侵袭性影像学检查中, EUS、TAUS、MSCT和MRI等检查方法对腹膜转移的敏感度均较低, 而通过腹腔镜对腹腔的直视检查则可鉴别其他影像学方法难检出的较小的网膜及腹膜种植灶, 有望填补这一诊断间隙, 腹腔镜超声则为了传统腹腔镜检查提供了类似于EUS的图像质量.
腹腔镜检查对胃癌可切除性判断的准确率达91.6%-96%, 对腹膜转移的敏感度为69%-96%, 对肝脏转移的敏感度为60%-96%. Stell等[55]研究发现腹腔镜、B超和CT对肝脏转移判断的准确率分别为99%、76%和79%, 对腹膜转移的判断准确率分别为94%、84%和81%, 腹腔镜检查明显优于B超和CT. Lowy等[56]认为虽然新型CT对胃癌肝转移的敏感度高, 假阴性率仅4%, 不失为一种有效的分期方法, 但对缺乏腹水的腹膜转移则敏感度较差, 假阴性率达25%, 而腹腔镜检查成功地检出了其中94%的病例. 近年Muntean等[57]研究显示, 诊断性腹腔镜检查对胃癌远处转移的敏感度、特异度和准确率分别为89%、100%和95.5%, 成功避免了37.8%患者行不必要的剖腹探查术, 研究者据此认为行新辅助化疗等术前治疗的患者应常规接受诊断性腹腔镜检查.
LUS则综合了腹腔镜和内镜超声检查的优点, 其对肿瘤的T分期接近于EUS, 准确率达92%, 并可检出直径仅3 mm的转移淋巴结, 能对所有16组淋巴结作出比较准确的评估, 其准确率达89%. LUS可检出腹腔镜检查漏诊的肝脏转移灶, 其对肿瘤的M分期准确率达92%. 此外, LUS对肿瘤可切除性的评估准确率达96%, 有报道联合EUS和LUS对不可切除病例的检出率达100%. 但是, LUS对胃癌临床分期评估的运用在世界范围内并未普及, 近年已少有文献报道.
与此同时, 就存在诊断性腹腔镜检查的指征问题, 2010年《NCCN胃癌临床实践指南》中推荐对每位MSCT等检查未检出远处转移的胃癌患者进行腹腔镜探查分期. 既往有研究对CT检查排除明显远处转移的病例即行腹腔镜检查, 结果虽然提高了手术切除率, 但2/3以上的病例接受了无谓的腹腔镜检查. Lehnert等[58]在对120例胃癌患者的前瞻性研究中, 仅对临床分期(CT、MRI和EUS等)可疑T4期和可疑存在腹膜和肝脏转移的病例行腹腔镜检查, 结果既提高了手术切除率, 又避免了无谓的腹腔镜探查. Feussner等[59]对111例CT和EUS判断为T3或T4期并排除了有明显远处转移的胃癌患者行术前诊断性腹腔镜及LUS, 结果修改了46%胃癌患者的术前分期, 改变了40.5%患者的治疗方案, 避免了不必要的术前化疗和剖腹探查术. 该研究认为腹腔镜和LUS所增加的医疗费用完全可为避免不必要的手术、降低并发症等所减少的费用抵偿. 近年Song等[60]对符合上述条件的胃癌患者行诊断性腹腔镜检查, 亦取得了较好的临床效果. 由于诊断性腹腔镜检查主要用于检出腹膜转移, Hur等[61]研究显示, 如仅对临床分期为T3或T4期、无明显腹膜转移、大体分型为Borrmann Ⅲ或Ⅳ型、肿瘤直径>4 cm的胃癌患者行诊断性腹腔镜检查, 可以在Feussner等[59]标准的基础上进一步降低腹腔镜探查率及提高结果阳性率. 我们近期的一项大宗病例研究显示, 对MSCT判断为T0-2NxM0或TxN0M0期, 或肿瘤较小的胃癌病例由于其腹膜转移的发生概率较小而无需行腹腔镜探查[50].
PET针对肿瘤特殊的生物学特点, 通过选择不同的显像剂, 从分子水平显示肿瘤细胞的特征, 为临床提供肿瘤特征化和诊治相关的信息, 最常用的显像剂是18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose, 18F-FDG). PET可以同时对胃癌原发病灶、淋巴结转移、远处组织和器官转移作出判断, 对肿瘤的分期和治疗计划的制定有着重要的参考作用. PET较高的敏感度和特异度并不依赖于肿瘤的形态学改变, 他根据细胞的生理、生化功能的改变, 从18F-FDG摄取的角度发现恶变细胞, 并准确地作出定位和定性诊断.
国内一项研究显示PET对胃癌判断的敏感度和特异度分别为92%和71%, 对淋巴结转移的敏感度达80%, 对远处转移的敏感度为7/8[62]. 国外多项研究显示PET对胃癌诊断的敏感度和特异度分别为58%-94%和78%-100%[63]. PET对胃黏液腺癌、印戒细胞癌、低分化腺癌以及弥漫型胃癌(Lauren分型)的检出率较之管状腺癌、中分化腺癌及肠型胃癌为低[63]. 各项结果间的差异与各组病例间上述病理类型所占的比例存在一定的相关性. PET对区域转移淋巴结的显示不佳, 无法将其与原发灶清楚鉴别开[64]. PET对胃癌各站转移淋巴结的检出敏感度均较低, 特别是对N1站, 显著低于CT(17.6%-46.4% vs 58%-89.3%)[63]. PET对胃癌腹膜转移的敏感度和特异度分别为9%-50%和63%-99%[63]. PET对胃癌肝脏转移判断的敏感度和特异度分别为85%和74%, 对肺转移的判断分别为67%和88%, 对骨转移的判断则为30%和82%[63]. 此外, 尽管PET-CT较之PET有更多的优势, 其对进展期胃癌的检出率与CT基本一致, 但其对胃癌诊断的敏感度仍受病理类型的影响, 其对区域淋巴结转移检出的敏感度仍显著低于CT(41% vs 75%)[65]. 同时, 近期两项比较研究显示, PET和PET-CT对腹膜转移的诊断敏感度显著低于CT(35.3%-57.1% vs 76.5%-82.1%)[66,67]. 所以, 单用PET或PET-CT对胃癌进行检测和术前分期并不能提供充分的诊断信息.
尽管单用PET或PET-CT对胃癌术前分期的价值并未获得广泛认可, 但其另一项功能却越来越受到关注. PET可作为肿瘤治疗效果检测和评估指标, 18F-FDG摄取率的下降是证明肿瘤对治疗出现反应的客观标准. 在细胞培养和动物试验中证明, 在放、化疗初期, 存活的细胞18F-FDG摄取是增高的, 但临床上的研究却恰恰相反, 18F-FDG的摄取率和肿瘤细胞的减少是平行的. 少数学者甚至认为18F-FDG是唯一可以检测肿瘤放、化疗有效性的方法. 肿瘤糖代谢的降低加速了肿瘤体积的缩小, 尤其是化疗后, 18F-FDG摄取率下降比肿瘤缩小出现更早, 也更敏感. 如治疗后SUV下降程度越高, 说明肿瘤对治疗越敏感, 肿瘤细胞坏死越多, 虽然形态学上没有太大的改变, 但PET却已经能预言患者良好的预后了. Ott等[68,69]的前瞻性研究显示PET可以预测原发灶摄取FDG的胃癌病例对新辅助化疗的疗效及其预后. 通过比较初始治疗前及2 wk后胃癌原发灶SUV的变化准确地反映疗效, 从而在治疗早期使疗效不佳者避免无效治疗, 及时采用二线治疗以改善预后. 但是, 近期两项研究却显示, PET或PET-CT可能又无法准确反应新辅助化疗后的组织病理反应疗效[44,70]. 所以, 有待深入开展多中心大宗病例研究以取得足够的循证医学依据, 以明确PET或PET-CT对胃癌新辅助化疗等术前治疗疗效预测的价值. 2010年《NCCN胃癌临床实践指南》中仅将PET或PET-CT列为术前可选择检查项目.
准确的胃癌术前分期对选择合理的治疗方案、评价预后等具有重要的指导意义. 随着影像学技术的发展, 胃癌术前分期的准确率得到明显提高, 基本满足了胃癌综合治疗方案实施的需要, 但仍有待探讨更精确、合理的术前检查方案, 并最终达到提高胃癌患者预后及生活质量的目的.
胃癌是胃黏膜上皮细胞变异产生的恶性肿瘤, 是我国最常见的恶性肿瘤之一, 发病率居各类肿瘤之首. 虽然胃癌已成为临床高发病例之一, 但其致病机制依然不明.
张小晋, 主任医师, 北京积水潭医院消化内科
真核基因的剪接调节在胃癌的发生及发展过程中起重要作用, 目前已成为基于胃癌发病机制研究的重点和热点.
本文可读性较好, 具有一定的创新性和科学性.
编辑: 曹丽鸥 电编:何基才
| 4. | Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, Scarffe JH, Lofts FJ, Falk SJ, Iveson TJ. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20. [PubMed] [DOI] |
| 6. | Willis S, Truong S, Gribnitz S, Fass J, Schumpelick V. Endoscopic ultrasonography in the preoperative staging of gastric cancer: accuracy and impact on surgical therapy. Surg Endosc. 2000;14:951-954. [PubMed] [DOI] |
| 7. | Wang JY, Hsieh JS, Huang YS, Huang CJ, Hou MF, Huang TJ. Endoscopic ultrasonography for preoperative locoregional staging and assessment of resectability in gastric cancer. Clin Imaging. 1998;22:355-359. [PubMed] [DOI] |
| 8. | Hünerbein M, Handke T, Ulmer C, Schlag PM. Impact of miniprobe ultrasonography on planning of minimally invasive surgery for gastric and colonic tumors. Surg Endosc. 2004;18:601-605. [PubMed] [DOI] |
| 11. | Choi J, Kim SG, Im JP, Kim JS, Jung HC, Song IS. Comparison of endoscopic ultrasonography and conventional endoscopy for prediction of depth of tumor invasion in early gastric cancer. Endoscopy. 2010;42:705-713. [PubMed] [DOI] |
| 12. | Choi J, Kim SG, Im JP, Kim JS, Jung HC, Song IS. Is endoscopic ultrasonography indispensable in patients with early gastric cancer prior to endoscopic resection? Surg Endosc. 2010;24:3177-3185. [PubMed] [DOI] |
| 13. | Ajani JA, Barthel JS, Bekaii-Saab T, Bentrem DJ, D'Amico TA, Das P, Denlinger C, Fuchs CS, Gerdes H, Hayman JA. Gastric cancer. J Natl Compr Canc Netw. 2010;8:378-409. [PubMed] |
| 14. | Venkataraman I, Rao HK, Singh P, Elangovan S, Kate V. Efficacy of hydrogastric sonography and spiral Computed Tomography in staging of gastric carcinoma--a comparative study. J Clin Ultrasound. 2010;38:480-485. [PubMed] [DOI] |
| 15. | Segura JM, Olveira A, Conde P, Erdozain JC, Suárez J. Hydrogastric sonography in the preoperative staging of gastric cancer. J Clin Ultrasound. 1999;27:499-504. [PubMed] [DOI] |
| 17. | Lim HK, Kim S, Lim JH, Kim SH, Lee WJ, Chun H, Cho JW, Kim JJ. Assessment of pancreatic invasion in patients with advanced gastric carcinoma: usefulness of the sliding sign on sonograms. AJR Am J Roentgenol. 1999;172:615-618. [PubMed] |
| 18. | Yoshinaka H, Nishi M, Kajisa T, Kuroshima K, Morifuji H. Ultrasonic detection of lymph node metastases in the region around the celiac axis in esophageal and gastric cancer. J Clin Ultrasound. 1985;13:153-160. [PubMed] [DOI] |
| 19. | Chen CN, Cheng YM, Lin MT, Hsieh FJ, Lee PH, Chang KJ. Association of color Doppler vascularity index and microvessel density with survival in patients with gastric cancer. Ann Surg. 2002;235:512-518. [PubMed] [DOI] |
| 23. | Yan C, Zhu ZG, Yan M, Zhang H, Pan ZL, Chen J, Xiang M, Chen MM, Liu BY, Yin HR. Value of multidetector-row computed tomography in the preoperative T and N staging of gastric carcinoma: a large-scale Chinese study. J Surg Oncol. 2009;100:205-214. [PubMed] [DOI] |
| 24. | Takao M, Fukuda T, Iwanaga S, Hayashi K, Kusano H, Okudaira S. Gastric cancer: evaluation of triphasic spiral CT and radiologic-pathologic correlation. J Comput Assist Tomogr. 1998;22:288-294. [PubMed] [DOI] |
| 25. | Ziegler K, Sanft C, Zimmer T, Zeitz M, Felsenberg D, Stein H, Germer C, Deutschmann C, Riecken EO. Comparison of computed tomography, endosonography, and intraoperative assessment in TN staging of gastric carcinoma. Gut. 1993;34:604-610. [PubMed] |
| 26. | Perng DS, Jan CM, Wang WM, Chen LT, Su YC, Liu GC, Lin HJ, Huang TJ, Chen CY. Computed tomography, endoscopic ultrasonography and intraoperative assessment in TN staging of gastric carcinoma. J Formos Med Assoc. 1996;95:378-385. [PubMed] |
| 27. | Bhandari S, Shim CS, Kim JH, Jung IS, Cho JY, Lee JS, Lee MS, Kim BS. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastrointest Endosc. 2004;59:619-626. [PubMed] [DOI] |
| 28. | Habermann CR, Weiss F, Riecken R, Honarpisheh H, Bohnacker S, Staedtler C, Dieckmann C, Schoder V, Adam G. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology. 2004;230:465-471. [PubMed] [DOI] |
| 29. | Hwang SW, Lee DH, Lee SH, Park YS, Hwang JH, Kim JW, Jung SH, Kim NY, Kim YH, Lee KH. Preoperative staging of gastric cancer by endoscopic ultrasonography and multidetector-row computed tomography. J Gastroenterol Hepatol. 2010;25:512-518. [PubMed] [DOI] |
| 30. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 诸 琦, 陈 军, 刘 炳亚, 尹 浩然, 林 言箴. 内镜超声检查和多层螺旋CT对胃癌淋巴结转移状况的评估价值. 中华外科杂志. 2005;43:174-176. |
| 31. | 朱 正纲, 严 超, 陈 克敏, 诸 琦, 燕 敏, 陈 军, 刘 炳亚, 尹 浩然, 林 言箴. 内镜超声检查与多层螺旋CT对胃癌术前分期的对比研究. 中华胃肠外科杂志. 2002;5:99-103. |
| 32. | 陈 军, 严 超, 朱 正纲, 燕 敏, 陈 克敏, 诸 琦, 刘 炳亚, 尹 浩然, 林 言箴. 内镜超声检查和多层螺旋CT对胃癌术前T、N分期的比较研究. 中国实用外科杂志. 2005;25:278-281. |
| 34. | Matsuki M, Kani H, Tatsugami F, Yoshikawa S, Narabayashi I, Lee SW, Shinohara H, Nomura E, Tanigawa N. Preoperative assessment of vascular anatomy around the stomach by 3D imaging using MDCT before laparoscopy-assisted gastrectomy. AJR Am J Roentgenol. 2004;183:145-151. [PubMed] |
| 35. | Kumano S, Tsuda T, Tanaka H, Hirata M, Kim T, Murakami T, Sugihara E, Abe H, Yamashita H, Kobayashi N. Preoperative evaluation of perigastric vascular anatomy by 3-dimensional computed tomographic angiography using 16-channel multidetector-row computed tomography for laparoscopic gastrectomy in patients with early gastric cancer. J Comput Assist Tomogr. 2007;31:93-97. [PubMed] [DOI] |
| 36. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 项 明, 陈 明敏, 刘 炳亚, 尹 浩然, 林 言箴. 进展期胃癌CT征象与其临床病理特征的关系. 外科理论与实践. 2005;10:413-418. |
| 37. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 刘 炳亚, 尹 浩然, 林 言箴. 多层螺旋CT灌注成像对胃癌血管通透性评估的价值. 现代肿瘤医学. 2007;15:1796-1799. |
| 38. | Zhang H, Pan Z, Du L, Yan C, Ding B, Song Q, Ling H, Chen K. Advanced gastric cancer and perfusion imaging using a multidetector row computed tomography: correlation with prognostic determinants. Korean J Radiol. 2008;9:119-127. [PubMed] [DOI] |
| 39. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 项 明, 陈 明敏, 刘 炳亚, 尹 浩然, 林 言箴. 胃黏液腺癌的临床病理和CT特征. 外科理论与实践. 2007;12:362-366. |
| 40. | Maeda E, Akahane M, Uozaki H, Kato N, Hayashi N, Fukayama M, Ohtomo K. CT appearance of Epstein-Barr virus-associated gastric carcinoma. Abdom Imaging. 2009;34:618-625. [PubMed] [DOI] |
| 41. | Lee MW, Lee JY, Kim YJ, Park EA, Choi JY, Kim SH, Lee JM, Han JK, Choi BI. Gastric hepatoid adenocarcinoma: CT findings. Abdom Imaging. 2007;32:293-298. [PubMed] [DOI] |
| 42. | Lee JH, Paik YH, Lee JS, Ryu KW, Kim CG, Park SR, Kim YW, Kook MC, Nam BH, Bae JM. Abdominal shape of gastric cancer patients influences short-term surgical outcomes. Ann Surg Oncol. 2007;14:1288-1294. [PubMed] [DOI] |
| 43. | Park SR, Kim MJ, Ryu KW, Lee JH, Lee JS, Nam BH, Choi IJ, Kim YW. Prognostic value of preoperative clinical staging assessed by computed tomography in resectable gastric cancer patients: a viewpoint in the era of preoperative treatment. Ann Surg. 2010;251:428-435. [PubMed] [DOI] |
| 44. | Lee SM, Kim SH, Lee JM, Im SA, Bang YJ, Kim WH, Kim MA, Yang HK, Lee HJ, Kang WJ. Usefulness of CT volumetry for primary gastric lesions in predicting pathologic response to neoadjuvant chemotherapy in advanced gastric cancer. Abdom Imaging. 2009;34:430-440. [PubMed] [DOI] |
| 46. | Moschetta M, Stabile Ianora AA, Anglani A, Marzullo A, Scardapane A, Angelelli G. Preoperative T staging of gastric carcinoma obtained by MDCT vessel probe reconstructions and correlations with histological findings. Eur Radiol. 2010;20:138-145. [PubMed] [DOI] |
| 47. | Yan C, Zhu ZG, Yan M, Zhang H, Pan ZL, Chen J, Xiang M, Chen MM, Liu BY, Yin HR. Size of the largest lymph node visualized on multi-detector-row computed tomography (MDCT) is useful in predicting metastatic lymph node status of gastric cancer. J Int Med Res. 2010;38:22-33. [PubMed] |
| 48. | 贾 海鹏, 张 欢, 潘 自来, 付 天鹏, 宋 琦, 丁 蓓, 凌 华威, 陈 克敏. 胃癌术前淋巴结分期的MDCT研究. 中国医学计算机成像杂志. 2009;15:338-344. |
| 49. | Dhar DK, Kubota H, Kinukawa N, Maruyama R, Kyriazanos ID, Ohno S, Nagasue N. Prognostic significance of metastatic lymph node size in patients with gastric cancer. Br J Surg. 2003;90:1522-1530. [PubMed] [DOI] |
| 50. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 项 明, 陈 明敏, 刘 炳亚, 尹 浩然, 林 言箴. 多排CT对胃癌腹膜转移术前预测的单中心大宗病例研究. 中华胃肠外科杂志. 2010;13:106-110. |
| 51. | Kim AY, Han JK, Seong CK, Kim TK, Choi BI. MRI in staging advanced gastric cancer: is it useful compared with spiral CT? J Comput Assist Tomogr. 2000;24:389-394. [PubMed] [DOI] |
| 52. | Sohn KM, Lee JM, Lee SY, Ahn BY, Park SM, Kim KM. Comparing MR imaging and CT in the staging of gastric carcinoma. AJR Am J Roentgenol. 2000;174:1551-1557. [PubMed] |
| 53. | Anzidei M, Napoli A, Zaccagna F, Di Paolo P, Zini C, Cavallo Marincola B, Geiger D, Catalano C, Passariello R. Diagnostic performance of 64-MDCT and 1.5-T MRI with high-resolution sequences in the T staging of gastric cancer: a comparative analysis with histopathology. Radiol Med. 2009;114:1065-1079. [PubMed] [DOI] |
| 54. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 刘 炳亚, 尹 浩然, 林 言箴. 磁共振成像和多层螺旋CT对胃癌术前分期的比较研究. 中国现代医学杂志. 2005;15:2951-2955. |
| 55. | Stell DA, Carter CR, Stewart I, Anderson JR. Prospective comparison of laparoscopy, ultrasonography and computed tomography in the staging of gastric cancer. Br J Surg. 1996;83:1260-1262. [PubMed] [DOI] |
| 56. | Lowy AM, Mansfield PF, Leach SD, Ajani J. Laparoscopic staging for gastric cancer. Surgery. 1996;119:611-614. [PubMed] [DOI] |
| 57. | Muntean V, Mihailov A, Iancu C, Toganel R, Fabian O, Domsa I, Muntean MV. Staging laparoscopy in gastric cancer. Accuracy and impact on therapy. J Gastrointestin Liver Dis. 2009;18:189-195. [PubMed] |
| 58. | Lehnert T, Rudek B, Kienle P, Buhl K, Herfarth C. Impact of diagnostic laparoscopy on the management of gastric cancer: prospective study of 120 consecutive patients with primary gastric adenocarcinoma. Br J Surg. 2002;89:471-475. [PubMed] [DOI] |
| 59. | Feussner H, Omote K, Fink U, Walker SJ, Siewert JR. Pretherapeutic laparoscopic staging in advanced gastric carcinoma. Endoscopy. 1999;31:342-347. [PubMed] [DOI] |
| 60. | Song KY, Kim JJ, Kim SN, Park CH. Staging laparoscopy for advanced gastric cancer: is it also useful for the group which has an aggressive surgical strategy? World J Surg. 2007;31:1228-1223. [PubMed] [DOI] |
| 61. | Hur H, Lee HH, Jung H, Song KY, Jeon HM, Park CH. Predicting factors of unexpected peritoneal seeding in locally advanced gastric cancer: indications for staging laparoscopy. J Surg Oncol. 2010;102:753-757. [PubMed] [DOI] |
| 63. | Dassen AE, Lips DJ, Hoekstra CJ, Pruijt JF, Bosscha K. FDG-PET has no definite role in preoperative imaging in gastric cancer. Eur J Surg Oncol. 2009;35:449-455. [PubMed] [DOI] |
| 64. | McAteer D, Wallis F, Couper G, Norton M, Welch A, Bruce D, Park K, Nicolson M, Gilbert FJ, Sharp P. Evaluation of 18F-FDG positron emission tomography in gastric and oesophageal carcinoma. Br J Radiol. 1999;72:525-529. [PubMed] |
| 65. | Kim EY, Lee WJ, Choi D, Lee SJ, Choi JY, Kim BT, Kim HS. The value of PET/CT for preoperative staging of advanced gastric cancer: Comparison with contrast-enhanced CT. Eur J Radiol. 2011;79:183-188. [PubMed] [DOI] |
| 66. | Lim JS, Kim MJ, Yun MJ, Oh YT, Kim JH, Hwang HS, Park MS, Cha SW, Lee JD, Noh SH. Comparison of CT and 18F-FDG pet for detecting peritoneal metastasis on the preoperative evaluation for gastric carcinoma. Korean J Radiol. 2006;7:249-256. [PubMed] [DOI] |
| 67. | Dromain C, Leboulleux S, Auperin A, Goere D, Malka D, Lumbroso J, Schumberger M, Sigal R, Elias D. Staging of peritoneal carcinomatosis: enhanced CT vs. PET/CT. Abdom Imaging. 2008;33:87-93. [PubMed] [DOI] |
| 68. | Ott K, Fink U, Becker K, Stahl A, Dittler HJ, Busch R, Stein H, Lordick F, Link T, Schwaiger M. Prediction of response to preoperative chemotherapy in gastric carcinoma by metabolic imaging: results of a prospective trial. J Clin Oncol. 2003;21:4604-4610. [PubMed] [DOI] |
| 69. | Ott K, Herrmann K, Lordick F, Wieder H, Weber WA, Becker K, Buck AK, Dobritz M, Fink U, Ulm K. Early metabolic response evaluation by fluorine-18 fluorodeoxyglucose positron emission tomography allows in vivo testing of chemosensitivity in gastric cancer: long-term results of a prospective study. Clin Cancer Res. 2008;14:2012-2018. [PubMed] [DOI] |
| 70. | Vallböhmer D, Hölscher AH, Schneider PM, Schmidt M, Dietlein M, Bollschweiler E, Baldus S, Alakus H, Brabender J, Metzger R. [18F]-fluorodeoxyglucose-positron emission tomography for the assessment of histopathologic response and prognosis after completion of neoadjuvant chemotherapy in gastric cancer. J Surg Oncol. 2010;102:135-140. [PubMed] [DOI] |