修回日期: 2010-12-05
接受日期: 2010-12-15
在线出版日期: 2011-01-08
目的: 探讨不同肝组织中VEGF-B及其两个变位剪切体VEGF-B167、VEGF-B186 mRNA的表达, 并评估其临床意义.
方法: 应用荧光定量PCR法检测肝癌、癌旁、乙型肝炎肝硬化、慢性乙型肝炎及正常肝组织中总VEGF-B、VEGFB167及VEGFB186 mRNA的表达量, 与患者的临床病理资料做相关性分析, 并结合随访资料做生存分析.
结果: 总VEGF-B及VEGF-B186 mRNA在各组组织中表达量无统计学差异; VEGF-B167 mRNA在各组间表达量有统计学差异, 正常组表达最高, 乙型肝炎肝硬化组最低(252.59 vs 168.00, P = 0.005), 肝癌组中VEGF-B167的表达量明显高于慢性乙型肝炎组和乙型肝炎肝硬化组(234.13 vs 170.72, 168.00; P = 0.043, P<0.01). 依据VEGF-B表达高低, 将肝癌患者分组, VEGF-B167低表达组患者的总体生存率较高表达组和无差异组有升高趋势(P = 0.097), 而VEGF-B167低表达组患者术后无瘤生存率明显高于其他两组(P = 0.023). 肝癌组织中总VEGF-B、VEGF-B167及VEGF-B186的表达与患者性别、年龄、病毒感染、肝硬化、Child-Pugh分级、AFP值、肿瘤数目、肿瘤大小、血管侵犯、TNM分期及肿瘤分化之间相关性无统计学意义.
结论: VEGF-B参与了肝癌的发生发展过程, VEGF-B167在此过程中的作用较VEGF-B186更重要. VEGF-B167低表达患者预后较好, 术后总生存率和无瘤生存率较高.
引文著录: 王瞿辉, 王毅军, 高英堂, 杜智, 杨斌, 张晔, 郭华, 景丽, 余俊, 许彦杰. 血管内皮生长因子B及其变位剪切体在不同肝组织中的表达差异及意义. 世界华人消化杂志 2011; 19(1): 31-37
Revised: December 5, 2010
Accepted: December 15, 2010
Published online: January 8, 2011
AIM: To detect the mRNA expression of vascular endothelial cell growth factor B (VEGF-B) and its splice isoforms VEGF-B167 and VEGF-B186 in different types of liver lesions and to assess their clinical significance.
METHODS: The mRNA expression of VEGF-B, VEGF-B167 and VEGF-B186 in liver cancer, cancer-adjacent tissue, liver cirrhosis, chronic hepatitis B, and normal liver tissue was detected by quantitative real-time reverse transcription-polymerase chain reaction (RT-PCR). The correlation of VEGF-B, VEGF-B167, and VEGF-B186 expression with the clinical pathological data of patients was analyzed, and survival analysis was performed using follow-up data.
RESULTS: There were no statistical differences in the expression levels of total VEGF-B and VEGF-B186 among each group, while the expression level of VEGF-B167 mRNA was significantly different among each group, highest in the normal group but lowest in liver cirrhosis group (252.59 vs 168.00, P = 0.005). The expression level of VEGF-B167 mRNA was significantly higher in the liver cancer group than in the chronic hepatitis B group (234.13 vs 170.72, 168.00, both P < 0.05). The overall survival rate and tumor-free survival rate of patients with low VEGF-B167 expression tended to be higher than those of patients with high VEGF-B167 expression (P = 0.097, 0.023). The expression levels of total VEGF-B, VEGF-B167 and VEGF-B186 had no significant correlation with sex, age, virus infection, liver cirrhosis, Child-Pugh score, AFP score, tumor number or size, vascular invasion, TNM stage, or tumor differentiation.
CONCLUSION: VEGF-B is involved in hepatocarcinogenesis and VEGF-B167 plays a more important role than VEGF-B186 in this process. Patients with low VEGF-B167 expression have good prognosis since their postoperative overall survival rate and tumor-free survival rate are higher than those with high VEGF-B167 expression.
- Citation: Wang QH, Wang YJ, Gao YT, Du Z, Yang B, Zhang Y, Guo H, Jing L, Yu J, Xu YJ. Significance of expression of vascular endothelial growth factor B and its splice isoforms in different types of liver lesions. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 31-37
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/31.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.31
肝细胞癌(hepatocellular carcinoma, HCC)是一种高度恶性肿瘤, 严重威胁人类健康[1]. 肝癌为世界第6大常见恶性肿瘤, 全球每年新增约63万病例, 死亡人数约为60万, 为癌症中第3号杀手, 我国年发病人数约为35万, 每年约有32万人死于此病, 发病率与死亡率均占恶性肿瘤的第2位[2]. HCC是典型的多血管肿瘤, 丰富而又扭曲的血管是肝癌的重要特征, 血管生成已经成为目前肝癌研究的热点. 血管内皮生长因子(vascular endothelial cell growth factor, VEGF)与肝癌血管形成密切相关, 其家族包括: VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、胎盘生长因子和VEGF-F等7个成员以及各自的变位剪切体[3-5]. VEGF-A被公认为是体内最强的一种血管生成促进因子, 其在HCC发生发展过程中的作用及意义已经受到各国学者的关注. VEGF-B是该家族的另一成员[6], 他在HCC组织中的表达和意义尚不明确. 本试验采用实时荧光定量PCR技术检测VEGF-B、VEGF-B167及VEGF-B186 mRNA在HCC组织中的表达并研究其与临床资料的相关性.
组织标本均取自2004-12/2009-08天津市第三中心医院肝胆外科住院并手术的患者, 包括肝癌者98例: 获取肝癌组织(T)98份、癌旁<1 cm处组织(N0)21份、癌旁1 cm处组织(N1)21份、癌旁2 cm处组织(N2)98份、癌旁3 cm处组织(N3)85份; 乙型肝炎肝硬化组织(LC)32例; 慢性乙型肝炎组织(HV)5例; 正常肝组织(取自手术治疗的肝血管瘤瘤旁组织24例. 标本在术后立即置于-70 ℃低温冰箱冷冻保存备用. 所有肝癌组织均经病理学检查证实, 癌旁组织经病理检查未见肝癌细胞. 试验方案经天津市第三中心医院伦理委员会审核通过, 患者或家属均知情同意. 98例肝癌患者中男81例, 女17例, 中位年龄53岁, 患者来源以天津为主, 余近1/3来自北方其他省市. 术前血清学检查确定肝炎类型、肿瘤标记物水平, 依据术前1 wk指标、Child-Pugh标准评估肝功能, 以影像学及术中所见评估血管侵犯, 根据临床及病理结果进行国际TNM分期. 全部病例从手术日开始进入随访, 随访内容包括术后复发时间、生存时间等.
1.2.1 RNA提取和逆转录: 参照Promega公司RNAgents试剂盒操作说明提取总RNA, 每50 mg组织的总RNA溶于50 μL DEPC水中, 琼脂糖凝胶电泳检测RNA完整性, 紫外分光光度计检测RNA含量. 每个逆转录反应包含2 μg RNA、3 μL随机引物, 补DEPC水至体系为21 μL, 70 ℃热变性15 min, 迅速冰浴3 min; 再依次加入4.8 μL 25 mmol/L MgCl2、8 μL 5×逆转录缓冲液、2 μL 10 mmol/L dNTP、1.5 μL逆转录酶, 加DEPC水至终体积为40 μL. 37 ℃水浴90 min, 70 ℃ 10 min灭活逆转录酶.
1.2.2 引物设计: 依据GenBank中VEGF-B、VEGF-B167、VEGF-B186和管家基因GAPDH的mRNA序列设计引物, 采用Primer Express 2.0软件设计, 由上海生物工程技术服务有限公司合成, 引物序列及适宜退火温度见表1.
| 基因 | 上游引物(5'-3') | 下游引物(5'-3') | 片段长度(bp) | 退火温度(℃) |
| VEGF-B | CAGAGGAAAGTGGTGTCATGGA | CTGCATTCACACTGGCTGTGT | 281 | 55.0 |
| VEGF-B167 | CAGAGGAAAGTGGTGTCATGGA | GGGGCCTGGGGCTGTCTGGC | 338 | 64.0 |
| VEGF-B186 | CAGAGGAAAGTGGTGTCATGGA | GAGTGGCAGCCCTGTCTGGC | 328 | 62.5 |
| GAPDH | GGGCATCCTGGGCTACACTGA | CAAATTCGTTGTCATACCAGGAAATG | 143 | 62.5 |
1.2.3 实时荧光定量PCR检测: 采用ABI7000荧光定量PCR仪检测, 反应体系如下: cDNA模板2 μL、上下游引物各0.5 μL、1 U Taq聚合酶、2 μL 2.5 mmol/L dNTP和2.5 μL 10×PCR缓冲液, 加超纯水至总体积25 μL. 扩增条件为: 94 ℃预变性2 min; 94 ℃变性30 s, 适宜退火温度, 30 s, 72 ℃, 30 s; 反应45个循环. 将参比基因和目的基因的CT值按2-ΔΔCT[7-9]法计算目的基因相对表达量.
统计学处理 所有数据均用SPSS13.0统计软件处理分析, 基因表达差异组间分析采用秩和检验, 与临床病理资料的相关性分析采用卡方检验或Fisher精确概率检验, 采用Log-rank检验进行生存分析并绘制Kaplan-Meier生存曲线. 采用Cox多因素风险比例模型分析肝癌预后的影响因素. 所有结果均以P<0.05为有统计学意义.
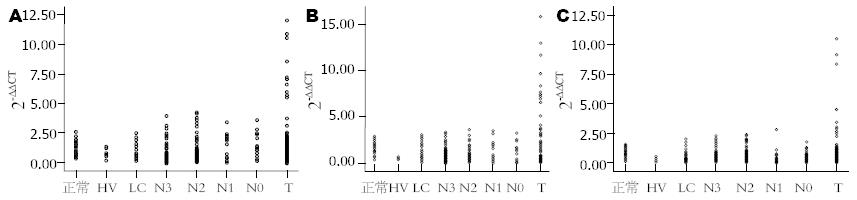
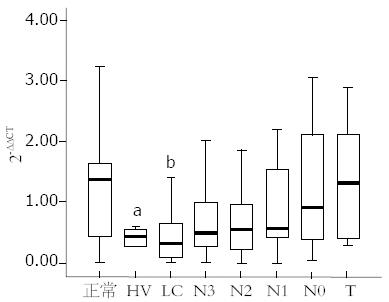
总VEGF-B、VEGF-B167及VEGF-B186 mRNA在各组组织中表达结果如图1、2所示, 总VEGF-B及VEGF-B186在各组组织中的表达无统计学差异, 而VEGF-B167在各组中的表达量差异有统计学意义(P = 0.005), LC组最低, 中位数为0.440, 正常组最高, 中位数为1.368; 肝癌组VEGF-B167表达水平明显高于HV和LC组(1.312 vs 0.526, 0.440), 并且从癌旁N3到肝癌T的表达量有递增趋势. 总VEGF-B、VEGF-B167和VEGF-B186在肿瘤组(T)分别有10例、12例和9例的表达量明显高于其他标本(2-ΔΔCT>5).
比较98对肝癌组织(T)与相应的癌旁2 cm组织(N2)的2-ΔΔCT值, 前者高于或低于后者3倍定义为该基因在肝癌中高表达或低表达[10], 差异<3倍的认为该基因在肝癌与癌旁间表达无差异. 在98例肝癌组织, 总VEGF-B、VEGF-B167和VEGF-B186高表达的分别为27例、24例和28例, 低表达的分别有29例、29例和25例; 差异<3倍的分别有42例、45例和45例. 总VEGF-B、VEGF-B167及VEGF-B186的表达与患者性别、年龄、病毒感染、肝硬化、Child-Pugh分级、AFP值、肿瘤数目、肿瘤大小、TNM分期及肿瘤分化无相关性(表2).
| 病理特征 | 总VEGF-B | VEGF-B167 | VEGF-B186 | |||||||||
| 高表达 | 低表达 | 无差异 | P值 | 高表达 | 低表达 | 无差异 | P值 | 高表达 | 低表达 | 无差异 | P值 | |
| 性别 | 0.948 | 0.088 | 0.854 | |||||||||
| 男 | 23 | 24 | 34 | 23 | 23 | 35 | 24 | 25 | 37 | |||
| 女 | 4 | 5 | 8 | 1 | 6 | 10 | 4 | 5 | 8 | |||
| 年龄(岁) | 0.061 | 0.100 | 0.775 | |||||||||
| ≤55 | 20 | 13 | 21 | 17 | 12 | 25 | 17 | 13 | 24 | |||
| >55 | 7 | 16 | 21 | 7 | 17 | 20 | 11 | 12 | 21 | |||
| HBSAg | 0.188 | 0.846 | 0.304 | |||||||||
| + | 21 | 22 | 38 | 20 | 23 | 38 | 22 | 19 | 40 | |||
| - | 6 | 7 | 4 | 4 | 6 | 7 | 6 | 6 | 5 | |||
| 肝硬化 | 0.765 | 0.230 | 0.914 | |||||||||
| 有 | 24 | 27 | 37 | 22 | 28 | 38 | 25 | 22 | 41 | |||
| 无 | 3 | 2 | 5 | 2 | 1 | 7 | 3 | 3 | 4 | |||
| Child-Pugh分级 | 0.123 | 0.748 | 0.554 | |||||||||
| A | 25 | 26 | 29 | 19 | 25 | 36 | 23 | 22 | 35 | |||
| B | 2 | 3 | 13 | 5 | 4 | 9 | 5 | 3 | 10 | |||
| AFP(ng/mL) | 0.276 | 0.943 | 0.676 | |||||||||
| ≥400 | 9 | 10 | 21 | 9 | 12 | 17 | 10 | 8 | 19 | |||
| <400 | 18 | 19 | 21 | 15 | 17 | 28 | 18 | 17 | 26 | |||
| 肿块数目 | 0.515 | 0.734 | 0.493 | |||||||||
| 单发 | 19 | 19 | 24 | 15 | 20 | 27 | 18 | 18 | 26 | |||
| 多发 | 8 | 10 | 18 | 9 | 9 | 18 | 10 | 7 | 19 | |||
| 肿块直径(cm) | 0.149 | 0.590 | 0.425 | |||||||||
| ≤5 | 10 | 6 | 18 | 7 | 9 | 18 | 11 | 6 | 17 | |||
| >5 | 17 | 23 | 24 | 17 | 20 | 27 | 17 | 19 | 28 | |||
| 血管侵犯 | 0.938 | 0.482 | 0.837 | |||||||||
| 有 | 9 | 11 | 15 | 11 | 9 | 15 | 9 | 10 | 16 | |||
| 无 | 18 | 18 | 27 | 13 | 20 | 30 | 19 | 15 | 29 | |||
| TNM分期 | 0.382 | 0.609 | 0.981 | |||||||||
| Ⅰ/Ⅱ | 14 | 10 | 20 | 11 | 15 | 18 | 13 | 11 | 20 | |||
| Ⅲ/Ⅳ | 13 | 19 | 22 | 13 | 14 | 27 | 15 | 14 | 25 | |||
| 分化程度 | 0.397 | 0.073 | 0.636 | |||||||||
| 高 | 8 | 9 | 18 | 6 | 8 | 21 | 9 | 8 | 18 | |||
| 中 | 11 | 16 | 16 | 12 | 18 | 14 | 12 | 14 | 18 | |||
| 低 | 8 | 4 | 8 | 6 | 3 | 10 | 7 | 3 | 9 | |||
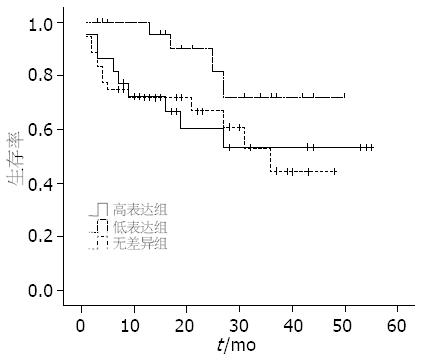
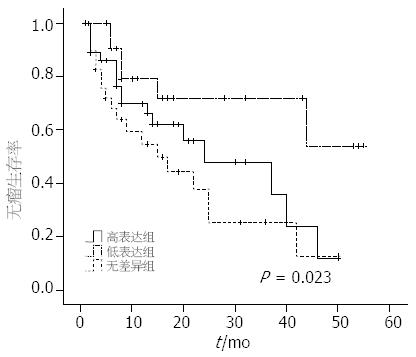
根据患者的术后随访资料计算该组患者的生存率, 以研究VEGF-B与预后之间的关系. 本组患者共98例, 失访4例, 全组患者的两年生存率为56.37%. 通过绘制Kaplan-Meier曲线(图3), 可以看出总VEGF-B167 mRNA低表达组患者的术后总生存率较高表达组和无差异组有升高趋势(P = 0.097), 而总VEGF-B、VEGF-B186 mRNA表达与患者术后生存之间的关系不明显(P = 0.394, 0.393). 根据患者术后是否复发以及复发时间作无瘤生存曲线(图4), VEGF-B167 mRNA低表达组患者术后无瘤生存率高于高表达组和无差异组, 差异有统计学意义(P = 0.023). 同样总VEGF-B、VEGF-B186 mRNA表达与患者术后生存之间的关系不明显(P = 0.083, 0.205).
应用COX回归模型对总VEGF-B、VEGF- B167、VEGF-B186及其他临床因素(性别、年龄、HBsAg、HCV、肝硬化、肝功能Child-Pugh分级、AFP、肿块数目、肿块直径、血管侵犯、TNM分期、肿瘤分化12个因素)进行分析后发现, Child-Pugh分级、肿瘤数目、肿瘤直径、血管侵犯、TNM分期是影响无瘤生存时间的危险因素(表3).
| 项目 | 无瘤生存 | |
| Exp(B)(95%CI) | P值 | |
| 总VEGF-B | ||
| 高表达 vs无差异 | 0.779(0.308-1.967) | 0.597 |
| 低表达 vs无差异 | 0.430(0.059-3.153) | 0.406 |
| VEGF-B167 | ||
| 高表达 vs无差异 | 1.267(0.618-2.598) | 0.519 |
| 低表达 vs无差异 | 0.464(0.153-1.402) | 0.173 |
| VEGF-B186 | ||
| 高表达 vs无差异 | 1.098(0.472-2.551) | 0.829 |
| 低表达 vs 无差异 | 0.850(0.387-1.870) | 0.687 |
| 性别 | 0.739(0.355-1.542) | 0.421 |
| 男 vs 女 | ||
| 年龄(岁) | ||
| ≤55 vs >55 | 0.779(0.421-1.442) | 0.427 |
| 乙型肝炎 | ||
| 阳性 vs阴性 | 0.606(0.288-1.278) | 0.189 |
| 丙型肝炎 | ||
| 阳性 vs阴性 | 1.664(0.512-5.407) | 0.397 |
| 肝硬化 | ||
| 有 vs无 | 1.096(0.389-3.086) | 0.863 |
| Child-Pugh分级 | ||
| B vs A | 2.853(1.213-6.712) | 0.016 |
| AFP(μg/L) | ||
| ≥400 vs <400 | 1.769(0.973-3.217) | 0.062 |
| 肿块数目 | ||
| 多发 vs单发 | 3.176(1.218-8.283) | 0.009 |
| 肿块直径(cm) | ||
| ≥5 vs <5 | 2.518(1.302-4.870) | 0.006 |
| 血管侵犯 | ||
| 有 vs无 | 3.170(1.215-8.271) | 0.018 |
| TNM分期 | ||
| Ⅲ+Ⅳ vsⅠ+Ⅱ | 2.685(1.198-6.020) | 0.016 |
| 肿瘤分化 | ||
| 低 vs中高 | 1.334(0.604-2.945) | 0.476 |
在多因素分析中, 同样选取上述单因素分析中所采用的15个指标, 应用COX回归模型分析其对于无瘤生存时间的影响. 采用基于Wald统计量的后退法进行分析, 仅有肿瘤数目和肿瘤直径为影响患者无瘤生存的危险因素(表4).
| 项目 | 无瘤生存 | |
| Exp(B)(95%CI) | P值 | |
| 肿块数目 单发 vs 多发 | 2.518(1.302-4.870) | 0.006 |
| 肿块直径(cm) ≥5 vs <5 | 14.927(4.078-54.637) | <0.001 |
VEGF-B位于11号染色体q13[6], 含有8个外显子和6个内含子, 大约跨度4 000 bp, 转录时由于不同的剪切方式可形成两种形式的mRNA, 即VEGF-B167和VEGF-B186[11], 编码的蛋白质分别含167和186个氨基酸. 二者由于羟基末端的氨基酸序列不同而具有不同的生物学特点[8]. VEGF-B以同源二聚体形式与内皮细胞表面的血管内皮生长因子受体1(vascular endothelia growth factor receptor 1, VEGFR1)结合而发挥促进血管生成的生物学作用[12-21].
成人肝脏的血管非常丰富, 血管的侧面是内皮细胞相连的肝窦与Disse间隙相隔开来; 而在肝癌组织中的肝窦与正常肝组织不同, 不再是由不连续的扁平内皮细胞覆盖, 而是由连续的内皮细胞围绕而成的常规毛细血管结构. 因此, 血管生成作用在肝癌中较为典型. VEGF-B对血管生成存在正性上调作用, 其对于肝癌的血管生成也应存在一定的作用. 但目前有关VEGF-B在肝癌血管生成中作用的研究还很少. Mas等[22]通过高密度寡核苷酸蛋白芯片技术检测发现VEGF-B在丙型肝炎引起的HCC患者血清中的表达量明显高于其在单纯丙型肝炎肝硬化患者血清中的表达水平. Kanda等[23]通过RT-PCR方法对48例肝癌组织以及无瘤肝组织进行VEGF-B因子的mRNA水平检测, 结果发现肝癌组织中VEGF-B的总体表达水平低于癌旁正常肝组织, 而肝癌组中VEGF-B表达量与肝癌的病理分期、肿瘤的数量、血管侵犯以及是否存在包膜具有相关性, 其两种亚型中VEGF-B167起着主导作用. 但是两位学者所研究的HCC标本都有HCV感染基础, 而中国的肝癌患者多数由HBV感染引起, 其临床特点具有特殊性[24], 迄今尚未发现研究VEGF-B在HBV引起的HCC中表达的报道, 因此本试验主要研究VEGF-B在我国乙型肝炎为主要发病因素的肝癌中表达及意义.
Mas等从蛋白水平研究发现HCC组VEGF-B表达量高于肝硬化组, 本实验从mRNA水平分别检测了总VEGF-B及其两个变位剪切体VEGF-B167、VEGF-B186在不同肝组织中表达量, 发现总VEGF-B及VEGF-B186在各组组织中的表达无统计学差异, 而肝癌组(T)中VEGF-B167表达量明显高于HV组和LC组, 表明VEGF-B167升高是导致肝癌组总VEGF-B 高于肝硬化组的主要原因, 提示VEGF-B167在从肝硬化向肝癌的发展过程中可能起了重要作用. 另外, 本试验结果显示总VEGF-B、VEGF-B167和VEGF-B186在正常肝组织中的表达高于HV组和LC组, 可能跟患者HBV感染和肝脏功能情况有关.
关于VEGF-B在肝癌中表达的意义目前只有Kanda等报道, 本试验改进了实验方法, 对总VEGF-B及其两个变位剪切体VEGF-B167、VEGF-B186的检测都采用了荧光定量PCR方法, 并且将研究对象依据表达的高低分成了高表达、低表达和无差异3组, 减小了分组对实验结果的干扰, 未发现肝细胞癌组织中总VEGF-B、VEGF-B167和VEGF-B86 mRNA表达与患者的性别、年龄、病毒感染、是否合并肝硬化、Child-Pugh分级、血管侵犯及肿瘤的数目、大小、分化程度等相关.
Kanda等报道在肝癌患者中, 总VEGF-B和VEGF-B167低表达组的5年生存率高于高表达组(P = 0.19, 0.13). 也有研究显示VEGF-B与其他肿瘤患者预后存在相关性, Mylona等[25]在用免疫组织化学方法研究VEGF-B在侵袭性乳腺癌中表达及意义的试验中发现, VEGF-B是影响淋巴结阳性患者总生存率的一个重要因素(P = 0.029), 说明VEGF-B可能成为检测淋巴结阳性乳腺癌患者预后的一个指标. Baty等[26]结合寡核苷酸微阵列芯片技术结果和非小细胞肺癌患者的随访资料, 指出VEGF-B是影响非小细胞肺癌患者预后的一个关键因素. 本研究结果显示VEGF-B167与肝癌患者预后的关系较密切, VEGF-B167低表达组较高表达组和无差异组有较高的术后总生存率和无瘤生存率(P = 0.097, 0.023). 此结果表明VEGF-B167低表达的肝癌患者术后复发风险较低, 但COX回归分析未发现VEGF-B167是影响患者无瘤生存的独立因素, 说明VEGF-B167可能和其他因素共同作用提高了患者的复发风险, 有待于进一步研究.
本实验结果表明VEGF-B参与了从肝硬化向肝癌的发展过程, VEGF-B167在此过程中发挥的作用比VEGF-B186更重要. VEGF-B167低表达的患者术后复发风险更低, 预后更好, 但机制尚不明确, 有待进一步研究.
肝细胞癌是一种高度恶性肿瘤, 严重威胁人类健康. 丰富而又扭曲的血管是肝癌的重要特征, VEGF-B在血管生成中的作用已经成为目前肝癌研究的新方向.
唐南洪, 教授, 福建医科大学附属协和医院省肝胆外科研究所
肿瘤血管生成已成为目前研究肿瘤发生与发展的热点, 通过调控促血管生成因子和抑制血管生成因子表达的分子靶向治疗可能成为控制肿瘤生长的有效途径.
Kanda等通过RT-PCR方法对48例肝癌组织以及无瘤肝组织进行VEGF-B因子的mRNA水平检测, 结果发现肝癌组中VEGF-B表达量与肝癌的病理分期、肿瘤的数量、血管侵犯以及是否存在包膜相关, 其两种亚型中VEGF-B167起着主导作用, 并且总VEGF-B和VEGF-B167低表达组的5年生存率高于高表达组.
本研究主要探讨VEGF-B在我国乙型肝炎为主要发病因素的肝癌组织中的表达情况, 为进一步研究肝癌发生的多因素提供了参考.
VEGF-B参与了肝癌的发生发展过程, VEGF-B167在此过程中的作用较VEGF-B186更重要. VEGF-B167低表达患者预后较好, 术后总生存率和无瘤生存率较高.
本文新颖性较好, 有一定的探索价值.
编辑: 李薇 电编:李薇
| 1. | Lau WY, Lai EC. Hepatocellular carcinoma: current management and recent advances. Hepatobiliary Pancreat Dis Int. 2008;7:237-257. [PubMed] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 4. | Shibuya M. Structure and function of VEGF/VEGF-receptor system involved in angiogenesis. Cell Struct Funct. 2001;26:25-35. [PubMed] [DOI] |
| 5. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] [DOI] |
| 6. | Olofsson B, Pajusola K, Kaipainen A, von Euler G, Joukov V, Saksela O, Orpana A, Pettersson RF, Alitalo K, Eriksson U. Vascular endothelial growth factor B, a novel growth factor for endothelial cells. Proc Natl Acad Sci USA. 1996;93:2576-2581. [PubMed] [DOI] |
| 7. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 8. | Romanowski T, Markiewicz A, Bednarz N, Bielawski KP. [Housekeeping genes as a reference in quantitative real-time RT-PCR]. Postepy Hig Med Dosw (Online). 2007;61:500-510. [PubMed] |
| 9. | Shamanina MIu, Vavilin VA, Mordvinov VA, Katokhin AV, Kuznetsova TN, Liakhovich VV. [Real-time polymerase chain reaction and its potential clinical application]. Vestn Ross Akad Med Nauk. 2007;11:37-46. [PubMed] |
| 10. | 王 伟丽, 高 英堂, 杜 智, 王 毅军, 景 丽, 郭 华, 杨 斌, 白 同. 应用实时荧光定量RT-PCR法建立肝癌分子诊断指数. 世界华人消化杂志. 2009;17:985-991. [DOI] |
| 11. | Olofsson B, Pajusola K, von Euler G, Chilov D, Alitalo K, Eriksson U. Genomic organization of the mouse and human genes for vascular endothelial growth factor B (VEGF-B) and characterization of a second splice isoform. J Biol Chem. 1996;271:19310-19317. [PubMed] [DOI] |
| 12. | Olofsson B, Korpelainen E, Pepper MS, Mandriota SJ, Aase K, Kumar V, Gunji Y, Jeltsch MM, Shibuya M, Alitalo K. Vascular endothelial growth factor B (VEGF-B) binds to VEGF receptor-1 and regulates plasminogen activator activity in endothelial cells. Proc Natl Acad Sci USA. 1998;95:11709-11714. [PubMed] [DOI] |
| 13. | Makinen T, Olofsson B, Karpanen T, Hellman U, Soker S, Klagsbrun M, Eriksson U, Alitalo K. Differential binding of vascular endothelial growth factor B splice and proteolytic isoforms to neuropilin-1. J Biol Chem. 1999;274:21217-21222. [PubMed] [DOI] |
| 14. | Li Y, Zhang F, Nagai N, Tang Z, Zhang S, Scotney P, Lennartsson J, Zhu C, Qu Y, Fang C. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. J Clin Invest. 2008;118:913-923. [PubMed] |
| 15. | Toi M, Taniguchi T, Yamamoto Y, Kurisaki T, Suzuki H, Tominaga T. Clinical significance of the determination of angiogenic factors. Eur J Cancer. 1996;32A:2513-2519. [PubMed] [DOI] |
| 16. | Enholm B, Paavonen K, Ristimäki A, Kumar V, Gunji Y, Klefstrom J, Kivinen L, Laiho M, Olofsson B, Joukov V. Comparison of VEGF, VEGF-B, VEGF-C and Ang-1 mRNA regulation by serum, growth factors, oncoproteins and hypoxia. Oncogene. 1997;14:2475-2483. [PubMed] [DOI] |
| 17. | Salven P, Lymboussaki A, Heikkilä P, Jääskela-Saari H, Enholm B, Aase K, von Euler G, Eriksson U, Alitalo K, Joensuu H. Vascular endothelial growth factors VEGF-B and VEGF-C are expressed in human tumors. Am J Pathol. 1998;153:103-108. [PubMed] |
| 18. | Bellomo D, Headrick JP, Silins GU, Paterson CA, Thomas PS, Gartside M, Mould A, Cahill MM, Tonks ID, Grimmond SM. Mice lacking the vascular endothelial growth factor-B gene (Vegfb) have smaller hearts, dysfunctional coronary vasculature, and impaired recovery from cardiac ischemia. Circ Res. 2000;86:E29-E35. [PubMed] |
| 19. | Mould AW, Tonks ID, Cahill MM, Pettit AR, Thomas R, Hayward NK, Kay GF. Vegfb gene knockout mice display reduced pathology and synovial angiogenesis in both antigen-induced and collagen-induced models of arthritis. Arthritis Rheum. 2003;48:2660-2669. [PubMed] [DOI] |
| 20. | Fan F, Wey JS, McCarty MF, Belcheva A, Liu W, Bauer TW, Somcio RJ, Wu Y, Hooper A, Hicklin DJ. Expression and function of vascular endothelial growth factor receptor-1 on human colorectal cancer cells. Oncogene. 2005;24:2647-2653. [PubMed] [DOI] |
| 22. | Mas VR, Maluf DG, Archer KJ, Yanek KC, Fisher RA. Angiogenesis soluble factors as hepatocellular carcinoma noninvasive markers for monitoring hepatitis C virus cirrhotic patients awaiting liver transplantation. Transplantation. 2007;84:1262-1271. [PubMed] [DOI] |
| 23. | Kanda M, Nomoto S, Nishikawa Y, Sugimoto H, Kanazumi N, Takeda S, Nakao A. Correlations of the expression of vascular endothelial growth factor B and its isoforms in hepatocellular carcinoma with clinico-pathological parameters. J Surg Oncol. 2008;98:190-196. [PubMed] [DOI] |
| 24. | Ishikawa T. Clinical features of hepatitis B virus-related hepatocellular carcinoma. World J Gastroenterol. 2010;16:2463-2467. [PubMed] [DOI] |
| 25. | Mylona E, Alexandrou P, Giannopoulou I, Liapis G, Sofia M, Keramopoulos A, Nakopoulou L. The prognostic value of vascular endothelial growth factors (VEGFs)-A and -B and their receptor, VEGFR-1, in invasive breast carcinoma. Gynecol Oncol. 2007;104:557-563. [PubMed] [DOI] |
| 26. | Baty F, Facompré M, Kaiser S, Schumacher M, Pless M, Bubendorf L, Savic S, Marrer E, Budach W, Buess M. Gene profiling of clinical routine biopsies and prediction of survival in non-small cell lung cancer. Am J Respir Crit Care Med. 2010;181:181-188. [PubMed] [DOI] |