修回日期: 2010-11-04
接受日期: 2010-11-10
在线出版日期: 2011-01-08
目的: 研究ARHI基因在胃癌组织与癌旁正常组织中的表达差异及其与患者临床病理特征的相关性.
方法: 用免疫组织化学SP法检测胃癌组织与癌旁正常组织中ARHI基因编码蛋白的表达情况, 用SPSS13.0统计软件对ARHI蛋白的表达差异及其与患者的临床病理特征进行统计学分析.
结果: ARHI蛋白在试验组中阳性表达27例, 阴性表达35例, 表达缺失率56.45%; 对照组中阳性表达21例, 阴性表达7例, 表达缺失率25%, 组间比较有明显统计学差异(P<0.01). 在试验组中, ARHI蛋白表达与患者的年龄、性别、发生部位、肿瘤大小、大体类型、是否淋巴结转移及神经、脉管侵犯均无明显统计学差异, 而与肿瘤的分化程度及TNM分期有关(P<0.05).
结论: ARHI蛋白在胃癌组织中表达明显下调或缺失, 而在胃正常组织中普遍表达. ARHI蛋白表达与患者肿瘤的分化程度及TNM分期有关.
引文著录: 唐海灵, 胡益群, 杨奕轩, 秦兴平, 陈建民, 巴亚斯古楞, 任建林. 抑癌基因ARHI在人胃癌组织中的表达及意义. 世界华人消化杂志 2011; 19(1): 25-30
Revised: November 4, 2010
Accepted: November 10, 2010
Published online: January 8, 2011
AIM: To investigate the expression of aplasia ras homologue member I (ARHI), a tumor suppressor gene, in gastric cancer and to define the correlation between ARHI expression and the clinicopathological characteristics of gastric cancer.
METHODS: Immunohistochemistry was used to detect the expression of ARHI protein in 62 gastric cancer specimens and 28 tumor-adjacent tissue specimens. The correlation between ARHI protein expression and clinicopathological characteristics of gastric cancer was then analyzed.
RESULTS: The percentage of gastric cancer specimens negative for ARHI staining was significantly higher than that of tumor-adjacent tissue specimens (56.45% vs 25.0%, P < 0.01). The expression of ARHI protein was not associated with age, gender, tumor location, tumor size, or metastasis in patients with gastric cancer. However, ARHI protein expression was correlated with tumor differentiation and TNM stage in patients with gastric cancer (both P < 0.05).
CONCLUSION: The expression of ARHI protein is significantly reduced or absent in gastric cancer. ARHI protein expression is closely related with tumor differentiation and TNM stage in patients with gastric cancer.
- Citation: Tang HL, Hu YQ, Yang YX, Qin XP, Chen JM, Guleng B, Ren JL. Significance of ARHI protein expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 25-30
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/25.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.25
ARHI(aplasia ras homologue member I)是1999年新发现的一个抑癌基因, 其编码的蛋白在人类多种正常组织内表达. 已有相关研究显示ARHI基因在卵巢癌[1]、乳腺癌[2]、胰腺癌[3,4]等多种恶性肿瘤中存在表达下调或缺失. 同时发现ARHI基因表达异常可能与印迹基因的突变[5]、杂合性丢失、DNA甲基化和染色体乙酰化修饰等有关[6-9]. ARHI基因与胃癌发生发展的相关性研究, 目前国内外尚无报道. 本研究通过免疫组织化学的方法研究ARHI基因在胃癌组织与癌旁正常胃组织之间的表达情况及其与患者临床病理特征之间的相关性, 从而为胃癌的基因诊治及分子靶向治疗提供新的思路和依据.
收集厦门大学附属中山医院2009-03/2009-12胃癌手术后标本62例作为试验组, 其中男38例, 女24例, 年龄34-85(平均62.78)岁; 收集癌旁正常胃组织(均距肿瘤边缘5 cm以上取材)28例作为对照组. 记录整理所有患者相关临床病理资料. 所有标本均经过病理诊断证实, 患者术前均未接受放化疗. ARHI单克隆抗体(Mouse anti-ARHI, Catalog No. 39-0400)购自invitrogen公司; 即用型免疫组织化学EliVisionTM plus试剂盒(No. KIT-9902)、DAB显色剂(DAB-0031)、柠檬酸抗原修复液(MVS-0100)及PBS缓冲液粉剂(PBS-0060)等均购自福州迈新生物技术公司.
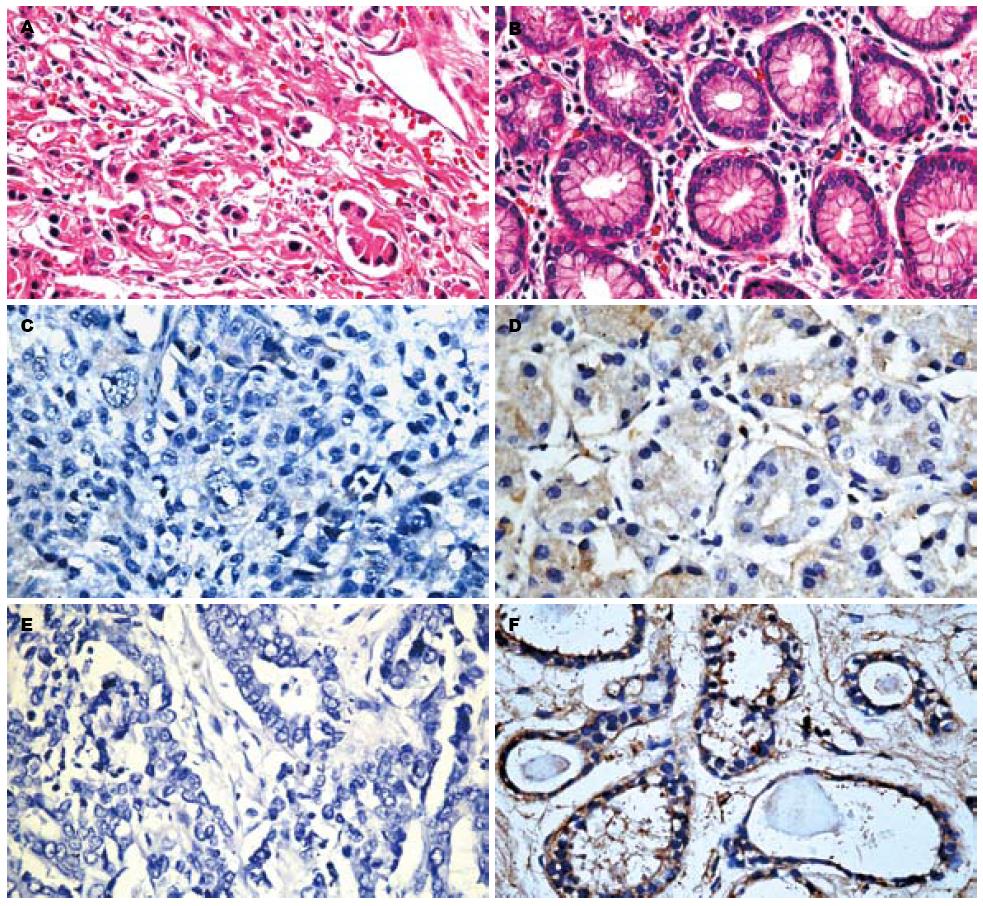
1.2.1 制片及资料分类: 全部标本取材后经40 g/L多聚甲醛溶液固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4 μm, 首先经HE染色病理组织学证实后再采用免疫组织化学SP方法检测胃癌组织ARHI表达. 严格按照试剂盒说明书所示步骤操作, 经反复验证取ARHI一抗最佳稀释浓度为1∶65. 用PBS代替一抗作为阴性对照, 用乳腺正常组织切片作为阳性对照. 试验组所有病例均根据国际抗癌联盟2002年修订的TNM分期标准进行分期, 按性别、年龄、肿瘤发生部位、大体类型、组织分化程度、是否有淋巴结转移及神经、脉管浸润分类.
1.2.2 阅片及判定标准: 采用半定量分析, 显微镜下随机选取5个视野观察, 按阳性着色范围和阳性着色强度分别计分[10]: 阳性范围无为0分, <25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; 阳性强度弱为1分, 中2分, 强3分, 极强4分. 阳性范围和强度的评分相乘, 即为阳性积分, 取5个视野的平均阳性积分为该例的阳性积分; 每例阳性积分<2分为阴性, ≥2分为阳性; 每组阳性积分总和除以例数, 为该组阳性强度平均分.
统计学处理 用SPSS13.0软件进行统计学分析, 定性资料率的比较采用卡方检验; 非参数检验用Wilcoxon秩和检验.
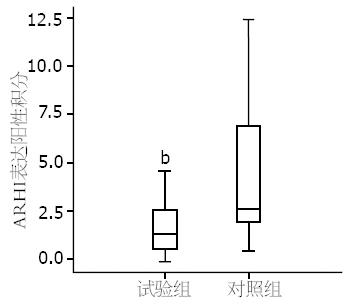
ARHI蛋白在胃癌组织中表达明显下调或缺失, 而在胃正常组织普遍表达. 光学显微镜下可见淡黄至棕黄色着色者即为阳性表达, 主要定位于细胞质、细胞膜(图1). ARHI蛋白在试验组中阳性表达27例, 阴性表达35例, 表达缺失率56.45%; 对照组中阳性表达21例, 阴性表达7例, 表达缺失率25%, 组间比较有明显统计学差异(P<0.01, 表1, 图2).
| 分组 | n | +(n) | -(n) | 阴性率(%) | 阳性率(%) | 平均阳性积分 | P值 |
| 试验组 | 62 | 27 | 35 | 56.45 | 43.55 | 1.68±1.034 | <0.01 |
| 对照组 | 28 | 21 | 7 | 25.00 | 75.00 | 4.19±3.431 |
在试验组ARHI蛋白表达与患者的年龄(≤60岁、>60岁)、性别、发生部位(胃底/贲门、胃体、胃窦)、肿瘤大小(<5 cm、≥5 cm)大体类型(溃疡型、浸润型、隆起型)、是否存在淋巴结转移及神经、脉管浸润与否均无明显统计学差异, 与肿瘤的分化程度(高分化、中分化、低分化)及TNM分期(ⅠA/B-Ⅱ、ⅢA/B-Ⅳ)有关(P<0.05, 表2). ARHI蛋白在胃癌组织中随组织分化程度的降低而表达缺失率逐渐升高; TNM分期Ⅲ-Ⅳ期的组织中较Ⅰ-Ⅱ期组织中的表达缺失率明显升高.
| 临床病理特征 | n | +(n) | -(n) | 缺失率(%) | χ2值 | P值 |
| 年龄(岁) | ||||||
| ≤60 | 24 | 13 | 11 | 45.83 | 1.796 | >0.05 |
| >60 | 38 | 14 | 24 | 63.16 | ||
| 性别 | ||||||
| 男 | 38 | 15 | 23 | 60.53 | 0.663 | >0.05 |
| 女 | 24 | 12 | 12 | 50.00 | ||
| 发生部位 | ||||||
| 胃底/贲门 | 28 | 13 | 15 | 53.57 | 0.892 | >0.05 |
| 胃体 | 24 | 11 | 13 | 54.17 | ||
| 胃窦 | 10 | 3 | 7 | 70.00 | ||
| 肿瘤大小(cm) | ||||||
| <5 | 30 | 11 | 19 | 63.33 | 1.120 | >0.05 |
| ≥5 | 32 | 16 | 16 | 50.00 | ||
| 大体类型 | ||||||
| 隆起型 | 10 | 4 | 6 | 60.00 | 1.081 | >0.05 |
| 溃疡型 | 42 | 20 | 22 | 52.38 | ||
| 浸润型 | 10 | 3 | 7 | 70.00 | ||
| 分化程度 | ||||||
| 低分化 | 37 | 12 | 25 | 67.57 | 6.027 | <0.05 |
| 中分化 | 23 | 13 | 10 | 43.48 | ||
| 高分化 | 2 | 2 | 0 | 0.00 | ||
| TNM分期 | ||||||
| ⅠA/B-Ⅱ | 39 | 25 | 14 | 35.89 | 4.996 | <0.05 |
| ⅢA/B-Ⅳ | 23 | 8 | 15 | 65.22 | ||
| 淋巴转移 | ||||||
| 是 | 49 | 20 | 29 | 59.18 | 3.332 | >0.05 |
| 否 | 13 | 9 | 4 | 30.77 | ||
| 神3/4脉管浸润 | ||||||
| 是 | 57 | 25 | 32 | 56.14 | 0.484 | >0.05 |
| 否 | 5 | 3 | 2 | 40.00 |
ARHI基因是1999年由美国德克萨斯大学Anderson癌症中心的Yu等[1]从人卵巢和乳腺上皮细胞及其癌细胞中克隆得出的母源性印迹基因, 定位于人染色体1p31. ARHI蛋白在结构上与ras/rap家族有50%-60%的同源性, 是ras/rap家族第一个被报道的抑癌基因[11,12].
ARHI基因发现较晚, 对其与肿瘤关系的研究相对较少. 目前相关研究显示ARHI基因在卵巢癌、乳腺癌、胰腺癌、肝细胞癌[13]、滤泡型甲状腺癌[14]等恶性肿瘤中存在表达下调或缺失, 并在这些肿瘤中发现了该基因的结构和功能变化. 提示ARHI基因与上述肿瘤的发生、发展密切相关, 进一步的研究认为ARHI基因表达异常可能与印迹基因的突变[5]、杂合性丢失、DNA甲基化和染色体乙酰化修饰等有关[6-9]. 另外, 近年研究显示: 在卵巢癌中ARHI在转录和转录后两个水平的调控促进其表达明显下调[15]; ARHI基因与信号转导蛋白和转录激活因子STAT3相互作用, 并通过抑制STAT3的激活而发挥抑癌基因功能[16,17], 进一步研究发现该基因通过抑制核输入因子与STAT3的结合而阻碍STAT3蛋白的核定位, 抑制其转录激活功能[18]; 在胰腺内分泌肿瘤[19]和上皮性卵巢癌[20]患者中ARHI的低表达与较短的无进展生存期相关; 通过对卵巢癌细胞的研究提示ARHI基因可以诱导自体吞噬细胞的死亡, 促进肿瘤细胞休眠[21,22]. 可见, 随着对ARHI基因的不断研究, 其发挥生物学功能的诸多分子机制逐渐在被发现和认识.
胃癌是最常见的恶性肿瘤之一. 但目前胃癌发病机制仍不清楚, 早期诊断和治疗比率仍很低. ARHI基因作为一个较特殊的抑癌基因, 其越来越多的生物学功能正在不断地被研究报道, 但这些研究大多集中于卵巢癌、乳腺癌及胰腺癌中. ARHI基因与人胃癌的发生、发展是否有相关性? 目前国内外尚无相关研究报道. 本试验通过免疫组织化学的方法首次初步研究了ARHI蛋白在人胃癌组织与癌旁正常组织的表达差异. 结果显示ARHI在胃癌组织(试验组)中的表达缺失率为56.45%, 而在癌旁正常组织(对照组)的表达缺失率为25%. 切片通过半定量评分的方法以平均阳性积分代表阳性强度, 用非参数秩和检验(Wilcoxon秩和检验)的方法统计比较后发现ARHI表达在两组间存在明显统计学差异(T = 2 407.0, P<0.01); 同时采用卡方检验方法对两组间蛋白表达率统计分析后也提示存在明显统计学差异(χ2 = 7.666, P<0.01). 对62例胃癌组织实验结果统计分析发现ARHI蛋白表达与肿瘤的分化程度及TNM分期有关(P<0.05), 而与患者的年龄、性别、肿瘤发生部位、大小、大体类型、是否淋巴结转移及神经、脉管浸润均无明显统计学差异. 同时我们的试验显示ARHI蛋白阳性着色主要集中于胞浆及胞膜, 但部分纤维结缔组织及肌层也有阳性分布, 这与Lu等[3]研究一致, 提示在正常情况下ARHI是一种在多组织中均有表达的基因, 说明这种基因有着重要的生物学功能.
癌基因的激活和抑癌基因的失活是肿瘤研究的热点, 抑癌基因的失活被认为是肿瘤发生的重要机制之一. ARHI既是母源性的抑癌印迹基因又是ras/rap超家族成员, 而我们知道ras/rap超家族成员属于癌基因, ARHI基因是该家族第1个被报道的抑癌基因, 并且近年来研究提示其还与肿瘤细胞的信号转导、自体吞噬、休眠及患者的预后相关. 另外, 印迹基因作为表观遗传学的研究内容也是近年研究的热点, 这就极大的引起了我们研究的兴趣. 目前关于ARHI基因的研究还相对较少, 而其与胃癌的相关研究尚无报道. 肿瘤的发生是一个多因素作用, 多基因参与, 逐步发展的过程. ARHI基因属于ras/rap癌基因家族成员, 为何目前的研究显示其发挥抑癌功能? 其发挥抑癌功能的具体机制是什么? ARHI基因是否仅仅是肿瘤发展的某个阶段的抑癌基因? 是否在不同的条件下也与其他某些基因一起共同参与肿瘤的发生、发展? 这些问题尚不确定. 本研究旨在初步探讨ARHI在胃癌的表达情况, 为进一步深入地研究提供依据, 从而为胃癌的基因诊断、基因治疗以及分子靶向药物的治疗提供新的思路.
ARHI基因是1999年从人卵巢和乳腺上皮细胞及其癌细胞中克隆得出的母源性抑癌印迹基因. 已有研究显示, 该基因与卵巢癌、乳腺癌、胰腺癌、甲状腺癌、肝癌等恶性肿瘤的发生和发展密切相关.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
癌基因的激活和抑癌基因的失活是肿瘤研究的热点, 抑癌基因的失活被认为是肿瘤发生的重要机制之一. 另外, 印迹基因作为表观遗传学的研究内容也是近年研究的热点.
本文首次研究并确定ARHI基因在胃癌的表达缺失率, 初步探讨ARHI基因在胃癌组织的表达异常与胃癌患者临床病理特征之间的相关性, 为胃癌发病机制的研究提供了新的思路.
ARHI基因是母源性的抑癌印迹基因. 作为较特殊的抑癌基因, 其在胃癌中的研究将为胃癌发病机制、分子靶向治疗药物的开发和早期基因诊治方面提供新的思路和理论依据.
本文学术性较好, 具有一定的创新性和临床意义.
编辑: 李薇 电编:李薇
| 1. | Yu Y, Xu F, Peng H, Fang X, Zhao S, Li Y, Cuevas B, Kuo WL, Gray JW, Siciliano M. NOEY2 (ARHI), an imprinted putative tumor suppressor gene in ovarian and breast carcinomas. Proc Natl Acad Sci USA. 1999;96:214-219. [PubMed] [DOI] |
| 2. | Hisatomi H, Nagao K, Wakita K, Kohno N. ARHI/NOEY2 inactivation may be important in breast tumor pathogenesis. Oncology. 2002;62:136-140. [PubMed] [DOI] |
| 3. | Lu ZH, Chen J, Gu LJ, Luo YF, Gu CF. [ARHI mRNA and protein expression in pancreatic cancers]. Zhongguo Yixue Kexueyuan Xuebao. 2001;23:324-327. [PubMed] |
| 5. | Yang J, Hu A, Wang L, Li B, Chen Y, Zhao W, Xu W, Li T. NOEY2 mutations in primary breast cancers and breast hyperplasia. Breast. 2009;18:197-203. [PubMed] [DOI] |
| 6. | Yuan J, Luo RZ, Fujii S, Wang L, Hu W, Andreeff M, Pan Y, Kadota M, Oshimura M, Sahin AA. Aberrant methylation and silencing of ARHI, an imprinted tumor suppressor gene in which the function is lost in breast cancers. Cancer Res. 2003;63:4174-4180. [PubMed] |
| 7. | Yu Y, Fujii S, Yuan J, Luo RZ, Wang L, Bao J, Kadota M, Oshimura M, Dent SR, Issa JP. Epigenetic regulation of ARHI in breast and ovarian cancer cells. Ann N Y Acad Sci. 2003;983:268-277. [PubMed] [DOI] |
| 8. | Feng W, Marquez RT, Lu Z, Liu J, Lu KH, Issa JP, Fishman DM, Yu Y, Bast RC Jr. Imprinted tumor suppressor genes ARHI and PEG3 are the most frequently down-regulated in human ovarian cancers by loss of heterozygosity and promoter methylation. Cancer. 2008;112:1489-1502. [PubMed] [DOI] |
| 9. | Janssen EA, Øvestad IT, Skaland I, Søiland H, Gudlaugsson E, Kjellevold KH, Nysted A, Søreide JA, Baak JP. LOH at 1p31 (ARHI) and proliferation in lymph node-negative breast cancer. Cell Oncol. 2009;31:335-343. [PubMed] |
| 11. | Luo RZ, Peng H, Xu F, Bao J, Pang Y, Pershad R, Issa JP, Liao WS, Bast RC Jr, Yu Y. Genomic structure and promoter characterization of an imprinted tumor suppressor gene ARHI. Biochim Biophys Acta. 2001;1519:216-222. [PubMed] |
| 12. | Yu Y, Luo R, Lu Z, Wei Feng W, Badgwell D, Issa JP, Rosen DG, Liu J, Bast RC Jr. Biochemistry and biology of ARHI (DIRAS3), an imprinted tumor suppressor gene whose expression is lost in ovarian and breast cancers. Methods Enzymol. 2006;407:455-468. [PubMed] [DOI] |
| 13. | Huang J, Lin Y, Li L, Qing D, Teng XM, Zhang YL, Hu X, Hu Y, Yang P, Han ZG. ARHI, as a novel suppressor of cell growth and downregulated in human hepatocellular carcinoma, could contribute to hepatocarcinogenesis. Mol Carcinog. 2009;48:130-140. [PubMed] [DOI] |
| 14. | Weber F, Aldred MA, Morrison CD, Plass C, Frilling A, Broelsch CE, Waite KA, Eng C. Silencing of the maternally imprinted tumor suppressor ARHI contributes to follicular thyroid carcinogenesis. J Clin Endocrinol Metab. 2005;90:1149-1155. [PubMed] [DOI] |
| 15. | Lu Z, Luo RZ, Peng H, Rosen DG, Atkinson EN, Warneke C, Huang M, Nishmoto A, Liu J, Liao WS. Transcriptional and posttranscriptional down-regulation of the imprinted tumor suppressor gene ARHI (DRAS3) in ovarian cancer. Clin Cancer Res. 2006;12:2404-2413. [PubMed] [DOI] |
| 16. | Nishimoto A, Yu Y, Lu Z, Mao X, Ren Z, Watowich SS, Mills GB, Liao WS, Chen X, Bast RC Jr, Luo RZ. A Ras homologue member I directly inhibits signal transducers and activators of transcription 3 translocation and activity in human breast and ovarian cancer cells. Cancer Res. 2005;65:6701-6710. [PubMed] [DOI] |
| 17. | Zhang J, Li YH, Cui AR, Wang JL, Cheng JX, Wang SJ. [Expression and clinical relevance of ARHI, STAT3 and E2F1 in ovarian serous carcinoma]. Zhonghua Zhongliu Zazhi. 2008;30:905-909. [PubMed] |
| 18. | Huang S, Chang IS, Lin W, Ye W, Luo RZ, Lu Z, Lu Y, Zhang K, Liao WS, Tao T. ARHI (DIRAS3), an imprinted tumour suppressor gene, binds to importins and blocks nuclear import of cargo proteins. Biosci Rep. 2009;30:159-168. [PubMed] [DOI] |
| 19. | Dalai I, Missiaglia E, Barbi S, Butturini G, Doglioni C, Falconi M, Scarpa A. Low expression of ARHI is associated with shorter progression-free survival in pancreatic endocrine tumors. Neoplasia. 2007;9:181-183. [PubMed] [DOI] |
| 20. | Rosen DG, Wang L, Jain AN, Lu KH, Luo RZ, Yu Y, Liu J, Bast RC Jr. Expression of the tumor suppressor gene ARHI in epithelial ovarian cancer is associated with increased expression of p21WAF1/CIP1 and prolonged progression-free survival. Clin Cancer Res. 2004;10:6559-6566. [PubMed] [DOI] |
| 21. | Lu Z, Luo RZ, Lu Y, Zhang X, Yu Q, Khare S, Kondo S, Kondo Y, Yu Y, Mills GB. The tumor suppressor gene ARHI regulates autophagy and tumor dormancy in human ovarian cancer cells. J Clin Invest. 2008;118:3917-3929. [PubMed] |
| 22. | Amaravadi RK. Autophagy-induced tumor dormancy in ovarian cancer. J Clin Invest. 2008;118:3837-3840. [PubMed] |