修回日期: 2010-01-25
接受日期: 2010-02-01
在线出版日期: 2010-03-18
目的: 探讨生长抑素类似物奥曲肽(OCT)联合细胞毒化疗药物丝裂霉素(MMC)对胃癌细胞系SGC-7901的抑制作用.
方法: 体外培养人胃癌细胞株SGC-7901, 分别设空白组、对照组、OCT组、MMC组以及OCT+MMC组. 用MTT比色法观察对胃癌细胞生长的影响; 用免疫组织化学法分析对细胞凋亡调节基因Bcl-2表达的影响.
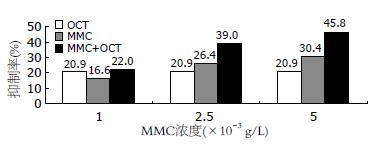
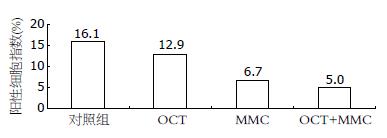
结果: 在OCT组中, 当浓度从1×10-9 g/L到1×10-3 g/L变化时, OCT对胃癌细胞均有抑制, 当OCT为1×10-5 g/L时, 其抑制作用最明显(20.9%, P<0.05). MMC随着浓度由1×10-4 g/L增加至1×10-2 g/L其抑制率也由14.1%增加至71.1%, 呈递增趋势. OCT联合MMC的抑制作用随着MMC浓度由1×10-3 g/L增加至5×10-3 g/L, 抑制率也由22%增加至45.8%(均P<0.05); 当MMC为5×10-3 g/L时, 联合治疗组优于单独给药组(54.8% vs 30.4%, P<0.05). OCT、MMC及OCT+MMC均可以下调Bcl-2的表达, 阳性细胞数分别为12.9%、6.7%和5.0%(均P<0.05), 其中OCT+MMC组下调作用最明显.
结论: OCT联合MMC可以增强对胃癌细胞的抑制作用, 联合应用可以减低MMC的剂量.
引文著录: 苏海燕, 刘文天, 王邦茂, 张文治, 苏心. 生长抑素类似物联合丝裂霉素对胃癌细胞的抑制作用. 世界华人消化杂志 2010; 18(8): 815-818
Revised: January 25, 2010
Accepted: February 1, 2010
Published online: March 18, 2010
AIM: To investigate the synergistic effects of somatostatin analogue octreotide (OCT) and chemotherapeutic drug mitomycin (MMC) on the growth of gastric cancer SGC-7901 cells.
METHODS: SGC-7901 cells were cultured in vitro and divided into four groups: control group, OCT group, MMC group and OCT plus MMC group. The proliferation of SGC-7901 cells was evaluated by methyl thiazolyl tetrazolium (MTT) assay. The expression of apoptosis-related protein Bcl-2 was measured by immunohistochemistry.
RESULTS: OCT at concentrations ranging from 1 × 10-9 g/L to 1 × 10-3 g/L could exert inhibitory effects on the growth of SGC-7901 cells. OCT at a concentration of 1 × 10-5 g/L achieved a reduced rate of cell proliferation of 20.9%, significantly higher than that in the control group (P < 0.05). The reduced rates of cell proliferation varied from 14.1% to 71.1% when the concentrations of MMC increased from 1 × 10-4 g/L to 1 × 10-2 g/L. OCT in combination with MMC showed a synergistic effect on the growth of SGC-7901 cells: the reduced rates of cell proliferation varied from 22% to 45.8% when the concentration of MMC increased from 1 × 10-3 g/L to 5 × 10-3 g/L (P < 0.05). The combined inhibitory effects of MMC and OCT were higher than that of MMC (5 × 10-3 g/L) alone (54.8% vs 30.4%, P < 0.05). The percentages of Bcl-2-positive cells were reduced in the OCT group, MMC group and OCT plus MMC group (12.9%, 6.7% and 5.0%, respectively). The percentage of Bcl-2-positive cells was significantly lower in the OCT plus MMC group than in the OCT group and MMC group (both P < 0.05).
CONCLUSION: OCT can enhance the inhibitory effects of MMC on the growth of SGC-7901 cells.
- Citation: Su HY, Liu WT, Wang BM, Zhang WZ, Su X. Octreotide enhances the inhibitory effects of mitomycin on the growth of gastric cancer SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 815-818
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/815.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.815
胃癌是消化系常见恶性肿瘤之一, 其发病率占所有恶性肿瘤的第1位, 近年我国胃癌死亡率呈上升趋势[1]. 手术是治疗胃癌的主要方法, 但其恶性程度高、转移早及多药耐药等问题常导致进展期胃癌术后复发和转移、远期疗效不理想, 因此化疗仍占有重要地位. 近年来, 生长抑素类似物(somatostatin analogue, SSTA)的抗肿瘤活性备受关注, 本文将着重研究OCT对胃癌细胞的抑制作用以及联合MMC的抗肿瘤效果.
人胃癌细胞株SGC-7901, 由本实验室提供. 标准胎牛血清(FBS)购自美国HycLone公司. 四甲基偶氮唑蓝(MTT)及二甲基亚砜(DMSO)购自美国Sigma公司. 胰蛋白酶购自美国Gibco公司. 丝裂霉素(MMC)购自协和发酵工业株式会社. SSTA-奥曲肽(OCT)由瑞士诺华公司提供.
1.2.1 细胞培养: 人胃癌细胞株SGC-7901培养于含100 g/L热灭活FBS的RPMI 1640培养基中, 在37 ℃、50 mL/L CO2及饱和湿度培养箱中培养.
1.2.2 MTT实验: 取对数生长期的人胃癌细胞株SGC-7901, 调整细胞浓度为1×104/mL, 接种于96孔培养板中, 每孔100 μL, 同时进行以下实验: (1)空白组, 不含细胞; (2)对照组, 含细胞不加药物; (3)OCT组, 每孔中加入OCT后其终浓度分别为1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8、1×10-9 g/L; (4)MMC组, 每孔中加入MMC后其终浓度分别为: 1×10-4、1×10-3、2.5×10-3、5×10-3、7.5×10-3、1×10-2 g/L; (5)OCT(1×10-5 g/L)+MMC组: MMC取小于IC50的3个浓度1×10-3、2.5×10-3和5×10-3 g/L. 每个浓度设8个平行复孔, 培养24 h后加入MTT(5 g/L)每孔15 μL, 再培养4 h, 弃去上清液, 每孔加入DMSO 150 μL, 震荡至MTT完全溶解, 酶联检测仪600 nm处测吸光度(A)值, 求抑制率. 抑制率 = (对照组A值-实验组A值)/对照组A值×100%.
1.2.3 免疫组织化学法测定Bcl-2蛋白在胃癌细胞的表达: 将实验分为对照组、OCT组(1×10-5 g/L)、MMC组(5×10-3g/L)和OCT+MMC组, 37 ℃, 50 mL/L CO2孵育箱中培育24 h后, PBS冲洗, 固定, 室温孵育, 血清封闭, 加鼠抗人P53单克隆抗体4 ℃过夜, 次日加入山羊抗小鼠IgG, 滴加SABC, 加入DAB-H2O2显色, 显微镜观察. 在Olympus倒置光学显微镜下Bcl-2阳性细胞呈棕黄或棕黑色, 与背景同色为阴性. 而后200倍显微镜下计数5个视野, 计算阳性细胞百分数.
统计学处理 实验数据均由3次以上独立的重复实验得出, 计量资料以mean±SD描述, 数据统计用SAS统计软件进行t检验、组间资料的方差分析及χ2检验, P<0.05具有统计学意义.
随着OCT浓度由1×10-9 g/L增加至1×10-5 g/L, 其抑制率由7.9%增加至20.9%, 再增加浓度至1×10-3 g/L其抑制率转而下降为14.3%. 当OCT为1×10-5 g/L时, 其A值与对照组相比有统计学差异(P<0.05).
随着MMC浓度由1×10-4 g/L增加至1×10-2 g/L其抑制率也由14.1%增加至71.1%, 呈递增趋势. 当MMC浓度为1×10-4 g/L时, 其A值与对照组相比无统计学差异(P>0.05), 余治疗组与对照组相比均有统计学差异(均P<0.05).
随着MMC浓度由1×10-3 g/L增加至5×10-3 g/L, MMC+OCT的抑制率也由22%增加至45.8%. 各治疗组与对照组相比均有统计学差异(均P<0.05).
当MMC为1×10-3 g/L时, OCT、MMC及OCT+MMC三者的抑制率之间无统计学差异(P>0.05); 当MMC为2.5×10-3 g/L时, OCT与MMC及MMC与OCT+MMC之间无统计学差异(P>0.05), 但OCT与OCT+MMC之间有统计学差异(P<0.05); 当MMC为5×10-3 g/L时, OCT与MMC之间无统计学差异(P>0.05), OCT+MMC与OCT及OCT+MMC与MMC之间均有统计学差异(均P<0.05, 图1).
OCT、MMC及OCT+MMC均可以下调Bcl-2的表达, MMC及OCT+MMC与对照组相比有统计学差异(P<0.05), 其中OCT+MMC组下调作用最明显(图2).
生长抑素(somatostatin, SST)是一种下丘脑及胃肠道D细胞分泌的神经肽类激素, 具有抑制脑垂体生长激素分泌、调节胃肠激素分泌、消化系外分泌以及胃肠内脏血流的作用. 天然SST的血浆半衰期较短(不超过3 min), 临床开发出几种SSTA, 其血浆半衰期约为120 min, 而且抑制生长激素从垂体释放的作用较SST强约50倍. 目前, SSTA已用于许多临床疾病的治疗, 例如: 垂体瘤、肝硬化食管静脉曲张出血以及急性胰腺炎等, 并取得良好疗效. 由于SST具有诱导癌细胞凋亡和抑制肿瘤细胞生长等作用, 应用SSTA治疗肿瘤, 特别是胃肠道肿瘤已成为一个研究热点[2,3]. OCT是目前临床中常用的SSTA.
生长抑素受体(somatostatin receptor, SSTR)在体内不仅存在于正常组织中, 多种肿瘤也表达SSTR, 这是应用SSTA治疗肿瘤的分子基础[4,5]. 大量研究显示[6-8], SSTA抗肿瘤机制包括(1)与存在于肿瘤细胞表面的SSTR结合后发挥的直接作用; (2)与存在于正常细胞表面的SSTR结合的间接作用. Denzler等报道, 在1例胃癌患者的肿瘤周围黏膜下层血管有成倍的SSTR表达, 而在来自食管或胰腺癌而没有胃部病变的对照组胃黏膜下层血管中SSTR表达就很少[9]. SSTR亚型的研究显示, 胃癌细胞膜上有SSTR3蛋白表达[10]. 还有研究显示胃癌肿瘤组织中存在5种SSTR亚型的表达, 并以SSTR2表达最为显著[11]. 胃癌细胞系SGC-7901是人低分化胃腺癌细胞, 细胞膜表达SSTR2、3[12,13]. 因此, 这为OCT治疗胃癌提供了可能. 间接的抗肿瘤作用是通过抑制GH/IGF-1轴, 从而抑制促肿瘤生长的细胞因子或激素(EGF、胰岛素、IGF-1、CCK等)的合成与分泌、抑制肿瘤血管的形成、诱导肿瘤细胞发生凋亡. Ferjoux等[14]认为受体亚型不同, SSTA抗增殖作用就会涉及不同的传导通路.
本研究显示, 单独应用OCT作用于胃癌细胞系SGC-7901, 随着浓度的增加其抑制率也增加, 但当其浓度达到1×10-5 g/L时, 其抑制率最大为20.9%, 再增加浓度其抑制率反而下降, 提示OCT对SGC-7901的抑制具有饱和性, 这也间接提示了SGC-7901表面存在与OCT结合的SSTR.
当OCT与MMC联合应用时, 其抑制率与两药单独应用相比有所增加. 随着MMC浓度由1×10-3 g/L增加至5×10-3 g/L时, 其抑制率由16.6%增加至30.4%, 联合OCT(1×10-5 g/L)后其抑制率由22.0%增至45.8%. 由实验结果可见, 1×10-5 g/L OCT及低浓度的MMC对SGC-7901的抑制无明显差异, 但当二者联合应用时, 轻度MMC浓度的增加, 可以导致对SGC-7901的明显抑制. 该结果显示, OCT可以增强 MMC对胃癌细胞的抑制作用, 联合应用可以使小剂量的MMC抑制作用增加, 因而减少MMC的不良反应.
Bcl-2是目前公认的调节细胞凋亡的重要基因之一, 其激活和过度表达能抑制细胞正常的凋亡, 延长细胞寿命, 使生理状态下细胞凋亡和增殖的动态平衡发生紊乱, 从而增加肿瘤发生的机会并促进肿瘤的发展. 有研究证实Bcl-2基因在胃癌中呈高表达[15,16]. 本研究结果显示, OCT可以下调Bcl-2的表达, 这可能是OCT抑制胃癌细胞生长的机制之一. OCT联合MMC后, 使其阳性细胞指数由6.7%下降至5.0%. 由此可见, OCT可协同MMC下调Bcl-2的表达, 减少Bcl-2对细胞凋亡的抑制, 进而达到抑制胃癌细胞生长的作用.
OCT是自身分泌的神经肽类激素, 有较低的毒性, 同时又具有一定的抗肿瘤特性; 细胞毒化疗药物具有抑制肿瘤细胞生长的作用, 但其存在抑制效率低、不良反应多的缺陷, 二者的联合应用则有可能增强作用效率、减少用药剂量, 从而减少不良反应, 本研究的结果初步显示了OCT与MMC联合应用的优势.
胃癌是消化系统常见的恶性肿瘤, 发病率、死亡率高, 手术和化疗是主要治疗手段. 但是由于恶性程度高、转移早以及术后复发和转移等, 远期疗效不理想. 化疗药物不良反应大, 患者耐受性差, 因此本课题组希望找到一种不良反应小、具有抗肿瘤活性的药物, 能够增强化疗药的作用.
宋于刚, 教授, 南方医科大学南方医院消化内科研究所
生长抑素类似物-奥曲肽(OCT)对胃癌抑制作用和机制的研究已有报道, 但是单独应用抑制率不高, 效果不明显. 因此本研究应用OCT联合丝裂霉素(MMC), 结果显示联合应用抑制率高于MMC单独用药, 其机制可能是通过下调细胞凋亡抑制基因Bcl-2的表达, 今后仍需要进一步的进行动物实验, 以明确其临床价值.
OCT具有抗肿瘤活性, 但其自身的抑癌活性较弱, 单独用药尚不能达到满意的疗效, 因此本课题组研究OCT联合经典的化疗药物MMC的作用, 探讨OCT是否具有化疗药增敏剂的作用, 并进一步从细胞凋亡调节基因Bcl-2表达上探讨了二者联合的机制和可能.
本研究从细胞水平探讨了OCT联合MMC对胃癌细胞的抑制作用, 为今后进一步的临床试验提供了细胞水平的应用基础.
本研究选题较好, 设计基本合理, 结果可靠, 学术价值较好.
编辑: 李瑞敏 电编:何基才
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连第, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况 分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 2. | Wängler C, Buchmann I, Eisenhut M, Haberkorn U, Mier W. Radiolabeled peptides and proteins in cancer therapy. Protein Pept Lett. 2007;14:273-279. [PubMed] [DOI] |
| 3. | Parry JJ, Eiblmaier M, Andrews R, Meyer LA, Higashikubo R, Anderson CJ, Rogers BE. Characterization of somatostatin receptor subtype 2 expression in stably transfected A-427 human cancer cells. Mol Imaging. 2007;6:56-67. [PubMed] |
| 4. | Guillermet-Guibert J, Lahlou H, Cordelier P, Bousquet C, Pyronnet S, Susini C. Physiology of somatostatin receptors. J Endocrinol Invest. 2005;28:5-9. [PubMed] |
| 5. | Reubi JC, Maecke HR. Peptide-based probes for cancer imaging. J Nucl Med. 2008;49:1735-1738. [PubMed] [DOI] |
| 6. | Charland S, Boucher MJ, Houde M, Rivard N. Somatostatin inhibits Akt phosphorylation and cell cycle entry, but not p42/p44 mitogen-activated protein (MAP) kinase activation in normal and tumoral pancreatic acinar cells. Endocrinology. 2001;142:121-128. [PubMed] [DOI] |
| 8. | 邹 奕, 肖 小平, 李 月琴, 张 欣, 周 天鸿. 生长抑素类似物通过细胞生长抑制和细胞溶解途径以SSTR2依赖的方式抑制癌 细胞增殖. 暨南大学学报(自然科学与医学版). 2009;30:325-330. |
| 9. | Denzler B, Reubi JC. Expression of somatostatin receptors in peritumoral veins of human tumors. Cancer. 1999;85:188-198. [PubMed] [DOI] |
| 10. | Hu C, Yi C, Hao Z, Cao S, Li H, Shao X, Zhang J, Qiao T, Fan D. The effect of somatostatin and SSTR3 on proliferation and apoptosis of gastric cancer cells. Cancer Biol Ther. 2004;3:726-730. [PubMed] |
| 14. | Ferjoux G, Bousquet C, Cordelier P, Benali N, Lopez F, Rochaix P, Buscail L, Susini C. Signal transduction of somatostatin receptors negatively controlling cell proliferation. J Physiol Paris. 2000;94:205-210. [PubMed] [DOI] |