修回日期: 2010-01-26
接受日期: 2010-02-01
在线出版日期: 2010-03-18
目的: 研究uPA、MMP-2、MMP-9、TGF-β1等侵袭转移相关因子在胃肠道间质瘤(GISTs)中的表达及其临床病理意义.
方法: 应用RT-PCR及Western blot法检测uPA、MMP-2、MMP-9、TGF-β1在124例GISTs中的表达.
结果: 在GISTs中, 随着NIH分级增高, uPA、MMP-2、MMP-9、TGF-β1的mRNA表达水平上调, 低、中、高危组有明显差异(P<0.05或0.01), 其阳性表达率与性别、年龄、组织学类型无关, 与肿瘤侵袭转移和黏膜受侵关系密切; 四者的蛋白表达水平与mRNA表达一致; uPA与TGF-β1蛋白阳性表达之间呈显著正相关(r = 0.356)、uPA与MMP-2、MMP-9蛋白阳性表达之间亦呈显著正相关(r = 0.323, 0.346).
结论: TGF-β1、uPA、MMP-2及MMP-9参与了GISTs的浸润和转移; TGF-β1可能通过上调uPA, 激活MMP-2及MMP-9, 进而降解细胞外基质.
引文著录: 赵毅, 王强, 邓鑫, 赵滢, 张天彪. 侵袭转移相关因子在胃肠道间质瘤中的检测及其意义. 世界华人消化杂志 2010; 18(8): 791-797
Revised: January 26, 2010
Accepted: February 1, 2010
Published online: March 18, 2010
AIM: To investigate the significance of expression of urokinase-type plasminogen activator (uPA), matrix metalloproteinase-2 (MMP-2), matrix metalloproteinase-9 (MMP-9) and transforming growth factor-β1 (TGF-β1) in gastrointestinal stromal tumors (GISTs).
METHODS: The expression of uPA, MMP-2, MMP-9 and TGF-β1 mRNAs and proteins in 124 GISTs specimens was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: In gastrointestinal stromal tumors, the mRNA expression of uPA, MMP-2, MMP-9 and TGF-β1 is closely correlated with tumor stage (NIH classification), mucosal invasion and lymphatic metastasis. The mRNA expression levels of uPA, MMP-2, MMP-9 and TGF-β1 were up-regulated with increasing tumor stage, showing significant differences among low-, moderate- and high-risk GISTs. The positive rates of uPA, MMP-2, MMP-9 and TGF-β1 mRNA expression was not correlated with age, sex and histological type. Similar results were obtained for the expression of uPA, MMP-2, MMP-9 and TGF-β1 proteins in GISTs. The expression of uPA protein is positively correlated with that of TGF-β1, MMP-2 and MMP-9 (r = 0.356, 0.323 and 0.346, respectively).
CONCLUSION: The positive activation of TGF-β1 in GISTs possibly up-regulates uPA expression which in turn activates MMP-2 and MMP-9. The activation of MMP-2 and MMP-9 may lead to the degradation of extracellular matrix degradation and promote tumor invasion and metastasis.
- Citation: Zhao Y, Wang Q, Deng X, Zhao Y, Zhang TB. Significance of expression of metastasis-related factors uPA, MMP-2, MMP-9 and TGF-β1 in gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 791-797
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.791
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是胃肠道最常见的间叶源性肿瘤, 占胃肠道肿瘤的1%-4%, 每年发病率约2/10万[1]. 过去对GISTs的组织发生、生物学行为、肿瘤的恶性程度都不十分明确, 给临床诊治带来了很多混淆. 近几年随着免疫组织化学、分子生物学、基因诊断和治疗的发展, GISTs诊断与治疗取得了很大的进展. 尽管如此, 与其他肿瘤相比, GISTs肿瘤性质不可预测性仍较为突出, 其生物学特征仍较难以评估, 如何控制肿瘤的侵袭与转移仍是其治疗目前面临的主要问题[2].
肿瘤的侵袭、转移依赖于肿瘤细胞具备的降解细胞外基质(extracellular matrix, ECM)及基底膜的能力, 而这一降解过程主要依靠蛋白水解酶来完成. 尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)和基质金属蛋白酶类(matrix metallo proteinase, MMPs)能有效地降解ECM, 参与肿瘤的侵袭及转移过程.
迄今为止, 关于GISTs侵袭转移相关因子的研究报道极少, 因此我们采用RT-PCR和Western blot方法检测GISTs组织中转化生长因子β(TGF-β1)、尿激酶型纤溶酶原激活因子uPA和基质金属蛋白酶MMP-2、MMP-9基因以及蛋白的表达, 以探讨其与GISTs侵袭转移的关系.
选择临床病理资料完整、随访结果确切的中国医科大学附属盛京医院1990/2007-02手术切除、病理证实的GISTs新鲜组织标本124例. 男64例、女60例, 年龄9-79(中位年龄54.3)岁. 其中肿瘤发生于胃62例(50.0%)、小肠28例(22.6%)、结直肠14例(11.3%)、食管9例(7.3%)、胃肠道外11例(8.9%, 其中网膜4例、肠系膜4例、后腹膜3例); 一抗为兔抗人购自美国Santa Cruz公司. 二抗为牛抗兔购自中山金桥生物公司.
1.2.1 GISTs的诊断标准: 常规形态符合GISTs诊断要点, 免疫组织化学CD117阳性确诊; 或者常规形态符合GISTs诊断要点, CD117阴性而CD34阳性确诊, 或者CD117、CD34阴性, 并且平滑肌肌动蛋白(SMA)、结蛋白(Desmin)、神经脊突细胞抗原(S-100)蛋白也均阴性, 排除平滑肌源性和神经源性肿瘤, 病理组织学形态符合GISTs而纳入本研究. 其中CD117阳性113例(91.1%)、CD34阳性109例(87.9%). 依据Fletcher等[3]提出的GISTs生物学行为分级标准进行分级(NIH分级): 肿瘤直径<2 cm和核分裂相<5/50 HPF为极低度侵袭危险性(Ⅰ级); 肿瘤直径2-5 cm和核分裂相<5/50 HPF为低度侵袭危险性(Ⅱ级); 肿瘤直径5-10 cm和核分裂相<5/50 HPF或肿瘤<5 cm和核分裂相6-10/50 HPF为中度侵袭危险性(Ⅲ级); 肿瘤直径>5 cm和核分裂相>5/50 HPF或肿瘤>10 cm和核分裂相>10/50 HPF为高度侵袭危险性(Ⅳ级). 本文124例GISTs中、除9例因其他原因死亡外, 其余115例随访资料完整, 随诊时间10-204 mo, 中位随访时间52 mo.
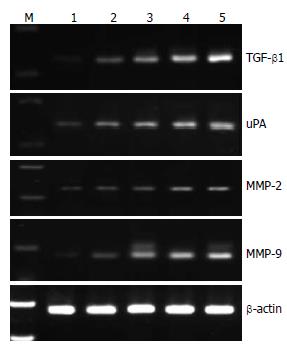
1.2.2 RT-PCR检测GISTs中uPA、MMP-2、MMP-9及TGF-β1的mRNA表达: 选择特异性引物序列分别为: uPA上游序列5'-ccatctacaggaggcaccg-3', 下游序列5'-gccaaactggggatcgttat-3'; MMP-2上游序列5'-ccccaaaacggacaaagagt-3', 下游序列5'-gcacgagcaaaggcatcat-3'; MMP-9上游序列5'-cgaactttgacagcgacaaga-3', 下游序列5'-agggcgaggaccatagagg-3'; TGF-β1上游序列5'-ctgctgtggctactggtgc-3', 下游序列5'-catagatttcgttgtgggtttc-3'; 内参照β-actin上游序列5'-aaatcgtgcgtgacattaa-3', 下游序列5'-ctcgtcatactcctgcttg-3'. PCR反应条件为95 ℃变性1 min, 52 ℃-57 ℃退火2 min, 72 ℃延伸10 min. 所有的标本都经过3次重复检测. 产物大小分别为347、315、212及322 bp. 将各目的基因的PCR反应产物在20 g/L的琼脂糖溴化乙锭凝胶上电泳, 采用UVP凝胶成像分析系统扫描测定PCR产物带的密度, 将各目的基因产物带所测得的密度值与内对照β-actin产物带的密度值进行比较, 各目的基因表达水平以与β-actin内对照比值的形式来表达.
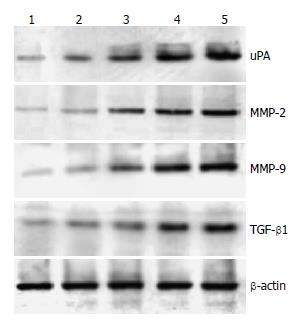
1.2.3 Western印迹法检测GISTs中uPA、MMP-2、MMP-9及TGF-β1的蛋白表达: 0.5 g GISTs加入1 mL细胞裂解缓冲液(cell signaling technology, Beverly, MA)及1 mmol的PMSF(苯甲基磺酰氟)匀浆. 按常规步骤提取蛋白, 测定蛋白浓度. 电泳前, 加入SDS样品缓冲液, 100 ℃煮沸5 min, 离心后上样, 12% SDS-PAGE分离, 然后将蛋白转至硝酸纤维素膜上, 一抗孵育, 碱性磷酸酶偶联的IgG作为二抗, O-dianidine及β-naphthyl acid phosphate作为碱性磷酸酶底物显色.
统计学处理 所有统计资料应用SPSS13.0软件包进行数据分析, 采用t检验和相关分析. 以P<0.05为差异有统计学意义.
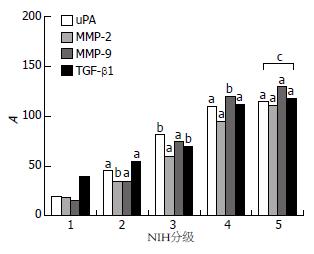
在124例GISTs患者中, TGF-β1 mRNA的表达随NIH分级而上调(P<0.05或0.01,图1), TGF-β1的阳性表达率与性别、年龄、组织学类型无关, 但与黏膜受侵和肿瘤侵袭转移均显著相关(P<0.05或0.01, 表1); 同时我们也发现uPA mRNA的表达随NIH分级上调(P<0.05或0.01, 图1), uPA的阳性表达率与性别、年龄、组织学类型无关, 与肿瘤侵袭转移和黏膜受侵显著相关(P<0.05或0.01, 表1); MMP-2、MMP-9 mRNA的表达随NIH分级上调(P<0.05或0.01, 图1), 其阳性表达率与性别、年龄、组织学类型无关, 但与黏膜受侵和肿瘤侵袭转移均显著相关(P<0.05或0.01, 表1). 各指标与临床病理特征之间的关系详见表1.
| 临床病理指标 | n | uPA | MMP-2 | MMP-9 | TGF-β1 |
| 性别 | |||||
| 男 | 65 | 0.7285±0.0801a | 0.4426±0.0575a | 0.5826±0.0641a | 0.6389±0.0792 |
| 女 | 59 | 0.7264±0.0872b | 0.4251±0.0510a | 0.6198±0.0806a | 0.6226±0.0770 |
| 年龄(岁) | |||||
| ≥55 | 70 | 0.7086±0.0921a | 0.4189±0.0503a | 0.6025±0.0723b | 0.6128±0.0735b |
| <55 | 54 | 0.7116±0.0996a | 0.4496±0.0540a | 0.6084±0.0791a | 0.6351±0.0714a |
| 组织学类型 | |||||
| 上皮样 | 28 | 0.7183±0.0791a | 0.4283±0.0474a | 0.6188±0.0804a | 0.6238±0.0772a |
| 梭形 | 73 | 0.7015±0.0842b | 0.4305±0.0689a | 0.5925±0.0770a | 0.6024±0.0904a |
| 混合型 | 23 | 0.7265±0.0799a | 0.4534±0.0589b | 0.6286±0.0817a | 0.6373±0.1024a |
| 肿瘤侵袭转移 | |||||
| 无 | 84 | 0.6297±0.0693a | 0.3206±0.0353a | 0.4827±0.0531a | 0.3429±0.0477b |
| 有 | 40 | 0.7502±0.0825ac | 0.4587±0.0551ac | 0.6482±0.0843ac | 0.7518±0.0456ac |
| 肿瘤旁组织 | 124 | 0.4302±0.0645 | 0.2749±0.0412 | 0.2357±0.0353 | 0.1928±0.0289 |
| NIH分级 | |||||
| 超低危 | 6 | 0.5555±0.0889bc | 0.3260±0.0522bc | 0.3450±0.0552bc | 0.3460±0.0554ad |
| 低危 | 20 | 0.6444±0.0709ac | 0.3673±0.0404ad | 0.5448±0.0599ad | 0.4881±0.0537ac |
| 中危 | 37 | 0.7063±0.0848ad | 0.4534±0.0544ac | 0.6132±0.0736ac | 0.6024±0.0723ad |
| 高危 | 61 | 0.7488±0.0899ac | 0.4552±0.0546bc | 0.6455±0.0775bc | 0.7336±0.0880bc |
| 黏膜受侵 | |||||
| 无 | 79 | 0.5986±0.0841a | 0.3341±0.0357a | 0.4752±0.0618a | 0.3829±0.0388a |
| 有 | 34 | 0.7134±0.0856a | 0.4592±0.0597a | 0.6382±0.0845ac | 0.7208±0.0963ac |
在124例GISTs患者中, TGF-β1蛋白的表达随NIH分级而上调, TGF-β1蛋白的阳性表达率随着肿瘤侵袭转移危险性的升高呈现逐渐升高的趋势(P<0.05或0.01, 图2, 3). TGF-β1蛋白的阳性表达率与性别、年龄、组织学类型无关, 但与黏膜受侵和肿瘤侵袭转移均显著相关(P<0.05或0.01); 同时我们也发现uPA蛋白的表达随NIH分级亦呈上调趋势(P<0.05或0.01, 图2, 3), uPA的阳性表达率亦与性别、年龄、组织学类型无关, 与黏膜受侵和肿瘤侵袭转移显著相关(P<0.05或0.01). MMP-2、MMP-9蛋白的表达也随着NIH分级的增加而上调(P<0.05或0.01, 图2, 3). 本研究的124例GISTs组织中, TGF-β1与uPA蛋白阳性表达之间呈显著正相关(r = 0.356, P = 0.036); TGF-β1与MMP-2、MMP-9蛋白阳性表达之间呈显著正相关(r = 0.266, P = 0.0031; r = 0.532, P = 0.0053); uPA与MMP-2、MMP-9蛋白阳性表达之间亦呈显著正相关(r = 0.323, P = 0.031; r = 0.346, P = 0.024).
肿瘤的侵袭和转移是牵涉多个分子生物学事件的极其复杂过程, 他是决定肿瘤恶性度的最重要因素[4]. 肿瘤转移过程涉及多种机制, ECM的降解和基底膜破坏是肿瘤浸润和转移的先决条件[5], ECM和基底膜既能为肿瘤的生长和转移提供酶作用底物, 同时又是肿瘤侵袭和转移的屏障[6]. 研究表明, 肿瘤细胞首先必须具备降解ECM及基底膜的能力, 然后通过已存在的或新形成的结合位点与ECM结合, 进而溶解ECM, 最后向外扩散、侵袭和转移至邻近组织及远处器官[7].
TGF-β家族是一组结构相关蛋白的异二聚体多肽, 能够通过与细胞膜上的TGF-β受体结合, 发挥信号传导作用[8]. 目前发现TGF-β至少包括5种亚型, 其中, TGF-β1是人体内的主要存在形式, 因此, 对TGF-β1的研究有助于我们进一步明确TGF-β在体内的生物学活性. 成熟的TGF-β1是由112个氨基酸亚单位通过二硫键形成的二聚体多肽, 相对分子质量为25 kDa. 主要在内皮细胞、血细胞、结缔组织细胞和上皮细胞中表达. TGF-β1作为生长因子, 具有调节细胞增殖、分化和凋亡等多种生物活性. 近年的研究表明, 他还在调节细胞增殖、分化、细胞外基质形成、细胞的移动、黏附、肿瘤转移等方面具有重要作用[9].
uPA由Astedt等首先发现, 其基因定位于10号染色体长臂上, 长度为6.5 kb, 编码相对分子质量为53 kDa的蛋白酶[10]. uPA是一种丝氨酸蛋白水解酶, 具有水解蛋白和信号转导等多种功能, 最重要的作用是激活纤溶酶原转变为纤溶酶, 后者可催化降解多种底物, 如细胞外基质的重要组成部分: 纤维蛋白、纤维结合素和层粘连蛋白等. 另外, 活性纤溶酶还能激活MMP-2、MMP-3、MMP-9和MMP-13等基质金属蛋白酶的前体, 活化的MMPs可进一步降解细胞外基质, 特别是降解其中的基质和Ⅳ型胶原, 对细胞迁移和肿瘤侵袭转移过程中细胞外基质的降解有重要作用[11]. 目前有大量研究证实uPA与乳腺癌及其他肿瘤转移密切相关[12], 但对于其表达与信号转导通路的关系目前研究较少.
许多学者通过对乳腺癌、胆囊癌、结肠癌[13-15]等肿瘤的研究发现, TGF-β1 mRNA的表达与肿瘤浸润深度、生长方式和肿瘤侵袭转移等生物学行为密切相关, 能在一定程度上促进肿瘤的侵袭和转移[16]. 本研究中, 124例GISTs均检测到TGF-β1 mRNA的表达, 且与年龄、性别及组织学类型无显著关系, 而与肿瘤侵袭转移、NIH分级及黏膜受侵有显著相关. 这一结果提示, GISTs中TGF-β1 mRNA的水平与GISTs的恶性表型有关. TGF-β1 mRNA水平高的病灶具有较强的纵深浸润和广泛转移的倾向和能力, 表现出较恶的生物学行为, 预后也较差[17-19], 可能是TGF-β1通过上调蛋白水解酶和其他细胞因子的分泌等机制, 增强了肿瘤的侵袭转移能力; 此外, TGF-β1本身还可作为一种运动因子, 促进肿瘤细胞的运动和迁移[20,21]. Bae等[22]研究结果显示, 胃癌组织内TGF-β1表达和血管生成之间无任何关系, 而另一血管生成因子VEGF与肿瘤内的MVD[23]有高度相关性, 认为其差异可能由TGF-β1首先通过刺激VEGF高表达间接影响肿瘤中血管生成而产生[24-26]. 有试验表明, TGF-β能以剂量和时间依赖的方式上调uPA mRNA和蛋白的表达, 促进转移[27,28], 而其上调uPA的作用主要是通过PI3K/Akt/NF-κB通路所介导的[29]. 本研究中发现: 随着GISTs组织中TGF-β1 mRNA表达的增高, uPA mRNA亦呈高表达, 其近肿瘤旁组织表达较弱. 且与TGF-β1 mRNA表达趋势一致, uPA mRNA阳性表达率在黏膜侵袭和肿瘤侵袭组显著增高, 与年龄、性别、组织学类型不相关. 此结果与我们观察到的TGF-β1 mRNA表达结果相同 同时二者的蛋白表达水平与mRNA表达水平一致, 提示TGF-β1可能介导uPA的上调; uPA在具有浸润能力的GISTs恶性肿瘤细胞中高表达, 表明uPA与GISTs的进展有关, 提示uPA可作为判断GISTs侵袭和转移的指标. uPA可以激活纤溶酶原转变为纤溶酶[30], 纤溶酶能激活MMP-2、MMP-3、MMP-9和MMP-13等MMPs的前体. 这些MMPs是一组Zn离子依赖性内肽酶, 可以降解所有ECM. 肿瘤细胞分泌的MMPs一方面通过降解基底膜和包绕肿瘤的基质(Ⅳ型胶原), 另一方面则通过新生血管生成等促进肿瘤生长和扩散, 从而促进肿瘤的浸润和转移[31]. 其中MMP-2, MMP-9与肿瘤浸润和转移关系最密切[32,33]. Bloomston等[34]通过基因转染, 将MMP-2基因转入人乳腺癌细胞株中, 发现转基因后的肿瘤细胞侵袭能力明显增加.
本试验中我们发现: MMP-2阳性表达与患者的年龄、性别及组织学分型无明显相关性, 而与肿瘤侵袭转移、NIH分级有关, 说明MMP-2参与了GISTs的浸润和转移, 与患者预后密切相关; 随着GISTs恶性程度的增高, MMP-9表达亦呈递增趋势, 结果提示MMP-2、MMP-9的过度表达可以降解细胞外基质及基底膜, 水解血管基底膜, 使血管通透性增高, 导致肿瘤的局部浸润和远处转移. 在GISTs中MMP-2与MMP-9的表达呈明显正相关, uPA和MMP-2、MMP-9表达之间呈明显正相关, 故我们猜测在GISTs中uPA在PI3K/Akt信号转导通路介导的TGF-β1调节下, 可进一步激活MMP-2和MMP-2同时也具有激活MMP-9的功能. 四者在GISTs的发生、发展过程中的密切相关, 协同促进GISTs肿瘤ECM的降解和肿瘤细胞的侵袭、转移.
肿瘤的侵袭和转移程度是影响预后的主要因素, uPA、MMP-2、MMP-9和TGF-β1四者之间相互调节、共同参与GISTs的发生发展. 因此, 我们认为uPA、MMP-2、MMP-9和TGF-β1的表达可能是GISTs恶性肿瘤生长、浸润、转移以及判断预后的重要指标. 以他们作为靶点, 抑制其表达可阻断肿瘤的转移通道, 进而治疗肿瘤改善预后.
胃肠道间质瘤(GISTs)是一类独立起源于胃肠道原始间质干细胞呈非定向分化的消化系间叶肿瘤, 占全部胃肠道恶性肿瘤的2.2%. GISTs主要发生血行转移, 极少经淋巴转移, 且其治疗措施单一, 手术治疗是其主要的治疗手段, 术后放化疗均不敏感. 研究GISTs的侵袭与转移对肿瘤的治疗具有重要意义.
张国梁, 主任医师, 天津市第一中心医院消化内科
TGF-β1作为生长因子, 具有调节细胞增殖、分化和凋亡等多种生物活性. 近年的研究表明, 他还在调节细胞增殖、分化、细胞外基质形成、细胞的移动、黏附、肿瘤转移等方面具有重要作用.
Desruisseau等通过对乳腺癌的研究发现, TGF-β1 mRNA的表达与肿瘤浸润深度、生长方式和肿瘤侵袭转移等生物学行为密切相关, 能在一定程度上促进肿瘤的侵袭和转移.
迄今为止, 关于GISTs侵袭转移相关因子的研究报道极少, 因此本研究采用RT-PCR和Western blot方法检测GISTs组织中TGF-β1、尿激酶型纤溶酶原激活因子uPA和基质金属蛋白酶MMP-2、MMP-9基因以及蛋白的表达, 以探讨其与GISTs侵袭转移的关系.
本研究选题较好, 新颖性强, 设计合理, 证据充足, 学术价值较好.
编辑: 李瑞敏 电编:何基才
| 1. | Nowain A, Bhakta H, Pais S, Kanel G, Verma S. Gastrointestinal stromal tumors: clinical profile, pathogenesis, treatment strategies and prognosis. J Gastroenterol Hepatol. 2005;20:818-824. [PubMed] |
| 3. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Int J Surg Pathol. 2002;10:81-89. [PubMed] [DOI] |
| 4. | Korfel A, Thiel E. Targeted therapy and blood-brain barrier. Recent Results Cancer Res. 2007;176:123-133. [PubMed] [DOI] |
| 5. | Stewart DA, Cooper CR, Sikes RA. Changes in extracellular matrix (ECM) and ECM-associated proteins in the metastatic progression of prostate cancer. Reprod Biol Endocrinol. 2004;2:2. [PubMed] [DOI] |
| 6. | Adler G. Has the biology and treatment of pancreatic diseases evolved? Best Pract Res Clin Gastroenterol. 2004;18 Suppl:83-90. [PubMed] [DOI] |
| 7. | Dumont N, Bakin AV, Arteaga CL. Autocrine transforming growth factor-beta signaling mediates Smad-independent motility in human cancer cells. J Biol Chem. 2003;278:3275-3285. [PubMed] [DOI] |
| 8. | De Crescenzo G, Hinck CS, Shu Z, Zúñiga J, Yang J, Tang Y, Baardsnes J, Mendoza V, Sun L, López-Casillas F. Three key residues underlie the differential affinity of the TGFbeta isoforms for the TGFbeta type II receptor. J Mol Biol. 2006;355:47-62. [PubMed] [DOI] |
| 9. | Yatsuya H, Tamakoshi A, Tamakoshi K, Hoshiyama Y, Fujino Y, Tokui N, Mizoue T, Kikuchi S, Sakata K, Hayakawa N. Lack of an association between serum level of transforming growth factor beta -1 and stomach cancer risk in the JACC study. Asian Pac J Cancer Prev. 2005;6:170-176. [PubMed] |
| 10. | Romer J, Nielsen BS, Ploug M. The urokinase receptor as a potential target in cancer therapy. Curr Pharm Des. 2004;10:2359-2376. [PubMed] [DOI] |
| 11. | Davis DR, Wilson K, Sam MJ, Kennedy SE, Mackman N, Charlesworth JA, Erlich JH. The development of cardiac fibrosis in low tissue factor mice is gender-dependent and is associated with differential regulation of urokinase plasminogen activator. J Mol Cell Cardiol. 2007;42:559-571. [PubMed] [DOI] |
| 12. | Yoon SY, Lee YJ, Seo JH, Sung HJ, Park KH, Choi IK, Kim SJ, Oh SC, Choi CW, Kim BS. uPAR expression under hypoxic conditions depends on iNOS modulated ERK phosphorylation in the MDA-MB-231 breast carcinoma cell line. Cell Res. 2006;16:75-81. [PubMed] [DOI] |
| 13. | Desruisseau S, Palmari J, Giusti C, Romain S, Martin PM, Berthois Y. Determination of TGFbeta1 protein level in human primary breast cancers and its relationship with survival. Br J Cancer. 2006;94:239-246. [PubMed] [DOI] |
| 14. | Pasini FS, Brentani MM, Kowalski LP, Federico MH. Transforming growth factor beta1, urokinase-type plasminogen activator and plasminogen activator inhibitor-1 mRNA expression in head and neck squamous carcinoma and normal adjacent mucosa. Head Neck. 2001;23:725-732. [PubMed] [DOI] |
| 15. | Liu S, Liang Y, Huang H, Wang L, Li Y, Li J, Li X, Wang H. ERK-dependent signaling pathway and transcriptional factor Ets-1 regulate matrix metalloproteinase-9 production in transforming growth factor-beta1 stimulated glomerular podocytes. Cell Physiol Biochem. 2005;16:207-216. [PubMed] [DOI] |
| 16. | Ylä-Outinen H, Aaltonen V, Björkstrand AS, Hirvonen O, Lakkakorpi J, Vähä-Kreula M, Laato M, Peltonen J. Upregulation of tumor suppressor protein neurofibromin in normal human wound healing and in vitro evidence for platelet derived growth factor (PDGF) and transforming growth factor-beta1 (TGF-beta1) elicited increase in neurofibromin mRNA steady-state levels in dermal fibroblasts. J Invest Dermatol. 1998;110:232-237. [PubMed] [DOI] |
| 17. | Xiangming C, Natsugoe S, Takao S, Hokita S, Ishigami S, Tanabe G, Baba M, Kuroshima K, Aikou T. Preserved Smad4 expression in the transforming growth factor beta signaling pathway is a favorable prognostic factor in patients with advanced gastric cancer. Clin Cancer Res. 2001;7:277-282. [PubMed] |
| 18. | Venkatasubbarao K, Ahmed MM, Mohiuddin M, Swiderski C, Lee E, Gower WR Jr, Salhab KF, McGrath P, Strodel W, Freeman JW. Differential expression of transforming growth factor beta receptors in human pancreatic adenocarcinoma. Anticancer Res. 2000;20:43-51. [PubMed] |
| 19. | Reinacher-Schick A, Baldus SE, Romdhana B, Landsberg S, Zapatka M, Mönig SP, Hölscher AH, Dienes HP, Schmiegel W, Schwarte-Waldhoff I. Loss of Smad4 correlates with loss of the invasion suppressor E-cadherin in advanced colorectal carcinomas. J Pathol. 2004;202:412-420. [PubMed] [DOI] |
| 20. | Hyman KM, Seghezzi G, Pintucci G, Stellari G, Kim JH, Grossi EA, Galloway AC, Mignatti P. Transforming growth factor- beta1 induces apoptosis in vascular endothelial cells by activation of mitogen-activated protein kinase. Surgery. 2002;132:173-179. [PubMed] [DOI] |
| 21. | Warner DR, Roberts EA, Greene RM, Pisano MM. Identification of novel Smad binding proteins. Biochem Biophys Res Commun. 2003;312:1185-1190. [PubMed] [DOI] |
| 22. | Bae SC, Choi JK. Tumor suppressor activity of RUNX3. Oncogene. 2004;23:4336-4340. [PubMed] [DOI] |
| 23. | 牛 保华, 皇甫 超申, 赵 卫. CD105及微血管密度与胃癌的关系. 河南大学学报(医学版). 2008;27:24-25. |
| 24. | Kalo E, Buganim Y, Shapira KE, Besserglick H, Goldfinger N, Weisz L, Stambolsky P, Henis YI, Rotter V. Mutant p53 attenuates the SMAD-dependent transforming growth factor beta1 (TGF-beta1) signaling pathway by repressing the expression of TGF-beta receptor type II. Mol Cell Biol. 2007;27:8228-8242. [PubMed] [DOI] |
| 25. | Benckert C, Jonas S, Cramer T, Von Marschall Z, Schäfer G, Peters M, Wagner K, Radke C, Wiedenmann B, Neuhaus P. Transforming growth factor beta 1 stimulates vascular endothelial growth factor gene transcription in human cholangiocellular carcinoma cells. Cancer Res. 2003;63:1083-1092. [PubMed] |
| 26. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] |
| 27. | Unlü A, Leake RE. Transforming growth factor beta1 stimulates urokinase plasminogen activator system on prostate cancer cells. Int J Biol Markers. 2003;18:147-151. [PubMed] |
| 28. | Tan X, Egami H, Nozawa F, Abe M, Baba H. Analysis of the invasion-metastasis mechanism in pancreatic cancer: involvement of plasmin(ogen) cascade proteins in the invasion of pancreatic cancer cells. Int J Oncol. 2006;28:369-374. [PubMed] |
| 29. | Tanaka Y, Kobayashi H, Suzuki M, Kanayama N, Terao T. Transforming growth factor-beta1-dependent urokinase up- regulation and promotion of invasion are involved in Src-MAPK-dependent signaling in human ovarian cancer cells. J Biol Chem. 2004;279:8567-8576. [PubMed] [DOI] |
| 30. | Belkacemi L, Lam E, Caldwell JD, Siemens DR, Graham CH. Stimulation of human breast carcinoma cell invasiveness and urokinase plasminogen activator activity by glucose deprivation. Exp Cell Res. 2006;312:1685-1692. [PubMed] [DOI] |
| 31. | Kinoh H, Inoue M. New cancer therapy using genetically-engineered oncolytic Sendai virus vector. Front Biosci. 2008;13:2327-2334. [PubMed] [DOI] |
| 32. | Quaranta M, Daniele A, Coviello M, Venneri MT, Abbate I, Caringella ME, Di Tardo S, Divella R, Trerotoli P, Di Gennaro M. MMP-2, MMP-9, VEGF and CA 15.3 in breast cancer. Anticancer Res. 2007;27:3593-3600. [PubMed] |
| 33. | Kurakata H, Oka M, Matsubara Y, Niwa T, Utsunomiya H, Fujishiro M, Miki K, Fukamachi H, Kubota S, Ichinose M. Developmentally regulated expression of matrix metalloproteinases during fetal rat colon morphogenesis. Dev Growth Differ. 2008;50:41-48. [PubMed] |
| 34. | Bloomston M, Zervos EE, Rosemurgy AS 2nd. Matrix metalloproteinases and their role in pancreatic cancer: a review of preclinical studies and clinical trials. Ann Surg Oncol. 2002;9:668-674. [PubMed] [DOI] |