修回日期: 2010-01-18
接受日期: 2010-01-26
在线出版日期: 2010-03-18
目的: 研究p14ARF基因甲基化及蛋白表达在直肠癌中的作用, 探讨p14ARF基因与直肠癌生物学行为的关系.
方法: 采用MSP方法(甲基化特异性PCR)检测30例直肠癌组织、腺瘤组织、正常黏膜组织p14ARF基因甲基化情况. 采用RT-PCR方法(半定量逆转录PCR)检测p14ARF基因在大肠癌组织、腺瘤组织、正常黏膜组织中的表达情况及采用免疫组织化学法(SP法)检测p14ARF蛋白在这些组织中的表达情况. 然后用t检验及卡方检验对其数据进行分析.
结果: p14ARF基因在30例直肠癌组织、腺瘤组织、直肠正常黏膜组织中表达量分别为0.283±0.011, 0.721±0.023, 0.958±0.015. 直肠癌组织中p14AR基因表达低于腺瘤组织(P<0.05), 明显低于直肠正常黏膜组织(P<0.01), 三者差异有统计学意义(P<0.05). p14ARF蛋白在30例直肠癌组织、腺瘤组织、正常黏膜组织中表达率分别为20.0%、56.7%、76.7%. p14ARF蛋白在正常组织中的表达高于直肠腺瘤(P<0.05), 明显高于直肠癌组织(P<0.01); p14ARF甲基化在30例直肠癌组织、腺瘤组织、正常黏膜组织中表达率分别为46.6%、20.0%、0.0%. 三者差异有统计学意义. p14ARF基因甲基化与直肠癌分化程度及淋巴转移密切相关(P<0.05).
结论: p14ARF甲基化可能参与了直肠腺瘤-腺癌的演变过程, 可能是直肠癌发生的早期事件. p14ARF甲基化状态可作为直肠癌患者早期诊断的一个生物学指标.
引文著录: 熊超亮, 黄缘. p14ARF基因甲基化及蛋白表达在直肠癌中的作用. 世界华人消化杂志 2010; 18(8): 786-790
Revised: January 18, 2010
Accepted: January 26, 2010
Published online: March 18, 2010
AIM: To investigate p14ARF (alternative reading frame) methylation and expression in colorectal cancer and to analyze their relationship with the biological behavior of colorectal cancer.
METHODS: The methylation-specific polymerase chain reaction (MSP) method was used to detect p14ARF gene methylation in 30 colorectal cancer specimens, 30 colorectal adenoma specimens, and 30 normal mucosa specimens. The expression of p14ARF mRNA and protein in these specimens was detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively.
RESULTS: The expression level of p14ARF mRNA in colorectal cancer was not only lower than that in colorectal adenoma (0.283 ± 0.011 vs 0.721 ± 0.023, P < 0.05) but also significantly lower than that in normal mucosa tissue (0.283 ± 0.011 vs0.958 ± 0.015, P < 0.01). Similar results were also obtained for the positive rate of p14ARF protein expression (20.0% vs56.7%, P < 0.05; and 20.0% vs 76.7%, P < 0.01). The methylation rates of the p14ARF gene were 46.6%, 20.0% and 0.0% in colorectal cancer, colorectal adenoma and normal mucosa tissue, respectively, with significant differences among the three groups. The methylation of p14ARF is correlated with cancer differentiation and lymph node metastasis (both P < 0.05).
CONCLUSION: The methylation of p14ARF may be involved in the evolution of colorectal cancer and may be an early event in the carcinogenesis of colorectal cancer. Therefore, p14ARF methylation may be used as a marker for early diagnosis of colorectal cancer.
- Citation: Xiong CL, Huang Y. Methylation and expression of p14ARF in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 786-790
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/786.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.786
目前随着DNA翻译后修饰的表观遗传学研究发展, 人们发现DNA甲基化与肿瘤发生的关系越来越密切, 在许多肿瘤中存在一个或多个肿瘤抑制基因的CpG岛的甲基化, 由于甲基化可使这些关键基因表达失活, 功能丧失, 从而导致了肿瘤的发生[1,2]. 研究发现跟其他遗传学改变方式不同的是启动子区甲基化具有可逆性, 这就使的甲基化造成的基因沉默可由去甲基化试剂恢复其表达成为一种可能, 这为临床抗肿瘤化疗无疑开辟了了一条新的道路[3-5]. 因此现在研究抑癌基因的甲基化越来越受到人们的关注, 研究5'启动子区CpG岛甲基化已成为当今研究肿瘤分子生物学的热点. 我们研究p14ARF基因甲基化及蛋白表达在直肠癌中的作用, 无论是在对直肠癌发生机制的理论研究, 还是在对直肠癌早期诊治、预后判断的临床研究都具有重要的意义.
收集南昌大学第二附属医院2008-2009年直肠腺癌手术标本30例, 其中中分化20例, 低分化10例, 年龄40-75(平均57.4)岁, 男17例, 女13例, 所有癌标本术前未进行化疗、放疗. 到内镜室收集30例直肠腺瘤组织、30例正常黏膜组织对照. 腺瘤组织中绒毛状腺瘤15例, 管状腺瘤15例, 年龄30-75(平均51.3)岁, 男18例, 女12例. 正常直肠黏膜组织, 年龄30-72(平均48.7)岁, 其中男15例, 女15例. 试剂: TRIzol RNA试剂盒, 逆转录试剂盒, 2×TaqPCR MasterMix, DNA Marker DL600, 蛋白酶K, Wizard DNA Clean-up试剂盒, 鼠抗人p14ARF单克隆抗体, SP试剂盒, DAB显色试剂盒等.
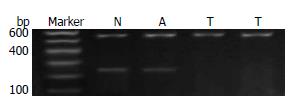
1.2.1 甲基化特异性PCR: (1)采用蛋白酶K消化、酚一氯仿抽提法提取基因组DNA. (2)DNA纯化及修饰: DNA纯化用Wizard clean-up systerm试剂盒纯化. 具体步骤按说明书进行. DNA亚硫酸氢盐修饰: 取2 µL DNA, 加入50 µL灭菌双蒸水, 加3 mol/L的NaOH 3.3 µL, 37 ℃变性15 min, 加10 mol/L对苯二酚30 mL和3 mol/L亚硫酸氢钠520 µL混匀, 加200 µL液状石蜡封闭, 锡纸包裹55 ℃水浴16 h. (3)甲基化特异性PCR: 取纯化及修饰后DNA 2 µL加入目的基因上下游引物各1 µL, 2×Taq PCR MasterMix 12.5 µL, 无核酶水8.5 µL建立25 µL反应体系行PCR扩增. 甲基化p14ARF引物: 5'-GTGTTAAAGGGCGGCGTAGC-3', 5'-AAAACCCTCACTCGCGACGA-3'; 扩增条件: 95 ℃预变性5 min, 94 ℃ 45 s, 54 ℃ 45 s, 72 ℃ 1 min, 35个循环, 72 ℃再延伸7 min; 非甲基化p14ARF引物: 5'-TTTTTGGTGTTAAAGGGTGGTGTAGT-3', 5'-CACAAAAACCCTCACTCACAACAA-3'; 扩增条件: 95 ℃预变性5 min, 94 ℃ 45 s, 60 ℃ 45 s, 72 ℃ 1 min, 35个循环, 72 ℃再延伸7 min; PCR扩增产物鉴定: 各取上述产物10 µL在2%的琼脂糖凝胶上电泳观察结果, p14ARF基因甲基化条带大小为122 bp, 未甲基化条带为132 bp; 结果判定: MSP产物电泳时只出现未甲基化条带, 样本计为未甲基化; 出现甲基化条带, 无论是否出现未甲基化条带, 均为甲基化.
1.2.2 半定量逆转录PCR: (1)用TRIzol试剂分别提取直肠癌组织和腺瘤组织、正常直肠黏膜组织的总RNA(A260/A280均在1.8-2.0). (2)用逆转录酶和Olingo(dT)合成cDNA, 严格按逆转录试剂盒说明步骤进行. (3)基因组扩增(PCR): 取上述产物2 μL依次加入目的基因上下游引物各1 μL, 2×TaqPCR MasterMix 12.5 μL无核酶水8.5 μL建立25 μL反应体系, 行PCR扩增: 内参β-actin基因引物: 正义: 5'-CCAGGCACCAGGGCGTGATGGTGGGCATGG-3', 反义: 5'-AGCAGCCGTGGCCATCTCTTGCTCGAAGTC-3'; p14ARF基因引物: 正义: 5'-GGTTTTCGTGGTTCACATCC-3', 反义: 5'-CAGGAAGCCCTCCCGGGCA-3'; 扩增条件: 95 ℃预变性5 min; 94 ℃变性45 s, 56 ℃退火45 s, 72 ℃延伸45 s, 30个循环; 72 ℃末次延伸5 min. (4)电泳鉴定: 各取上述产物5 μL在2%的琼脂糖凝胶上电泳, 在紫外下观察条带并用凝胶成像系统分析, p14ARF基因条带大小为254 bp, 内参β-actin基因为581 bp, PCR产物量以光密度/面积表示, 以p14ARF基因产物量/β-actin产物量的比值作为表达结果.
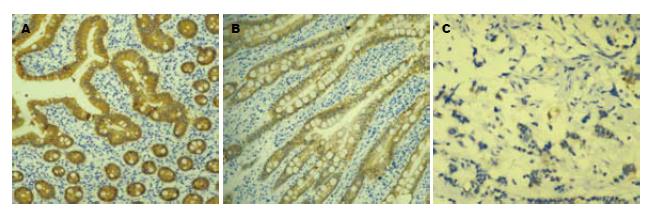
1.2.3 免疫组织化学法: (1)采用免疫组织化学SP法, 具体实验步骤按免疫组织化学试剂盒说明书进行, 用PBS代替一抗做阴性对照. (2)结果判定: p14ARF蛋白阳性反应主要定位于细胞核, 参照Sulzers分级法, 阴性(-): 阳性细胞<10%; 阳性(+): 阳性细胞数10%-50%; 强阳性(++): 阳性细胞数>50%.
统计学处理 采用t检验对RT-PCR数据; χ2检验对甲基化及免疫组织化学相关数据进行分析, 检验显著性水准取α = 0.05, 以P<0.05为有统计学意义. 数据由SPSS13.0统计软件处理.
在30例直肠癌组织中有14例(46.67%)发生了p14ARF基因甲基化, 30例直肠腺瘤组织中有6例(20%)发生了p14ARF基因甲基化, 30例正常黏膜组织中有0例(0%)发生甲基化. 他们之间两两比较差异均存在统计学意义(P<0.05, 图1, 表1).
| 分组 | p14ARF | χ2值 | P值 | |
| 甲基化 | 非甲基化 | |||
| 直肠癌组织 | 14 | 16 | 18.26 | <0.01 |
| 正常黏膜组织 | 0 | 30 | 4.63 | <0.05 |
| 直肠腺瘤组织 | 6 | 24 | 4.80 | <0.05 |
p14ARF基因mRNA在直肠癌组织中基本不表达, 在直肠腺瘤组织中可见表达, 在直肠正常黏膜组织中明显表达. 正常黏膜组织mRNA表达量(0.958±0.015)高于腺瘤组织(0.721±0.023)(P<0.05), 明显高于肿瘤组织组织(0.283±0.011)(P<0.01, 图2).
p14ARF蛋白在直肠癌组织中表达率为20%(6/30), 在腺瘤组织中表达率为56.67%(17/30), 在直肠正常黏膜组织中表达率为76.67%(23/30), 他们三者之间差异均存在统计学意义(P<0.05, 图3, 表2).
| 分组 | p14ARF | χ2值 | P值 | |
| 阳性 | 阴性 | |||
| 直肠癌组织 | 6 | 24 | 19.28 | <0.01 |
| 正常黏膜组织 | 23 | 7 | 6.16 | <0.05 |
| 直肠腺瘤组织 | 17 | 13 | 8.53 | <0.05 |
p14ARF甲基化与直肠癌发生关系密切, 在直肠癌临床病理特点中, p14ARF甲基化与直肠癌患者年龄、性别、肿瘤大小无关; 但与肿瘤分化程度及淋巴转移呈正相关, 分化程度越低, p14ARF甲基化程度相对越高(表3).
| 临床病理参数 | n | p14ARF甲基化 | 甲基化率(%) | P值 | |
| + | - | ||||
| 性别 | |||||
| 男 | 17 | 8 | 9 | 47.1 | >0.05 |
| 女 | 13 | 6 | 7 | 46.1 | |
| 年龄(岁) | |||||
| ≤50 | 11 | 5 | 6 | 45.4 | >0.05 |
| >50 | 19 | 9 | 10 | 47.4 | |
| 肿瘤大小(cm) | |||||
| ≤3 | 12 | 6 | 6 | 50.0 | >0.05 |
| >3 | 18 | 8 | 10 | 44.4 | |
| 分化程度 | |||||
| 中分化 | 20 | 6 | 14 | 30.0 | <0.05 |
| 低分化 | 10 | 8 | 2 | 80.0 | |
| 淋巴结转移 | |||||
| 无 | 18 | 7 | 11 | 38.9 | <0.05 |
| 有 | 12 | 7 | 5 | 58.3 | |
直肠癌是人类最常见的恶性肿瘤之一, 占大肠癌发病率中70%以上, 且随人们生活习惯、饮食结构及环境的改变, 发病率有逐年上升趋势[6]. 现代分子生物学研究证实肿瘤的发生是一个多基因、多因素、多阶段参与的复杂过程, 涉及各种抑癌基因的失活及癌基因的激活, 同时凋亡调节基因、DNA修复调节基因和端粒等也在其中发挥着重要的作用. p14ARF基因作为人体一种重要抑癌基因, 在正常细胞生长周期调控中起着重要作用.
ARF基因位于人染色体9p21, 通过可变阅读框, 编码两种蛋白质: p16INK4a和p14ARF. p14ARF含有2个外显子, 即Exon1β和Exon2. p14ARF蛋白是一种核蛋白, 蛋白折叠产生一个由5个大约32个氨基酸残基锚蛋白袢重复组成的椭圆形分子. 该蛋白相对十分稳定, 半衰期接近6 h, 主要经过蛋白酶体途径降解. p14ARF基因通过减弱mdm2介导的p53基因降解而起作用, 形成了人类正常细胞生长周期调控的p53依赖性通路, 并在此通路中扮演着源头开关作用. p14ARF基因通过加速癌基因mdm2表达蛋白的降解, 能恢复和稳定细胞野生型p53水平, 增强p53的G1/S卡点效应, 抑制细胞生长[7]. 从我们的研究中可以看到: p14ARF基因及蛋白表达在直肠癌、直肠腺瘤、直肠正常黏膜组织中均存在明显差异, 在直肠癌表达中低于直肠腺瘤(P<0.05), 明显低于直肠黏膜正常组织(P<0.01). 这说明p14ARF基因在维持直肠正常黏膜细胞生长周期中起着十分重要的作用, 他的存在有效地抑制了直肠癌的发生. 而各种原因引起p14ARF基因的异常表达, 使p14ARF基因丧失了对正常细胞生长周期的调控, 致p53依赖性通路失效, p53不能抑制细胞发生凋亡, 细胞生长失控, 从而导致肿瘤的发生. 目前, 在很多肿瘤中发现有p14ARF基因表达异常, 常见于非小细胞肺癌、胃癌、神经胶质瘤、白血病和黑色素瘤, 这也说明p14ARF基因异常表达与多种肿瘤发生关系密切[8]. 作为抑癌基因, p14ARF基因失活方式主要包括基因的甲基化、基因缺失和突变[9]. 而近年来随着表观遗传学的兴起, 人们发现DNA甲基化是表观遗传学的主要方式之一, 许多肿瘤存在一个或多个抑癌基因的CpG岛的甲基化. 5'启动子区CpG岛富含C-G对, 此区高度甲基化可影响启动子功能, 导致基因表达受影响, 在癌变过程中发挥着主要作用[10]. 本研究发现p14ARF基因甲基化同样存在于直肠癌中. 我们的研究显示: 30例直肠癌组织中有14例(46.67%)发生了p14ARF基因甲基化, 30例直肠腺瘤组织中有6例(20%)发生了甲基化, 30例正常黏膜组织中有0例(0%)发生甲基化. 他们之间两两比较差异均存在统计学意义(P<0.05). 这说明p14ARF基因甲基化在直肠癌、直肠腺瘤、直肠正常黏膜组织中3组之间明显存在差异, 在直肠癌中呈现高甲基化状态, 甲基化率可高达46.67%, 而腺瘤组织也存在部分甲基化(甲基化率为20%), 且p14ARF基因甲基化与直肠癌肿瘤分化有关(P<0.05), 而与直肠癌患者性别、年龄、及肿瘤大小无关(P>0.05), 这说明p14ARF基因甲基化可能参与了直肠癌由腺瘤演变为腺癌的形成过程, 可能是直肠癌发生中的早期事件. 我们的研究还显示: p14ARF基因甲基化不仅与肿瘤分化程度呈正相关, 与直肠癌淋巴转移也存在正相关, 这说明p14ARF基因甲基化可能也参与了直肠癌的转移机制, 也可能是因为直肠癌组织分化程度低、恶性程度更高、侵袭性更强, 以致更容易发生早期转移. 我们还研究了下直肠癌中p14ARF基因甲基化与p14ARF蛋白表达的关系, 我们发现有14例p14ARF基因甲基化的直肠癌组织4例发生了p14ARF蛋白阳性表达, 其解释原因可能是部分甲基化只发生在单等位基因上, 而另一等位基因未发生甲基化, 故能编码蛋白表达. 而16例未发生p14ARF基因甲基化直肠癌组织有14例p14ARF蛋白阴性表达. 这说明可能还有其他p14ARF基因失活方式参与直肠癌的形成, 如突变、缺失等.
总之, 我们通过研究p14ARF基因甲基化及蛋白表达在直肠癌中的作用, 探讨直肠癌发生发展的分子机制, 检测p14ARF基因甲基化状态可作为直肠癌患者早期诊断或判断预后的一个生物学指标. 如果我们能通过对直肠癌中p14ARF甲基化进行干扰, 寻找合适的去甲基化试剂使直肠癌甲基化基因恢复去甲基化状态, 从可以在源头上防止p14ARF甲基化对直肠癌产生的影响, 这将为临床药物抗肿瘤治疗及基因干扰治疗提供了一种可能, 开辟一条新的重要途径.
目前表观遗传学在肿瘤中的作用机制研究越来越成为热点, 也为预防肿瘤发生, 进行肿瘤基因治疗提供了新的思路. 目前, 在很多肿瘤中发现了p14ARF基因表达异常, 但研究直肠腺瘤-癌演变过程p14ARF甲基化情况较少, p14ARF基因恢复去甲基化状态治疗直肠癌尚处在临床研究阶段.
李华山, 主任医师, 中国中医科学院广安门医院肛肠科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
目前研究认为p14ARF基因表达异常与多种肿瘤的发生及转移有关, 相关分子机制的研究中还有不少问题需要一步阐明: (1)p14ARF基因表达失活形式有多种, 他们是不是单一作用于肿瘤发生过程. (2)p14ARF甲基化在直肠腺瘤-癌演变生物学行为中涉及的信号通路及与其他癌基因及抑癌基因的相互作用如何; (3)用去甲基化试剂使p14ARF基因恢复去甲基化状态对抑制直肠癌发生、发展价值有多大, 去甲基化过程相关机制如何.
已有多项研究支持p14ARF基因在肿瘤发生过程中发挥抑制性调节作用, 目前对其可能的机制研究主要包括如何参与正常细胞生长周期调控及异常表达对肿瘤细胞的成瘤、侵袭、转移能力影响等. 不少研究认为p14ARF基因在肿瘤组织中表达缺失与p14ARF基因甲基化水平有关.
p14ARF基因是人类最重要的正常细胞生长周期调控基因之一, 关于p14ARF基因失活与肿瘤的关系研究很多, 但迄今关于p14ARF基因甲基化在直肠腺瘤-癌演变过程中的相关作用报道尚少.
本研究表明p14ARF基因甲基化是直肠癌发生过程中的重要分子事件, 检测p14ARF基因甲基化状态可作为直肠癌患者早期诊断或判断预后的一个生物学指标. 恢复p14ARF基因去甲基化状态可能成为直肠癌治疗的一种重要手段.
本研究选题较好, 思路清晰, 结构完整, 有一定的临床意义.
编辑: 李军亮 电编:何基才
| 1. | Luczak MW, Jagodziński PP. The role of DNA methylation in cancer development. Folia Histochem Cytobiol. 2006;44:143-154. [PubMed] |
| 2. | Mosskalev EA, Eprintsev AT, Hoheisel JD. [DNA methylation profiling in cancer: from single nucleotides towards methylome]. Mol Biol (Mosk). 2007;41:793-807. [PubMed] |
| 3. | Karpf AR, Jones DA. Reactivating the expression of methylation silenced genes in human cancer. Oncogene. 2002;21:5496-5503. [PubMed] [DOI] |
| 4. | Ghoshal K, Bai S. DNA methyltransferases as targets for cancer therapy. Drugs Today (Barc). 2007;43:395-422. [PubMed] [DOI] |
| 5. | Palii SS, Van Emburgh BO, Sankpal UT, Brown KD, Robertson KD. DNA methylation inhibitor 5-Aza-2'-deoxycytidine induces reversible genome-wide DNA damage that is distinctly influenced by DNA methyltransferases 1 and 3B. Mol Cell Biol. 2008;28:752-771. [PubMed] [DOI] |
| 6. | Sung JJ, Lau JY, Goh KL, Leung WK. Increasing incidence of colorectal cancer in Asia: implications for screening. Lancet Oncol. 2005;6:871-876. [PubMed] [DOI] |
| 7. | Gallagher SJ, Kefford RF, Rizos H. The ARF tumour suppressor. Int J Biochem Cell Biol. 2006;38:1637-1641. [PubMed] [DOI] |
| 8. | Pimkina IuS, Dorosevich AE. [Role of the tumor suppressor ARF in oncogenesis]. Arkh Patol. 2009;71:60-63. [PubMed] |
| 9. | Watanabe T, Nakamura M, Yonekawa Y, Kleihues P, Ohgaki H. Promoter hypermethylation and homozygous deletion of the p14ARF and p16INK4a genes in oligodendrogliomas. Acta Neuropathol. 2001;101:185-189. [PubMed] |
| 10. | Boland CR, Shin SK, Goel A. Promoter methylation in the genesis of gastrointestinal cancer. Yonsei Med J. 2009;50:309-321. [PubMed] [DOI] |