修回日期: 2010-01-18
接受日期: 2010-02-09
在线出版日期: 2010-03-18
目的: 探讨并对比PCNA、c-Myc、cdc2 k shRNA对PC的过度增殖和成石潜力的影响, 以期筛选PC抗增殖治疗的最佳靶点.
方法: 经十二指肠乳头向胆总管内逆行插入尼龙缝合线建立慢性增生性胆管炎的大鼠实验模型. 三种反义治疗组则以尼龙缝合为导引向胆总管内分别注入0.5 mL的PCNA、c-Myc或cdc2 k shRNA.
结果: PCNA shRNA治疗组的胆道黏膜上皮和胆管壁胶原纤维的过度增殖程度均明显低于c-Myc、cdc2 k shRNA治疗组; 此外, PCNA shRNA治疗组胆管壁的黏蛋白基因表达及黏蛋白分泌也低于c-Myc、cdc2 k shRNA治疗组.
结论: PCNA shRNA治疗能够更为有效的抑制PC病变胆管的胶原纤维过度增生及黏液过度分泌, 更有望达到预防胆道再狭窄和结石术后复发的目的.
引文著录: 周涌, 李富宇, 王晓东, 蒋力生, 程南生, 李全生, 何生. 反义基因治疗对慢性增生性胆管炎的抗增殖作用. 世界华人消化杂志 2010; 18(8): 767-772
Revised: January 18, 2010
Accepted: February 9, 2010
Published online: March 18, 2010
AIM: To compare the effects of short hairpin RNAs (shRNAs) targeting the proliferating cell nuclear antigen (PCNA), c-Myc and cdc2 k genes on the hyperplastic behavior and lithogenic potential of proliferative cholangitis (PC), and to select the best target for antiproliferative treatment of PC.
METHODS: A rat model of PC was developed by retrogradely inserting a nylon thread into the common bile duct. Using the nylon thread as the guide wire, an intralumenal injection of PCNA, c-Myc and cdc2 k shRNAs into the common bile duct was performed in three different groups of model rats, respectively.
RESULTS: Compared to the c-Myc and cdc2 k shRNA treatment groups, the degree of hyperplasia of biliary epithelium and collagen fibers in the bile duct wall in the PCNA shRNA treatment group were significantly decreased. In addition, the protein expression and secretion of mucin from the hyperplastic biliary epithelium and peribiliary gland were remarkably reduced in the PCNA shRNA treatment group.
CONCLUSION: PCNA shRNA possesses more strong inhibitory effects on collagen fiber hyperplasia in and mucin secretion from the bile duct wall of rats with experimental PC than c-Myc and cdc2 k shRNAs. Therefore, PCNA shRNA holds more promise for prevention of postoperative biliary restenosis and stone recurrence in PC patients.
- Citation: Zhou Y, Li FY, Wang XD, Jiang LS, Cheng NS, Li QS, He S. Efficacy of antisense gene therapy for proliferative cholangitis. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 767-772
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.767
肝内胆管结石虽是亚太地区的常见病, 但其至今仍被视为是一种难治性疾病; 单纯的手术治疗已很难使当今肝内胆管结石的远期疗效有较大的提高, 如何预防肝内胆管结石的术后复发和胆道再狭窄至今依然是肝胆外科中的难点, 对其治疗亦需探讨新的途径[1-5]. 近年来, 随着对肝内胆管结石病理的深入研究发现, 结石的术后高复发率和胆道再狭窄率均与术后遗留的慢性增生性胆管炎(proliferative cholangitis, PC)密切相关[6-10]. PC在肝内胆管结石的发生和发展中发挥着极为重要的作用[11,12]. 首先, PC病变胆管壁内过度增生的纤维结缔组织可促使胆管腔的变形及狭窄, 造成胆汁淤积. 其次, 大部分的胆管周围腺体均有旺盛的黏液分泌功能, 这进一步的加剧了病变胆管腔内的胆汁淤积. 另需着重指出的是, 这些分泌至胆管腔内的过多的黏液不仅参与形成启动结石生成的成核因子, 而且还可通过促使胆汁中其他成分的聚集、沉淀, 形成丝网状支架而使结石增大[8,13,14]. 鉴于此, PC业已被认为是结石术后复发的主要诱因和病理学基础所在, 而对PC的后续治疗将有助于降低结石复发率和胆道再狭窄率, 但遗憾的是对于PC的治疗现阶段仍无行之有效的办法[13-17].
鉴于PC是一种慢性增殖性疾病的特点, 抗增殖治疗可能会有助于抑制PC的过度增殖行为, 而这种过度增殖行为又恰恰与肝内胆管结石的形成密切相关[7,9,18]. 鉴于此, 我们在前期研究中曾分别探讨了PCNA、c-Myc、cdc2k shRNA对PC的抗增殖疗效, 以期通过控制或逆转PC, 而达到预防结石术后复发和胆道再狭窄的目的[8,10]. 本研究拟在前期研究基础上, 进一步对比三种反义治疗的确切疗效, 以期筛选PC抗增殖治疗的最佳靶点.
健康SD大鼠56只, 体质量220-250 g, 由四川大学华西实验动物中心提供.
1.2.1 分组及造模: 随机分为以下5组: 慢性增生性胆管炎模型组(PC模型组, 10只): 按Park等介绍的方法建立慢性增生性胆管炎动物模型[9]. 以26号针头刺破十二指肠前壁, 经十二指肠乳头向胆总管内逆行插入5-0的尼龙缝合线直至肝门处, 缝合线末端缝合戳孔处; 三种反义治疗组 (PCNA组、c-Myc组、cdc2k组, 每组10只): 以尼龙缝线为导引, 向胆总管内插入20号静脉留置针, 分别注入0.5 mL的 PCNA、c-Myc或cdc2k shRNA; 假手术组(SO组, 6只): 仅行开腹手术. 7 d后, 收集胆总管内的胆汁以备Mucin 3的ELISA检测, 切取大鼠胆总管以备进一步检测.
1.2.2 Ki-67和Mucin3的Real time-PCR检测: 以TRIzol提取胆管壁总RNA, RNA的逆转录反应按照试剂盒说明进行. 用SYBR Green进行实时荧光定量分析, 以目标基因与GAPDH的比值作为相对表达水平.
1.2.3 Mucin 3的ELISA检测: 胆汁标本与Mucin 3抗体在96孔板内孵育1 h, PBS漂洗后每空加入100 µL过氧化物聚合羊抗鼠血清孵育1 h, PBS漂洗3次, TMB显色, 450 nm读取积分光密度.
1.2.4 collagenⅠ的Western blot检测: 取100 µg蛋白进行SDS-PAGE凝胶电泳, 电转膜至PVDF后进行杂交. 滴加collagenⅠ一抗后4 ℃孵育过夜, TBS漂洗后, 滴加HRP结合的二抗孵育2 h, X线显影, 以目标基因与β-actin表达的积分光密度比值作为相对表达水平.
统计学处理 应用SPSS10.01统计软件进行分析处理. 计量资料以mean±SD表示, 各组间比较用方差分析(One-way ANOVA), 两两比较用LSD过程. 差异显著标准: P<0.05.
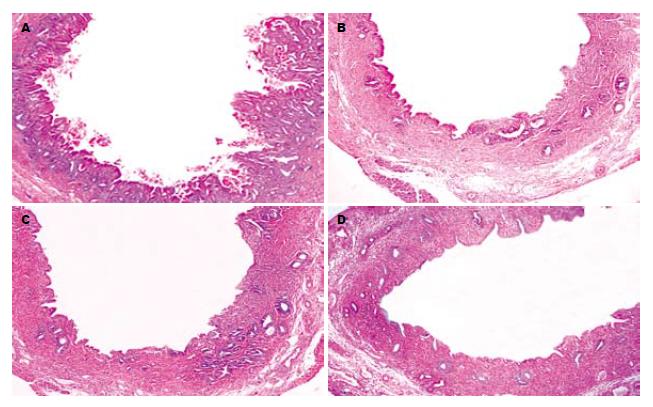
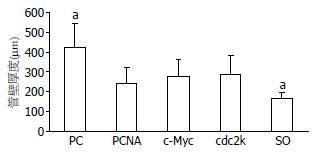
PC模型组胆管的主要病理特点为: 乳头状增生的胆管黏膜上皮、过度增生的黏膜下腺体、纤维化增厚的胆管壁, 这些病理改变均可导致胆管腔的阻塞及狭窄(图1A), 而且上述病理变化与肝内胆管结石病例中经常观察到的慢性增生性胆管炎十分相似. 值得关注的是, 三种反义治疗组的胆道黏膜上皮、管周黏膜下腺体、管壁胶原纤维的过度增殖情况、胆管壁的纤维化增厚程度均较PC模型组明显降低, 特别是PCNA shRNA治疗组(图1B-D). 此外, PCNA shRNA治疗组的胆管壁纤维化增厚程度虽略低于c-Myc和cdc2k shRNA组, 但差异并未达到统计学意义(P>0.05, 图2).
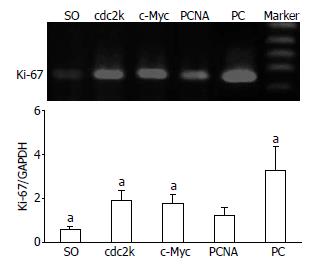
PC模型组胆管壁的Ki-67表达明显上调; c-Myc和cdc2k shRNA治疗组的Ki-67 mRNA表达较PC组已明显降低, 而PCNA shRNA治疗组的降低程度要更为明显, 但其表达水平仍高于假手术组(P<0.05). c-Myc和cdc2k shRNA治疗组之间的Ki-67表达并无显著性差异(P>0.05, 图3).
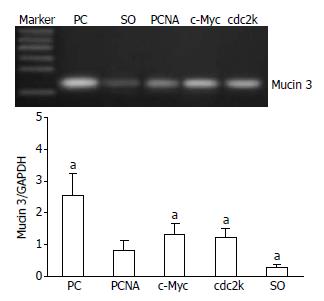
PC模型组胆管壁的Mucin 3 mRNA表达明显上调, 但经PCNA、c-Myc或cdc2k shRNA治疗后, Mucin 3 mRNA表达明显降低, 其中PCNA shRNA治疗组的Mucin 3 mRNA表达又要略低于c-Myc和cdc2k shRNA治疗组, 但仍高于假手术组(P<0.05, 图4).
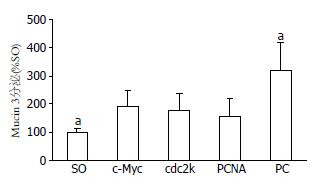
PC模型组胆汁的Mucin 3蛋白含量增加至假手术组的3倍, 而经PCNA、c-Myc或cdc2k shRNA治疗后, Mucin 3蛋白含量明显下降. 此外, PCNA shRNA治疗组的Mucin 3蛋白虽略低于c-Myc和cdc2k shRNA治疗组, 但差异并不显著(P>0.05, 图5).
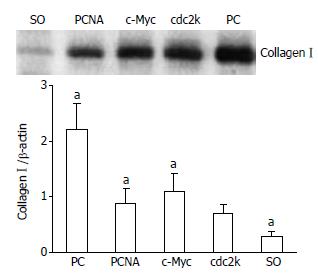
PC模型组的collagenⅠ蛋白表达明显上调, 但经PCNA、c-Myc或cdc2k shRNA治疗后, collagenⅠ蛋白表达明显降低, 其中PCNA shRNA治疗组的减低程度最为明显, 但仍高于假手术组(P<0.05, 图6).
作为一种难治性疾病, 肝内胆管结石具有治疗失败率高和复发率高(4.2%-40%)等特点, 其术后4-10年的再手术率可高达37.1%-74.4%[19-21]. 过去, 由于我们过多的关注于如何提高肝内胆管结石的手术技能, 未能充分的认识到PC与结石形成及发展之间的关系, 对取石后尚遗留的PC一直未给与足够的重视, 由此而造成的术后胆道再狭窄和结石复发等问题极大地影响了当今肝内胆管结石的术后远期疗效[2-4,7-10,15]. PC与结石之间可形成恶性循环: 结石本身及其继发的感染均可刺激胆管壁组织持续性过度增生, 发生PC和胆管狭窄, 而反过来PC的反复发作, 又可通过产生黏蛋白及造成胆道狭窄、胆汁淤积等病理改变促成新的结石形成[13-18]. 因而即使取净结石后, 由结石引发的PC仍将持续、广泛的存在, 成为结石术后复发的隐患. 由此可见, 对肝内胆管结石的治疗, 不仅要重视结石的清除和病变胆管狭窄的纠正, 更要注重对术后遗留的PC的后续治疗, 因PC恰是该恶性循环的中枢环节[9,14,17]. 鉴于此, 我们有理由相信, 通过对手术后或胆道镜取石后遗留的PC的后续治疗将有助于预防肝内胆管结石的术后复发及胆管再狭窄率, 从而减少肝内胆管结石患者的再次手术或内镜取石的机率[3,15,20-22]. 另需着重指出的是, PC这种慢性增殖性炎症结构亦是肝内胆管结石并发胆管癌的病理学结构基础, 对这种慢性增殖性炎症的早期阻断亦有助于预防胆管癌的发生[14-18,23]. 但遗憾的是对于PC的治疗现阶段仍无有效的解决办法.
作为慢性增生性胆管炎的主要病理学表现, 胆道黏膜上皮的过度增殖在肝内胆管结石的形成及发展中起到了至关重要的作用, 但现阶段却无任何行之有效的治疗措施来控制或逆转病变胆管黏膜的这种过度增殖行为[9,17-21]. 近年来, 多项体内、外研究业已表明, 应用反义技术特异性的封闭增殖相关基因(PCNA, c-Myc, cdc2k或E2F等)的表达, 可通过阻止细胞从G1进入S期或从G2进入M期进行DNA复制, 使细胞的增殖活动明显受到抑制, 可有效地防止球囊成形术后因血管内膜细胞过度增殖所致的管腔狭窄, 在过度增殖性疾病的治疗中显示了良好的应用前景[24-28]. 鉴于PC也是一种慢性增殖性疾病的特征, 我们在前期研究中探讨并证实了, 病变胆管腔内给予PCNA、c-Myc、cdc2k shRNA能够通过特异性的封闭PCNA、Ki-67等细胞增殖相关基因的表达, 抑制胆管黏膜上皮的过度增殖及胆管壁的纤维化增厚[8,10]. 在本研究中进一步的对比上述三种反义治疗的确切抗增殖疗效时发现, PCNA shRNA治疗组的胆管黏膜的增生程度及Ki-67表达水平均明显低于c-Myc或cdc2k shRNA治疗组. 该结果提示, PCNA shRNA治疗能够更为有效的抑制胆管黏膜的过度增殖行为, 更有望成为PC抗增殖治疗的最佳靶点.
作为慢性增生性胆管炎的另两项主要病理学表现, 病变胆管壁胶原纤维的过度增生及黏液的过度分泌亦在胆道狭窄及结石形成中起到了至关重要的作用[9,16,28,29]. 首先, 由胶原纤维过度增生所致的胆道狭窄可改变胆汁流, 造成胆汁淤积; 而胆汁淤积及胆道狭窄又可引发细菌定植及胆道感染, 可刺激胆管黏膜分泌大量的黏液[16,21,30]. 分泌至胆管腔内过多的黏液将促使非结合胆红素及钙盐的溶解性降低, 并相互结合形成结石的成核因子. 不仅如此, 胆汁中如存在过多的黏液还可促使胆汁中的其他成分聚集、沉淀, 形成结石的丝网状支架而使结石增大[29,31]. 鉴于此, 我们有理由相信, 通过对这种胶原纤维过度增殖及黏液过度分泌的有效抑制, 将有助于减少结石的术后复发率及胆道再狭窄率, 但现阶段对此却无任何行之有效的治疗措施[23,27-29].
对此, 我们在前期研究中曾探讨并证实了, PCNA、c-Myc或cdc2k shRNA治疗能够通过抑制增殖相关基因的表达来抑制病变胆管壁胶原纤维的过度增殖; 此外, 三种反义治疗对胆管黏膜上皮及黏膜下腺体的抗增殖疗效还有助于降低病变胆管的黏液分泌[8,10]. 在本研究中进一步对比三种反义治疗的确切疗效时发现, PCNA shRNA治疗组的胆汁中Mucin 3含量和胆管壁厚度虽略低于c-Myc或cdc2k shRNA治疗组, 但差异并不显著. 然而, PCNA shRNA治疗组的胆管壁Mucin 3 mRNA和collagenⅠ蛋白表达却显著低于c-Myc或cdc2k shRNA治疗组. 上述结果表明, PCNA shRNA治疗能够更为有效的抑制PC病变胆管壁的胶原纤维过度增生及黏液过度分泌, 更有望达到抑制病变胆管成石潜力的目的. 上述三种反义治疗的不同疗效的根源可能在于: PCNA作为细胞增殖所必需的核抗原, 是DNA聚合酶δ的重要辅助因子, 许多细胞内、外增殖因子如c-Myc、EGF、TGF-α的信号传导过程都必须经过PCNA的参与, 才能引发细胞的DNA合成及分裂增殖; 与c-Myc, cdc2k相比, PCNA在DNA复制、细胞增殖和细胞周期调控中可能发挥着更为广泛和关键的作用, 因而, 靶向PCNA的反义抗增殖治疗, 能够更为有效的抑制PC的过度增殖行为和成石潜力, 更有望达到预防结石复发和胆管再狭窄的目的[15,27,32,33].
现阶段肝内胆管结石术后高复发率的根源即在于: 目前尚无任何有效的药物来控制结石复发的病理基础-PC, 因而在胆道镜取石后也无任何的后续的药物治疗措施, 只有任凭结石的复发, 这使此类患者常需多次进行手术或胆道镜取石[7-11]. 对此, 我们的研究结果显示, 三种反义治疗, 特别是应用PCNA shRNA治疗能够有效的抑制PC的过度增殖行为和成石潜力. 虽然本实验是在胆总管上验证而不是在肝内胆管, 但这种新的抗增殖疗法依然在PC的治疗中显示了良好的应用前景, 因本研究中所选用的大鼠PC模型业已被证实与人肝内胆管结石的病理学和细菌学均十分相似[9,17-19]. 鉴于此, 本研究可能会为预防肝内胆管结石术后复发和胆管再狭窄的药物研发奠定相关实验基础, 以期减少或避免肝内胆管结石患者的再次手术或内镜治疗机率, 从而提高当今肝内胆管结石的术后远期疗效[3,5,19-21,34]. 但目前该方面的研究甚少, 本研究也仅对其疗效进行了初步的探讨, 该新疗法的远期疗效、相关并发症及更为全面的靶基因筛选均需在后续的研究中进一步探讨和验证[24-27,35].
近年来, 随着对肝内胆管结石病理的深入研究发现, 结石的术后高复发率和胆道再狭窄率均与术后遗留的慢性增生性胆管炎(PC)密切相关. PC在肝内胆管结石的发生和发展中发挥着极为重要的作用. PC业已被认为是结石术后复发的主要诱因和病理学基础所在, 而对PC的后续治疗将有助于降低结石复发率和胆道再狭窄率, 但遗憾的是对于PC的治疗现阶段仍无行之有效的办法.
房林, 副教授, 同济大学附属上海市第十人民医院普外科; 刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科
PC这种慢性增殖性炎症结构亦是肝内胆管结石并发胆管癌的病理学结构基础, 对这种慢性增殖性炎症的早期阻断亦有助于预防胆管癌的发生. 但遗憾的是对于PC的治疗现阶段仍无有效的解决办法.
近年来, 多项体内、外研究业已表明, 应用反义技术特异性的封闭增殖相关基因(PCNA, c-Myc, cdc2k或E2F等)的表达, 可通过阻止细胞从G1进入S期或从G2进入M期进行DNA复制, 使细胞的增殖活动明显受到抑制, 可有效地防止球囊成形术后因血管内膜细胞过度增殖所致的管腔狭窄, 在过度增殖性疾病的治疗中显示了良好的应用前景.
通过对手术后或胆道镜取石后遗留的PC的后续治疗将有助于预防肝内胆管结石的术后复发及胆管再狭窄率, 从而减少肝内胆管结石患者的再次手术或内镜取石的机率.
本研究有一定的实用性和先进性, 对于临床工作有指导意义.
编辑: 李军亮 电编:何基才
| 1. | Liu CL, Fan ST, Wong J. Primary biliary stones: diagnosis and management. World J Surg. 1998;22:1162-1166. [PubMed] [DOI] |
| 2. | Huang ZQ, Huang XQ. Evolution of surgical treatment of intrahepatic lithiasis in China. World J Gastroenterol. 1997;3:131-133. |
| 3. | He XD, Liu W, Li BL, Zhang ZH, Zhang JX. Combined surgical therapy for hepatolithiasis. Chin Med Sci J. 2005;20:123-125. [PubMed] |
| 4. | Chijiiwa K, Yamashita H, Yoshida J, Kuroki S, Tanaka M. Current management and long-term prognosis of hepatolithiasis. Arch Surg. 1995;130:194-197. [PubMed] |
| 5. | Uchiyama K, Onishi H, Tani M, Kinoshita H, Ueno M, Yamaue H. Indication and procedure for treatment of hepatolithiasis. Arch Surg. 2002;137:149-153. [PubMed] [DOI] |
| 6. | Ker CG, Kuo KK, Chen HJ, Chen JS, Lee KT, Sheen PC. Morphology of intrahepatic duct in surgical treatment of hepatolithiasis. Hepatogastroenterology. 1997;44:317-321. [PubMed] |
| 7. | Lu S, Yan L, Rao L, Xia T, Gou J, Zhang S, Lei S. Down stream involvement of the bile duct in hepatolithiasis. Chin Med J (Engl). 2002;115:62-64. [PubMed] |
| 8. | Li FY, Cheng NS, Cheng JQ, Mao H, Jiang LS, Li N, He S. Treatment of chronic proliferative cholangitis with c-myc shRNA. World J Gastroenterol. 2009;15:95-101. [PubMed] [DOI] |
| 9. | Park SM, Choi JW, Kim ST, Cho MC, Sung RH, Jang LC, Park JW, Lee SP, Park YH. Suppression of proliferative cholangitis in a rat model by local delivery of paclitaxel. J Hepatobiliary Pancreat Surg. 2003;10:176-182. [PubMed] [DOI] |
| 10. | Li FY, Cheng NS, Cheng JQ, Mao H, Zhou Y, Jiang LS, Li N. Proliferating cell nuclear antigen shRNA treatment attenuates chronic proliferative cholangitis in rats. J Gastroenterol Hepatol. 2009;24:920-926. [PubMed] [DOI] |
| 11. | Li FY, Cheng JQ, Li N, He S, Zhang MM, Dong JH, Jiang LS, Cheng NS. Effectiveness of chemical biliary duct embolization for chemical hepatectomy. J Gastroenterol Hepatol. 2006;21:880-886. [PubMed] [DOI] |
| 12. | Otani K, Shimizu S, Chijiiwa K, Ogawa T, Morisaki T, Sugitani A, Yamaguchi K, Tanaka M. Comparison of treatments for hepatolithiasis: hepatic resection versus cholangioscopic lithotomy. J Am Coll Surg. 1999;189:177-182. [PubMed] [DOI] |
| 13. | Li F, Cheng J, He S, Li N, Zhang M, Dong J, Jiang L, Cheng N, Xiong X. The practical value of applying chemical biliary duct embolization to chemical hepatectomy for treatment of hepatolithiasis. J Surg Res. 2005;127:131-138. [PubMed] [DOI] |
| 14. | Terada T, Nakanuma Y. Pathologic observations of intrahepatic peribiliary glands in 1,000 consecutive autopsy livers: IV. Hyperplasia of intramural and extramural glands. Hum Pathol. 1992;23:483-490. [PubMed] [DOI] |
| 15. | Li FY, Cheng NS, Mao H, Jiang LS, Cheng JQ, Li QS, Munireddy S. Significance of controlling chronic proliferative cholangitis in the treatment of hepatolithiasis. World J Surg. 2009;33:2155-2160. [PubMed] [DOI] |
| 16. | Cheng YF, Lee TY, Sheen-Chen SM, Huang TL, Chen TY. Treatment of complicated hepatolithiasis with intrahepatic biliary stricture by ductal dilatation and stenting: long-term results. World J Surg. 2000;24:712-716. [PubMed] [DOI] |
| 17. | Nakanuma Y, Yamaguchi K, Ohta G, Terada T. Pathologic features of hepatolithiasis in Japan. Hum Pathol. 1988;19:1181-1186. [PubMed] [DOI] |
| 18. | Terada T, Nakanuma Y. Innervation of intrahepatic bile ducts and peribiliary glands in normal human livers, extrahepatic biliary obstruction and hepatolithiasis. An immunohistochemical study. J Hepatol. 1989;9:141-148. [PubMed] [DOI] |
| 19. | Fan ST, Choi TK, Lo CM, Mok FP, Lai EC, Wong J. Treatment of hepatolithiasis: improvement of result by a systematic approach. Surgery. 1991;109:474-480. [PubMed] |
| 20. | Lee SK, Seo DW, Myung SJ, Park ET, Lim BC, Kim HJ, Yoo KS, Park HJ, Joo YH, Kim MH. Percutaneous transhepatic cholangioscopic treatment for hepatolithiasis: an evaluation of long-term results and risk factors for recurrence. Gastrointest Endosc. 2001;53:318-323. [PubMed] |
| 21. | Hwang JH, Yoon YB, Kim YT, Cheon JH, Jeong JB. Risk factors for recurrent cholangitis after initial hepatolithiasis treatment. J Clin Gastroenterol. 2004;38:364-367. [PubMed] [DOI] |
| 22. | Lee TY, Chen YL, Chang HC, Chan CP, Kuo SJ. Outcomes of hepatectomy for hepatolithiasis. World J Surg. 2007;31:479-482. [PubMed] [DOI] |
| 23. | Yamamoto K. Intrahepatic periductal glands and their significance in primary intrahepatic lithiasis. Jpn J Surg. 1982;12:163-170. [PubMed] [DOI] |
| 24. | Ehsan A, Mann MJ. Antisense and gene therapy to prevent restenosis. Vasc Med. 2000;5:103-114. [PubMed] |
| 25. | Mitra AK, Agrawal DK. Gene therapy of fibro-proliferative vasculopathies: current ideas in molecular mechanisms and biomedical technology. Pharmacogenomics. 2006;7:1185-1198. [PubMed] [DOI] |
| 26. | Quarck R, Holvoet P. Restenosis and gene therapy. Expert Opin Biol Ther. 2001;1:79-91. [PubMed] [DOI] |
| 27. | Fulton GJ, Davies MG, Barber L, Svendsen E, Hagen PO. Locally applied antisense oligonucleotide to proliferating cell nuclear antigen inhibits intimal thickening in experimental vein grafts. Ann Vasc Surg. 1998;12:412-417. [PubMed] [DOI] |
| 28. | Li N, Xiao LJ, Chen SW, Li L, Xiao BL, Chen WB, Gao XK, Gu SJ. [Mucus histochemical study of bilirubin cholangiolithiasis in rabbit model]. Huaxi Yike Daxue Xuebao. 1989;20:417-420. [PubMed] |
| 29. | Bouchier IA, Cooperband SR, el-Kodsi BM. Mucous substances and viscosity of normal and pathological human bile. Gastroenterology. 1965;49:343-353. [PubMed] |
| 30. | Yoon HK, Sung KB, Song HY, Kang SG, Kim MH, Lee SG, Lee SK, Auh YH. Benign biliary strictures associated with recurrent pyogenic cholangitis: treatment with expandable metallic stents. AJR Am J Roentgenol. 1997;169:1523-1527. [PubMed] |
| 31. | Yamasaki T, Nakayama F, Tamura S, Endo M. Characterization of mucin in the hepatic bile of patients with intrahepatic pigment stones. J Gastroenterol Hepatol. 1992;7:36-41. [PubMed] [DOI] |
| 32. | Pickering JG, Isner JM, Ford CM, Weir L, Lazarovits A, Rocnik EF, Chow LH. Processing of chimeric antisense oligonucleotides by human vascular smooth muscle cells and human atherosclerotic plaque. Implications for antisense therapy of restenosis after angioplasty. Circulation. 1996;93:772-780. [PubMed] |
| 33. | Miniati DN, Hoyt EG, Feeley BT, Poston RS, Robbins RC. Ex vivo antisense oligonucleotides to proliferating cell nuclear antigen and Cdc2 kinase inhibit graft coronary artery disease. Circulation. 2000;102:III237-III242. [PubMed] |
| 34. | Naryzhny SN. Proliferating cell nuclear antigen: a proteomics view. Cell Mol Life Sci. 2008;65:3789-3808. [PubMed] [DOI] |
| 35. | Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners. J Cell Sci. 2003;116:3051-3060. [PubMed] [DOI] |