修回日期: 2010-01-25
接受日期: 2010-02-01
在线出版日期: 2010-03-18
目的: 建立一新型细胞株, 使该细胞株既能自然感染HBV又能传代培养, 评价杂交细胞对HBV的自然感染能力.
方法: 分离培养未携带HBV的人原代肝细胞, 与诱导突变的HepG2细胞进行融合得杂交细胞, 经HAT培养基筛选, 利用胰蛋白酶G显带技术鉴定所得细胞, 用含HBV的慢性乙型肝炎患者血清感染杂交细胞(同时感染HepG2作为对照), 巢式PCR检测感染后细胞内HBV DNA合成及分泌情况及有无HBV复制中间产物HBV cccDNA, 间接免疫荧光检测感染后细胞内HBcAg的表达, 电化学发光法检测感染后细胞培养上清中的HBsAg和HBeAg.
结果: 成功建立人原代肝细胞与HepG2的杂交细胞, 能体外传代培养, 染色体核型分析示杂交细胞染色体众数为99条, 证实为融合细胞, HBV感染后第4天起, 杂交细胞内和培养上清中均能检测到HBV DNA, HBV感染后第3天起, 杂交细胞内可以检测到HBV的复制中间产物HBV cccDNA, HBV感染后第4天起, 杂交细胞胞质及部分胞核内HBcAg始终是阳性表达, 间接免疫荧光染色呈胞质弥漫性着色, 电化学发光法检测培养上清中HBsAg及HBeAg持续表达; 而感染后的HepG2细胞检测结果均为阴性.
结论: 成功建立的兼具有人原代肝细胞和HepG2遗传特性的杂交细胞株可以被慢性乙型肝炎患者血清中的HBV病毒自然感染, 可进一步用作研究HBV感染的体外细胞模型.
引文著录: 姚永远, 马立宪, 赛林涛, 邵丽华, 关彦彦, 王刚. 新型乙型肝炎病毒细胞感染模型的建立. 世界华人消化杂志 2010; 18(8): 755-760
Revised: January 25, 2010
Accepted: February 1, 2010
Published online: March 18, 2010
AIM: To establish a hybrid cell line (by fusing HepG2 cells with primary human hepatocytes) that can be infected by hepatitis B virus (HBV) and be serially subcultured in vitro, and to evaluate the infection ability of HBV in this hybrid cell line.
METHODS: Normal human hepatocytes were isolated and cultured. Primary human hepatocytes were then fused with HGPRT-deficient HepG2 cells (induced with ethyl methanesulfonate). The hybrid cells were identified by the trypsin G-banding method. After the hybrid cells and normal HepG2 cells were infected with serum-derived HBV virions, intracellular and secreted HBV DNA as well as intracellular HBV cccDNA (covalent closed circle DNA) were detected by nested polymerase chain reaction (PCR). HBcAg in infected cells was analyzed by indirect immunofluorescence. HBsAg and HBeAg in the supernatants of infected cells were identified by electrochemiluminescence.
RESULTS: A hybrid cell line was established successfully by fusing HepG2 cells with primary human hepatocytes. This hybrid cell line could be subcultured in vitro. Karyotype analysis showed that the modal chromosome number of hybrid cells was 99. HBV DNA was detected consistently in both hybrid cells and their culture medium 4 days post-infection. HBV cccDNA was detected consistently 3 days post-infection. HBcAg, HBsAg and HBeAg were also detected consistently 4 days post-infection. In contrast, negative results were obtained in control HepG2 cells infected with HBV virions.
CONCLUSION: A new hybrid cell line that can be used for establishing an in vitro cell model of HBV infection is established successfully. This new hybrid cell line inherits the characteristics of both HepG2 cells and primary human hepatocytes.
- Citation: Yao YY, Ma LX, Sai LT, Shao LH, Guan YY, Wang G. Establishment of a novel cell model of hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 755-760
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/755.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.755
乙型肝炎病毒(hepatitis B virus, HBV)感染是全球范围内影响人类健康的重大问题, 我国是乙型肝炎高流行地区, 全国一般人群HBsAg阳性率为9.09%, 估计约1.1亿人为慢性HBV感染, 占全世界慢性HBV感染人数的1/3[1]. 目前人们对HBV及其所致疾病有了相当深入的认识, 但由于缺乏合适的动物模型及体外细胞培养系统, HBV的生物学研究和治疗进展缓慢[2-6]. 常用的HBV细胞模型2.2.15细胞系由于HBV基因整合于细胞染色体, 不能形成HBV自然生活周期中至为关键的cccDNA, 与病毒自然感染存在很大差异. 为此, 本研究旨在建立一新型细胞系, 能够自然感染HBV并能体外传代培养, 为HBV感染宿主细胞的早期机制的研究, 以及病毒侵入人肝细胞后完整的复制过程的研究提供一个强有力的工具.
HepG2细胞购自武汉大学中国典型培养物保藏中心, 成人原代肝细胞取自齐鲁医院一未携带HBV的肝血管瘤手术患者, 胎牛血清、DMEM培养基、HAT选择培养基、HT培养基均购自Gibco公司, 6-巯基嘌呤(6-MP)、乙基甲磺酸(EMS)、秋水仙素购自Sigma公司, 二甲基亚砜(DMSO)购自Gibco公司, 聚乙二醇1500(PEG)购自罗氏公司, 微量样品基因组DNA提取试剂盒(TIANamp Micro DNA Kit)为北京天根生化科技有限公司产品, HBV DNA和HBV cccDNA基因扩增引物由上海博尚生物工程有限公司合成, Taq DNA聚合酶、dNTPs、DNA Marker为天根(TIANGEN)产品, 绿豆核酸酶为美国Promega公司产品, 单克隆抗体Mouse Anti-HBcAg为美国Chemicon公司产品, FITC标记的二抗: FITC-conjugated goat anti-mouse IgG(H+L chain specific)为美国Southern Biotechnology Associates产品, 封闭用山羊血清为进口分装产品, 购自上海麦莎生物科技有限公司.
1.2.1 HGPRT缺陷HepG2细胞(HGPRT-HepG2)的诱导和筛选[7,8]: 选择增殖活力强并处于对数生长期的HepG2细胞, 用含EMS 0.3 g/L的完全培养基作用16 h后, 换为含胎牛血清100 mL/L的培养基培养7-10 d, 然后更换为含6-MP 0.01 g/L的完全培养基作用48 h后用含胎牛血清50 mL/L的培养基维持生长, 为防止回复突变, 每3 wk左右加入6-MP重复筛选.
1.2.2 人原代肝细胞的分离与培养: 参照文献[9], 取自一未携带HBV的肝血管瘤患者手术切除的肝脏组织, 经病理学证实为非癌组织, 超净工作台内去除坏死部位及结缔组织, 用含青霉素、链霉素终浓度分别为100 IU/mL和100 mg/L的PBS缓冲液冲洗肝脏组织标本3-4次, 用手术剪将标本剪成细小碎块(≤5 mm3), 采用直接胶原酶消化法在肝组织碎块中加入5 mL左右0.1 g/L的Ⅳ型胶原酶, 37 ℃消化15 min, 将含胶原酶的上清液移入离心管中, 重复上述操作1次, 收集上清, 将剩余组织块在200目铜网上研磨, 培养基冲洗, 收集上清, 将收集的所有上清一起离心, 500 r/min离心5 min, 重复3次, 以去除血细胞. 用不完全培养基重悬离心所得沉淀, 采用差异贴壁法分离肝实质细胞与成纤维细胞, 将纯化的肝细胞用肝细胞培养基(含胎牛血清、胰岛素、地塞米松、谷胱甘肽等)培养, 经台盼兰染色排除法确定肝细胞存活率≥90%.
1.2.3 细胞融合和杂交细胞的筛选: 将HGPRT-HepG2细胞和人原代肝细胞制成细胞悬液, 计数板计数, 调整浓度分别为2×106/mL、1×105/mL, 等体积混合两细胞悬液, 1 000 r/min离心10 min, 30 s内加入1 mL 50% PEG溶液[10], 作用2 min, 800 r/min离心5 min弃上清, 用完全培养基重悬细胞, 移入培养板, 24 h后加HAT选择培养基, 2-3 d换液1次, 2 wk后利用有限稀释法将融合后细胞进行单克隆, 直至每孔含1个细胞, 等细胞稳定生长后换HT选择培养基, 1 wk后换含胎牛血清100 mL/L胎牛血清的DMEM培养基维持培养.
1.2.4 杂交细胞的染色体核型分析: 利用常规胰蛋白酶G显带技术[11]处理对数生长期的野生型HepG2细胞、HGPRT-HepG2细胞和杂交细胞,高倍显微镜下观察细胞染色体标本, 分别随机计数这3种细胞的20个分裂相的染色体数.
1.2.5 HBV感染杂交细胞: 经实时定量PCR检测的HBV DNA阳性血清(来自山东大学齐鲁医院检验科)以无血清DMEM培养基稀释至1.5×108拷贝/mL, 以HepG2细胞作为对照细胞, 将杂交细胞和HepG2细胞接种至6孔板, 生长至铺满60%孔板面积时(约4×105/孔)开始感染, 每孔加入2 mL病毒血清稀释液, 37 ℃、50 mL/L CO2条件下孵育2 h, PBS冲洗细胞5次, 换成完全培养基, 将细胞放回37 ℃、50 mL/L CO2的培养箱中继续培养[12], 此时开始计算为0 d.
1.2.6 HBV感染后杂交细胞内及培养上清液中HBV DNA的检测: 从HBV感染后第1天起, 每天收集感染后杂交细胞和HepG2细胞, 用微量样品基因组DNA提取试剂盒提取感染后各天的杂交细胞和HepG2细胞的基因组DNA, -20 ℃储存备用; 为避免感染血清里病毒残留的可能, 从感染后第3天开始收集杂交细胞和HepG2细胞的培养上清液, 1 000 r/min离心10 min, 去除沉淀后煮沸裂解10 min, 15 000 r/min离心10 min, 取上清10 μL作为第1轮PCR反应的模板. 巢式PCR检测感染后细胞及培养上清液内是否存在HBV DNA, 引物序列P1-1: 5'-TCA CCA TAT TCT TGG GAA CAA GA-3', P1-2: 5'-CGA ACC ACT GAA CAA ATG GC-3'; P2-1: 5'-GGC TCA AGT TCA GGA ACA GT-3', P2B(B型HBV DNA下游引物): 5'-CAG GTT GGT GAG TGA CTG GAG A-3', P2C(C型HBV DNA下游引物): 5'-GGT CCT AGG AAT CCT GAT GTT G-3'. 巢式PCR实验流程及扩增条件参考文献[13-16].
1.2.7 感染后杂交细胞内HBV cccDNA的检测: 选用绿豆核酸酶消化法结合缺口引物法检测HBV cccDNA. 微量样品基因组DNA提取试剂盒提取感染后各天的杂交细胞和HepG2细胞的基因组DNA, 用绿豆核酸酶消化基因组DNA, 绿豆核酸酶是单链水解酶, 使rcDNA线性化, 而cccDNA可以抵抗绿豆核酸酶的消化而保持完整双链结构, 继续作为PCR模板而被选择性扩增[17-20], 引物序列P3-1: 5'-CTG AAT CCC GCG GAC GAC CC-3', P3-2: 5'-ACC CAA GGC ACA GCT TGG AGG-3'; P4-1: 5'-GTC TGT GCC TTC TCA TCT GCC-3', P4-2: 5'-AGA TGA TTA GGC AGA GGT GAA AAA-3'.
1.2.8 电化学发光法检测感染后细胞培养上清液中的HBsAg和HBeAg: 为了避免感染血清病毒残留的可能, 从感染后第4天开始收集杂交细胞和HepG2细胞的培养上清液, 1 000 r/min离心10 min去除沉淀, 送往齐鲁医院检验科, 按Roche公司的HBsAg、HBeAg定量检测试剂盒说明书及Roche Elecsys 2010全自动电化学发光免疫分析仪操作流程进行检测, 计算机自动给出所测样本的COI值(Cutoff值指数). 所购Roche公司的HBsAg、HBeAg定量检测试剂盒的阳性标准为COI≥1.0.
1.2.9 间接免疫荧光检测感染后杂交细胞内HBcAg的表达: 从感染后第1天起, 每天收集1孔细胞, 40 g/L多聚甲醛(冰预冷)4 ℃固定细胞15-20 min, 100 mL/L的山羊血清封闭30 min, 加入抗-HBcAg一抗4 ℃过夜, 二抗为FITC标记的山羊抗鼠IgG, 37 ℃孵育30 min, 荧光显微镜下观察结果.
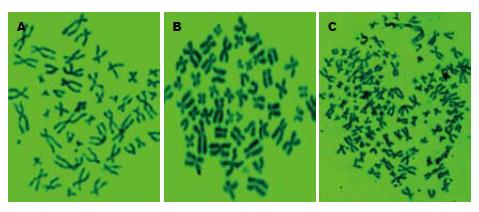
该杂交细胞在培养瓶中呈单层贴壁生长, 细胞呈长多角形, 比HepG2细胞略饱满, 可传代培养, 传代一次约需2-4 d, 经冻存复苏后可继续生长. 利用胰蛋白酶G显带技术分别对野生型HepG2细胞、HGPRT-HepG2细胞和杂交细胞的20个分裂相的染色体进行计数, 所得染色体众数分别为: 51、53、99条(图1). 该结果表明杂交细胞为人原代肝细胞与HGPRT-HepG2细胞的杂合体.
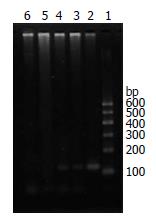
巢式PCR检测感染后细胞及培养上清液发现, 从感染后的第4天到第20天的杂交细胞及培养上清液都可以扩增120 bp的HBV DNA特异性片段(图2); 而对照细胞HepG2在感染后不能检出HBV DNA. 这说明HBV病毒颗粒能够自然感染该杂交细胞并且能够合成HBV DNA分泌到胞外.
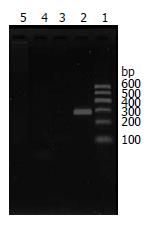
绿豆核酸酶消化法结合缺口引物法检测HBV的复制中间产物HBV cccDNA发现, 从感染第3天至第20天, 杂交细胞内可以检测到HBV cccDNA(图3). 而对照细胞HepG2在HBV感染后没有检出HBV cccDNA. 该结果提示HBV侵入细胞后启动了病毒在细胞内自然复制, 合成了HBV cccDNA作为HBV DNA复制和转录的最初模板.
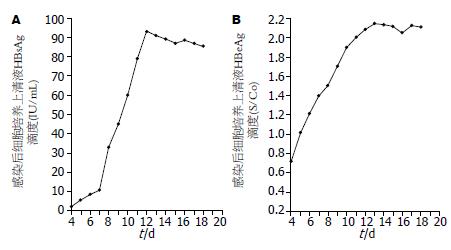
收集感染后第4天到第20天的杂交细胞培养上清液, 利用电化学发光法检测结果显示: 从HBV感染后第4天起, 杂交细胞能持续分泌HBsAg, 最低值为2.12 IU/mL, 最高值为93.16 IU/mL(≥1为阳性), 从感染后第5天起, 杂交细胞能持续分泌HBeAg, 最低值为1.012 S/Co, 最高值为2.146 S/Co(≥1为阳性), 而对照细胞HepG2检测结果为阴性(图4).
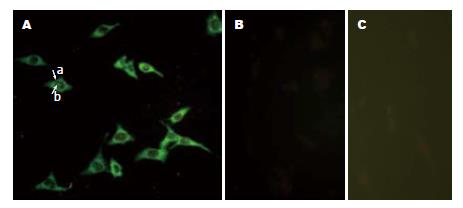
间接免疫荧光检测证实, 从感染后第1天到感染后第20天, 杂交细胞胞质及部分胞核内HBcAg始终阳性表达, 荧光染色后呈弥漫性着色, 而对照细胞HepG2在HBV感染后没有检测到HBcAg的表达(图5).
HBV属于嗜肝DNA病毒科, 其感染具有高度的种属特异性和组织特异性, 能用做感染的动物模型只能是与人类亲缘关系相近的灵长类动物如黑猩猩、树鼩等[21], 然而由于黑猩猩体积较大、成本高以及受伦理道德约束等因素限制了其应用; 而树鼩由于其感染效率低, 且仅导致短暂的轻度感染, 病毒滴度也很低[22], 因此也难以推广应用. 另外, HBV相关病毒如土拨鼠HBV(WHV)、鸭HBV(DHBV)等也有用来做HBV的相关研究[23-26], 但是由于这些病毒与HBV存在一定差异, 不能真实反映HBV的复制及转录情况, 因此上述这些动物都不是理想的HBV动物模型. 现有HBV体外感染细胞模型主要包括人原代肝细胞(primary human hepatocytes, PHH)[27]、树鼩原代肝细胞(primary tupaia hepatocytes, PTH)和HepRG细胞[28,29], 但各自都有其缺陷, PHH来源困难、体外存活时间短, 而PTH体外HBV感染效率很低, HepRG细胞在肾上腺皮质激素和DMSO连续诱导2 wk以上可获得对HBV的易感性[30-32], 但其培养条件苛刻并且化学处理后可能对HBV感染过程影响也限制了其应用. 能在体外长期培养的HepG2.2.15细胞也是目前应用较广泛的细胞模型, 问题是HBV是整合在宿主细胞染色体上, 不能模拟HBV自然感染细胞的过程, 不能形成HBV自然生活周期中至为关键的cccDNA, 病毒复制水平低且不能人为改变[33,34]. 总之, 目前应用于HBV感染的模型均存在明显的缺陷.
本实验借鉴体细胞杂交技术将人原代肝细胞与HGPRT-HepG2细胞融合, 经HAT选择培养基筛选及有限稀释法得到一新型杂交细胞株, 之所以选择HepG2细胞不仅因为他具有可传代性, 并且因其属肝胚瘤细胞系, 与原代肝细胞具有同源性. 核型分析证实该杂交细胞株染色体众数为99条, 人原代肝细胞为46条, HGPRT-HepG2细胞为53条, 据此可推测该杂交细胞是含人原代肝细胞和HGPRT-HepG2细胞基因组的杂交细胞. 经HBV感染实验证实, 杂交细胞株对血清来源的HBV自然感染易感, 并能在感染后启动有效的病毒复制, 合成HBV复制中间产物cccDNA, 合成HBV DNA和HBV特异性蛋白抗原HBsAg、HBeAg和HBcAg. 因此, 该杂交细胞株可作为HBV自然感染的细胞模型, 进行HBV感染宿主细胞的早期机制, 包括病毒黏附、胞吞、脱壳等早期感染过程的研究和病毒侵入人肝细胞后完整的复制过程的研究, 为体外研究HBV的自然感染及其生命过程提供新的研究平台, 目前国际上尚无类似用作HBV体外感染的细胞模型[2,33,35].
杂交细胞融合成功到现在已经历时9 mo余, 已传至40代以上. 第40代的杂交细胞与第1代杂交细胞相比, 除在染色体数目上稍有丢失外, 在细胞形态、生长特性和对HBV的易感性等方面没有明显差别, 说明我们建立的杂交细胞株具有较好的遗传稳定性.
本课题组之前曾用HBV携带者的原代肝细胞与HepG2细胞融合建立了一株杂交细胞HepCHLine-4[12], 与之相比该新型细胞株有着独特的优势, 用于HBV体外感染时可以完全排除细胞模型自带病毒的影响(经巢式PCR检测, 该新型杂交细胞株本身并未携带HBV基因组), 由于是空白模型, 因此同理推测该杂交细胞株也可用作其他类型病毒性肝炎如丙型肝炎、戊型肝炎等体外感染的研究, 因硕士期间时间及精力有限, 未能进行其他病毒性肝炎的探究, 接下来将由课题组继续探讨.
由于缺乏有效的体外病毒感染和复制模型系统, HBV感染肝脏的早期机制研究进展较为缓慢, 从而在一定程度上影响了乙型肝炎及其相关肝脏疾病的基础和临床研究.
刘成海, 研究员, 上海中医药大学附属曙光医院(东部)肝病研究所
体外模型是研究乙型肝炎的一种重要工具, 迄今为止缺乏良好的HBV感染细胞模型, 因此一种新的更理想的细胞模型的建立显得极为重要.
常用的细胞模型HepG2.2.15细胞系稳定转染了完整的HBV基因组, 表达HBV DNA、病毒蛋白并能产生病毒样颗粒, 但由于HBV基因是通过转染而非自然感染的方式进入细胞, 不能用于HBV早期感染过程的研究, 不能形成HBV自然生活周期中至为关键的cccDNA, 与病毒自然感染存在很大差异.
本研究借鉴体细胞杂交技术将人原代肝细胞与HGPRT-HepG2细胞融合得到一新型杂交细胞株, 该细胞株既能自然感染HBV又能传代培养, 为HBV侵入人肝脏的机制研究提供一个强有力的工具.
本文具有创新性, 方法学基本可靠, 所建立的细胞株对于乙型肝炎的基础研究与体外药效评价等均有重要意义.
编辑: 李军亮 电编:何基才
| 1. | 梁 晓峰, 陈 园生, 王 晓军, 贺 雄, 陈 丽娟, 王 骏, 林 长缨, 白 呼群, 严 俊, 崔 钢. 中国3岁以上人群乙型肝炎 血清流行病学研究. 中华流行病学杂志. 2005;26:655-658. |
| 2. | Fellig Y, Almogy G, Galun E, Ketzinel-Gilad M. A hepatocellular carcinoma cell line producing mature hepatitis B viral particles. Biochem Biophys Res Commun. 2004;321:269-274. [PubMed] [DOI] |
| 3. | Guha C, Mohan S, Roy-Chowdhury N, Roy-Chowdhury J. Cell culture and animal models of viral hepatitis. Part I: hepatitis B. Lab Anim (NY). 2004;33:37-46. [PubMed] [DOI] |
| 4. | Dandri M, Volz TK, Lütgehetmann M, Petersen J. Animal models for the study of HBV replication and its variants. J Clin Virol. 2005;34 Suppl 1:S54-S62. [PubMed] [DOI] |
| 5. | Nassal M, Dallmeier K, Schultz U, Sun D. Phenotyping hepatitis B virus variants: from transfection towards a small animal in vivo infection model. J Clin Virol. 2005;34 Suppl 1:S89-S95. [PubMed] [DOI] |
| 6. | Liu FJ, Liu L, He F, Wang S, Zhou TY, Liu C, Deng LY, Tang H. Establishment and primary application of a mouse model with hepatitis B virus replication. World J Gastroenterol. 2007;13:5324-5330. [PubMed] |
| 7. | Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. 1975. J Immunol. 2005;174:2453-2455. [PubMed] |
| 8. | 翁 秀芳, 吴 雄文, 梁 智辉, 陆 盛军, 卢 小玲, 张 彩娥, 钟 茂华, 陈 雪玲, 龚 非力. HGPRT缺陷型T淋巴瘤细胞系的建立 与鉴定. 华中科技大学学报(医学版). 2006;35:701-704. |
| 9. | LeCluyse EL, Alexandre E, Hamilton GA, Viollon-Abadie C, Coon DJ, Jolley S, Richert L. Isolation and culture of primary human hepatocytes. Methods Mol Biol. 2005;290:207-229. [PubMed] |
| 10. | Zhu HC, Wu SH, Huang BY, Zhu B, Gu HH, Luo XB, Xiong Z, Chen WS. [Activation of anti-tumor cytotoxic T lymphocytes by fusion of human dendritic cells and melanoma cells]. Zhongnan Daxue Xuebao Yixueban. 2008;33:1012-1018. [PubMed] |
| 11. | Schreck RR, Distèche CM. Chromosome banding techniques. Curr Protoc Hum Genet. 2001;Chapter 4:Unit4.2. [PubMed] |
| 12. | Jiang Y, Wang AH, Shao LH, Wang G, Yao YY, Sai LT, Chen FZ, Zheng F, Li Y, Ma LX. A new cell culture system for infection with hepatitis B virus that fuses HepG2 cells with primary human hepatocytes. J Int Med Res. 2009;37:650-661. [PubMed] |
| 13. | Kirschberg O, Schüttler C, Repp R, Schaefer S. A multiplex-PCR to identify hepatitis B virus--enotypes A-F. J Clin Virol. 2004;29:39-43. [PubMed] [DOI] |
| 14. | Chen J, Yin J, Tan X, Zhang H, Zhang H, Chen B, Chang W, Schaefer S, Cao G. Improved multiplex-PCR to identify hepatitis B virus genotypes A-F and subgenotypes B1, B2, C1 and C2. J Clin Virol. 2007;38:238-243. [PubMed] [DOI] |
| 15. | Liu WC, Lindh M, Buti M, Phiet PH, Mizokami M, Li HH, Sun KT, Young KC, Cheng PN, Wu IC. Genotyping of hepatitis B virus--genotypes a to g by multiplex polymerase chain reaction. Intervirology. 2008;51:247-252. [PubMed] [DOI] |
| 16. | Bartholomeusz A, Schaefer S. Hepatitis B virus genotypes: comparison of genotyping methods. Rev Med Virol. 2004;14:3-16. [PubMed] [DOI] |
| 17. | Kim MH, Cha CH, An D, Choi SE, Oh HB. [Performance evaluation of Abbott RealTime HBV Quantification Kit for HBV viral load by real-time PCR] Korean. J Lab Med. 2008;28:144-150. [PubMed] [DOI] |
| 18. | Hagelstein J, Fathinejad F, Stremmel W, Galle PR. pH-independent uptake of hepatitis B virus in primary human hepatocytes. Virology. 1997;229:292-294. [PubMed] [DOI] |
| 19. | Thibault V, Pichoud C, Mullen C, Rhoads J, Smith JB, Bitbol A, Thamm S, Zoulim F. Characterization of a new sensitive PCR assay for quantification of viral DNA isolated from patients with hepatitis B virus infections. J Clin Microbiol. 2007;45:3948-3953. [PubMed] [DOI] |
| 20. | Pawlotsky JM. [Virologic techniques for the diagnosis and monitoring of hepatitis B]. Gastroenterol Clin Biol. 2008;32:S56-S63. [PubMed] [DOI] |
| 21. | Feitelson MA, Larkin JD. New animal models of hepatitis B and C. ILAR J. 2001;42:127-138. [PubMed] |
| 22. | von Weizsäcker F, Köck J, MacNelly S, Ren S, Blum HE, Nassal M. The tupaia model for the study of hepatitis B virus: direct infection and HBV genome transduction of primary tupaia hepatocytes. Methods Mol Med. 2004;96:153-161. [PubMed] |
| 23. | Gudima S, He Y, Chai N, Bruss V, Urban S, Mason W, Taylor J. Primary human hepatocytes are susceptible to infection by hepatitis delta virus assembled with envelope proteins of woodchuck hepatitis virus. J Virol. 2008;82:7276-7283. [PubMed] [DOI] |
| 24. | Kulkarni K, Jacobson IM, Tennant BC. The role of the woodchuck model in the treatment of hepatitis B virus infection. Clin Liver Dis. 2007;11:707-725, vii. [PubMed] [DOI] |
| 25. | Hu Q, Fang Y, Zhang ZM, Zhang XY, Zhang ZH, Yang DL. [Establishment of an in vivo model for duck hepatitis B virus infection using Hubei duckling]. Zhonghua Shiyan He Linchuang Bingduxue Zazhi. 2008;22:113-115. [PubMed] |
| 26. | Chen ZY, Cheng AC, Wang MS, Xu DW, Zeng W, Li Z. Antiviral effects of PNA in duck hepatitis B virus infection model. Acta Pharmacol Sin. 2007;28:1652-1658. [PubMed] [DOI] |
| 28. | Glebe D, Urban S. Viral and cellular determinants involved in hepadnaviral entry. World J Gastroenterol. 2007;13:22-38. [PubMed] |
| 30. | Gripon P, Rumin S, Urban S, Le Seyec J, Glaise D, Cannie I, Guyomard C, Lucas J, Trepo C, Guguen-Guillouzo C. Infection of a human hepatoma cell line by hepatitis B virus. Proc Natl Acad Sci U S A. 2002;99:15655-15660. [PubMed] [DOI] |
| 31. | Guillouzo A, Corlu A, Aninat C, Glaise D, Morel F, Guguen-Guillouzo C. The human hepatoma HepaRG cells: a highly differentiated model for studies of liver metabolism and toxicity of xenobiotics. Chem Biol Interact. 2007;168:66-73. [PubMed] [DOI] |
| 32. | Jossé R, Aninat C, Glaise D, Dumont J, Fessard V, Morel F, Poul JM, Guguen-Guillouzo C, Guillouzo A. Long-term functional stability of human HepaRG hepatocytes and use for chronic toxicity and genotoxicity studies. Drug Metab Dispos. 2008;36:1111-1118. [PubMed] [DOI] |
| 34. | Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci U S A. 1987;84:1005-1009. [PubMed] [DOI] |
| 35. | Wang K, Wang W, Song S. Dynamics of an HBV model with diffusion and delay. J Theor Biol. 2008;253:36-44. [PubMed] [DOI] |