修回日期: 2010-01-03
接受日期: 2010-01-11
在线出版日期: 2010-03-08
目的: 探讨内源性NO在慢性病毒性肝炎-肝硬化发展进程中的作用.
方法: 采用硝酸还原酶法比色测定外周静脉及门静脉血浆中iNOS活性, 并用免疫组织化学和RT-PCR方法观察肝组织iNOS蛋白及RNA的表达.
结果: 在慢性肝炎患者及肝硬化患者门静脉血与外周血中iNOS活性与对照组相比均明显升高(F = 102.793, 25.052, P<0.01), 且门静脉血iNOS活性增高更为明显. 慢性肝炎组及肝硬化组中iNOS蛋白的灰阶值均低于正常对照组(F = 46.796, P<0.05), 表明iNOS表达增强. 慢性肝炎组、肝硬化组iNOS mRNA的表达均分别显著高于正常对照组(F = 26.832, P<0.01), 且随着肝脏病变的加重表达逐渐增加.
结论: iNOS/NO体系在慢性肝炎-肝硬化发生发展中起着保持血管舒张状态的重要作用.
引文著录: 李睿, 张宁, 赵瑾, 徐丽红, 黎永军, 刘芳, 陈卫刚. iNOS/NO体系在慢性肝炎及肝硬化患者中的表达. 世界华人消化杂志 2010; 18(7): 664-668
Revised: January 3, 2010
Accepted: January 11, 2010
Published online: March 8, 2010
AIM: To investigate the role of nitric oxide (NO) in the development and progression of hepatitis and liver cirrhosis.
METHODS: Peripheral and portal plasma inducible nitric oxide synthase (iNOS) activity was measured by the nitric acid reductase method. The expression of iNOS mRNA and protein in the liver was measured by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemisty, respectively.
RESULTS: Peripheral and portal plasma iNOS activity, especially the latter, was significantly higher in patients with chronic hepatitis or liver cirrhosis than in normal controls (F = 102.793 and 25.052, respectively; both P < 0.01). The expression levels of iNOS protein in the liver of patients with chronic hepatitis or liver cirrhosis were enhanced when compared to that in normal controls (F = 46.796, P < 0.05). The expression levels of iNOS mRNA in the liver of patients with chronic hepatitis or hepatic cirrhosis were also higher than that in normal controls (F = 26.832, P < 0.01), showing an increasing trend with the progression of the diseases.
CONCLUSION: The iNOS/NO system plays an important role in the development and progression of chronic hepatitis and hepatic cirrhosis perhaps by dilating blood vessels.
- Citation: Li R, Zhang N, Zhao J, Xu LH, Li YJ, Liu F, Chen WG. Peripheral and portal plasma iNOS activity and hepatic expression of iNOS in patients with chronic hepatitis or liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2010; 18(7): 664-668
- URL: https://www.wjgnet.com/1009-3079/full/v18/i7/664.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i7.664
一氧化氮(nitric oxide, NO)作为一种气体信号分子具有信息传递、介导炎症反应等多种功能. NO参与了多种肝脏疾病的发生与发展, 参与肝硬化高动力循环的形成和维持, 近年来, 肝内一氧化氮合酶(nitric oxide synthase, NOS)克隆的出现, 使NO与肝病关系的研究不断深入. 然而, 有关NO慢性肝炎患者与肝硬化患者中的表达差异尚少见报道. 本文通过病理诊断对20例慢性肝炎患者、20例肝硬化患者和10例正常人门静脉血及外周血中NO进行检测, 并观察诱导型一氧化氮合酶(iNOS)在肝组织中蛋白以及mRNA的表达情况, 比较NO在门静脉血与外周血中的差异, 并检测iNOS/NO体系在慢性肝炎患者及肝硬化患者中的表达水平, 分析其中的差异变化, 以探讨NO在肝硬化发生、发展过程中发挥的作用, 为肝硬化的早期诊断提供新思路.
收集2006-01/2009-01我院肝病住院患者40例, 肝硬化诊断均符合2000-09西安中华医学会传染病与寄生虫病学会分会肝病分会联合修订的标准, 慢性肝炎组均为乙型肝炎表面抗原阳性, 但病理检查未达到肝硬化诊断标准的患者, 正常对照组为经伦理委员会讨论批准的健康体检人员, 甲、乙、丙型肝炎肝均为阴性, 肝功能正常, 通过B超导向下肝穿刺活检, 取患者肝组织, 通过病理学诊断, 确定慢性肝炎组患者20例, 其中男12例, 女8例, 平均年龄53.55岁; 乙型肝炎后肝硬化组患者20例, 其中男8例, 女12例, 平均年龄50.35岁; 正常对照组10例, 其中男7例, 女3例, 平均年龄45.68岁, 肝病组均无原发性心肺肾疾病, 无肿瘤病史, 近期无服用硝基类药物史. iNOS测定试剂盒购自南京建成生物工程研究所; iNOS上下游引物均由上海生工生物工程公司合成; RNA抽提试剂TRIzol为美国Invitrogen公司产品; RT-PCR一步法试剂盒为德国QIAGEN产品; iNOS单克隆抗体购自美国Santa Cruz公司.
1.2.1 标本收集: 3组人员清晨空腹采肘静脉血(肝素钠抗凝)3 mL, B超导向下经肝穿刺门静脉插管取门静脉血约1 mL, 4 ℃ 4 000 r/min离心10 min, 分离血清-80 ℃冰箱保存; 所有受试者均在B超导向下经肝穿刺, 取肝组织1.8 cm×0.2 cm放入洁净EP管中密封, -80 ℃冰箱保存, 另取一次用100 g/L甲醛固定后, 石蜡包埋.
1.2.2 血清中iNOS活性的测定: 采用硝酸还原酶化学比色法, 根据试剂盒操作步骤检测.
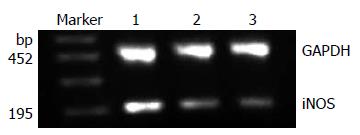
1.2.3 RT-PCR检测肝组织内iNOS mRNA的表达: 使用TRIzol法提取肝脏总RNA, 应用10 g/L的琼脂糖凝胶电泳检查RNA的完整性, 并用紫外分光光度仪行RNA浓度及纯度测定, A260/A280均为1.8-2.0说明RNA纯度较高. 应用RT-PCR一步法检测试剂盒对肝组织总RNA进行扩增. 设计引物, iNOS引物序列为: 上游: 5'- GGAGCCAGCTCTGCATTATC -3', 下游: 5'-TTTTGTCTCCAAGGGACCAG-3', 片段长度195 bp; 内参GAPDH引物序列: 上游: 5'-ACCACAGTCCATGCCATCAC-3', 下游: 5'-TCCACCACCCTGTTGCTGTA-3', 片段长度452 bp. iNOS的RT-PCR反应条件: 50 ℃, 30 min; 95 ℃, 15 min; 94 ℃, 30 s, 52 ℃, 45 s, 72 ℃, 60 s, 共35个循环; 72 ℃延伸10 min, 反应结束后, PCR产物用20 g/L的琼脂糖凝胶进行电泳分析, 采用Quantity one凝胶成像分析系统计算各个条带的吸光度值, 以iNOS/GAPDH比值表示iNOS mRNA的相对表达水平.
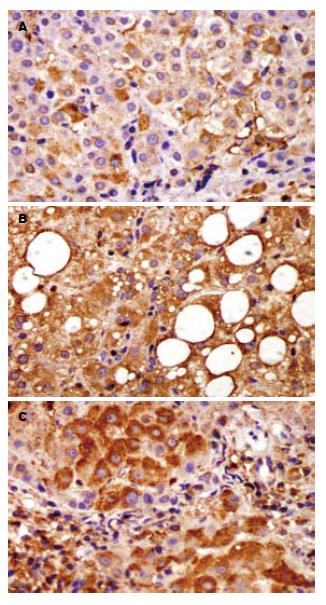
1.2.4 iNOS蛋白表达: 采用ABC免疫组织化学方法, 石蜡包埋组织后, 5 μm厚连续切片, 脱蜡至水, 抗原热修复, DAB显色, 苏木素复染, 脱水、透明, 中性树胶封片. 阳性部位在胞质处显棕黄色. 每例切片在低倍镜下将视野按十字形分为上、下、左、右、中5个区域, 然后在400倍镜视野下应用OLMPUS-DP70彩色病理图文分析系统, 测定免疫反应阳性产物灰度值, 灰度值越低说明表达越强, 反映细胞内蛋白表达量越多, 以灰度值来进行量化后的统计学分析.
统计学处理 采用SPSS13.0软件进行统计学分析, 所有数据以mean±SD表示, 采用方差分析进行组间比较, 使用独立样本t检验与相关性分析, P<0.05表示差异有统计学意义.
肝硬化组以及慢性肝炎组患者门静脉血iNOS活性与正常对照组比较均明显升高(F = 102.793, P<0.01). 在此基础上进一步行组间两两比较差异均有统计学意义. 肝硬化组以及慢性肝炎组患者外周静脉血iNOS活性与正常对照组比较也明显升高(F = 25.052, P≤0.01). 各组患者门静脉血与外周静脉血之间iNOS活力的比较, 正常对照组和慢性肝炎组门静脉血与外周静脉血之间iNOS活力相比差异无统计学意义, 但在肝硬化组, 门静脉血中iNOS活力明显高于外周静脉血, 二者差异有统计学意义(表1).
肝硬化组iNOS mRNA的相对表达量显著高于正常对照组(F = 26.832, P<0.01), 行Q检验示肝硬化组、慢性肝炎组及正常对照组两两比较均有统计学意义, 且随着肝硬化病变的加重, iNOS mRNA的表达逐渐增加(图1, 表2).
肝硬化是一种多种致病因素长期或反复作用于肝脏引起的肝实质弥漫性损害, 使肝细胞变性、坏死、再生, 导致肝小叶和肝血管结构的紊乱, 最终形成假小叶及血管重建, 进一步引起一系列肝功能损害和门静脉高压的临床表现, 病毒性肝炎是肝硬化发病的主要原因之一.
NO由L-精氨酸(L-argine)在NOS的作用下生成, NO是一种活性很强的自由基, 具有氧化、还原特性. 内源性NO是由L-精氨酸通过NOS的催化, 脱去胍基末端氮原子与氧结合而成. 在NO合成过程中, NOS是一重要的限速酶, 目前已经确定的NOS有3型[1]: 神经原型NOS(nNOS)主要分布在神经元细胞, 参与神经信息传递; 内皮型NOS(eNOS)主要分布于内皮细胞, 起着维持血液和淋巴循环的作用; 诱导型NOS(iNOS)分布广泛, 主要参与炎症反应. nNOS、eNOS在静息期细胞持续表达, 产生低浓度的NO, 发挥生理性调节作用, 所以也统称为结构型NOS, 受钙调素调控; 而iNOS在静息期细胞不表达, 在细胞受到各种刺激因子例如内毒素、IL-1β、TNF-α、IFN-γ等作用后可诱导激活iNOS, 以不依赖钙调素调控的方式促进NO的快速合成, 发挥特定的病理生理调节作用. iNOS主要分布在血管内皮、巨噬细胞、中性粒细胞、肝细胞等部位[2]. NO是一种强有力的血管内皮细胞舒张因子, 广泛参与机体生理功能的调节. NO作为一种细胞传导信使, 以扩散方式到达靶细胞, 在许多组织中发挥重要的生理和病理作用, 其重要作用是介导血管平滑肌扩张. 有很多实验证明, 在肝硬化患者和动物血浆中, NO水平明显增高, 且与疾病的严重性相关[3,4]. 有学者证实肝硬化门脉高压者内脏组织, 如腹主动脉、肠系膜动脉、肝脏、胃肠黏膜等NOS均表达升高, 致使内脏血管扩张从而使流入门静脉血量增多[5,6].
我们的研究显示: 在肝硬化患者门静脉血与外周血中iNOS活力与对照组、慢性肝炎组相比均明显升高; 研究还显示肝硬化时门静脉血较外周静脉血中iNOS活力升高更为明显, 表示iNOS活力在门脉系统中作用更为显著. 慢性肝炎及肝硬化肝组织中iNOS蛋白的表达以及iNOS mRNA的表达与对照组相比均明显增加, 且肝硬化组较慢性肝炎组iNOS蛋白及mRNA的表达也明显升高. 因此, iNOS慢性肝炎向肝硬化发展过程中可能逐渐增高, NO参与了慢性肝炎到肝硬化的发展进程.
然而在肝炎、肝硬化发病过程中, NO起损伤还是保护作用, 仍有争议. 潘红英等[7]报道, 慢性重型病毒肝炎(早期)患者血清NO的水平显著高于健康者, 且NO与总胆红素呈显著正相关, 与血浆凝血酶原活动度呈显著负相关, 由此说明, 慢重肝(早期)患者血清NO水平高低在一定程度上反映了肝细胞受损害的轻重, 可作为判定慢重肝(早期)的指标之一. Sharara等[8]在用IFN-α治疗丙型肝炎的过程中, 观察到NOS活性及NO含量随血清ALT和HCV mRNA的降低而升高, 提示NO水平与肝损害程度呈负相关, 推测NO在肝损害中具有保护作用. 然而, 另有研究显示: LPS和/或病毒诱生的IFN-γ、TNF-α等多种细胞因子导致肝细胞、库普弗细胞产生大量NO, 而NO可造成线粒体损伤, 即过量NO可致氧化性肝损伤. 因此, 长期高水平NO对细胞的毒性作用可能大于保护作用[9]. Stark等[10]的研究表明内毒素刺激的库普弗细胞和肝细胞的NO释放增加, NO水平的上升与肝细胞蛋白质合成的下降相平行, 表明NO能抑制肝细胞蛋白质的合成, 这可能是临床上常见的肝硬化患者易产生低蛋白血症的原因之一. NO可以通过抑制线粒体乌头酸酶活性对肝细胞的能量代谢产生重要影响. 另外, NO对肝细胞葡萄糖代谢、脂类代谢亦有影响, 并且可通过抑制DNA合成的酶类而抑制NOS DNA的合成, 早在1991年Vallance等[11]首先提出内源性NO合成和释放过多是引起肝硬化高动力循环的主要介质这一假说. 有学者对肝硬化患者血清NO水平与对照组进行比较, 发现肝硬化患者血清NO水平明显升高, 且随着病情进展呈递增性变化, 说明血清中NO水平与肝功能状态有关[12].
肝硬化门静脉高压主要与门静脉系统血流受阻以及内脏血流高动力循环有关, 二者均与肝硬化时血管活性物质的代谢紊乱密切相关. NO致门静脉高压高动力循环的机制是: (1)NO能与可溶性鸟苷酸环化酶活性基团的Fe2+结合, 使该酶激活, 激活的鸟苷酸环化酶作用于GTP使之转化为cGMP, 进而激活依赖于cGMP的蛋白激酶, 使胞质内游离Ca2+降低, 血管平滑肌舒张[13]. Pizcueta等[14]对CCl4所致大鼠肝硬化的研究表明, 在使用NOS抑制剂L-NMMA后肝硬化大鼠平均动脉压、内脏血管阻力、门静脉阻力显著升高, 心输出量、门静脉压力显著降低, 如预先给予L-精氨酸则可以阻断L-NMMA的有关效应, 提示NO参与了肝硬化门静脉高压时高动力循环的形成, 在肝硬化门静脉高压症的形成和维持中起着重要作用; (2)肝硬化时血清NO水平升高能够降低内脏血管对缩血管物质如内皮素、去甲肾上腺素、血管紧张素等的敏感性[15]; (3)NO对门脉系统侧支循环的建立也起一定作用, NO能使血管括约肌舒张, 或引起A-V短路开放, 可导致门静脉血流量和内脏血流量的进一步增加[16].
由此我们推测NO含量升高主要因为高水平的内毒素通过刺激巨噬细胞、库普弗细胞释放细胞因子, 诱导诱生型一氧化氮合酶生成大量NO, 硬化的肝窦内皮细胞内皮型一氧化氮合酶功能减退, NO释放减少使肝内血管阻力增加, 进一步促进肝硬化的发展.
目前对于NO对肝炎、肝硬化形成的作用机制并未完全阐明, 但是气体信号分子NO体系的确参与了肝硬化门静脉高压的形成, 并对肝脏的血流调节具有重要的作用, 而NO与其他信号分子之间有无相互调节作用, 均有待于进一步的研究证实.
在病毒性肝炎和肝硬化的发生、发展过程中, 内源性NO是一个非常重要的生理性及病理生理性因子, 但NO与肝病的确切关系有待进一步阐明.
朱传武, 主任医师, 江苏省苏州市第五人民医院传染科.
肝病患者血清NO水平明显升高, 说明NO参与肝炎、肝炎后肝硬化发病过程, 寻求NO在慢性肝病损害和保护作用的浓度界限, 有可能为利用NO控制慢性肝病、肝硬化提供新的治疗方案.
Stark等的研究表明内毒素刺激的库普弗细胞和肝细胞的NO释放增加, NO水平的上升与肝细胞蛋白质合成的下降相平行, 表明NO能抑制肝细胞蛋白质的合成, 这可能是临床上常见的肝硬化患者易产生低蛋白血症的原因之一.
本文采用门静脉取血的方法测定门静脉血中iNOS的含量并与外周静脉血比较差异.
本研究提示, 门静脉取血的方法相对安全, 门静脉血中相关因子的变化可相对直接的反应肝脏病理生理变化.
本文通过检测慢性肝炎和肝硬化患者外周静脉血、门静脉血及肝组织中iNOS/NO体系的表达, 进一步说明NO与肝硬化的关系, 具有一定的意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Rockey DC, Shah V. Nitric oxide biology and the liver: report of an AASLD research workshop. Hepatology. 2004;39:250-257. [PubMed] [DOI] |
| 2. | Stadler J, Billiar TR, Curran RD, Stuehr DJ, Ochoa JB, Simmons RL. Effect of exogenous and endogenous nitric oxide on mitochondrial respiration of rat hepatocytes. Am J Physiol. 1991;260:C910-C916. [PubMed] |
| 3. | Huang YQ, Xiao SD, Zhang DZ, Mo JZ. Nitric oxide synthase distribution in esophageal mucosa and hemodynamic changes in rats with cirrhosis. World J Gastroenterol. 1999;5:213-216. [PubMed] |
| 5. | Ohta M, Tarnawski AS, Itani R, Pai R, Tomikawa M, Sugimachi K, Sarfeh IJ. Tumor necrosis factor alpha regulates nitric oxide synthase expression in portal hypertensive gastric mucosa of rats. Hepatology. 1998;27:906-913. [PubMed] [DOI] |
| 6. | Sánchez-Rodríguez A, Criado M, Rodríguez-López AM, Esteller A, Martín de Arriba A, López-Novoa JM. Increased nitric oxide synthesis and inducible nitric oxide synthase expression in patients with alcoholic and non-alcoholic liver cirrhosis. Clin Sci (Lond). 1998;94:637-643. [PubMed] |
| 7. | 潘 红英, 童 永喜, 娄 国强, 俞 秀丽, 卢 德荣, 吴 惟一. N-乙酰半胱氨酸对重型病毒性肝炎患者血清一氧化氯水平的影响. 中国现代应用药学杂志. 2004;21:255-257. |
| 8. | Sharara AI, Perkins DJ, Misukonis MA, Chan SU, Dominitz JA, Weinberg JB. Interferon (IFN)-alpha activation of human blood mononuclear cells in vitro and in vivo for nitric oxide synthase (NOS) type 2 mRNA and protein expression: possible relationship of induced NOS2 to the anti-hepatitis C effects of IFN-alpha in vivo. J Exp Med. 1997;186:1495-1502. [PubMed] [DOI] |
| 10. | Stark ME, Szurszewski JH. Role of nitric oxide in gastrointestinal and hepatic function and disease. Gastroenterology. 1992;103:1928-1949. [PubMed] |
| 11. | Vallance P, Moncada S. Hyperdynamic circulation in cirrhosis: a role for nitric oxide? Lancet. 1991;337:776-778. [PubMed] [DOI] |
| 12. | Wiest R, Groszmann RJ. The paradox of nitric oxide in cirrhosis and portal hypertension: too much, not enough. Hepatology. 2002;35:478-491. [PubMed] [DOI] |
| 13. | Dufour JF, Turner TJ, Arias IM. Nitric oxide blocks bile canalicular contraction by inhibiting inositol trisphosphate-dependent calcium mobilization. Gastroenterology. 1995;108:841-849. [PubMed] [DOI] |
| 14. | Pizcueta P, Piqué JM, Fernández M, Bosch J, Rodés J, Whittle BJ, Moncada S. Modulation of the hyperdynamic circulation of cirrhotic rats by nitric oxide inhibition. Gastroenterology. 1992;103:1909-1915. [PubMed] |
| 15. | Hartleb M, Moreau R, Cailmail S, Gaudin C, Lebrec D. Vascular hyporesponsiveness to endothelin 1 in rats with cirrhosis. Gastroenterology. 1994;107:1085-1093. [PubMed] |
| 16. | Lee FY, Colombato LA, Albillos A, Groszmann RJ. Administration of N omega-nitro-L-arginine ameliorates portal-systemic shunting in portal-hypertensive rats. Gastroenterology. 1993;105:1464-1470. [PubMed] |