修回日期: 2009-12-31
接受日期: 2010-01-04
在线出版日期: 2010-02-28
目的: 探讨慢性HBV感染者外周血Vα24自然杀伤T细胞(NKT)数量变化及其与肝脏损伤程度的关系.
方法: 观察对象为慢性乙型肝炎(CHB)患者26例、乙型肝炎后肝硬化患者(LC)9例、慢加急性肝衰竭患者(ACLF)8例和7名正常对照组(NC), 入院后次日清晨取静脉全血2 mL, 裂解红细胞后, 采用流式细胞仪检测外周血Vα24 NKT细胞数量占外周血T淋巴细胞的比例, 同时检测肝功能、凝血功能判断肝脏损害程度.
结果: CHB, ACLF组患者外周血Vα24 NKT细胞数量分别为0.8012%±0.2979%、0.4638%±0.2244%, 明显低于正常对照组(1.1114%±0.3546%, P<0.05); CHB中度及重度患者NKT数(0.7344%±0.2441%, 0.6925%±0.3612%)明显低于正常对照组. NKT数与凝血酶原活动度(PTA)呈显著正相关, 与血清总胆红素(TB)呈显著负相关.
结论: 慢性HBV感染者外周血Vα24 NKT细胞数明显降低, 并随肝损害程度加重而减少, 提示Vα24 NKT细胞可能参与CHB患者肝细胞损伤.
引文著录: 黄晓刚, 苏毅, 林世德, 龙骏, 陈应华, 刘士荣. 慢性HBV感染者外周血Vα24 NKT细胞数量变化及其与肝脏损害程度的关系. 世界华人消化杂志 2010; 18(6): 601-605
Revised: December 31, 2009
Accepted: January 4, 2010
Published online: February 28, 2010
AIM: To investigate the changes in the number of Vα24 natural killer (NK) T cells in peripheral blood and its possible correlation with the severity of hepatic injury in patients with chronic hepatitis B virus (HBV) infection.
METHODS: Twenty-six patients with chronic hepatitis B (CHB), 9 patients with liver cirrhosis (LC), 8 patients with acute-on-chronic liver failure (ACLF), and 7 normal controls (NCs) were included in the study. The percentage of Vα24 NK T cells in total peripheral blood T lymphocytes was determined by flow cytometry.
RESULTS: The percentages of Vα24 NKT cells in patients with CHB and ACLF were significantly lower than that in NCs (0.8012% ± 0.2979% and 0.4638% ± 0.2244% vs 1.1114% ± 0.3546%, respectively, both P < 0.05). The percentage of Vα24 NK T cells had a significant positive correlation with prothrombin time (PT) and a significant negative correlation with total bilirubin (TB), but had no significant correlations with serum alanine aminotransferase (ALT) and HBV DNA level.
CONCLUSION: The percentage of Vα24 NK T cells in peripheral blood decreases with the aggravation of hepatic injury in patients with chronic HBV infection, implying that Vα24 NKT cells play an important role in the pathogenesis of chronic hepatitis B.
- Citation: Huang XG, Su Y, Lin SD, Long J, Chen YH, Liu SR. Correlation of peripheral blood Vα24 NK T cell count with the severity of hepatic injury in patients with chronic hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 601-605
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/601.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.601
自然杀伤T细胞(natural killer T cells, NKT)是一个具有自然杀伤细胞(NK)受体及功能的T细胞亚群, 人类NKT细胞表面特异性的标记是TCRVα24片段, 通常和Vβ11片段结合[1,2]. NKT活化时主要识别抗原提呈细胞表面分化抗原CD1d分子提呈的糖脂类抗原[3], 并在活化后释放高水平性的γ-干扰素(IFN-γ)和白介素(IL-4)等[4], 对于免疫应答的方向起着重要调节作用. 并且NKT在肝脏优势聚集, 占肝脏T淋巴细胞数的20%-30%[5,6]. 这种倾向性的分布说明NKT细胞在肝脏的局部免疫中有着重要地位. 多数学者认为, NKT细胞以CD3+CD56+作为表面标志[7], 但近年来研究认为CD3+CD56+细胞为细胞因子诱导的杀伤细胞(cytokine-induced killer cell, CIK细胞)主要的效应细胞, CIK细胞表面也同时表达T细胞和NK细胞的表面标志, 是一类NKT 样细胞群[8], 国内有些研究将NKT细胞完全等同于CD3+CD56+CIK细胞[9,10]. 最新文献证实, NKT细胞表面特异性标志是TCRVα24[11]. 因此, 本试验选择抗-TCRVα24单克隆抗体作为特异性标志物进行检测. 最近在动物模型中的研究提示NK细胞或NKT细胞参与多种病因引起的肝细胞损伤, 但对NK细胞或NKT细胞在慢性HBV感染者肝细胞损伤机制中的作用尚不清楚. NKT细胞为固有免疫细胞, 对不同HBV感染患者的外周血Vα24 NKT细胞数量变化未见报道. 本试验通过流式细胞术检测乙型肝炎患者外周血中的NKT细胞数, 并探讨其与肝脏损伤程度的关系, 初步探索NKT细胞在乙型肝炎患者发病机制中的作用.
2009-04/2009-08贵州省遵义医学院第一附属医院住院的慢性HBV感染患者43例及门诊体检者7例, 慢性HBV感染者及肝损伤分度参照2000年《病毒性肝炎防治方案》[12]的诊断标准. 各组分别为门诊健康体检者7例, 女2例, 男5例, 年龄22-38岁. HBV感染患者43例, 女16例, 男27例, 年龄11-70岁, 血清学抗HCV、HDV、HGV、HIV阴性; 并除外自身免疫性及酒精性肝病和肝占位性病变.
1.2.1 标本采集: 健康对照组标本为门诊体检肝功能正常的早晨空腹外周静脉血, 慢性乙型肝炎病毒感染者均为入院后次日清晨取1 mL静脉全血肝素钠抗凝.
1.2.2 一般治疗: 所有患者住院前未接受正规治疗, 入院后予保肝降酶等对症治疗, 慢性乙型肝炎、乙型肝炎后肝硬化和慢加急性肝衰竭据病情予干扰素或核苷类似药物抗病毒治疗, 均未用糖皮质激素等特殊治疗.
1.2.3 流式细胞仪检测: 取肝素钠抗凝全血100 μL, 加入荧光标志的单克隆抗体CD3-FITC 10 μL、TCRVα24-PE 20 μL, 混匀, 4 ℃避光孵育30 min, 加入2 mL红细胞裂解液, 迅速于混旋器上混匀, 室温放置8 min, 弃上清液, 加PBS 2 mL洗涤, 离心, 转速为1 000 r/min, 5 min, 弃上清液, 加220 μL固定液混匀后, 立即上流式细胞仪检测. 用美国BD公司FACSCalibur流式细胞仪, 启动FACSCom软件, 使仪器处于最佳工作状态. 采用Cellquest软件检测及分析. 测定时各荧光通道均以相应同型(isotype)IgG染色细胞作阴性对照.
统计学处理 研究数据按成组统计要求收集、整理, 用SPSS13.0软件进行数据统计分析. 数值用mean±SD表示, 组间比较采用成组设计的t检验, 并进行直线相关分析.
各组间男女比例和年龄差别统计学无意义. 血常规的白细胞(WBC)和血小板计数(PLT)在各组间统计学无意义. 肝功、凝血功能和甲胎蛋白(AFP)统计学结果见表1.
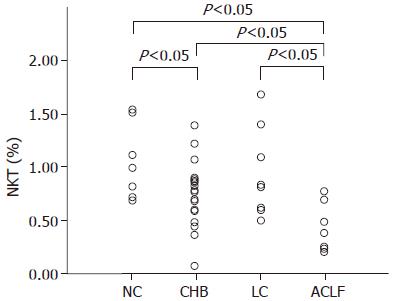
各组患者外周血NKT细胞数检测结果: CHB组(0.8012%±0.2979%)及ACLF组(0.4638%±0.2244%)患者外周血NKT细胞数明显低于正常对照组(1.1114%±0.3546%, P<0.05), LC组(0.9856%±0.3926%)与NC组(1.1114%±0.3546%)比较无显著差异. 从图1可以看出, ACLF患者组降低最为明显, 最高值为0.83%、最低值为0.26%. 而肝硬化患者外周血NKT细胞差异较大, 虽然多数患者在1.0%以下, 少数患者与正常对照组比较无明显降低.
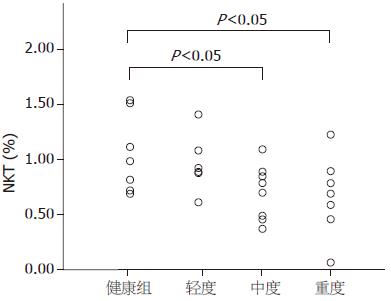
从图2可以看出慢性乙型肝炎患者随肝损害程度加重, NKT细胞明显降低. 慢性乙型肝炎轻度患者NKT细胞与正常对照比较无显著差异, 而中度及重度患者NKT细胞数显著低于正常对照组.
NKT细胞数与凝血酶原活动度(PTA)呈显著正相关(r = 0.336, P<0.05), 与总胆红素(TB)呈显著负相关(r = -0.297, P<0.05). 和ALT、CHE、AFP、WBC及HBV DNA无明显相关性.
NKT细胞是一类特殊的T淋巴细胞, 他可识别非典型MHC-Ⅰ样的CD1d分子表面糖脂类抗原[13,14]. NKT细胞强大的免疫调节功能及其自身具有的细胞毒性, 并且可在肝脏内倾向性地大量聚集, 而肝细胞本身也表达NKT细胞的配体CD1d, 从而具有激活NKT细胞的能力, 提示着NKT细胞可能在肝脏局部免疫中起着重要作用.
NKT细胞有两种功能, 一方面他有较弱的抗病毒, 抗肿瘤的作用, 可通过Fas-FasL途径和分泌穿孔素等直接介导细胞毒作用. 更为重要的功能是其双向的免疫调节功能, 使机体TH1与TH2处于相对平衡的状态. 当HBV诱导肝脏免疫紊乱引起T细胞免疫耐受打破, 细胞毒性T细胞(CTL)可导致肝细胞的免疫性损伤. 因此, 外周血NKT细胞可发挥其弱的抗病毒的作用, 但由于NKT细胞数量及功能的低下, 其调节免疫的功能减弱, 促使调节TH0向TH2转化的能力下降, 肝脏炎症仍可进一步的加重.
激活后的NKT细胞产生大量的细胞因子, 在肝脏受损、纤维化和损伤修复过程中发挥抗病毒、预防肿瘤及免疫调节方面等重要的作用. NKT细胞在自身免疫性肝炎的作用已被证明[15,16]. 故而, NKT细胞在天然免疫和特异性免疫之间起着重要的桥梁作用.
在CCl4处置引起的慢性肝损伤模型中, 其NKT细胞枯竭与敲除Ja18基因野生型小鼠所产生的肝脏炎症和损伤是一致的[17]. 这表明在慢性的肝脏炎症与损伤中NKT细胞可能发挥有限的作用, 可能是由于肝NKT细胞耗竭. 最新的证据提示在许多的鼠类模型中, 激活的NK/NKT细胞也促成了肝损伤的发展及进程[18,19]. 也从反面证实NKT在肝脏炎症损伤中所起的作用. 另外, CXCR6及CXCL16在诱导肝脏NKT细胞募集中的重要作用也提供了明确的证据[6,20].
基于上述事实, 我们的实验主要是通过探寻NKT细胞在不同肝炎组中其外周血的分布变化的规律, 从而间接阐明NKT细胞在乙型肝炎发病机制中所起的作用. 我们的实验结果显示, 正常健康人组与HBV感染者组中(慢性中、重度组、肝衰竭组)外周血NKT细胞的数量分布有明显的统计学差异, 随肝损害程度加重NKT细胞降低明显, 并与PTA呈正相关, 与TB呈负相关, 提示NKT细胞数与乙型肝炎患者肝细胞损伤程度有关. 另外, 我们发现正常健康人组与肝硬化无明显的统计学差异, 其原因可能与肝硬化化患者主要以肝脏的纤维化为主, 而其肝脏炎症损伤不明显, 提示慢性HBV感染者外周血NKT细胞数主要与肝脏炎症损害程度相关, 与肝脏纤维化程度无明显相关.
乙型肝炎患者外周血NKT细胞降低的原因尚不清楚, 可能与肝脏募集外周循环血液中的淋巴细胞有关, 因为肝窦内皮细胞有孔窗并且缺乏基底膜, 这种独特的解剖使得肝脏更有利于直接或间接引发的淋巴细胞富集[21], 调节免疫反应, 以清除病原体感染的肝细胞; 也可能是由于HBV直接作用于NKT细胞, 使之发生损伤或凋亡而减少. 因为既往的研究提示HBV既可感染肝细胞, 又可以感染外周血单个核细胞[22].
慢性HBV感染者NKT细胞的总体水平均降低的意义尚不清楚. 我们曾检测2例急性自限性乙型肝炎外周血NKT细胞含量(结果未报告), 发现明显高于健康对照组和慢性感染组(分别为: 2.31%, 2.56%), 考虑可能是急性HBV初次感染, 激活了NKT细胞的活性, 发挥抗HBV的作用. 提示慢性肝炎患者外周血NKT细胞降低可能和HBV感染后病情的慢性化有关, NKT细胞在HBV感染慢性化中的作用还值得今后进一步探讨.
尽管肝脏NK/NKT细胞的作用在动物模型中已被广泛的研究, 但他们在肝脏疾病中发挥的作用目前仍不清楚. 进一步阐述肝脏NK/NKT细胞在肝脏疾病中的作用, 可能对今后开展乙型肝炎的免疫治疗开创新的思路. 考虑分离出乙型肝炎患者体内的NKT细胞, 在体外培养扩增, 回输到患者体内; 或者应用某种药物, 例如NKT细胞的刺激物α-GalCer, 在乙型肝炎患者体内直接刺激NKT细胞使其活化、增殖以提高抗HBV的能力. 因此, 关于NKT细胞的作用机制及其在临床的应用价值仍有待进一步探讨.
最近在动物模型中的研究提示NK细胞或NKT细胞参与多种病因引起的肝细胞损伤, 但对NK细胞或NKT细胞在慢性乙型肝炎病毒(HBV)感染者肝细胞损伤机制中的作用尚不清楚.
姚希贤, 教授, 河北医科大学附属第二医院消化内科
自然杀伤T(NKT)细胞是近年来新发现的一种新型免疫细胞. 近年来的研究认为NKT细胞在机体免疫自稳、抗感染和抗肿瘤免疫等方面具有重要的作用. NKT细胞活化后能迅速产生高水平的IFN-γ, 且其细胞毒活性亦增强, 因此NKT细胞具有抗病毒的潜能. 目前国内外尚无人体NKT细胞抗HBV的体内研究.
Guidotti等研究发现急性感染HBV的黑猩猩体内确实存在发挥非细胞毒性作用的HBV DNA清除机制. 而且这种效应细胞分泌表达的IFN-γ细胞因子可能是由NKT或NKT活化的NK细胞产生.
本研究通过探讨HBV感染者外周血Vα24 NKT细胞与肝脏损害程度的相关性, 以期阐明Vα24 NKT细胞在CHB免疫损伤机制中的作用及途径, 为下一步开展以IFN-γ及诱导NKT细胞为基础的免疫治疗慢性乙型肝炎提供理论依据, 寻找出一种乙型肝炎的治疗新途径.
本研究内容新颖, 分析论证合乎逻辑, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Dellabona P, Padovan E, Casorati G, Brockhaus M, Lanzavecchia A. An invariant V alpha 24-J alpha Q/V beta 11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J Exp Med. 1994;180:1171-1176. [PubMed] [DOI] |
| 2. | Porcelli S, Gerdes D, Fertig AM, Balk SP. Human T cells expressing an invariant V alpha 24-J alpha Q TCR alpha are CD4- and heterogeneous with respect to TCR beta expression. Hum Immunol. 1996;48:63-67. [PubMed] [DOI] |
| 3. | Nieda M, Nicol A, Koezuka Y, Kikuchi A, Takahashi T, Nakamura H, Furukawa H, Yabe T, Ishikawa Y, Tadokoro K. Activation of human Valpha24NKT cells by alpha-glycosylceramide in a CD1d-restricted and Valpha24TCR-mediated manner. Hum Immunol. 1999;60:10-19. [PubMed] [DOI] |
| 4. | Zhai WH, Huang Y, Wang M, Zhou Z, Zhai WJ, Zhang RL, Zhang P, Han MZ. [Expansion and cytokine secretion profile of human valpha24(+) NKT cells from different sources]. Zhongguo Shiyan Xueyexue Zazhi. 2009;17:633-636. [PubMed] |
| 5. | Matsuda JL, Naidenko OV, Gapin L, Nakayama T, Taniguchi M, Wang CR, Koezuka Y, Kronenberg M. Tracking the response of natural killer T cells to a glycolipid antigen using CD1d tetramers. J Exp Med. 2000;192:741-754. [PubMed] [DOI] |
| 6. | Geissmann F, Cameron TO, Sidobre S, Manlongat N, Kronenberg M, Briskin MJ, Dustin ML, Littman DR. Intravascular immune surveillance by CXCR6+ NKT cells patrolling liver sinusoids. PLoS Biol. 2005;3:e113. [PubMed] [DOI] |
| 7. | Schmidt-Wolf IG, Negrin RS, Kiem HP, Blume KG, Weissman IL. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. J Exp Med. 1991;174:139-149. [PubMed] [DOI] |
| 8. | Alvarnas JC, Linn YC, Hope EG, Negrin RS. Expansion of cytotoxic CD3+ CD56+ cells from peripheral blood progenitor cells of patients undergoing autologous hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2001;7:216-222. [PubMed] [DOI] |
| 10. | 邱 大鹏, 邱 双健, 吴 志全, 樊 嘉, 叶 胜龙, 余 耀, 周 俭, 蔡 晓燕. NKT细胞在肝癌组织中的分布状况与肝癌局部免疫的研究. 中国临床医学. 2004;11:567-569. |
| 11. | Prussin C, Foster B. TCR V alpha 24 and V beta 11 coexpression defines a human NK1 T cell analog containing a unique Th0 subpopulation. J Immunol. 1997;159:5862-5870. [PubMed] |
| 13. | Kronenberg M. Toward an understanding of NKT cell biology: progress and paradoxes. Annu Rev Immunol. 2005;23:877-900. [PubMed] [DOI] |
| 14. | Bendelac A, Savage PB, Teyton L. The biology of NKT cells. Annu Rev Immunol. 2007;25:297-336. [PubMed] [DOI] |
| 15. | Dennert G, Aswad F. The role of NKT cells in animal models of autoimmune hepatitis. Crit Rev Immunol. 2006;26:453-473. [PubMed] |
| 16. | Mattner J, Savage PB, Leung P, Oertelt SS, Wang V, Trivedi O, Scanlon ST, Pendem K, Teyton L, Hart J. Liver autoimmunity triggered by microbial activation of natural killer T cells. Cell Host Microbe. 2008;3:304-315. [PubMed] [DOI] |
| 17. | Park O, Jeong WI, Wang L, Wang H, Lian ZX, Gershwin ME, Gao B. Diverse roles of invariant natural killer T cells in liver injury and fibrosis induced by carbon tetrachloride. Hepatology. 2009;49:1683-1694. [PubMed] [DOI] |
| 18. | Notas G, Kisseleva T, Brenner D. NK and NKT cells in liver injury and fibrosis. Clin Immunol. 2009;130:16-26. [PubMed] [DOI] |
| 19. | Dong Z, Wei H, Sun R, Tian Z. The roles of innate immune cells in liver injury and regeneration. Cell Mol Immunol. 2007;4:241-252. [PubMed] |
| 20. | Germanov E, Veinotte L, Cullen R, Chamberlain E, Butcher EC, Johnston B. Critical role for the chemokine receptor CXCR6 in homeostasis and activation of CD1d-restricted NKT cells. J Immunol. 2008;181:81-91. [PubMed] |
| 21. | Racanelli V, Rehermann B. The liver as an immunological organ. Hepatology. 2006;43:S54-S62. [PubMed] [DOI] |
| 22. | Cabrerizo M, Bartolomé J, Carreño V. In vitro infection of human peripheral blood mononuclear cells by a defective hepatitis B virus with a deletion in the PreS1 region of the viral genome. J Viral Hepat. 2002;9:265-271. [PubMed] [DOI] |