修回日期: 2009-12-20
接受日期: 2009-12-29
在线出版日期: 2010-02-28
目的: 研究不同时程慢性束缚水浸应激大鼠胃窦Cajal间质细胞(ICC)的超微结构改变.
方法: ♂SD大鼠48只随机分为6组, 即实验3、7、28 d组和对照3、7、28 d组, 每组8只. 实验组每日束缚水浸1 h, 对照组自由摄食饮水; 于实验第4、8、29天晨禁食12 h后脱颈处死. 取胃窦组织2块放入3%戊二醛中固定并电镜下观察ICC超微结构.
结果: 所有对照组ICC的超微结构均无异常改变, 试验3、7、28 d各组ICC的超微结构与同期对照组比较均有明显的损害, 主要表现为ICC的缝隙连接减少、细胞器减少等, 以肌内ICC(ICC-MY)和肌间ICC(ICC-IM)为主; 随着应激时间的延长, ICC的超微结构受损逐渐加重.
结论: 慢性束缚水浸应激可以损伤大鼠胃窦ICC的超微结构.
引文著录: 张丹, 夏志伟, 韩亚京. 不同时程慢性束缚水浸应激对大鼠胃窦Cajal间质细胞超微结构的影响. 世界华人消化杂志 2010; 18(6): 581-585
Revised: December 20, 2009
Accepted: December 29, 2009
Published online: February 28, 2010
AIM: To investigate the impact of chronic water immersion-restraint stress on the ultrastructure of interstitial cells of Cajal (ICC) in the gastric antrum of rats.
METHODS: Forty-eight male Sprague-Dawley rats were randomly and equally divided into six groups: three experimental groups and three matched control groups. The three experimental groups underwent water immersion-restraint stress for one hour daily for 3, 7 and 14 days, respectively, while the three control groups were allowed free access to food and water. On days 4, 15 and 28, the rats in both the experimental and control groups were sacrificed. Two pieces of antrum tissues were taken from each rat and fixed in 3% glutaraldehyde for electron microscopic examination.
RESULTS: ICC were normal in all the control groups but showed visible injuries in the three experimental groups. With the prolongation of the stress, the morphological damage became more evident in ICC, especially in inter-muscular ICC (ICC-MY) and intramuscular ICC (ICC-IM). Major ultrastructural changes in ICC included reduced number of gap junctions and organelles.
CONCLUSION: Chronic water immersion-restraint stress can lead to ultrastructural damage in ICC in the gastric antrum of rats.
- Citation: Zhang D, Xia ZW, Han YJ. Ultrastructural changes in interstitial cells of Cajal in the gastric antrum of rats undergoing water immersion-restraint stress. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 581-585
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/581.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.581
以往的研究已经证明, 慢性束缚水浸应激可以导致大鼠胃排空功能的改变[1-3]. 影响胃动力的因素多种多样, ICC可能参与其中. 以往的研究多集中在ICC数量上的改变方面, 且多数以急性应激刺激为主, 更多的研究着眼于糖尿病相关的ICC细胞损伤[4]. 本研究拟通过不同时程的慢性低强度应激刺激实验来观察大鼠胃窦ICC的超微结构改变, 探讨慢性应激损伤胃排空功能的可能机制.
SD健康♂大鼠, 体质量150-160 g, 购自北京大学医学部实验动物部, 并按照SPF级别动物饲养要求饲养. 本研究得到北京大学医学部动物保护委员会伦理批准.
1.2.1 分组: 将18只大鼠随机分成实验组和对照组, 对照组不接受任何刺激, 自由摄食饮水; 实验组每日上午于21 ℃水浴箱内束缚水浸1 h. 于实验第3、7、28天20:00后禁食, 次日8:00将实验组及同期对照组大鼠序贯脱颈处死.
1.2.2 取材: 全部大鼠剖腹后结扎贲门及幽门, 在结扎部位远端0.5 cm处游离全胃, 滤纸拭干称质量; 注入2%甲醛5 mL进行内固定, 20 min后沿胃大弯侧剪开, 去离子水冲洗干净. 即刻剪取腺胃幽门旁0.5 cm前壁大弯侧组织2块, 大小为2 mm×1 mm, 立即放入戊二醛(3%)固定液中固定, 送北医病理电镜室.
1.2.3 电镜观察: 固定后的组织用0.2 mol/L蔗糖磷酸缓冲液漂洗, 再用2%的四氧化锇后固定1 h, 丙酮中梯度脱水, 在1%醋酸双氧铀中停滞染色1 h, 再通过环氧丙烷与环氧树脂. 1 mm切片用亚甲蓝染色, 在光镜下观察, 确定黏膜层、环形肌层、纵行肌层. 超薄切片用酒精醋酸双氧铀、再用柠檬酸盐后染色, 保留纵行肌层、环形肌层、黏膜下层、部分黏膜层, 用HITACHI H-600透射电镜观察、照相.
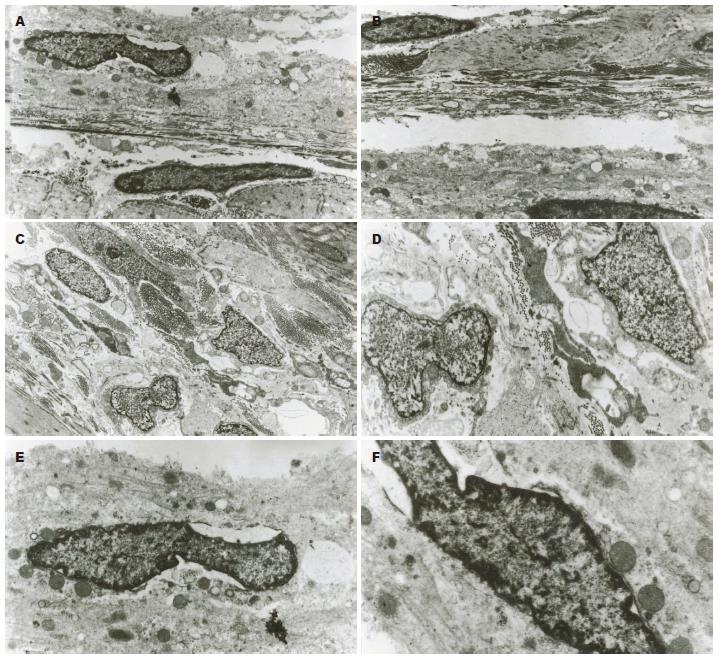
2.1.1 形态: 对照组大鼠胃的平滑肌细胞排列整齐, 肌细胞内细胞器丰富, 线粒体的嵴较多. 肌间丛神经元的胞核清晰, 细胞器丰富, 并有大量线粒体及粗面内质网, 神经轴突和树突末梢处电子密度均匀, 神经膨体内有较多的突触小泡. 紧邻肌间丛神经元可见ICC. ICC多为细长形、纺锤形(图1A)、梭形(图1B)、椭圆形(图1C)星形或不规则形(图1D), 细胞突起较多, 突起较长, 突起常放射状变平, 在突起中有很多中间丝和细丝. ICC与其他的ICC之间、ICC与平滑肌细胞和神经细胞之间多见由紧密并置的质膜形成的缝隙连接(图1C). 有丰富的沿细胞膜分布的膜下小空腔, 有较完整的基膜, 细胞核多不规则, 细胞核大, 占细胞大部分, 胞质较少, 异染色质较多见, 沿核膜下分布, 结构清晰, 胞质和突起内线粒体非常丰富, 常紧密排列在胞质里, 游离核糖体与多聚核糖体多见, 可见到发达的粗面内质网、滑面内质网、高尔基体(图1E, F). 其胞质突起围绕神经束形成不完整的髓鞘样结构, 壁内神经及ICC的突起相互连接形成网络, 分布均匀.
2.1.2 分布: ICC主要分布于环行肌细胞之间(ICC-IM)及环行肌层与纵行肌层之间(ICC-MY), 而内外环形肌之间ICC(ICC-DMP)及环行肌层的内表面ICC(ICC-SM)则相对较少. ICC细胞往往与神经纤维末梢及神经束伴随存在, 并由许多的缝隙连接紧密连接在一起. 存在于肌细胞之间的ICC形状较圆, 存在于环行肌层内的ICC形状则为细长形.
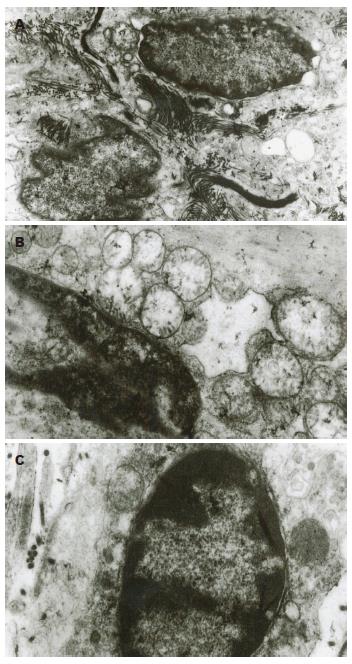
2.2.1 3 d组: (1)ICC与其他细胞之间的缝隙连接稍有减少, 尚存的细胞连接结构较完整, 连接较对照组松散(图2A); (2)ICC核周的细胞质无明显减少, 但空泡样变增多, 线粒体空泡样肿胀(图2B), 胞质广泛溶解, 胞质内可见自噬性空泡(图2A); (3)ICC基膜与细胞膜未分离, 无空洞形成; (4)ICC内的细胞器数量较正常减少, 核糖体减少, 内质网轻度扩张(图2A); (5)核内染色质边集(图2C), 可见少许凋亡小体.
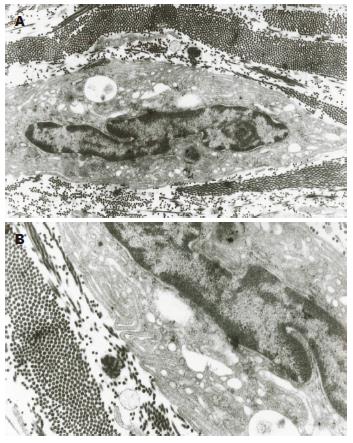
2.2.2 7 d组: (1)缝隙连接减少较3d组显著, 尚存的细胞连接结构也有所破坏, 连接松散; (2)ICC核周的细胞质空泡样变加重, 线粒体肿胀, 部分嵴消失, 胞质广泛溶解; (3)ICC基膜不完整, 与细胞膜部分分离, 可见空洞形成; (4)ICC内的细胞器数量较正常减少, 核糖体减少, 内质网轻度扩张, 粗面内质网脱颗粒; (5)核固缩, 核内异染色质明显, 形成空网状结构, 核内凋亡小体增多(图3).
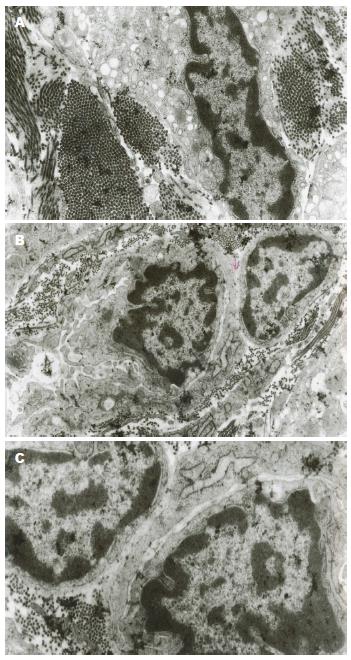
2.2.3 28 d组: (1)缝隙连接显著减少, 尚存的细胞连接结构也有破坏, 结构不清, 连接松散; (2)ICC核周的细胞质明显减少, 线粒体肿胀, 胞质广泛溶解, 胞质内可见许多自噬性空泡; (3)ICC基膜与细胞膜部分分离, 形成空洞; (4)ICC内的细胞器数量较正常减少, 核糖体减少, 内质网扩张, 粗面内质网脱颗粒; (5)核固缩, 核内异染色质明显, 形成空网状结构, 核内凋亡小体多见(图4).
本研究的透射电镜观察显示: 正常情况下ICC的主要分布区域在肌间和肌内, 这与文献报道一致[5,6]. 慢性束缚水浸应激后, 实验组ICC超微结构出现明显的损害, 其受损的主要表现为缝隙连接减少、细胞器减少等; 随着应激时间的延长, ICC超微结构受损情况逐渐加重, 而且以ICC-MY和ICC-IM为主.
缝隙连接也叫融合膜, 是细胞间隙内的窄缝. 并列的细胞膜在这里不融合, 而是被一个宽20-40 A的缝隙隔开, 示踪剂硝酸镧可以显示缝隙内的六角形排列的颗粒. 融合膜是一个对传递生物电信息和代谢信息阻力特别低的细胞膜区域. 大鼠的平滑肌细胞之间、平滑肌与神经细胞及ICC与平滑肌细胞、ICC与神经细胞间均可通过缝隙连接和牙样突起而互相连接, 周围细胞质特别富于微胞饮小泡, 而质膜的其余部分被基板、胶原和网状纤维包围着. 缝隙连接和牙样突起共同保证了动作电位的传导以及同步收缩. 广泛的缝隙连接成为ICC适应作为神经系统控制胃肠平滑肌运动的中介的结构基础[7]; 慢性束缚水浸后细胞连接破坏, 导致缝隙连接减少, 神经系统对肌细胞的调节减弱. 因而其作为胃肠运动起搏细胞和作为神经细胞控制肌细胞运动的中介功能显著下降, 可能引致胃肠道慢波节律减慢或紊乱, ICC的损伤很可能是慢性应激大鼠胃动力改变的原因之一.
对照组大鼠胃窦ICC超微结构显示, 线粒体含量丰富, 滑面内质网、粗面内质网和高尔基体丰富, 说明其具有活跃的合成功能, 这一特征支持ICC作为胃肠道慢波起搏细胞的需要. 接受慢性应激刺激后, ICC的细胞器减少, 突出表现在线粒体数量减少, 随应激时间的延长改变更加显著, 线粒体肿胀, 甚至溶解. 内质网也出现肿胀现象, 粗面内质网脱颗粒, 并逐渐出现基质溶解空泡化等. 线粒体数目的减少及残存线粒体质量变差使其合成功能大大降低, 从而使能量供应减少, 这可能导致ICC细胞作为神经细胞兴奋的传导功能降低. 在应激状况下, 粗面内质网显著扩张, 脱颗粒, 其内容物的密度减低, 并且向核周间隙的开口变宽, 表现为肿胀; 而这一系列的变化均导致其合成体内重要蛋白质的功能降低. ICC细胞器的变化必然会带来其细胞功能的异常.
先期的研究显示[1], 经低强度慢性束缚水浸刺激后, 大鼠胃排空率改变, 早期并不明显, 而本文显示, 此时ICC的超微结构已经出现损伤. 至实验7 d时, 实验组大鼠胃排空率较对照组增加, 而ICC细胞超微结构的损伤改变进一步加重. 至实验28 d时, 实验组大鼠的胃排空较对照组减慢, 此时的ICC损伤则进一步加重. ICC超微结构的损伤持续进行性加重, 但大鼠的胃排空快慢于此并不平行, 提示参与胃排空功能的调节因素是多方面的. 应激刺激导致的ICC结构损伤只是机制之一.
从胃的生理角度讲, 胃排空受胃蠕动的力量、频率和幽门对胃内容物流出阻力的双重影响, 而胃蠕动的力量、频率又由激素机制、神经源性机制、肌源性机制(即起搏胃慢波的ICC机制)三种因素的共同作用结果决定. 当给予动物机体应激刺激后, 如上多种途径共同改变决定胃排空率的变化, 也就是说, ICC起搏胃慢波的肌源性机制只是控制胃排空率的其中一种机制, 在不同的阶段这几种机制所发挥的作用可能不同. 短期内的应激虽然可以导致ICC超微结构的改变, 一方面可能起搏功能仍未完全丧失, 另一方面, 参与调节胃排空的其他途径可能通过调节补偿了尚属细微的ICC功能变化. 因此其胃排空功能在短期内尚可维持正常. 这种复杂的在接受应激后的不同阶段内所发挥的作用可能存在一定的差异, 应激时间越长, 调节机制的补偿作用越复杂. 随着ICC的超微结构破坏渐趋严重, 缝隙连接破坏不可逆, 细胞器、胞质、胞核固缩, 变形, 甚至细胞死亡, 包括ICC起搏胃慢波在内的正向调节机制彻底失利. ICC超微结构的改变只是其中的一个重要发病机制.
其他研究显示: 短期强烈的应激刺激可以导致大鼠胃窦ICC的超微机构改变[8]. 而本研究结果表明, 低强度的慢性束缚水浸应激也可以损伤大鼠胃窦ICC的超微结构, 其损伤程度随应激时间延长而逐渐加重. 超微结构改变的同时胃排空功能出现异常, 但大鼠胃排空快慢的改变与其胃窦ICC细胞的损伤程度不平行, 说明应激后的胃功能改变有多种机制参与, ICC细胞的损伤可能参与应激性胃动力改变的过程.
以往的研究已经证明, 慢性束缚水浸应激可以导致大鼠胃排空功能的改变. 影响胃动力的因素多种多样, ICC可能参与其中. 以往的研究多集中在ICC数量上的改变方面, 且多数以急性应激刺激为主, 更多的研究着眼于糖尿病相关的ICC细胞损伤. 本研究拟通过不同时程的慢性低强度应激刺激实验来观察大鼠胃窦ICC的超微结构改变, 探讨慢性应激损伤胃排空功能的可能机制.
任超世, 研究员, 中国医学科学院生物医学工程研究所; 魏睦新, 教授, 南京医科大学第一附属医院中西医结合科; 宋于刚, 教授, 南方医科大学南方医院消化内科研究所
应激导致的消化动力的改变及其机制成为近年的研究热点, 主要集中在探讨ICC在急性应激中发挥的作用方面.
本文旨在研究不同时程的慢性应激对大鼠ICC超微结构的影响, 探讨慢性应激后胃动力改变的可能机制.
本研究设计合理, 数据可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 3. | Nakae Y, Kagaya M, Takagi R, Matsutani Y, Horibe H, Kondo T. Cold pain prolongs gastric emptying of liquid but not solid meal: an electrical impedance tomography (EIT) study. J Gastroenterol. 2000;35:593-597. [PubMed] [DOI] |
| 4. | He CL, Soffer EE, Ferris CD, Walsh RM, Szurszewski JH, Farrugia G. Loss of interstitial cells of cajal and inhibitory innervation in insulin-dependent diabetes. Gastroenterology. 2001;121:427-434. [PubMed] [DOI] |
| 5. | Hagger R, Finlayson C, Jeffrey I, Kumar D. Role of the interstitial cells of Cajal in the control of gut motility. Br J Surg. 1997;84:445-450. [PubMed] [DOI] |
| 6. | Kenny SE, Connell MG, Rintala RJ, Vaillant C, Edgar DH, Lloyd DA. Abnormal colonic interstitial cells of Cajal in children with anorectal malformations. J Pediatr Surg. 1998;33:130-132. [PubMed] [DOI] |
| 7. | Ishikawa K, Komuro T, Hirota S, Kitamura Y. Ultrastructural identification of the c-kit-expressing interstitial cells in the rat stomach: a comparison of control and Ws/Ws mutant rats. Cell Tissue Res. 1997;289:137-143. [PubMed] [DOI] |
| 8. | Kaszuba-Zwoińska J, Gil K, Ziomber A, Zaraska W, Pawlicki R, Królczyk G, Matyja A, Thor PJ. Loss of interstitial cells of Cajal after pulsating electromagnetic field (PEMF) in gastrointestinal tract of the rats. J Physiol Pharmacol. 2005;56:421-432. [PubMed] |