修回日期: 2009-12-19
接受日期: 2009-12-21
在线出版日期: 2010-02-28
目的: 探讨血管内皮生长因子(VEGF)、CD34的表达与人胃癌多种临床病理因素的关系, 分析其在患者预后中的意义.
方法: 通过免疫组织化学方法回顾性检测169例不同分级分期胃癌组织VEGF的表达, 用CD34免疫染色法计数肿瘤微血管密度(MVD), 分析VEGF、MVD和胃癌的临床病理因素之间的相关性; 并就169例胃癌患者的预后及其相关因素进行统计分析.
结果: VEGF的阳性表达率为50.3%, VEGF和CD34为正相关(P = 0.0053). VEGF的表达与肿瘤侵袭深度, 淋巴结转移, 静脉侵犯及TNM分期有关, MVD与原发肿瘤侵犯深度、淋巴结转移、肿瘤大小、静脉侵犯显著相关. VEGF阳性表达者5年无病生存率和总生存率较低(38.8% vs 57.1%, P<0.05; 35.3% vs 54.8%, P<0.01); MVD积分高者5年无病生存率和总生存率也较低(35.3% vs 53.9%, 23.5% vs 49.3%, 均P<0.05).
结论: VEGF表达与血管生成和肿瘤演进相关, VEGF、MVD及肿瘤部位对胃癌患者是一个有价值的预后因素.
引文著录: 龙辉, 吴清明, 李欢. VEGF的表达及其微血管密度在胃癌组织中的意义. 世界华人消化杂志 2010; 18(6): 557-562
Revised: December 19, 2009
Accepted: December 21, 2009
Published online: February 28, 2010
AIM: To detect the correlations among vascular endothelial growth factor (VEGF) expression, microvessel density (MVD) and multiple pathological parameters in gastric cancer and analyze the significance of VEGF expression and MVD in patients with gastric cancer.
METHODS: A total of 169 patients with gastric cancer were retrospectively analyzed. The expression of VEGF and CD34 in gastric cancer specimens was detected by immunohistochemistry. The correlations among VEGF expression, MVD, and prognostic parameters were then analyzed.
RESULTS: A positive correlation was noted between VEGF expression and MVD in gastric carcinoma (P = 0.0053). Both VEGF expression and MVD were associated with tumor invasion, lymph node metastasis and TNM stage. The five-year disease-free survival and overall survival were lower in patients with tumors positive for VEGF than in those with tumors negative for VEGF (38.8% vs 57.1% and 35.3% vs 54.8%, respectively; both P < 0.01). The five-year disease-free survival and overall survival were lower in patients with tumors having high MVD score (> 5) than in patients with tumors having low MVD score (35.3% vs 53.9% and 23.5% vs 49.3%, both P < 0.05).
CONCLUSION: VEGF expression is closely associated with tumor angiogenesis and progression in gastric cancer. VEGF expression, MDV and tumor site are valuable parameters for predicting the prognosis of gastric cancer.
- Citation: Long H, Wu QM, Li H. Significance of vascular endothelial growth factor expression and microvessel density in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 557-562
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/557.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.557
胃癌是当今世界范围内最常见的恶性肿瘤之一[1], 尽管近来胃癌早期检测技术和手术治疗方式有很大的改进, 他仍然是癌症的第二死因[2], 因此, 寻找能够精确代表肿瘤生物特性、筛选高危早期胃癌患者且能预测预后的生物标志物非常重要, 这些标志物将会有助于更好地实施个体化治疗. 肿瘤血管生成在恶性肿瘤发生、发展过程中起重要作用. 迄今为止学者们已描述了多种促血管生成及抗血管生成因子, 其中最重要的是血管内皮生长因子(vascular endothelial growth factor, VEGF)[3,4], 此种糖蛋白能刺激内皮细胞增殖、阻止新生血管退化、增加微血管通透性. 研究发现, 在食管癌、胃癌、结直肠癌、乳腺癌、卵巢癌、子宫内膜癌和非小细胞肺癌等肿瘤组织中[5-10], VEGF的表达预示增高的肿瘤转移风险和差的预后. 当前常用的定量评估血管生成过程的方法之一是检测CD34抗原的表达. CD34是人类造血祖细胞表面的一种糖蛋白, 血管内皮细胞表面同样可以检测到他的表达. CD34常用来检测肿瘤血管化内皮细胞, 并且通过微血管密度(microvessel density, MVD)定量测定其表达[11]. 本研究是通过免疫组织化学SP法对169例胃癌组织中VEGF、CD34的表达及MVD的变化, 并对患者临床病理资料进行统计分析, 探讨了VEGF和CD34的表达与人胃癌多种临床病理因素的相互性, 分析其在患者生存和预后中的意义.
选取1992-01/2002-06本院住院手术治疗的169例患者胃癌标本, 收集患者的临床、病理及手术资料, 采用回顾性研究. 患者中年龄17-86(平均59.6)岁, 临床随访期1-144 mo, 平均56 mo. (2)VEGF多克隆抗体(1:50)、CD34单克隆抗体(1:30)及SP检测试剂盒和DAB显色液均购自武汉博士德生物技术有限公司.
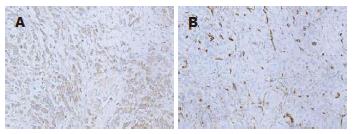
1.2.1 免疫组织学SP法检测胃癌组织VEGF、CD34表达: 根据病理报告从最具有侵袭力的部位行组织切片(3 µm厚), 采用免疫组织化学SP方法检测胃癌组织VEGF、CD34表达, 按照试剂盒说明书所示步骤操作. PBS代替一抗作为阴性对照, 用VEGF阳性直肠癌组织切片及CD34阳性血管内皮组织切片作为阳性对照.
1.2.2 染色分析: 采用染色强度和染色细胞百分比的联合评分来评判VEGF[12]. 染色强度评分为: 0(无), 1+(弱), 2+(中等), 3+(强). 阴性表达定义为: 各种强度且小于25%肿瘤细胞染色; 强度0、1或2且小于50%肿瘤细胞染色; 强度0、1且小于75%肿瘤细胞染色; 其余病例定义为VEGF阳性表达.
1.2.3 CD34染色法评估和胃癌组织新生血管数及MVD: 每例标本先在低倍镜下寻找3个以上的热点区域(hot spots), 然后在高倍镜下(×200)观察. 计算此区域的微血管数和MVD. 所有标本分为2组(低和高)进行统计分析, CD34评分前10%者为高MVD[13].
统计学处理 结果处理应用SPSS13.0软件. 采用χ2检验和Fisher精确概率法评估VEGF和CD34的表达与其他变量的相互关系; Spearman秩相关分析评估等级数据; Kaplan-Meier法进行生存分析; Log rank检验进行多预后性变量比较; COX比例风险模型研究独立危险因素(经单变量分析中证实为有意义的独立危险因素). 以P<0.05为差异有统计学意义.
VEGF染色: 85例阳性(表1). VEGF主要位于癌细胞胞质(图1). 所有标本的MVD平均值为50±22. 17例标本定为高MVD(>86), 其他152例例为低MVD.
169例患者中, VEGF阳性表达85例, CD34高表达152例, 17例低表达. VEGF表达与肿瘤侵犯深度、淋巴结转移、静脉侵犯、TNM分期显著相关. MVD与原发肿瘤侵犯深度、淋巴结转移、肿瘤大小、静脉侵犯显著相关(表2).
| 观察指标 | 总计(n=169) | VEGF n(%) | P值 | CD34 n(%) | P值 | ||
| 阴性 | 阳性 | 低 | 高 | ||||
| 年龄(岁) | |||||||
| <60 | 84 | 41(48.8) | 43(51.2) | 0.8171 | 75(89.3) | 9(10.7) | 0.7784 |
| ≥60 | 85 | 43(5.6) | 42(49.4) | 77(90.6) | 8(9.4) | ||
| 性别 | |||||||
| 男 | 122 | 58(47.5) | 64(52.5) | 0.3649 | 108(88.5) | 14(11.5) | 0.4834 |
| 女 | 47 | 26(55.3) | 21(44.7) | 44(93.6) | 3(6.4) | ||
| 肿瘤部位(胃) | |||||||
| 前1/3 | 26 | 9(34.6) | 17(65.4) | 24(92.3) | 2(7.7) | ||
| 中1/3 | 69 | 37(53.6) | 32(46.4) | 0.2380 | 61(88.4) | 8(11.6) | 0.8310 |
| 后1/3 | 74 | 38(51.4) | 36(47.6) | 67(90.5) | 7(9.5) | ||
| 肿瘤大小(mm) | |||||||
| <50 | 92 | 47(51.1) | 45(48.9) | 0.6943 | 84(91.3) | 8(9.4) | |
| ≥50 | 77 | 37(48.1) | 40(51.9) | 65(88.3) | 8(11.7) | 0.0355 | |
| 组织学类型 | |||||||
| 分化型 | 86 | 40(46.5) | 46(53.5) | 0.3981 | 80(91.4) | 6(8.7) | 0.1751 |
| 未分化型 | 83 | 44(53.0) | 39(47.0) | 72(91.7) | 11(8.4) | ||
| 浸润深度 | |||||||
| 黏膜 | 41 | 30(73.2) | 11(26.8) | 41(100.0) | 0(0.0) | ||
| 黏膜下 | 48 | 27(56.3) | 21(43.7) | 0.0001 | 45(93.8) | 3(6.2) | 0.0059 |
| 肌层及更深 | 80 | 27(33.8) | 53(66.2) | 66(82.5) | 14(17.5) | ||
| 淋巴结转移 | |||||||
| 阴性 | 96 | 52(54.2) | 44(45.8) | 87(90.6) | 9(9.4) | ||
| 阳性 | 73 | 32(43.8) | 41(56.2) | 0.0086 | 65(89.1) | 8(10.9) | 0.0389 |
| 静脉侵犯 | |||||||
| 阴性 | 86 | 56(65.1) | 30(34.9) | 0.0001 | 84(97.7) | 2(2.3) | 0.0007 |
| 阳性 | 83 | 28(38.8) | 55(66.3) | 68(81.9) | 15(18.1) | ||
| 肿瘤分期(TNM) | |||||||
| Ⅰ | 24 | 11(45.8) | 13(54.2) | 19(79.2) | 5(20.8) | ||
| Ⅱ | 24 | 5(20.8) | 19(79.2) | 0.0121 | 20(83.3) | 4(16.7) | |
| Ⅲ | 26 | 12(46.2) | 14(53.8) | 24(92.3) | 2(7.7) | ||
| Ⅳ | 95 | 56(58.9) | 39(41.1) | 89(93.7) | 6(6.3) | 0.1180 | |
| 化疗 | |||||||
| 否 | 105 | 55(52.4) | 50(47.6) | 0.3721 | 97(92.4) | 8(7.6) | 0.1767 |
| 是 | 64 | 29(45.3) | 35(54.7) | 55(85.9) | 9(14.1) | ||
MVD的表达与VEGF有显著相关性. VEGF阳性表达肿瘤MVD为62.1±24.8, 高于阴性者(52.5±19.4, P = 0.0087).
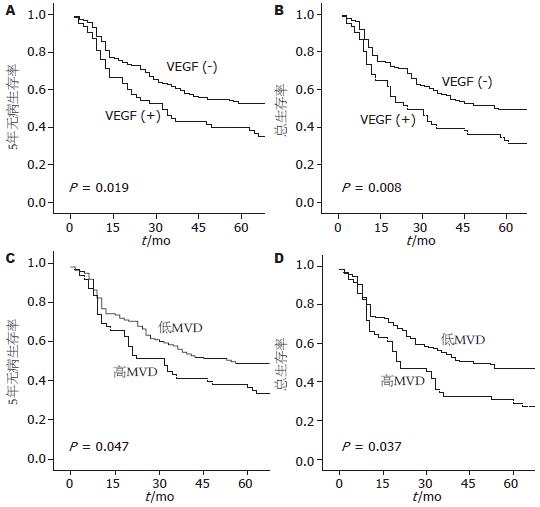
5年无病生存率和总生存率为40.6%. Kaplan-Meier生存率曲线表明: VEGF阳性表达者有着低的5年无病生存率和总生存率(38.8% vs 57.1%, P<0.05; 35.3% vs 54.8%, P<0.01); MVD积分高者有着低的5年无病生存率和总生存率(35.3% vs 53.9%, P<0.05; 23.5% vs 49.3%, P<0.05, 图2).
用单变量分析法评估了所有临床病理因素的预后. 表3表明: 肿瘤大小、部位、侵犯深度、淋巴结转移、静脉侵犯、VEGF评分、MVD和TNM分期可作为5年无病生存率和总生存率的独立预后因素; 用COX比例风险回归模型多变量分析表明: 仅肿瘤侵犯深度、淋巴结转移情况可作为无病生存和总体生存的独立预后因素. 肿瘤部位仍可作为无病生存的独立预后因素(表4).
| 因素 | n | 无病生存率(%) | P值 | 总体生存率(%) | P值 |
| 年龄(岁) | |||||
| ≤60 | 84 | 44.0 | 0.535 | 42.9 | 0.4898 |
| >60 | 85 | 43.5 | 37.6 | ||
| 性别 | |||||
| 男 | 122 | 42.6 | 0.374 | 41.8 | 0.4330 |
| 女 | 47 | 46.8 | 44.7 | ||
| 肿瘤大小(mm) | |||||
| ≤50 | 92 | 54.3 | 0.030 | 51.1 | 0.0200 |
| >50 | 77 | 32.5 | 28.6 | ||
| 肿瘤部位 | |||||
| 前1/3 | 26 | 30.8 | 0.107 | 26.9 | 0.0970 |
| 中1/3 | 69 | 47.8 | 0.488 | 44.9 | 0.5210 |
| 后1/3 | 74 | 44.6 | 39.2 | ||
| 组织学类型 | |||||
| 分化型 | 86 | 47.7 | 0.235 | 41.9 | 0.3890 |
| 未分化型 | 83 | 41.0 | 38.6 | ||
| 浸润深度 | |||||
| 黏膜 | 41 | 93.2 | <0.0001 | 90.6 | <0.0001 |
| 黏膜下 | 48 | 85.6 | 83.2 | ||
| 更深 | 80 | 27.5 | 23.8 | ||
| 淋巴结转移 | |||||
| PN0 | 71 | 56.3 | 0.0001 | 52.1 | <0.0001 |
| PN1-3 | 98 | 28.6 | 24.5 | ||
| 静脉侵犯 | |||||
| 阴性 | 86 | 55.8 | <0.0001 | 53.5 | <0.0001 |
| 阳性 | 83 | 31.3 | 26.5 | ||
| VEGF表达 | |||||
| 阴性 | 84 | 57.1 | 0.019 | 54.8 | 0.008 |
| 阳性 | 85 | 38.8 | 35.3 | ||
| MVD | |||||
| 低 | 152 | 53.9 | 0.047 | 49.3 | 0.037 |
| 高 | 17 | 35.3 | 23.5 | ||
| TNM分期 | |||||
| Ⅰ | 24 | 58.3 | 54.2 | ||
| Ⅱ | 24 | 45.8 | 37.5 | ||
| Ⅲ | 26 | 26.9 | 23.1 | ||
| Ⅳ | 95 | 0.0 | <0.0001 | 0.0 | <0.0001 |
| 因素 | 相对危险度(95%CI) | χ2值 | P值 |
| 无病生存率 | |||
| 肿瘤部位 | |||
| 前1/3 | 48.00(0.23-99.00) | 3.99 | 0.458 |
| 其他 | |||
| 浸润深度 | |||
| 黏膜及黏膜下 | 11.03(1.15-105.93) | 4.33 | 0.038 |
| 肌层及更深 | |||
| 淋巴结转移 | |||
| PN0 | 3.34(1.30-8.59) | 6.26 | 0.012 |
| PN1-3 | |||
| 总体生存率 | |||
| 浸润深度 | |||
| 黏膜及黏膜下 | 4.28(1.15-15.95) | 4.70 | 0.030 |
| 肌层及更深 | |||
| 淋巴结转移 | |||
| PN0 | 2.94(1.34-6.46) | 7.20 | 0.007 |
| PN1-3 |
对实体瘤来说, 如果没有血管生成其体积不会超过1-2 mm3. 血管生成过程受精密的调节: 局部肿瘤及宿主细胞释放的促血管生成因子和抗血管生成因子(包括内皮细胞、周细胞及免疫细胞). 本研究不仅阐明了VEGF表达与血管生成和肿瘤演进呈正相关, 同时其与淋巴结转移、肿瘤侵犯深度、血管侵犯相关, 进一步验证了VEGF是促癌因子这一假设, 提示了VEGF可能作为肿瘤侵袭性的一个有用的生物指标. 另外本研究证实VEGF阳性患者MVD比VEGF阴性者高, 这与以前的结果一致[14]. VEGF阳性肿瘤新生血管化最显著这一发现提示增多的血管供应反映增高的转移能力. 肿瘤形成血管前, 肿瘤细胞很少进入全身血液循环, 新生的肿瘤血管有增加的长度、直径和不完整的内皮细胞层和基底膜, 其形状不规则且易于出血和或血栓形成, 进而使肿瘤细胞进入循环系统. 所谓的血管生成开关依赖于肿瘤正阳性和负性血管生成物质的静平衡, 其中VEGF发挥着关键的正性调节作用.
我们采用CD34免疫染色法可视化内皮细胞来检测微血管. 用微血管计数法来测定肿瘤新生血管性可能解释一些重要的假设, 然而此方法依赖于代表新生血管活性的肿瘤热点区域, 并且假设高的转移率与多的血管状态有关. 内皮标志物并不能区分新生血管和已存在的血管, 并且这2种血管的结构不同, 其肿瘤细胞进入微循环的能力也不同. 即使同一区域也可能存在血管不均一性, 肿瘤边缘也不一定总包含最多的血管. 这些瘤内的变异可能会解释一些文献报道的相反的预后结果. 尽管MVD是一个有用的预后指标, 但其本身并不是血管功能或治疗效果的指示器, 也不应该用MVD来指导治疗试验患者的筛选[11].
现在有理由考虑一些在恶性肿瘤进展中影响多条通路的治疗方案. Yoshida等[15]认为VEGF起效后可促进肿瘤血管形成及瘤体生长, 本研究也认同这一观点.
Shi等研究表明对于一些类型的胃癌VEGF可作为一独立的预后因素[6], 然而也有报道不同意这种观点[16]. 这些不同的报道可能由于采用的方法和患者的数量不同导致. 当前研究发现[6]VEGF阳性患者5年生存率远低于VEGF阴性患者. 多变量分析结果显示, VEGF并不能作为独立的预后因素. 本研究表明VEGF联合其他临床病理因素可能作为筛选胃癌患者和提示预后有价值的工具.
总之, 本研究的表明, VEGF是血管生成中的很重要的环节, 并且是胃癌患者预后的有价值的预测因子. 目前还需要更多的前瞻性研究去确认VEGF是胃癌发生发展过程中起标志作用, 至于VEGF是否可作为治疗靶点, 患者是否从抗血管生成制剂中获得疗效且监测这些治疗方法的有效性还需进一步研究.
VEGF的表达预示增高的肿瘤转移风险和差的预后. 当前常用的定量评估血管生成过程的方法之一是检测CD34抗原的表达. CD34常用来检测肿瘤血管化内皮细胞, 并且通过微血管密度(MVD)定量测定其表达. 本研究是通过免疫组织化学SP法对169例胃癌组织中VEGF、CD34的表达及MVD的变化, 并对患者临床病理资料进行统计分析, 探讨了VEGF和CD34的表达与人胃癌多种临床病理因素的相互性, 分析其在患者生存和预后中的意义.
张俊, 副教授, 上海交通大学医学院附属瑞金医院外科
本文通过研究证实VEGF在胃癌的血管生成中起着重要作用, 联合其他指标更能准确预测胃癌的预后, 但是VEGF能否成为胃癌的治疗靶点仍有待进一步研究.
Yoshida等认为VEGF起效后可促进肿瘤血管形成及瘤体生长, 本研究也认同这一观点.
本研究的表明, VEGF是血管生成中的很重要的环节, 并且是胃癌患者预后的有价值的预测因子.
本文涉及胃癌的预后问题, 样本量大, 临床数据资料齐全, 随访时间长, 有一定的临床应用价值.
编辑: 李瑞敏 电编:何基才
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Lambert R, Guilloux A, Oshima A, Pompe-Kirn V, Bray F, Parkin M, Ajiki W, Tsukuma H. Incidence and mortality from stomach cancer in Japan, Slovenia and the USA. Int J Cancer. 2002;97:811-818. [PubMed] [DOI] |
| 3. | Nagy JA, Vasile E, Feng D, Sundberg C, Brown LF, Detmar MJ, Lawitts JA, Benjamin L, Tan X, Manseau EJ. Vascular permeability factor/vascular endothelial growth factor induces lymphangiogenesis as well as angiogenesis. J Exp Med. 2002;196:1497-1506. [PubMed] [DOI] |
| 4. | Hoeben A, Landuyt B, Highley MS, Wildiers H, Van Oosterom AT, De Bruijn EA. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 2004;56:549-580. [PubMed] [DOI] |
| 5. | Kleespies A, Guba M, Jauch KW, Bruns CJ. Vascular endothelial growth factor in esophageal cancer. J Surg Oncol. 2004;87:95-104. [PubMed] [DOI] |
| 6. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] |
| 7. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] |
| 8. | Morabito A, Sarmiento R, Bonginelli P, Gasparini G. Antiangiogenic strategies, compounds, and early clinical results in breast cancer. Crit Rev Oncol Hematol. 2004;49:91-107. [PubMed] [DOI] |
| 9. | Raspollini MR, Amunni G, Villanucci A, Baroni G, Boddi V, Taddei GL. Prognostic significance of microvessel density and vascular endothelial growth factor expression in advanced ovarian serous carcinoma. Int J Gynecol Cancer. 2004;14:815-823. [PubMed] [DOI] |
| 10. | Bremnes RM, Camps C, Sirera R. Angiogenesis in non-small cell lung cancer: the prognostic impact of neoangiogenesis and the cytokines VEGF and bFGF in tumours and blood. Lung Cancer. 2006;51:143-158. [PubMed] [DOI] |
| 11. | Hlatky L, Hahnfeldt P, Folkman J. Clinical application of antiangiogenic therapy: microvessel density, what it does and doesn't tell us. J Natl Cancer Inst. 2002;94:883-893. [PubMed] |
| 12. | Soumaoro LT, Uetake H, Higuchi T, Takagi Y, Enomoto M, Sugihara K. Cyclooxygenase-2 expression: a significant prognostic indicator for patients with colorectal cancer. Clin Cancer Res. 2004;10:8465-8471. [PubMed] [DOI] |
| 13. | Vermeulen PB, Gasparini G, Fox SB, Toi M, Martin L, McCulloch P, Pezzella F, Viale G, Weidner N, Harris AL. Quantification of angiogenesis in solid human tumours: an international consensus on the methodology and criteria of evaluation. Eur J Cancer. 1996;32A:2474-2484. [PubMed] [DOI] |
| 14. | Joo YE, Rew JS, Seo YH, Choi SK, Kim YJ, Park CS, Kim SJ. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer. J Clin Gastroenterol. 2003;37:28-33. [PubMed] [DOI] |
| 15. | Yoshida S, Amano H, Hayashi I, Kitasato H, Kamata M, Inukai M, Yoshimura H, Majima M. COX-2/VEGF-dependent facilitation of tumor-associated angiogenesis and tumor growth in vivo. Lab Invest. 2003;83:1385-1394. [PubMed] [DOI] |
| 16. | Tanigawa N, Amaya H, Matsumura M, Shimomatsuya T. Correlation between expression of vascular endothelial growth factor and tumor vascularity, and patient outcome in human gastric carcinoma. J Clin Oncol. 1997;15:826-832. [PubMed] |