修回日期: 2010-01-15
接受日期: 2010-01-19
在线出版日期: 2010-02-28
目的: 探讨芹菜素(apigenin)对Huh-7肝癌细胞生长及基因表达的影响.
方法: 采用四甲基偶氮唑蓝(MTT)比色法、平板克隆形成实验、流式细胞术分别检测芹菜素对Huh-7细胞增殖、克隆形成、周期及凋亡的影响; 通过动物模型观察芹菜素对裸鼠人肝癌Huh-7移植瘤肿瘤质量及体积的影响; 采用基因芯片技术检测芹菜素作用前后Huh-7细胞全基因组序列, 分析其基因表达差异; 采用qRT-PCR、Western blot技术验证基因芯片结果.
结果: 与对照组相比, 不同浓度的芹菜素(5、10、20 mg/L)处理Huh-7细胞后, 芹菜素对Huh-7细胞的生长有显著的抑制作用(IC50 = 10.5 mg/L±0.3 mg/L). 细胞周期阻滞于G2/M期、降低G0-G1期细胞的比例、并促进细胞凋亡和抑制移植瘤的生长. 全基因芯片发现芹菜素可改变Huh-7细胞中1 764个功能性基因的表达. 在这些差异表达的基因中, 大多数与核酸结合、转运、接触和酶调节活性、转录调节、细胞骨架结构和黏附、信号转导、代谢、凋亡以及免疫反应等有关. 其中最重要的发现是芹菜素显著下调IL-4R和USP18基因表达, qRT-PCR、Western blot检测结果与芯片结果相符.
结论: 芹菜素可能通过阻滞细胞周期于G2/M期并诱导细胞凋亡从而抑制体内体外Huh-7细胞的生长, 并影响多种基因的表达.
引文著录: 蔡婧, 刘安文, 赵向丽, 张树辉. 芹菜素对肝癌细胞生长及基因表达的影响. 世界华人消化杂志 2010; 18(6): 542-549
Revised: January 15, 2010
Accepted: January 19, 2010
Published online: February 28, 2010
AIM: To investigate the effects of apigenin on cell growth and gene expression in human hepatoma cell line Huh-7.
METHODS: After Huh-7 cells was cultured and treated with different concentrations of apigenin, cell proliferation was measured by colorimetric methyl thiazolyl tetrazolium (MTT) assay; cell clonogenicity was detected by colony-forming assay; and cell cycle distribution and apoptosis were examined by flow cytometry. The impact of apigenin on the tumorigenicity of Huh-7 cells in nude mice was also detected. The differential gene expression between cells treated and untreated with apigenin was detected by cDNA microarray and verified by quantitative real-time reverse transcription-polymerase chain reaction and Western blot.
RESULTS: Compared with untreated cells, cells treated with apigenin exhibited a marked growth inhibition. The half maximal inhibitory concentration (IC50) of apigenin on cell growth was approximately 10.5 mg/L ± 0.3 mg/L. Apigenin treatment could cause a cell cycle block at G2/M phase, decrease the percentage of cells at G0/G1 phase, promote apoptosis, and inhibit the tumorigenicity of Huh-7 cells in vivo. Apigenin treatment could also dramatically alter the expression of 1 764 functionally related genes in Huh-7 cells. Of these differentially expressed genes, the majority are involved in nucleic acid binding and transport, enzyme catalytic activity regulation, transcriptional regulation, cytoskeletal structure and/or adhesion, signal transduction, metabolism, apoptosis or the immune response. Of note, apigenin could significantly downregulate the expression of interleukin-4 receptor and ubiquitin-specific protease 18.
CONCLUSION: Apigenin partially inhibits Huh-7 cell growth in vitro and in vivo by blocking cell cycle at G2/M phase and promoting apoptosis. Apigenin treatment alters the expression of multiple genes in Huh-7 cells.
- Citation: Cai J, Liu AW, Zhao XL, Zhang SH. Apigenin inhibits cell growth and alters expression of multiple genes in human hepatoma cell line Huh-7. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 542-549
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/542.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.542
近年来, 膳食物中提取的天然抗癌药物的研究主要集中在通过诱导凋亡而导致癌细胞选择性和持久性的清除. 黄酮类化合物是一种具有多种生物活性的植物膳食成分, 他具有预防多种癌症的潜能[1,2]. 芹菜素是天然存在的一种黄酮类化合物, 广泛存在于多种水果、蔬菜(包括芹菜)、橘子、茶叶、小麦芽和一些调味品中, 作为一种健康的食物成分被证明具有抗炎、抗癌和清除自由基的能力[3,4]. 近年, 许多研究表明芹菜素通过P53依赖途径诱导细胞周期阻滞以及诱导凋亡而具有对多种人类癌细胞特有的毒性作用, 包括乳腺癌、结肠癌、肺癌、皮肤癌和前列腺癌[4-17]. 研究证实, 芹菜素通过诱导凋亡及诱导细胞周期阻滞于G2/M期而抑制肝癌细胞的生长[4,16,17]. 芹菜素抗癌作用的分子机制包括: 增加Bax/Bcl-2的比例而诱导凋亡, 或者通过其他分子机制包括上调DR5、调节IGF-1/IGF-1R信号、FAK/Src信号、β-catenin信号、P38-MAPK、PI-3K/AKT和ERK信号途径等[7,14,15,18-23]. 然而, 这种化合物对肝癌细胞抑制作用的具体分子机制至今仍未完全清楚. 本研究验证芹菜素的抗肝癌活性, 并进一步阐述其细胞毒性的分子机制.
DMEM培养基、胰酶及胎牛血清(FBS)购自Gibco公司. 芹菜素、二甲基亚砜(DMSO)、MTT、碘化丙啶(PI)、Rnase购自Sigma公司. 细胞凋亡检测试剂盒购自北京凯基生物有限公司. IL-4R抗体及Western blot试剂盒购自Santa公司, USP18、SLC27A3、CCR2抗体分别购自LifeSpan、Novus和Abcam公司. 实验前, 芹菜素用DMSO溶解, 培养基稀释, DMSO终浓度≤0.1%.
1.2.1 细胞培养: Huh-7细胞购自上海中科院细胞研究所, 细胞接种于DMEM培养基中(含100 mL/L FBS), 置于37 ℃, 饱和湿度, 50 mL/L CO2培养箱中, 2-3 d传代1次, 取对数生长期细胞用于实验.
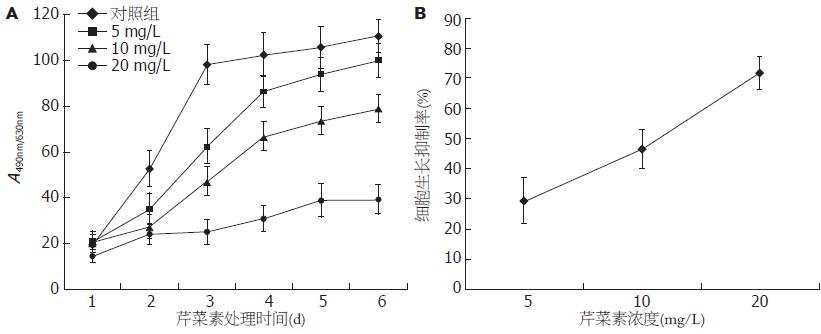
1.2.2 增殖抑制实验: Huh-7细胞接种于96孔板, 每孔加入100 μL(每孔接种细胞数约8×103个), 待细胞贴壁后吸出培养液, 加入终浓度为5、10、20 mg/L的芹菜素, 阴性对照加0.1% DMSO, 将接种并开始贴壁生长的当天设为0 d, 连续观察6 d, 每组设3个复孔, 实验重复3次. 加入MTT测光吸收值, 绘制各组细胞生长曲线[24]. 细胞增殖抑制率(%) = (1-实验组平均A490/对照组平均A490)×100%. IC50值代表能产生50%增殖抑制率时的药物浓度.
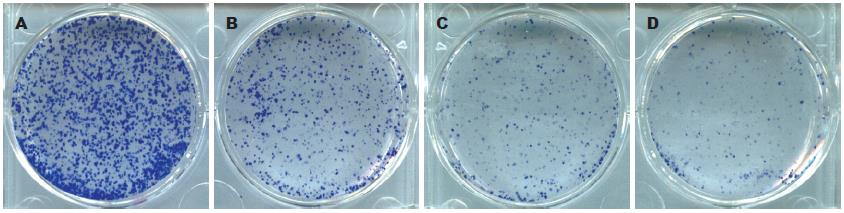
1.2.3 平板克隆形成实验: 终浓度为5、10、20 mg/L芹菜素处理的及对照组Huh-7细胞按每孔2 000个细胞接种于六孔板, 每组3个复孔, 培养10-15 d, 甲醇固定后姬姆萨染液染色10-30 min, 显微镜下计算克隆形成数(克隆形成率 = 克隆数/接种细胞数×100%), 实验重复3次.
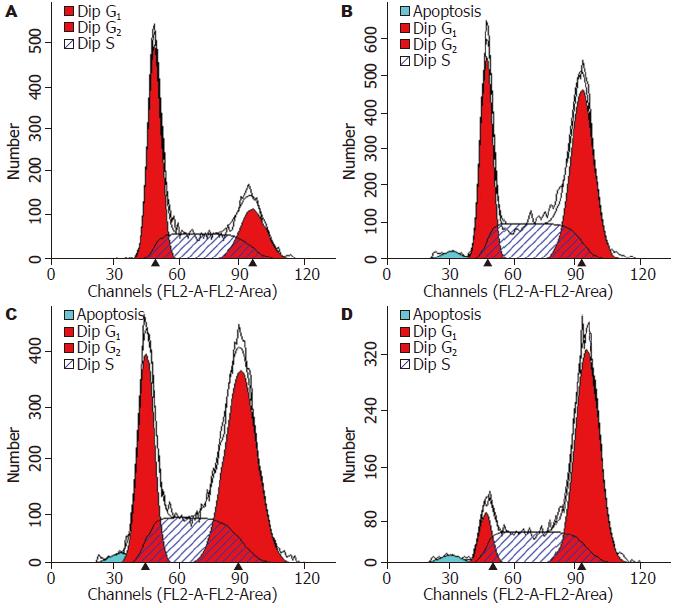
1.2.4 流式细胞术检测细胞周期分布: 终浓度为5、10、20 mg/L芹菜素作用48 h后收集细胞, 离心, 700 mL/L乙醇固定后PI染色, 用流式细胞仪(FACSCAN, USA)测定细胞周期分布[24], 以0.1% DMSO为对照组, 每组3个复孔, 实验重复3次.
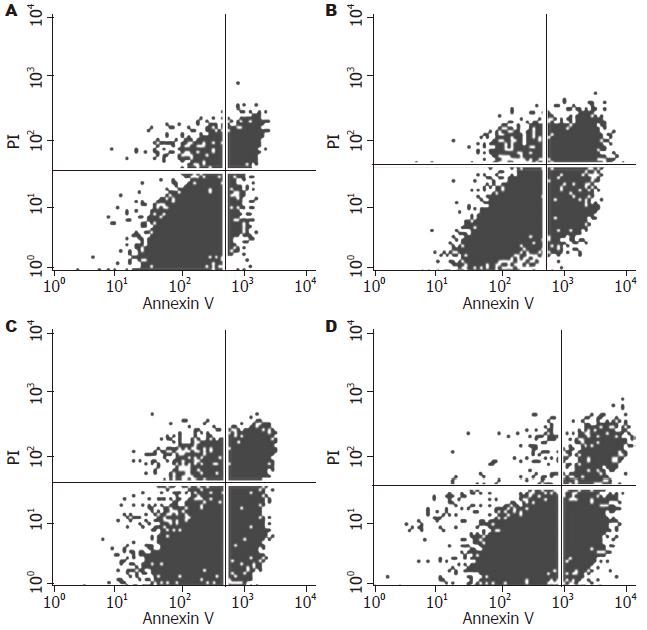
1.2.5 Annexin V-FITC/PI染色流式细胞仪检测细胞凋亡: 终浓度为5、10、20 mg/L芹菜素作用48 h后收集细胞, 离心, Annexin V-FITC/PI染色后, 用流式细胞仪检测细胞凋亡率, 以0.1% DMSO为对照组, 每组3个复孔, 实验重复3次.
1.2.6 裸鼠移植瘤实验: BALBA/c裸鼠购自上海实验动物中心, 经随机分组, 实验组和对照组各4只裸鼠. 在同一部位皮下注射2×106个培养的Huh-7细胞, 2 d后实验组裸鼠腹膜内给以芹菜素50 μg/d[22], 对照组给以0.1% DMSO. 30 d后, 取出肿瘤比较质量及体积并在显微镜下观察其病理学变化.
1.2.7 cDNA基因芯片分析: 终浓度为10 mg/L芹菜素(实验组)及0.1% DMSO(对照组)作用48 h后, TRIzol法提取总RNA, 进行Agilent人全基因组芯片检测(Agilent人全基因组芯片含有41 000个基因, 操作步骤见文献[25]. 实验由上海康成生物科技有限公司协助完成, Ratio值为0.5-2.0的基因不存在显著的表达差异, 而在该范围之外的基因则被认为表达出现显著改变. 实验重复3次.
1.2.8 Real-time定量RT-PCR(qPCR): 将10 mg/L芹菜素作用48 h后及对照组的细胞TRIzol法抽提RNA, 然后逆转录成cDNA, 按SYBR-荧光定量检测试剂盒说明书配成反应体系进行PCR扩增, 用于qPCR的基因包括SLC27A3, FATP-3, OVOL1, CCR2, ECT2, IL4Ra, USP18, SLC10A2, HIP1R, NUP35, GAPDH作为内对照. 反应条件为: 95 ℃预变性10 min, 然后95 ℃变性5 s, 60 ℃退火34 s, 共40个循环. 实验重复3次. 结果由厂家自带的应用软件系统进行分析.
1.2.9 Western blot检测[26]: 终浓度为5、10、20 mg/L芹菜素作用Huh-7细胞后48 h后收集细胞, 将其溶解于含10 mmol/L Tris(pH7.4), 1% SDS, 1 mmol/L原钒酸钠及蛋白酶抑制剂的蛋白提取液中, 利用Klose法提取. 取50 µg总蛋白上样, SDS-PAGE电泳分离, 转膜, 分别孵育一抗, IL4Rα(sc-28361, 1:500), USP18(LS-B1182-50, 1:1 000), SLC27A3(H00011000-A01, 1:1 000), CCR2(ab32144, 1:500)及GAPDH (sc-47724, 1:2 000). 实验重复3次. 条带密度用Fluor-S MultiImager and Quantity-One软件分析.
统计学处理 采用SPSS13.0统计软件进行统计分析, 以P<0.05为差异有显著性.
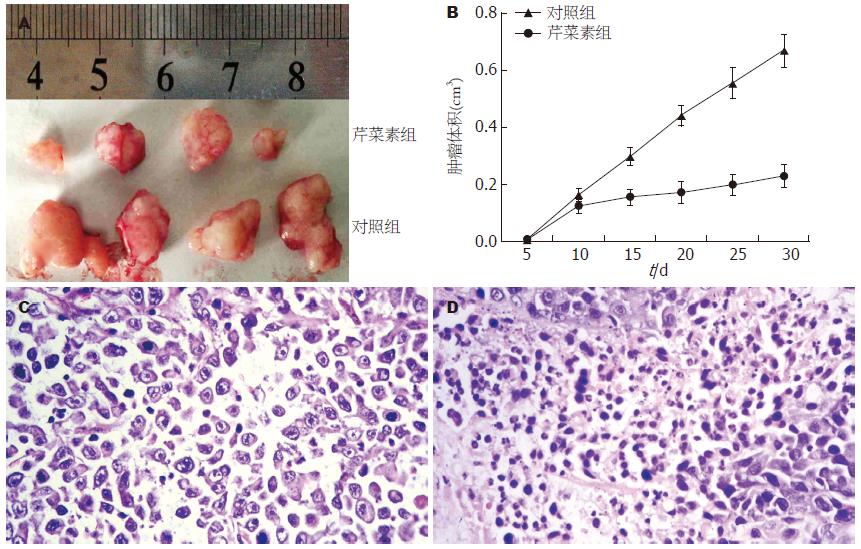
从生长曲线可以看出, 不同浓度的芹菜素(5、10、20 mg/L)处理Huh-7细胞后, 芹菜素对Huh-7细胞的生长有显著的抑制作用(IC50 = 10.5 mg/L±0.3 mg/L)(图1), 各组间差异具有统计学意义(P<0.05). 同样, 从平板克隆实验结果看出, 不同浓度芹菜素(5、10、20 mg/L)处理Huh-7细胞的克隆形成率分别为33.67%±6.51%, 24.33%±6.51%和17.33%±6.66%, 与对照组(72.33%±15.82%)相比差异具有显著性(P<0.001, 图2).
与不加药组相比, 不同浓度芹菜素(5、10、20 mg/L)处理Huh-7细胞48 h后, 细胞周期的分布均发生改变, 主要表现在G0/G1期细胞减少, 细胞周期阻滞于G2/M期, 各组间的差异具有显著性(P<0.05, 图3, 表1), 同时还可见芹菜素处理Huh-7细胞后, 细胞周期分布出现明显的亚二倍体峰. 通过凋亡检测实验进一步证实芹菜素可诱导细胞凋亡, 各组间差异具有统计学意义(P<0.05, 图4, 表1).
芹菜素处理的裸鼠肿块体积明显较未用芹菜素处理的小(P<0.05, 图5A, B), HE染色, 显微镜下观察发现芹菜素未处理的裸鼠肿块组织中可见弥漫的小梁、显著的异型性及较强的核分裂(图5C), 而芹菜素处理组裸鼠肿块组织则可见明显的坏死(图5D).
全基因组芯片检测显示, 在41 000个基因中, 1 764个基因的表达发生改变. 其中1 336基因显示上调(≥2倍), 428个基因显示下调表达(≤0.5倍). 在这些基因中大多数属于核酸结合、转运、接触反应或酶调节活性、转录调节、细胞骨架结构或黏附、信号转导、代谢、凋亡以及免疫反应相关基因. 此外, 我们意外地发现了免疫反应相关基因IL-4R下调了5.21倍, 以及与泛素依赖性蛋白分解代谢相关基因USP18下调了5.03倍. 本研究还发现了一些与代谢(SLC27A3, P4HB), 转录(OVOL1, OTP), 细胞信号转导(ECT2, MAPK1IP1L, BMPR1A, AMFR), 细胞运动(AMFR), 生物学过程(HIP1R), 转运(NUP35, SLC10A2), 炎症反应(CCR2), 肿瘤抑制(ZDHHC2), 糖分解代谢(GLDC)等相关的基因表达差异.
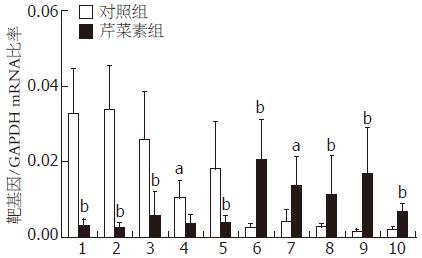
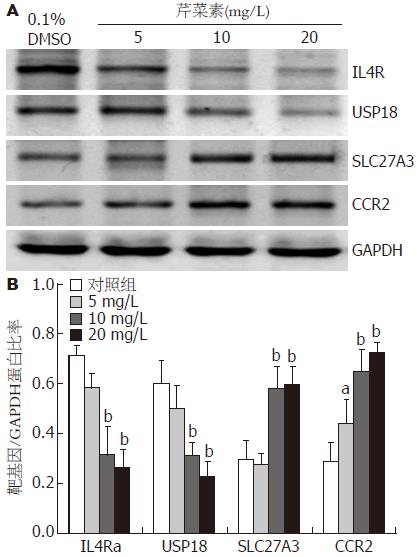
选择了10个显著差异的基因进行qPCR验证, 结果与基因芯片分析的结果是一致的, 其中IL4R, USP18, SLC27A3 和CCR2的mRNA存在显著差异(P<0.05, 图6). 随后用Western blot对4个基因的蛋白表达也验证这一差异(P<0.05, 图7). 结果显示, 10 mg/L芹菜素处理后Huh-7细胞中IL4R, USP18, SLC27A3和CCR2基因mRNA及蛋白水平的表达较对照组均有显著性差异(P<0.05, 图7).
在本研究中, 我们首先验证了芹菜素通过阻滞细胞周期于G2/M期、降低G0/G1期细胞比例, 诱导细胞凋亡而抑制体内体外肿瘤细胞生长的作用. 同时, 我们还发现了芹菜素可显著改变Huh-7细胞中的多种基因的表达. 在这些基因中大多数属于核酸结合、转运、接触反应或酶调节活性、转录调节、细胞骨架结构或黏附、信号转导、代谢、凋亡以及免疫反应相关基因. 其中最重要发现是, 芹菜素处理后免疫反应相关基因IL-4R的表达下调了5.21倍, 泛素特异性蛋白酶USP18基因下调了5.03倍. 通过qPCR和Western blot检测, 进一步证实这2个基因在RNA及蛋白水平的表达与芯片检测结果一致.
目前已有研究表明IL-4R在多种肿瘤细胞中过度表达, 包括神经胶质瘤、肺癌、卵巢癌、结直肠腺癌和头颈部肿瘤. 并且研究证实了由IL-4和假单胞菌外毒素的突变形式熔合构成的一种IL-4R靶向细胞毒素对脑部肿瘤、胆囊癌、卵巢癌、脑膜间皮瘤、鳞状细胞癌及乳腺癌的抑制作用[27,28]. 在肿瘤的发生过程中, IL-4R可激活多种信号途径, 包括P38MAPK、PI3K/AKT和JAK-STAT信号途径[29]. 而芹菜素被证明可通过多条信号途径抑制细胞增殖、诱导细胞凋亡[7,14,15,20-23], 这提示芹菜素可能通过IL-4R信号途径抑制肝癌细胞的生长[27,30].
USP18基因编码一种泛素类蛋白酶UBP43, 后者是一种Ⅰ型干扰素诱导基因, 他可通过JAK/STAT途径, 在INF-β处理的肿瘤细胞中上调而发挥抑制肿瘤细胞增殖及分化的作用[31-33]. Duex等[34]在鳞状上皮细胞癌的研究中发现USP18可通过上调EGFR的表达促进肿瘤的进展. 另有研究提出, UBP43表达的降低可增加机体清除HBV病毒的能力, 小鼠中UBP43基因的敲除可表现出抑制HBV、细菌感染及恶性转化的能力[35]. 这些结果为芹菜素抗肿瘤及抗病毒的作用提出了新的证据.
除此之外, 芹菜素处理后, 一些代谢(SLC27A3, P4HB), 转录(OVOL1, OTP), 细胞信号转导(ECT2, MAPK1IP1L, BMPR1A, AMFR), 细胞运动(AMFR), 生物学过程(HIP1R), 转运(NUP35, SLC10A2), 炎症反应(CCR2), 肿瘤抑制(ZDHHC2), 糖分解代谢(GLDC)等相关的基因表达也发生了显著的改变, 我们还发现了一个探针名称为A_32_P100452的基因上调了近6倍, 但是他的功能目前还并不清楚. 对于以上这些基因在芹菜素抗肿瘤作用都有待进一步深入研究.
本研究表明芹菜素通过阻滞细胞周期于G2/M期和增加细胞凋亡抑制Huh-7细胞的生长, 并调节多种基因的表达, 首次报道芹菜素可下调IL-4R以及USP18的表达. 本研究结果为芹菜素抑制肝癌细胞的机制提出了新的研究思路, 膳食中的黄酮类化合物可能成为预防及治疗肿瘤(例如肝癌)的一种有效药物.
原发性肝癌绝大多数是肝细胞癌, 素有"癌中之王"之称, 现有的治疗手段效果不佳. 近年, 从膳食中获取癌症的有效预防和治疗制剂成为目前人们普遍关注的问题. 芹菜素是天然存在的一种黄酮类化合物, 广泛存在于多种水果、蔬菜(包括芹菜)、茶叶、小麦芽和一些调味品中, 近年来, 越来越多的研究表明芹菜素可以抑制肿瘤的发生、发展.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
研究报道, 芹菜素通过诱导凋亡及诱导细胞周期阻滞于G2/M期而抑制肝癌细胞的生长. 然而, 这种化合物对肝癌细胞抑制作用的具体分子机制至今仍未完全清楚.
有关研究提出芹菜素抗癌作用的分子机制包括: 增加Bax/Bcl-2的比例而诱导凋亡, 或者通过其他分子机制包括上调DR5、调节IGF-1/IGF-1R信号、FAK/Src信号、β-catenin信号、P38MAPK、PI-3K/AKT和ERK信号途径等.
目前国内外关于芹菜素影响肝癌细胞生长的研究较少. 本研究观察芹菜素对Huh-7肝癌细胞生长及基因表达的影响, 证实了芹菜素的抗肝癌活性, 并初步探究其细胞毒性的分子机制.
本研究芹菜素抑制肝癌细胞生长的作用及其分子机制, 为研发新的天然、高效的临床抗肝癌药物以及寻找新的抗肝癌分子靶点提供了一定的理论依据.
本研究选题较好, 设计合理, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Salmela AL, Pouwels J, Varis A, Kukkonen AM, Toivonen P, Halonen PK, Perälä M, Kallioniemi O, Gorbsky GJ, Kallio MJ. Dietary flavonoid fisetin induces a forced exit from mitosis by targeting the mitotic spindle checkpoint. Carcinogenesis. 2009;30:1032-1040. [PubMed] [DOI] |
| 2. | Khan N, Asim M, Afaq F, Abu Zaid M, Mukhtar H. A novel dietary flavonoid fisetin inhibits androgen receptor signaling and tumor growth in athymic nude mice. Cancer Res. 2008;68:8555-8563. [PubMed] [DOI] |
| 3. | Zheng PW, Chiang LC, Lin CC. Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells. Life Sci. 2005;76:1367-1379. [PubMed] [DOI] |
| 4. | Khan TH, Sultana S. Apigenin induces apoptosis in Hep G2 cells: possible role of TNF-alpha and IFN-gamma. Toxicology. 2006;217:206-212. [PubMed] [DOI] |
| 5. | Siddique YH, Beg T, Afzal M. Antigenotoxic effect of apigenin against anti-cancerous drugs. Toxicol In Vitro. 2008;22:625-631. [PubMed] [DOI] |
| 6. | Karmakar S, Davis KA, Choudhury SR, Deeconda A, Banik NL, Ray SK. Bcl-2 inhibitor and apigenin worked synergistically in human malignant neuroblastoma cell lines and increased apoptosis with activation of extrinsic and intrinsic pathways. Biochem Biophys Res Commun. 2009;388:705-710. [PubMed] [DOI] |
| 7. | Lee WJ, Chen WK, Wang CJ, Lin WL, Tseng TH. Apigenin inhibits HGF-promoted invasive growth and metastasis involving blocking PI3K/Akt pathway and beta 4 integrin function in MDA-MB-231 breast cancer cells. Toxicol Appl Pharmacol. 2008;226:178-191. [PubMed] [DOI] |
| 8. | Choi EJ, Kim GH. Apigenin causes G(2)/M arrest associated with the modulation of p21(Cip1) and Cdc2 and activates p53-dependent apoptosis pathway in human breast cancer SK-BR-3 cells. J Nutr Biochem. 2009;20:285-290. [PubMed] [DOI] |
| 9. | Zhang Q, Zhao XH, Wang ZJ. Cytotoxicity of flavones and flavonols to a human esophageal squamous cell carcinoma cell line (KYSE-510) by induction of G2/M arrest and apoptosis. Toxicol In Vitro. 2009;23:797-807. [PubMed] [DOI] |
| 10. | Au A, Li B, Wang W, Roy H, Koehler K, Birt D. Effect of dietary apigenin on colonic ornithine decarboxylase activity, aberrant crypt foci formation, and tumorigenesis in different experimental models. Nutr Cancer. 2006;54:243-251. [PubMed] [DOI] |
| 11. | Chung CS, Jiang Y, Cheng D, Birt DF. Impact of adenomatous polyposis coli (APC) tumor supressor gene in human colon cancer cell lines on cell cycle arrest by apigenin. Mol Carcinog. 2007;46:773-782. [PubMed] [DOI] |
| 12. | Kachadourian R, Day BJ. Flavonoid-induced glutathione depletion: potential implications for cancer treatment. Free Radic Biol Med. 2006;41:65-76. [PubMed] [DOI] |
| 13. | Liu LZ, Fang J, Zhou Q, Hu X, Shi X, Jiang BH. Apigenin inhibits expression of vascular endothelial growth factor and angiogenesis in human lung cancer cells: implication of chemoprevention of lung cancer. Mol Pharmacol. 2005;68:635-643. [PubMed] |
| 14. | Franzen CA, Amargo E, Todorović V, Desai BV, Huda S, Mirzoeva S, Chiu K, Grzybowski BA, Chew TL, Green KJ. The chemopreventive bioflavonoid apigenin inhibits prostate cancer cell motility through the focal adhesion kinase/Src signaling mechanism. Cancer Prev Res (Phila Pa). 2009;2:830-841. [PubMed] [DOI] |
| 15. | Shukla S, Gupta S. Apigenin suppresses insulin-like growth factor I receptor signaling in human prostate cancer: an in vitro and in vivo study. Mol Carcinog. 2009;48:243-252. [PubMed] [DOI] |
| 16. | Chiang LC, Ng LT, Lin IC, Kuo PL, Lin CC. Anti-proliferative effect of apigenin and its apoptotic induction in human Hep G2 cells. Cancer Lett. 2006;237:207-214. [PubMed] [DOI] |
| 17. | Choi SI, Jeong CS, Cho SY, Lee YS. Mechanism of apoptosis induced by apigenin in HepG2 human hepatoma cells: involvement of reactive oxygen species generated by NADPH oxidase. Arch Pharm Res. 2007;30:1328-1335. [PubMed] [DOI] |
| 18. | Gupta S, Afaq F, Mukhtar H. Involvement of nuclear factor-kappa B, Bax and Bcl-2 in induction of cell cycle arrest and apoptosis by apigenin in human prostate carcinoma cells. Oncogene. 2002;21:3727-3738. [PubMed] [DOI] |
| 19. | Shukla S, Mishra A, Fu P, MacLennan GT, Resnick MI, Gupta S. Up-regulation of insulin-like growth factor binding protein-3 by apigenin leads to growth inhibition and apoptosis of 22Rv1 xenograft in athymic nude mice. FASEB J. 2005;19:2042-2044. [PubMed] |
| 20. | Hu XW, Meng D, Fang J. Apigenin inhibited migration and invasion of human ovarian cancer A2780 cells through focal adhesion kinase. Carcinogenesis. 2008;29:2369-2376. [PubMed] [DOI] |
| 21. | Shukla S, MacLennan GT, Flask CA, Fu P, Mishra A, Resnick MI, Gupta S. Blockade of beta-catenin signaling by plant flavonoid apigenin suppresses prostate carcinogenesis in TRAMP mice. Cancer Res. 2007;67:6925-6935. [PubMed] [DOI] |
| 22. | Kaur P, Shukla S, Gupta S. Plant flavonoid apigenin inactivates Akt to trigger apoptosis in human prostate cancer: an in vitro and in vivo study. Carcinogenesis. 2008;29:2210-2217. [PubMed] [DOI] |
| 23. | Shukla S, Gupta S. Apigenin-induced cell cycle arrest is mediated by modulation of MAPK, PI3K-Akt, and loss of cyclin D1 associated retinoblastoma dephosphorylation in human prostate cancer cells. Cell Cycle. 2007;6:1102-1114. [PubMed] |
| 24. | 张 红燕, 李 珊珊, 洋 孙, 王 新华, 阎 爱华, 王 小军. TGF-β1反义寡核苷酸对食管鳞癌细胞EC9706增殖及凋亡的影响. 世界华人消化杂志. 2009;17:3480-3485. [DOI] |
| 25. | Agilent technologies. SurePrint technology. Agilent Home, 2008-10, cited 2010-02. Available from: http://www.chem.agilent.com/en-US/products/instruments/dnamicroarrays/pages/gp557.aspx. |
| 26. | 马 俊芬, 江 亚南, 赵 继敏, 黄 幼田, 赵 明耀, 董 子明. 曲古菌素A对食管癌EC1细胞增殖和细胞周期的影响及其分子机制. 世界华人消化杂志. 2009;17:3534-3537. [DOI] |
| 27. | Kioi M, Takahashi S, Kawakami M, Kawakami K, Kreitman RJ, Puri RK. Expression and targeting of interleukin-4 receptor for primary and advanced ovarian cancer therapy. Cancer Res. 2005;65:8388-8396. [PubMed] [DOI] |
| 28. | Li Z, Jiang J, Wang Z, Zhang J, Xiao M, Wang C, Lu Y, Qin Z. Endogenous interleukin-4 promotes tumor development by increasing tumor cell resistance to apoptosis. Cancer Res. 2008;68:8687-8694. [PubMed] [DOI] |
| 29. | Puri S, Puri S, Mahapatra AK, Hussain E, Sarkar C, Sinha S, Joshi BH. A review of studies on targeting interleukin 4 receptor for central nervous system malignancy. Curr Mol Med. 2009;9:732-739. [PubMed] [DOI] |
| 30. | Todaro M, Lombardo Y, Francipane MG, Alea MP, Cammareri P, Iovino F, Di Stefano AB, Di Bernardo C, Agrusa A, Condorelli G. Apoptosis resistance in epithelial tumors is mediated by tumor-cell-derived interleukin-4. Cell Death Differ. 2008;15:762-772. [PubMed] [DOI] |
| 31. | Zou W, Kim JH, Handidu A, Li X, Kim KI, Yan M, Li J, Zhang DE. Microarray analysis reveals that Type I interferon strongly increases the expression of immune-response related genes in Ubp43 (Usp18) deficient macrophages. Biochem Biophys Res Commun. 2007;356:193-199. [PubMed] [DOI] |
| 32. | Sarasin-Filipowicz M, Wang X, Yan M, Duong FH, Poli V, Hilton DJ, Zhang DE, Heim MH. Alpha interferon induces long-lasting refractoriness of JAK-STAT signaling in the mouse liver through induction of USP18/UBP43. Mol Cell Biol. 2009;29:4841-4851. [PubMed] [DOI] |
| 33. | Randall G, Chen L, Panis M, Fischer AK, Lindenbach BD, Sun J, Heathcote J, Rice CM, Edwards AM, McGilvray ID. Silencing of USP18 potentiates the antiviral activity of interferon against hepatitis C virus infection. Gastroenterology. 2006;131:1584-1591. [PubMed] [DOI] |
| 34. | Duex JE, Sorkin A. RNA interference screen identifies Usp18 as a regulator of epidermal growth factor receptor synthesis. Mol Biol Cell. 2009;20:1833-1844. [PubMed] [DOI] |