修回日期: 2009-12-30
接受日期: 2010-01-04
在线出版日期: 2010-02-18
目的: 探讨幽门螺杆菌(H.pylori)感染、TGF-β1及T淋巴细胞亚群在胃黏膜癌变过程中的作用及相互关系.
方法: 选取不同胃黏膜病变组织的72例胃镜活检标本, 采用快速尿素酶试验(rapid urease test, RUT)结合Giemsa染色判断H.pylori感染, 免疫组织化学染色技术检测胃黏膜组织中TGF-β1表达, 流式细胞术检测不同胃黏膜病变患者外周血T淋巴细胞亚群CD3+、CD4+、CD8+及CD4+/CD8+比值.
结果: TGF-β1在慢性浅表性胃炎(CSG)、慢性萎缩性胃炎(CAG)、肠上皮化生及不典型增生(IM/Dy)和胃癌(GC)中表达的阳性率分别为39.1%, 52.6%, 62.3%和87.5%, CSG组与IM/Dy、GC组相比, 差异有统计学意义(P<0.05); IM/Dy中H.pylori阳性者TGF-β1表达明显高于H.pylori阴性者(87.5% vs 33.3%, P<0.05). 与CSG相比, GC中CD3+明显降低(P<0.05), CD4+及CD4+/CD8+明显降低(P<0.01); IM/Dy患者CD4+及CD4+/CD8+低于CSG, 有显著性差异(均P<0.01). 不同胃黏膜病变TGF-β1表达与CD3+、CD4+ T细胞、CD4+/CD8+呈负相关.
结论: 在GC前病变中, 从CSG到GC, TGF-β1表达逐渐增加, 细胞免疫功能降低, TGF-β1对细胞免疫功能的抑制作用是IM/Dy、GC患者细胞免疫功能低下的原因之一.
引文著录: 李红平, 赵逵, 毛万姮, 方宁, 刘华庆, 张锚链. 胃黏膜TGF-β1在幽门螺杆菌感染中的表达及与外周血T细胞亚群变化的关系. 世界华人消化杂志 2010; 18(5): 506-511
Revised: December 30, 2009
Accepted: January 4, 2010
Published online: February 18, 2010
AIM: To investigate the association of transforming growth factor-beta 1 (TGF-β1) expression in gastric mucosa with Helicobacter pylori (H.pylori) infection and changes in peripheral blood T lymphocyte subsets in patients with gastric precancerous lesions at different stages.
METHODS: Seventy-two gastric mucosa specimens were taken gastroscopically from patients with gastric precancerous lesions at different stages. H.pylori infection was evaluated by rapid urease test (RUT) in combination with Giemsa staining. The expression of TGF-β1 in gastric mucosa was detected by immunohistochemistry. The T lymphocyte subsets in peripheral blood were measured by flow cytometry .
RESULTS: The positive rates of TGF-β1 expression in chronic superficial gastritis (CSG), chronic atrophic gastritis (CAG), intestinal metaplasia and atypical dysplasia (IM/Dy), and gastric carcinoma (GC) were 39.1%, 52.6%, 62.3% and 87.5%, respectively. The positive rate of TGF-β1 expression in CSG was significantly lower than that in IM/Dy (P < 0.05). In patients with IM/Dy, the positive rate of TGF-β1 expression in H.pylori-positive patients was higher than that in H.pylori-negative ones (P < 0.05). The percentages of CD3+, CD4+ and CD4+/CD8+ T lymphocytes were significantly lower in patients with GC than in patients with CSG (all P < 0.05 or 0.01). The percentages of CD4+ and CD4+/CD8+ T lymphocytes in patients with IM/Dy were lower than those in patients with CSG (both P < 0.01). The positive rate of TGF-β1 expression was negatively correlated with the percentages of CD3+, CD4 and CD4+/CD8+ T lymphocytes in patients with gastric precancerous lesions.
CONCLUSION: The expression of TGF-β1 gradually increases and cellular immune function is gradually weakened during the evolution from CSG to GC. The suppressive effects of TGF-β1 on cellular immune function can partly explain why patients with IM/Dy have lower cellular immune function.
- Citation: Li HP, Zhao K, Mao WH, Fang N, Liu HQ, Zhang ML. Association of TGF-β1 expression in gastric mucosa with Helicobacter pylori infection and changes in peripheral blood T lymphocyte subsets during gastric carcinogenesis. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 506-511
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/506.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.506
幽门螺杆菌(Helicobacter pylori, H.pylori)在胃癌(gastric carcinoma, GC)发生中的重要作用日益受到重视. 从慢性浅表性胃炎(chronic superficial gastritis, CSG)、慢性萎缩性胃炎(chronic atrophic gastritis, CAG)、肠上皮化生(intestinal metaplasia, IM)及不典型增生(atypical dysplasia, Dy)到GC的演变过程是GC发生的基本规律. 目前研究认为, H.pylori感染可以增加GC发生的危险性, 已被公认为胃炎、胃溃疡以及GC的重要致病因素[1]. 胡兰英等[2]报道, H.pylori感染程度越严重者, 胃黏膜组织中人白介素-8、肿瘤坏死因子-α水平越高, H.pylori根除后血清、胃黏膜组织中白介素-8、肿瘤坏死因子-α水平水平明显下降, 这些结果说明细胞因子在胃炎的发病机制中占有重要位置. Ebert等[3]研究表明转化生长因子-β1(transforming growth factor β1, TGF-β1)在GC患者及其一级亲属中胃黏膜过度表达并使其细胞增殖, TGF-β1在GC患者的一级亲属中表达增加则使GC发生的风险性增大. 近年来对TGFβ家族在人类GC组织中的分布与GC的发生及癌组织恶性程度关系的研究在不断深入, 但其对H.pylori感染患者胃镜活检组织中的表达及其意义国内外报道相对较少. 笔者通过免疫组织化学方法对H.pylori感染组和非感染组的CSG、CAG、IM/Dy及GC的胃黏膜TGF-β1表达进行检测, 以探讨TGF-β1、H.pylori感染的关系. H.pylori除了通过本身的致病因素、黏附特性以及各种毒力因子造成对胃黏膜的直接损伤外, 宿主免疫应答的异常可能是一个重要的致病机制. 但目前对H.pylori感染所致特异性细胞免疫应答, 尤其是胃黏膜局部细胞因子与免疫应答的研究国内外报道甚少. 本研究应用流式细胞术检测H.pylori感染的不同胃黏膜病变患者外周血T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+比值并与H.pylori阴性者比较, 以了解H.pylori感染时的T淋巴细胞亚群的改变, 分析不同胃黏膜病变H.pylori感染、TGF-β1与细胞免疫功能的关系, 并且进一步分析H.pylori感染在GC的发生过程中的生物学意义.
全部病例选自2005-2007年遵义医学院附属医院内镜中心72例患者不同胃黏膜病变组织的胃镜活检标本及外周肝素抗凝血标本. 其中男38例, 女34例, 年龄21-77(平均56.3)岁. 取材于胃窦小弯侧距幽门2-3 cm及病变明显处黏膜共5块组织, 诊断标准参照2006年上海中国慢性胃炎共识意见[4], 结合胃镜和病理组织学检查, 诊断包括CSG 28例, CAG 19例, IM及Dy 14例, GC 16例. 外周血标本抽取后用肝素抗凝, 当天检测.
1.2.1 H.pylori的检测: 将组织切片行Giemsa染色, 操作如下: 常规石蜡切片, 脱蜡至水, 再用蒸馏水洗; 擦干切片周边的水分, 滴加Giemsa工作液覆盖组织片, 常温下放置1-2 min; 950 mL/L乙醇分化兼脱水, 无水乙醇片刻; 二甲苯透明, 中性树胶封片. 结果: H.pylori主要存在于胃黏膜表面的黏液中、细胞表面、胃小凹内、腺腔中及癌旁黏膜等, 蓝色或深蓝色, 呈海鸥状、弯曲状或杆状. 同时, 行胃镜检查时在胃窦取黏膜组织, 经H.pylori尿素酶检测试剂(福建三强生物化工有限公司)的检测, 两者均阳性者为H.pylori阳性, 两者均阴性者为H.pylori阴性(仅其中1项阳性者不纳入研究范围). H.pylori阳性41例, H.pylori阴性31例.
1.2.2 免疫组织化学染色: 采用EnVision法, 第一抗体为即用型TGF-β1多克隆抗体, 购自福州迈新生物技术公司; EnVision试剂盒(含DAB显色剂)购自上海基因公司. 以PBS代替一抗作空白对照, 用已知阳性片作阳性对照. 操作方法如下: (1)切片脱蜡至水化; (2)每步用PBS液洗3次, 每次3 min; (3)过氧化酶阻断剂10 min; (4)向标本中滴加TGF-β1抗体置37 ℃温箱孵育60 min; (5)滴加EnVision第二抗体, 置37 ℃温箱孵育30 min; (6)DAB显色; (7)苏木素复染、中性树胶封固(具体操作详见说明书).
1.2.3 T淋巴细胞亚群检测: 采用流式细胞术进行检测, 鼠抗人CD4/CD8/CD3, FITC/PE/PE-Cy5标记抗体购自深圳晶美生物工程有限公司. 操作方法如下: 取100 μL肝素抗凝全血加10 μL CD4/CD8/CD3, FITC/PE/PE-Cy5标记抗体充分混匀, 室温避光放置20 min后加2 mL红细胞裂解液, 完全溶血后离心洗涤, 弃上清液加PBS 2 mL混匀, 离心弃上清液, 再加 PBS 2 mL洗涤1次, 弃上清液加 PBS 0.5 mL混匀后上机检测. 用流式细胞仪(FACSCalibur型, 美国BD公司)及其配套软件取数和分析.
1.2.4 结果判定: TGF-β1免疫组织化学染色结果判断: TGF-β1为细胞质着色, 染色阳性以细胞质呈棕色颗粒状染色为标准, 且着色明显高于背景或背景不着色而细胞着色者为阳性细胞染色. 按切片中细胞染色强度记分: 0分为细胞无染色, 1分为染色呈浅黄色, 2分为棕黄色, 3分为褐色; 再按切片中显色细胞所占比例记分: 每片随机观察5个具有代表性的高倍视野, 计数500个细胞中染色阳性细胞数, 0分为无阳性染色细胞, 1分为染色细胞<30%, 2分为30%-70%, 3分为>70%. 每张切片细胞染色积分 = 强度记分×比例记分. 按积分高低分为4级: 0分为阴性, 大于1分为阳性, 其中以1-3分为弱阳性(+), 4-6分为阳性(++), 7-9分为强阳性(+++)[5].
统计学处理 应用SPSS13.0统计软件处理数据, 计量资料以mean±SD表示. 采用单因素方差分析、χ2检验、直线相关分析, 以P<0.05为差异有统计学意义, P<0.01为差异有显著性.
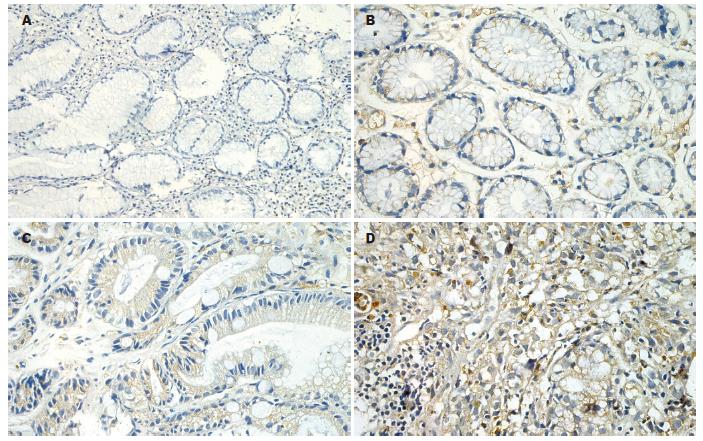
TGF-β1阳性反应产物呈棕黄色或棕褐色, 主要分布于细胞质或细胞膜, 细胞核未见着色. 在慢性浅表性胃炎中着色细胞较少, 主要分布于黏膜表层, 从慢性萎缩性胃炎、不典型增生或肠上皮化生至GC, 阳性染色细胞逐渐增多且分布不均. 淋巴细胞、血管上皮细胞、红细胞和平滑肌组织均呈不同程度着色(图1).
从CSG到GC, TGF-β1表达呈逐渐递增趋势, 在GC和IM/Dy中的表达显著高于CSG(均P<0.05, 表1).
TGF-β1在H.pylori阳性组表达(66.7%)虽高于H.pylori阴性组(46.7%), 但差异无统计学意义(P>0.05), 但在IM/Dy中H.pylori阳性者其表达(87.5%)高于H.pylori阴性者(33.3%), 差异有统计学意义(87.5% vs 33.3%, P<0.05), 而CSG、CAG中H.pylori阳性与H.pylori阴性者TGF-β1表达无统计学意义(P>0.05, 表2).
72例患者, 其中CSG、 CAG、 IM/Dy、GC分别为23、19、14、16例, 正常对照组10例, T淋巴细胞检测结果见表3.
不同胃黏膜病变TGF-β1表达与CD3+ T细胞呈负相关(r = -0.237, P<0.05), 与 CD4+ T细胞呈负相关(r = -0.491, P<0.01), 与CD4+/CD8+也呈负相关(r = -0.484, P<0.01), 与CD8+ T细胞呈正相关(r = 0.262, P<0.05).
GC为我国常见的恶性肿瘤之一, 他的发生是一个多因子作用、多步骤反应的生物学过程. H.pylori作为GC的重要危险因素以被世人公认, 动物实验也证实显示, 早期根除H.pylori可预防GC的发生. H.pylori可以通过诱发炎症、调节癌基因和抑癌基因的表达、诱导黏膜上皮增殖和凋亡异常及其代谢产物包括一些酶类、毒素和蛋白直接损害黏膜引发疾病. 流行病学资料表明, H.pylori感染在胃黏膜的癌变模式中起到重要作用, H.pylori感染胃黏膜导致萎缩性胃炎、肠化生、异型增生, 最终导致GC. H.pylori可以引起胃黏膜上皮细胞的过度增生和凋亡异常, 进而增加处于旺盛状态的DNA的受损机会, 促使细胞发生癌变[6]. 1998年日本Watanabe等[7]报道了通过建立蒙古沙土鼠H.pylori感染模型研究H.pylori的致癌性, 结果显示所有感染H.pylori的蒙古沙土鼠很快出现慢性胃炎, 26 wk后2/3的动物出现肠上皮化生, 54 wk后有1/4发展为GC. 日本Uemura等[8]研究胃溃疡、十二指肠溃疡、胃黏膜增生、非溃疡性消化不良等患者共1 526例, 其中H.pylori阳性1 246例, H.pylori阴性280例. 平均随访7.8年(其中最短1.0年, 最长10.6年), 结果发现H.pylori阳性组有36例(2.9%)发展为GC, 而H.pylori阴性组无一例GC发生, 均是H.pylori致癌的直接证据. 然而, H.pylori致胃黏膜癌变的确切机制仍不清楚.
TGF-β是一个多功能的细胞因子超家族, 其主要作用包括调节细胞增殖和分化, 参与胚胎发育调节, 促进细胞外基质(extracellular matrix, ECM)形成和抑制免疫反应, 在调节细胞的生长、分化、凋亡、黏附、细胞外基质合成与沉积、胚胎及形态发生和组织修复、炎症反应、间质纤维化、肿瘤的形成和发展中起重要的作用[9]. 在其5个亚型中哺乳动物只表达TGF-β1, 2, 3, 三者的生物学作用相似, 序列同源性70%-80%, 其中TGF-β1含量最高, 有代表性, 是人体内的主要形式. 他是一种多功能的细胞因子, 他在许多细胞中具有广泛的但可能互相矛盾的作用. 对正常上皮细胞而言, TGF-β1发挥着普遍的生长抑制效应, 在控制其细胞生长、胚胎发育、免疫调节和细胞凋亡等方面都具有重要作用; 但GC、结直肠癌等某些肿瘤在其发生发展中过程中, 可摆脱TGF-β1的抑制甚至被TGF-β1刺激而生长. 我们用免疫组织化学EnVision法检测和分析了H.pylori感染状态下不同病变类型胃黏膜TGF-β1表达, 本研究结果显示, 从正常胃黏膜组织到肠化及不典型增生组织, 随着胃黏膜病变程度的加重, TGF-β1表达呈逐渐增加的趋势, 在IM/Dy组其表达已接近GC组, 提示TGF-β1与GC的发生有关. 本研究还发现, TGF-β1表达在H.pylori阳性组虽稍高于H.pylori阴性组, 但无统计学意义(P>0.05); 而IM/Dy中H.pylori阳性组TGF-β1表达高于H.pylori阴性组(P<0.05), 在CSG、CAG中, TGF-β1在H.pylori阳性组与阴性组中的表达无差异性, 表明H.pylori感染则增强GC前病变中TGF-β1表达, 这可能是H.pylori感染致GC机制中起始阶段的一个重要环节.
T淋巴细胞在机体免疫中占有重要的地位, 外周血T淋巴细胞亚群的变化是反映机体细胞免疫状态的较好指标, CD8+ Ts细胞与CD4+ Th细胞的作用相反, 对免疫应答具有重要的调节作用. 在正常情况下, 两者相互诱导和制约形式的T细胞网络, 对维持免疫功能的平衡具有重要的意义[10], 当两者的比例失调时, 即可导致细胞免疫功能紊乱或失调, 而削弱机体抵抗力. 通过本实验研究表明, IM/Dy患者T细胞亚群与正常对照组相比, CD4+及CD4+/CD8+显著降低. 因此, 由于IM/Dy患者细胞免疫低下, 而导致抗肿瘤能力减弱, 对该类患者应密切观察, 定期复查. 诸多研究表明, 肿瘤患者的细胞免疫功能呈低下状态, 即与健康人相比, 术前的GC患者CD3+、CD4+ T细胞数及CD4+/CD8+比例均降低, 而CD8+则升高, 表明患者的 T细胞亚群间的平衡失调, 总体免疫功能低下[11]. 充分说明IM/Dy及GC患者存在细胞免疫功能紊乱, 而动态观察T细胞亚群变化, 不失为对CAG患者进行随访中的一项主要指标, 以利早期发现病变.
TGF-β是很强的免疫抑制因子, 可由多数肿瘤细胞产生, 通过抑制宿主免疫系统杀伤肿瘤细胞, 促进肿瘤的发生、侵袭和转移. 其机制有: TGF-β对白介素-2诱导的T淋巴细胞增殖和活化起负调控作用; 抑制细胞毒性T淋巴细胞(包括肿瘤浸润淋巴细胞)、自然杀伤细胞和淋巴因子激活杀伤细胞的杀伤活性; 增加CD8抑制性T细胞的产生; 阻止免疫球蛋白的合成; 抑制干扰素诱导的主要组织相容性复合体(major histocompatibility complex, MHC)Ⅱ类抗原表达, 阻止细胞毒性T淋巴细胞对肿瘤细胞的识别[12], 实验研究也证实了TGF-β在肿瘤逃避免疫监视方面发挥重要作用. 通过本实验研究表明, 在从慢性胃炎到GC的不同胃黏膜病变中, TGF-β1表达与CD3+ T细胞、CD4+ T细胞及CD4+/CD8+均呈负相关, TGF-β1表达水平明显升高, 而细胞免疫功能低下, 进一步说明TGF-β1对细胞免疫功能的抑制作用是IM/Dy、GC患者细胞免疫功能低下的原因之一. 当然对T淋巴细胞的调节是由多种细胞因子参与的复杂过程, 但是对于IM/Dy及GC患者, 寻找抑制TGF-β1分泌或拮抗其作用的方法, 不失为恢复细胞免疫功能的一条有效途径.
胃癌(GC)的发生是一个多因子作用、多步骤反应的生物学过程. H.pylori感染在胃黏膜的癌变模式中起到重要作用, TGF-β是很强的免疫抑制因子, 可由多数肿瘤细胞产生, 通过抑制宿主免疫系统杀伤肿瘤细胞, 促进肿瘤的发生、侵袭和转移. 侵袭因素与机体免疫反应的相互作用决定了GC的发生、病理过程及预后, 然而H.pylori感染、细胞因子及机体免疫功能三者关系目前不太十分明了, 因此有必要对三者关系进一步研究.
郑鹏远, 教授, 郑州大学第二附属医院消化科.
任彦等用免疫细胞化学方法, 检测NF-κB和TGF-α在H.pylori阳性和阴性胃炎患者及正常人的胃窦部活检标本, 结果在H.pylori阳性组, NF-κB和TGF-α呈高表达, 与阴性组和正常组比较均有显著性差异, 认为NF-κB和TGF-α的检测对于根治H.pylori阳性胃炎患者临床疗效判定是一种简单而有价值的指标, 同时也指出NF-κB、细胞因子和神经内分泌三者之间在胃窦黏膜病变的进程中的复杂关系.
本研究应用流式细胞术检测H.pylori感染的不同胃黏膜病变患者外周血T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+比值并与H.pylori阴性者比较, 以了解H.pylori感染时的T淋巴细胞亚群的改变, 分析不同胃黏膜病变H.pylori感染、TGF-β1与细胞免疫功能的关系, 并且进一步分析H.pylori感染在GC的发生过程中的生物学意义.
本研究提示, IM/Dy及GC患者存在明显的细胞免疫功能紊乱, 而动态观察T细胞亚群变化, 不失为对CAG患者进行随访中的一项主要指标, 以利早期发现病变.
本研究对临床常见的GC癌前病变进行观察, 具有一定的理论意义和潜在的临床价值.
编辑: 李军亮 电编:吴鹏朕
| 3. | Ebert MP, Yu J, Miehlke S, Fei G, Lendeckel U, Ridwelski K, Stolte M, Bayerdörffer E, Malfertheiner P. Expression of transforming growth factor beta-1 in gastric cancer and in the gastric mucosa of first-degree relatives of patients with gastric cancer. Br J Cancer. 2000;82:1795-1800. [PubMed] [DOI] |
| 6. | Isomoto H, Furusu H, Shin M, Ohnita K, Miyazaki M, Omagari K, Mizuta Y, Murase K, Inoue K, Murata I. Enhanced expression of transcription factor E2F in Helicobacter pylori-infected gastric mucosa. Helicobacter. 2002;7:152-162. [PubMed] [DOI] |
| 7. | Watanabe T, Tada M, Nagai H, Sasaki S, Nakao M. Helicobacter pylori infection induces gastric cancer in mongolian gerbils. Gastroenterology. 1998;115:642-648. [PubMed] [DOI] |
| 8. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 10. | 贾 战生, 于 兰. T淋巴细胞亚群的检测及其临床意义. 国外医学•临床生物化学与检验分册. 1992;13:157-160. |
| 12. | Letterio JJ, Roberts AB. Regulation of immune responses by TGF-beta. Annu Rev Immunol. 1998;16:137-161. [PubMed] [DOI] |