修回日期: 2009-12-30
接受日期: 2010-01-04
在线出版日期: 2010-02-18
目的: 探讨食管鳞癌中STAT3、p-STAT3蛋白表达与食管鳞癌上皮间质转化的关系及其在食管鳞癌浸润转移中的作用.
方法: 采用免疫组织化学技术检测80例食管鳞癌中STAT3、p-STAT3及上皮间质转化标志物E-cadherin和Vimentin的表达.
结果: 食管鳞癌组织中STAT3、p-STAT3、E-cadherin和Vimentin蛋白阳性率与癌旁正常组织相比有显著性差异(STAT3: 87.5% vs 70.0%; p-STAT3: 72.5% vs 28.8%; E-cadherin: 37.5% vs 78.8%; Vimentin: 48.8% vs 0%, 均P<0.01). 食管鳞癌组织中STAT3、p-STAT3的表达均与E-cadherin的表达呈负相关(r = -0.410, -0.506; 均P = 0.000), 与Vimentin表达均呈正相关(r = 0.293, 0.321; P = 0.008, 0.004), 且与癌组织的浸润深度密切相关(均P<0.05).
结论: 信号蛋白STAT3可能参与了食管鳞癌的上皮间质转化过程, 并与食管鳞癌的侵袭转移相关.
引文著录: 高远, 轩小燕, 张红燕, 王丰, 王志强, 曾庆汝, 李珊珊. STAT3信号蛋白与食管鳞癌上皮间质转化的关系及其意义. 世界华人消化杂志 2010; 18(5): 447-452
Revised: December 30, 2009
Accepted: January 4, 2010
Published online: February 18, 2010
AIM: To investigate the expression of signal transducer and activator of transcription 3 (STAT3) and phosphorylated STAT3 (p-STAT3) in esophageal squamous cell carcinoma (ESCC) and analyze their relationship with epithelial-mesenchymal transition and tumor infiltration and metastasis.
METHODS: Immunohistochemistry was used to determine the expression of STAT3, p-STAT3, E-cadherin and vimentin in 80 ESCC specimens and matched adjacent non-cancerous tissue specimens.
RESULTS: The positive rates of STAT3, p-STAT3, E-cadherin and vimentin in ESCC tissue were significantly different from those in adjacent non-cancerous tissue (87.5% vs 70.0%, 72.5% vs 28.8%, 37.5% vs 78.8% and 48.8% vs 0%, respectively; all P < 0.01). The expression of STAT3 and p-STAT3 was negatively correlated with E-cadherin expression (r = -0.410 and -0.506, respectively; both P = 0.000) but positively with vimentin expression (r = 0.293 and 0.321, respectively; P = 0.008 and 0.004, respectively) in ESCC tissue. The expression of STAT3 and p-STAT3 was significantly associated with depth of tumor invasion (both P < 0.05).
CONCLUSION: Overexpression of STAT3 protein may be involved in EMT and tumor invasion and metastasis in ESCC.
- Citation: Gao Y, Xuan XY, Zhang HY, Wang F, Wang ZQ, Zeng QR, Li SS. Relationship between STAT3 protein expression and epithelial-mesenchymal transition in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 447-452
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/447.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.447
上皮间质转化(epithelial to mesenchymal transition, EMT)是上皮细胞失去上皮特征获得间质特征的过程, 这一过程同恶性肿瘤的浸润转移密切相关[1]. 通常用来验证EMT发生的分子学标志物包括: 上皮标志物E-cadherin和Cytokeratin表达下降, 以及间质标志物N-cadherin和Vimentin表达的增加. 信号转导子和转录活化因子(signal transducers and activators of transcription, STATs)蛋白是转录因子家族成员, 这些多功能蛋白磷酸化激活后, 可调节下游靶基因的转录. STAT3基因是该家族现已被公认的癌基因, 持续活化的STAT3可调控下游多个与肿瘤细胞增殖、分化、凋亡及浸润转移有关的靶基因的转录, 从而在肿瘤的发生、发展中发挥重要作用. 本课题组前期研究已发现STAT3信号蛋白的激活与食管鳞癌的发生发展及恶性演变有关[2]. 本文应用免疫组织化学方法检测了食管鳞癌组织中信号蛋白STAT3及其活化形式p-STAT3以及上皮间质转化标志物E-cadherin和Vimentin的表达. 分析了STAT3、p-STAT3与E-cadherin和Vimentin的相关性, 探讨STAT3信号通路及其激活与食管鳞癌EMT的关系及在浸润转移中的作用, 可望进一步揭示食管鳞癌侵袭与转移的分子生物学机制.
收集郑州大学第一附属医院2007-08/2008-08食管鳞癌手术切除标本80例, 正常食管黏膜取自手术切除标本两残端, 距癌组织3 cm以上, 经病理证实为分化良好的鳞状上皮及少量固有层成分. 标本中男51例, 女29例, 年龄40-78(60.7±8.1)岁. 80例食管癌标本病理组织学类型均为鳞状细胞癌, 分化Ⅰ级21例, Ⅱ级40例, Ⅲ级19例; 侵及浅层(黏膜下层或浅肌层)16例, 侵及深层(深肌层或外膜层)64例; 有淋巴结转移者20例, 无淋巴结转移者60例. 兔抗人STAT3多克隆抗体和兔抗人E-cadherind多克隆抗体购自美国Santa Cruz公司, 兔抗人p-STAT3多克隆抗体购自武汉博士德公司, 鼠抗人Vimentin单克隆抗体和免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学: 染色采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxides, SP), 食管鳞癌标本以40 g/L多聚甲醛固定, 常规石蜡包埋. 蜡块以4 μm厚连续切片. 常规脱蜡, 水化, 高压锅修复, 一抗工作浓度均为1:200. DAB显色, 苏木素复染, 中性树胶封片. STAT3和p-STAT3采用已知阳性染色的胃癌组织切片作为阳性对照, E-cadherin采用已知阳性染色的卵巢癌组织切片作为阳性对照, Vimentin采用已知阳性染色的平滑肌瘤组织切片作为阳性对照, 均用PBS代替一抗作为阴性对照.
1.2.2 结果判定: STAT3阳性显色为棕黄色颗粒, 位于细胞质和(或)细胞核; p-STAT3以细胞核中有黄色或棕黄色着色的细胞为阳性; Vimentin以细胞质中有黄色或棕黄色着色的细胞为阳性; E-cadherin阳性显色为棕黄色颗粒, 主要位于细胞膜, 少部分位于细胞质. 参照有关文献[3], 在高倍视野下(400×)随机选取5个视野(每个视野观察不少于200个细胞), 按阳性细胞所占的百分比及着色强度进行结果判定: (1)按着色强度评分: 0分为无着色; 1分为浅黄色; 2为黄色; 3分为棕黄色. (2)按阳性细胞数占同类细胞数的百分比评分: 0分为阴性, 1分为阳性细胞数≤10%, 2分为阳性细胞数11%-50%, 3分为阳性细胞数51%-75%, 4分为阳性细胞数>75%. 取两项评分的乘积作为总积分, 0-3分为阴性(-), 3分以上为阳性(+).
统计学处理 应用SPSS13.0进行数据分析, 计数资料采用χ2检验(chi-square)及Fisher精确概率计算法; 两组均数的比较用t检验(t-test); 多组均数的比较用方差分析(ANVOA); 相关性分析采用Pearson's相关分析. 以α = 0.05为显著性.
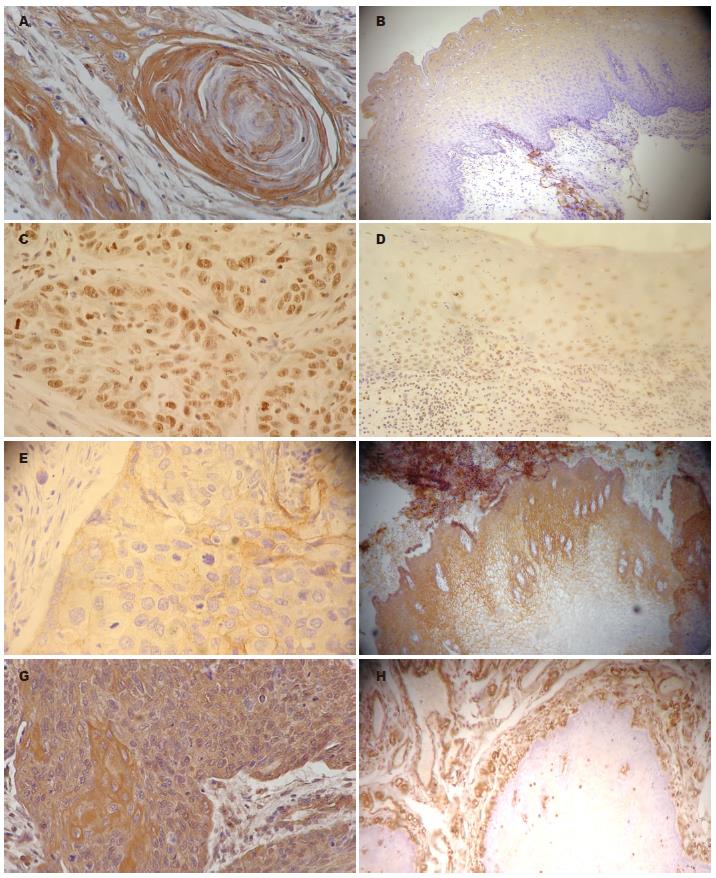
食管鳞癌组织中STAT3、p-STAT3蛋白的阳性表达率明显高于食管正常黏膜组织中的表达(87.5%, 72.5% vs 70%, 28.8%, P<0.01). STAT3蛋白表达和癌组织的分化程度、浸润深度有关(P<0.05), 与淋巴结转移无关(P>0.05). p-STAT3蛋白表达和癌组织的浸润深度有关(P<0.05), 与分化程度及淋巴结转移无关(P>0.05, 图1, 表1).
| 临床病理特征 | n | STAT3 | p-STAT3 | E-cadherin | Vimentin | |||||||||||||||||
| - | + | 阳性率(%) | χ2值 | P值 | - | + | 阳性率(%) | χ2值 | P值 | - | + | 阳性率(%) | χ2值 | P值 | - | + | 阳性率(%) | χ2值 | P值 | |||
| 正常黏膜 | 80 | 24 | 56 | 70 | 7.32 | 0.007 | 57 | 23 | 28.8 | 30.63 | 0 | 17 | 63 | 78.8 | 27.963 | 0 | 80 | 0 | 0 | 51.57 | 0 | |
| 鳞癌 | 80 | 10 | 70 | 87.5 | 22 | 58 | 72.5 | 50 | 30 | 37.5 | 41 | 39 | 48.8 | |||||||||
| 分化程度 | ||||||||||||||||||||||
| 高 | 19 | 6 | 13 | 68.4 | 9.522 | 0.008 | 7 | 12 | 63.2 | 1.584 | 0.453 | 8 | 11 | 57.9 | 6.423 | 0.04 | 14 | 5 | 26.3 | 8.175 | 0.017 | |
| 中 | 40 | 4 | 36 | 90 | 11 | 29 | 72.5 | 25 | 15 | 37.5 | 21 | 19 | 47.5 | |||||||||
| 低 | 21 | 0 | 21 | 100 | 4 | 17 | 81 | 17 | 4 | 19 | 6 | 15 | 71.4 | |||||||||
| 浸润深度 | ||||||||||||||||||||||
| 浅层 | 16 | 5 | 11 | 68.8 | 6.429 | 0.011 | 8 | 8 | 50 | 5.078 | 0.024 | 6 | 10 | 62.5 | 5.333 | 0.021 | 10 | 6 | 37.5 | 1.013 | 0.314 | |
| 深层 | 64 | 5 | 59 | 92.2 | 14 | 50 | 78.1 | 44 | 20 | 31.2 | 31 | 33 | 51.6 | |||||||||
| 淋巴结转移 | ||||||||||||||||||||||
| 有 | 20 | 3 | 17 | 85 | 0.152 | 0.696 | 2 | 18 | 90 | 3.009 | 0.083 | 14 | 6 | 30 | 1.111 | 0.292 | 10 | 10 | 50 | 0.017 | 0.897 | |
| 无 | 60 | 7 | 53 | 88.3 | 20 | 40 | 66.7 | 36 | 24 | 40 | 31 | 29 | 48.3 | |||||||||
E-cadherin在食管鳞癌组织的表达显著低于食管正常黏膜组织中的表达(37.5% vs 78.8%, P<0.01). E-cadhein蛋白表达和癌组织的浸润深度和分化程度有关(P<0.05), 与淋巴结转移无关(P>0.05). 而食管鳞癌组织中Vimentin蛋白的表达率明显高于食管正常黏膜组织中的表达(48.8% vs 0%, P<0.01). Vimentin蛋白表达和癌组织的分化程度有关(P<0.05), 与浸润深度及淋巴结转移无关(P>0.05, 图1, 表1).
70例STAT3蛋白表达阳性的食管鳞癌组织标本中, E-cadherin蛋白阳性表达标本例数为21例, 二者的相关系数为-0.410, 食管鳞癌组织中STAT3蛋白和E-cadherin蛋白表达呈负相关关系(P<0.01, 图1, 表2).
| STAT3 | E-cadherin | 合计 | r值 | P值 | Vimentin | 合计 | r值 | P值 | ||
| + | - | + | - | |||||||
| + | 21 | 49 | 70 | -0.410 | 0.000 | 38 | 32 | 70 | 0.293 | 0.008 |
| - | 9 | 1 | 10 | 1 | 9 | 10 | ||||
| 合计 | 30 | 50 | 80 | 39 | 41 | 80 | ||||
在70例STAT3蛋白表达阳性的食管鳞癌组织中, Vimentin蛋白的阳性表达高达38例, 二者的相关系数为0.293, 食管鳞癌组织中STAT3蛋白和Vimenin蛋白的表达呈正相关(P<0.01, 表2).
在58例p-STAT3蛋白阳性表达的标本中, E-cadherin蛋白阳性表达的标本仅为13例, 二者的相关系数为-0.506, 相关性分析显示p-STAT3蛋白的表达和E-cadherin蛋白的表达呈负相关 (P<0.01, 表3).
| p-STAT3 | E-cadherin | 合计 | r值 | P值 | Vimentin | 合计 | r值 | P值 | ||
| + | - | + | - | |||||||
| + | 13 | 45 | 58 | -0.506 | 0.000 | 34 | 24 | 58 | 0.321 | 0.004 |
| - | 17 | 5 | 22 | 5 | 17 | 22 | ||||
| 合计 | 30 | 50 | 80 | 39 | 41 | 80 | ||||
在58例p-STAT3蛋白阳性表达的标本中, Vimentin蛋白阳性表达的标本为34例, 二者的相关系数为0.321, 相关性分析显示p-STAT3蛋白的表达和Vimentin蛋白的表达呈正相关(P<0.01, 表3).
研究表明EMT是一个极其复杂的过程, 包括涉及细胞黏附, 极性, 细胞骨架, 动力学和细胞内信号的多个基因的改变[4,5], 但其最重要的特征是指上皮细胞在形态学上发生成纤维细胞或间质细胞表型的转变并获得迁移的能力. 因此EMT之后使细胞获得了更强的侵袭力. 研究表明EMT与多种信号通路的异常激活有关[6,7]. STAT3是最近新发现的一种重要的核转录因子[8], 在接受生长因子、细胞因子等细胞外信号刺激后, 以活化的p-STAT3形式进入细胞核中, 与靶基因启动子上特异的DNA原件相结合, 调控一些控制细胞基本生理功能的靶基因的转录, 从而影响细胞的增殖、分化、凋亡及浸润转移[9,10]. 已有研究证明, STAT3与多种肿瘤的发生有关, 如, 乳腺癌、前列腺癌、胰腺癌等. 也有研究发现STAT3的表达与胃癌的组织分化程度和淋巴结转移状态相关. 前期研究发现siRNA STAT3可以阻断STAT3信号通路, 并可能对食管鳞癌细胞株起到抑制增殖的作用[2], 这表明STAT3信号通路可能与食管鳞癌的增殖有关. 本文旨在探讨STAT3在食管鳞癌浸润转移中的作用及与食管鳞癌EMT的关系. 结果表明, 在食管鳞癌组织中STAT3蛋白和其活性形式p-STAT3蛋白的表达远高于食管正常黏膜(P<0.01), 表明STAT3信号蛋白及其活化与食管鳞癌的发生有关. 同时随着癌细胞侵袭能力的增强, STAT3和p-STAT3蛋白阳性率增高, 浸润至深层(深肌层和外膜)的食管鳞癌组织中STAT3和p-STAT3阳性表达率明显高于浸润至浅层(黏膜和浅肌层)的食管鳞癌组织(P<0.05). 另外本研究发现, STAT3的表达与食管鳞癌的分化程度有关, 随着癌分化程度的降低, STAT3蛋白的表达显著增强, 但未发现p-STAT3的表达与食管鳞癌分化程度的关系. 也未发现STAT3信号蛋白及其活化与食管鳞癌淋巴结转移的关系.
EMT在肿瘤浸润转移中的作用越来越引起人们的关注. Thiery等[1]研究描述了EMT发生的过程: 正常上皮细胞通过表型遗传学的改变或基因突变转化生成癌细胞, 癌细胞通过EMT形式局部扩散, 基底膜变脆, 癌细胞侵入淋巴管和血管, 从而发生转移, 同时伴随着E-cadheirn、Cytokeratins等上皮标志物的减少或缺失, N-cadherin、Vimentin和Demin等间质标志物出现表达. E-cadherin蛋白在各种类型的上皮细胞中均有表达, 是维持上皮细胞极性及细胞间黏附连接的主要分子[11]. 关于EMT与食管鳞癌浸润转移的研究目前报道较少, 本研究结果显示, 食管鳞癌组织中E-cadherin蛋白的表达较正常食管黏膜蛋白表达明显降低. 同时还显示, STAT3、p-STAT3与E-cadherin蛋白的表达均呈负相关, E-cadherin蛋白阳性率和癌组织的分化程度、浸润深度密切相关(P<0.05). Vimentin是细胞中间丝的一种, 分布于间质细胞, 是间质组织共有的标志物, 其阳性标志物定位于细胞质. 目前研究发现, 尽管Vimentin主要表达于间质来源的细胞及某些未分化细胞, 但也可能反常表达于一些上皮源细胞, 尤其是上皮源肿瘤细胞[12]. 对这种异常表达现象研究后发现, Vimentin与细胞的生长分化状态以及细胞游走迁移有关. Vimentin异常表达可引起细胞骨架蛋白发生变化, 导致细胞骨架发生排列变化, 从而干扰信号转导通路的工作, 导致细胞生物学性状发生改变[13]. 本研究显示了Vimentin在食管鳞癌组织中异常高表达, 并证实STAT3、p-STAT3与Vimentin蛋白的表达呈正相关. Vimentin在食管鳞癌中的表达和分化程度相关.
Ferrand等[14]研究发现在结肠癌细胞中, JAK2/STAT3信号转导通路参与调节上皮细胞之间的黏附, 可能与恶性病变中EMT有关. 同时最近研究显示由TGF-β1诱导的EMT与蛋白激酶A(PKA)和STAT3的激活有关. 抑制PKA可阻断STAT3的激活并抑制TGF-β1诱导的EMT, 缺乏磷酸化的STAT3(非野生型)可以对TGF-β1引发的EMT产生抑制作用[15]. 以上研究显示, STAT3参与EMT发生过程. STAT3是否与食管癌的EMT过程有关及其在食管癌浸润转移中所起的作用如何, 目前尚未见报道.
以上结果表明, 食管鳞癌中EMT的发生可能与STAT3信号通路的激活相关. STAT3信号通路异常活化并与下游调控基因启动子结合, 从而下调E-cadherin的表达并上调Vimentin的表达, 最终诱导食管鳞癌EMT的发生. 因此, STAT3信号蛋白及其激活在食管鳞癌浸润转移中的作用可能与食管鳞癌EMT有关.
食管癌是目前世界死亡率很高的恶性肿瘤之一, 在我国多发于河北南部和河南北部安阳地区. 到目前为止, 食管癌的病因和发病机制尚不清楚, 因此探讨食管癌的发生发展乃至浸润转移机制, 对降低食管癌的预防和术后治疗都有重要意义.
陈洪, 副教授, 东南大学附属中大医院消化科.
恶性肿瘤的浸润和转移是导致各种治疗方案失败, 预后不良, 乃至患者死亡的最重要因素. 大量研究发现, 上皮间质转化(EMT)同恶性肿瘤的浸润转移密切相关. 因此, EMT的发生发展机制及与相关调控因子的关系是研究恶性肿瘤浸润转移的重要途径, 也是目前研究的热点.
本研究首次探讨了食管鳞癌中STAT3蛋白、磷酸化STAT3(p-STAT3)蛋白表达与食管鳞癌EMT的关系及其在食管鳞癌浸润转移中的作用.
本文研究结果显示, STAT3信号蛋白及其活化与食管鳞癌的发生有关, 且STAT3、p-STAT3与E-cadherin蛋白的表达均呈负相关, 与Vimentin蛋白的表达呈正相关. 为进一步揭示食管鳞癌侵袭在转移的分子生物学机制提供理论依据.
1 上皮间质转化(EMT): 是上皮细胞失去上皮特征获得间质特征的过程, 这一过程同恶性肿瘤的浸润转移密切相关. 并伴随着上皮标志物E-cadherin、 Cytokeratin等表达下降, 以及间质标志物N-cadherin、 Vimentin等表达的增加.
2 信号转导子和转录活化因子(STATs)蛋白: 是转录因子家族成员, 这些多功能蛋白磷酸化激活后, 可调节下游靶基因的转录. 该家族中的STAT1、STAT3等因子均已被证明与恶性肿瘤的发生发展有关.
本文研究了STAT3信号蛋白在食管鳞癌EMT及浸润转移中的作用, 对理解食管癌发生发展的分子机制有重要意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Thiery JP. Epithelial-mesenchymal transitions in development and pathologies. Curr Opin Cell Biol. 2003;15:740-746. [PubMed] [DOI] |
| 2. | 王 新华, 李 珊珊, 阎 爱华, 孙 洋, 卢 创新, 郭 燕萍. 小干扰RNA阻断信号转导子和转录激活子3信号对人食管鳞癌细胞株增殖的抑制作用. 中华病理学杂志. 2007;36:380-384. |
| 3. | Wang YZ, Wharton W, Garcia R, Kraker A, Jove R, Pledger WJ. Activation of Stat3 preassembled with platelet-derived growth factor beta receptors requires Src kinase activity. Oncogene. 2000;19:2075-2085. [PubMed] [DOI] |
| 4. | LaGamba D, Nawshad A, Hay ED. Microarray analysis of gene expression during epithelial-mesenchymal transformation. Dev Dyn. 2005;234:132-142. [PubMed] [DOI] |
| 5. | Dugina VB, Alexandrova AY, Lane K, Bulanova E, Vasiliev JM. The role of the microtubular system in the cell response to HGF/SF. J Cell Sci. 1995;108:1659-1667. [PubMed] |
| 7. | Rosivatz E, Becker I, Specht K, Fricke E, Luber B, Busch R, Höfler H, Becker KF. Differential expression of the epithelial-mesenchymal transition regulators snail, SIP1, and twist in gastric cancer. Am J Pathol. 2002;161:1881-1891. [PubMed] |
| 8. | Alvarez JV, Greulich H, Sellers WR, Meyerson M, Frank DA. Signal transducer and activator of transcription 3 is required for the oncogenic effects of non-small-cell lung cancer-associated mutations of the epidermal growth factor receptor. Cancer Res. 2006;66:3162-3168. [PubMed] [DOI] |
| 9. | Stepkowski SM, Chen W, Ross JA, Nagy ZS, Kirken RA. STAT3: an important regulator of multiple cytokine functions. Transplantation. 2008;85:1372-1377. [PubMed] [DOI] |
| 11. | Takeichi M. Morphogenetic roles of classic cadherins. Curr Opin Cell Biol. 1995;7:619-627. [PubMed] [DOI] |
| 12. | Fraga CH, True LD, Kirk D. Enhanced expression of the mesenchymal marker, vimentin, in hyperplastic versus normal human prostatic epithelium. J Urol. 1998;159:270-274. [PubMed] [DOI] |
| 13. | 吴 静, 古 建鼐. 成纤维细胞和纤维肉瘤细胞的中等纤维构型特点及其意义. 暨南大学学报(自然科学与医学版). 1995;4:819-824. |
| 14. | Ferrand A, Kowalski-Chauvel A, Bertrand C, Pradayrol L, Fourmy D, Dufresne M, Seva C. Involvement of JAK2 upstream of the PI 3-kinase in cell-cell adhesion regulation by gastrin. Exp Cell Res. 2004;301:128-138. [PubMed] [DOI] |
| 15. | Lo HW, Hsu SC, Xia W, Cao X, Shih JY, Wei Y, Abbruzzese JL, Hortobagyi GN, Hung MC. Epidermal growth factor receptor cooperates with signal transducer and activator of transcription 3 to induce epithelial-mesenchymal transition in cancer cells via up-regulation of TWIST gene expression. Cancer Res. 2007;67:9066-9076. [PubMed] [DOI] |