修回日期: 2009-12-02
接受日期: 2009-12-07
在线出版日期: 2010-02-18
目的: 探讨表皮生长因子(EGF)对HepG2细胞丝状伪足形成和细胞体外侵袭能力的影响以及细胞分裂周期蛋白42(Cdc42)在其中的作用.
方法: 将Cdc42 siRNA转染HepG2细胞株, RT-PCR和Western blot检测EGF组、EGF+siRNA干扰组、siRNA干扰组及空白对照组细胞Cdc42 mRNA转录以及蛋白的表达水平, 微丝绿色荧光探针(actin-tracker green)染色检测HepG2细胞丝状伪足形成, 侵袭小室检测细胞体外侵袭能力.
结果: 经EGF处理后HepG2细胞可见明显丝状伪足形成, EGF组细胞内Cdc42 mRNA及总蛋白(Total-Cdc42)表达量无显著变化, 但活性Cdc42(Active-Cdc42)显著增高(0.713±0.021 vs 0.423±0.015, P<0.05), siRNA干扰组Cdc42表达及活性受到明显抑制(0.118±0.017 vs 1.128±0.024; 0.351±0.021 vs 0.936±0.024, 均P<0.05), 并抑制EGF诱导的细胞丝状伪足形成, EGF组细胞体外侵袭能力显著高于其余各组(98.43±3.11 vs 61.09±3.58, 50.53±2.34, 62.73±2.64, 均P<0.05).
结论: EGF通过激活Cdc42诱导HepG2细胞丝状伪足形成并增强其体外侵袭能力.
引文著录: 张勇, 江隆昌, 胡青钢, 刘小卫, 熊俊, 郑启昌. Cdc42基因在表皮生长因子促进HepG2细胞丝状伪足形成中的作用. 世界华人消化杂志 2010; 18(5): 443-446
Revised: December 2, 2009
Accepted: December 7, 2009
Published online: February 18, 2010
AIM: To explore the role of Cdc42 in epidermal growth factor (EGF)-stimulated formation of filopodia in HepG2 cells.
METHODS: HepG2 cells were divided into four groups: normal control group, EGF-treated group, small interfering RNA (siRNA) transfection group, and EGF-treated siRNA transfection group. The siRNA targeting the Cdc42 gene was introduced into HepG2 cells by liposome-mediated transfection. The expression of Cdc42 mRNA and protein was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. Actin-tracker green fluorescent probe was used to detect the formation of filopodia in HepG2 cells. Cell migration was measured by Transwell migration assay.
RESULTS: No significant differences were noted in the expression levels of total Cdc42 protein and Cdc42 mRNA between the EGF-treated group and the normal control group. However, the expression level of active Cdc42 protein was significantly higher in the EGF-treated group than in the normal control group (0.713 ± 0.021 vs 0.423 ± 0.015, P < 0.05). Transfection of siRNA targeting the Cdc42 gene could not only inhibit the expression of Cdc42 protein and mRNA (0.118 ± 0.017 vs 1.128 ± 0.024, and 0.351 ± 0.021 vs 0.936 ± 0.024, respectively; both P < 0.05) but also reduce filopodia formation and cell migration in EGF-treated cells (98.43 ± 3.11 vs 61.09 ± 3.58, 50.53 ± 2.34 and 62.73 ± 2.64, respectively; all P < 0.05).
CONCLUSION: Cdc42 activation is crucial for EGF-stimulated filopodia formation and cell migration in HepG2 cells.
- Citation: Zhang Y, Jiang LC, Hu QG, Liu XW, Xiong J, Zheng QC. Involvement of Cdc42 in epidermal growth factor-stimulated formation of filopodia in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 443-446
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/443.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.443
肝癌的发病率位于固体肿瘤的第6位, 而我国的患者则占一半以上[1], 目前肝癌的治疗效果仍然十分不理想. 表皮生长因子(epidermal growth factor, EGF)具有酪氨酸蛋白激酶活性, 是生长因子家族的主要成员之一. 研究证实EGF与肝癌的发生发展密切相关, EGF与其受体结合后能刺激肿瘤细胞增殖, 促进肿瘤细胞转移[2-4], 但其具体机制并不十分清楚. 细胞分裂周期蛋白42(cell division cycle 42, Cdc42)是Rho GTP超家族酶中的一个亚类, 是细胞骨架运动及物质运输的关键调控因子[5]. 近年来研究发现, Cdc42在多种恶性肿瘤中高表达, 并和肿瘤的发生、侵袭和转移密切相关[6,7]. 本课题旨在研究EGF对诱导肝细胞系HepG2丝状伪足形成的作用以及Cdc42基因在这一过程中的作用.
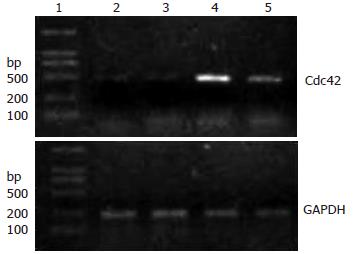
肝癌细胞株HepG2由本实验室保存; TRIzol RNA抽提试剂、聚合酶链反应试剂盒、RPMI 1640培养基、新生牛血清等购自美国Gibco公司; Lipofectamine 2000、Cdc42 siRNA购自Invitrogen公司; 免疫印迹(Western blot)化学发光试剂、硝酸纤维素膜、Cdc42及Anti-Active Cdc42单克隆抗体单克隆抗体购自美国Sigma公司; Cdc42引物由上海生物工程公司合成: 5'-GCCCGTGACCTGAAGGCTGTCA-3', 5'-TGCTTTTAGTATGATGCCGACACCA-3', 内参3-磷酸甘油醛脱氢酶(GAPDH)由ToYoBo公司试剂盒提供. 预期扩增产物的大小分别为477和264 bp.
1.2.1 细胞培养及Cdc42 siRNA转染: 将人肝癌细胞株HepG2细胞含10%血清、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养液中, 3 d传代1次. 细胞以2.5 mL培养基种入6孔培养板中, 4-6 h后采用脂质体介导方法转染siRNA, 参照说明书提供的资料. 每孔加入3 μL脂质体包裹的siRNA(终浓度为10 nmol/L), 每孔最终体积为1 mL. 40 h后更换含血清培养基进行分析.
1.2.2 分组: 将细胞分为EGF组、EGF+siRNA干扰组、siRNA干扰组和空白对照组, 前两组分别加入2 mL EGF(10 μg/L)作用5 min, 然后收集细胞检测.
1.2.3 Cdc42基因RT-PCR分析: TRIzol试剂提取各组细胞总RNA, 使用紫外分光光度计调整RNA浓度为1 g/L. 在9 μL无RNA酶水中加入1 μg RNA, Oligo(dT)20 1 µL, 温度65 ℃, 10 min后立即置于冰上. 加入5×RT Buffer 4 μL, dNTP Mixture(各10 mmol/L)2 μL, RNase Inhibitor(10 U/μL)1 μL, ReverTra Ace 1 μL, 反应条件: 42℃, 20 min, 85 ℃, 5 min, 4 ℃, 5 min. 瞬间离心后置-20 ℃保存. 在25 μLPCR体系中加入Cdc42上下游引物各1 μL, TaqDNA聚合酶1 μL, 循环条件: 94 ℃, 1 min预变性, 94 ℃, 30 s, 67 ℃(GAPDH为55 ℃)30 s, 72 ℃, 30 s. 共35个循环, 72 ℃延伸1 min. PCR产物25 µL上样琼脂糖凝胶, 50 V电泳30-45 min后照相.
1.2.4 各组细胞cdc42蛋白及活性Cdc42(Active-Cdc42)Western blot定量分析: 将约1×106细胞加60 μL去污剂裂解液进行匀浆. 置于冰上30 min, 4 ℃下12 000 r/min离心5 min, 取上清液即为总蛋白抽提物, BCA试剂盒测定蛋白浓度; 蛋白样品(每泳道60 µg)及蛋白相对分子质量标准进行120 g/L SDS-PAGE电泳, 再将蛋白质点转移到纤维素(NC)膜上, 置于含50 g/L脱脂奶粉的TBST(50 mmol/L Tris-HCL, pH7.6; 150 mmol/L NaCl; 0.1% Tween20)中4 ℃过夜; 加入以TBST稀释的抗Cdc42及Anti- Active-Cdc42单克隆抗体(1:200, V/V, 兔抗鼠)和抗GAPDH抗体(1:500, V/V, 兔抗鼠)后4 ℃过夜; 次日加入辣根过氧化物酶标记二抗(1:2000, V/V, 羊抗兔IgG), 37 ℃摇床下杂交1 h, 洗膜后用ECL试剂盒检测, X光胶片曝光、照相. 图像运用Quantitive one软件进行分析.
1.2.5 微丝绿色荧光染色: 收集各组细胞用PBS洗涤细胞2次, PBS配制的3.7%甲醛溶液室温固定细胞10 min. 含0.1% Triton X-100的PBS洗涤2-4次, 每次约5 min, 免疫荧光染色二抗稀释液(P0108)按照1:200的比例稀释Actin-Tracker Green, 把Actin-tracker Green染色工作液按照每个片子约200 μL的比例滴加到片子上, 室温避光孵育20-60 min. 用免疫染色洗涤液洗2-4次, 每次约5 min, 后用荧光显微镜进行观察.
1.2.6 细胞体外侵袭能力检测: 构建侵袭小室, 加入趋化因子, 每组小孔加入细胞数为6×105, 37 ℃, 50 mL/L CO2孵育箱中培养16 h, 棉棒擦去膜上细胞和matrigel胶, 取膜固定并染色, 高倍镜下计数膜背面细胞数, 同时以2.5 g/L的胰酶消化后计数贴附于24孔板内的细胞数, 计算穿膜细胞数. 穿膜细胞数 = 膜背面细胞数+贴附于24孔板内细胞数. 重复3次取平均值.
统计学处理 全部资料用SPSS10.0软件进行统计分析, 计量资料用mean±SD表示, 各组及组间比较用t检验.
EGF组细胞中Cdc42基因条带灰度为1.132±0.075, 空白对照组细胞条带灰度为1.128±0.024, 两组转录水平无显著差异(n = 4, P>0.05), EGF+siRNA组及siRNA组细胞中条带灰度为0.121±0.013, 0.118±0.017, 显著低于前两组(n = 4, 均P<0.01, 图1).
空白对照组及EGF处理组细胞中Total-Cdc42蛋白条带灰度为0.936±0.024及0.917±0.033, 无显著性差异(n = 4, P>0.05), EGF+siRNA转染组及siRNA转染组细胞中Total-Cdc42蛋白灰度为0.477±0.019, 0.351±0.021, 均显著低于前两组(n = 4, 均P<0.05). 空白对照组及EGF处理组细胞中Active-Cdc42蛋白条带灰度差异具有显著性意义(0.423±0.015 vs 0.713±0.021, n = 4, P<0.01, 图2). EGF+siRNA转染组及siRNA转染组细胞中ative-Cdc42蛋白表达水平为0.113±0.015, 0.098±0.021, 要显著低于前两组(n = 4, 均P<0.05).
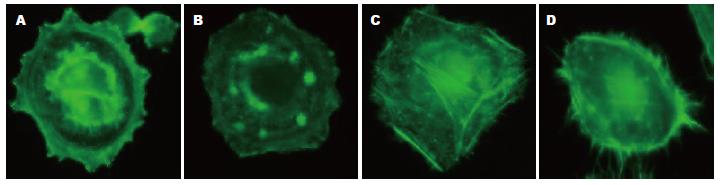
荧光显微镜观察发现EGF处理细胞形成大量丝状伪足, 而空白对照组、siRNA转染组以及EGF+siRNA转染组细胞未见明显丝状伪足形成(图3).
EGF组、EGF+siRNA干扰组、siRNA干扰组、空白对照组的穿膜细胞数分别为(98.43±3.11)个、(61.09±3.58)个、(50.53±2.34)个和(62.73±2.64)个, EGF组的穿膜细胞数要显著高于其余各组(均P<0.05).
EGF是细胞外重要的信息物质, 其与靶细胞上特异性EGFR结合诱导受体自身磷酸化, 激活众多的下游信号途径, 从而产生相应的生物学效应. EGF与创伤愈合, 细胞的增殖分化及肿瘤的发生均有密切关系[8]. 转基因小鼠研究发现当肝脏过表达EGF时可诱导肝癌的形成[9], 可见EGF在肝癌的形成过程中发挥了重要的作用[8,10], 但其具体参与途径目前并不十分清楚. 最新的活体内图像观察和侵袭性测定分析发现细胞伪足在肿瘤的侵犯与转移过程中发挥了至关重要的作用[11]. 细胞伪足包括丝状伪足、片状伪足、侵入性伪足、足体等, 细胞伪足内富含动力型的肌动蛋白, 其内的肌动蛋白呈网络状排列. 丝状伪足和片状伪足在肿瘤侵袭起始阶段起黏附作用[12]. 本实验发现经EGF处理的HepG2细胞可形成典型的丝状伪足, 且细胞的侵袭能力明显增强, 可见诱导丝状伪足形成是EGF促进肝癌细胞转移的重要途径之一, 肝癌细胞的丝状伪足在侵袭的起始阶段可能起主要作用, 主要功能有包括运动、黏附、摄取营养和吞噬以及支持作用. EGF是通过何种途径诱导肿瘤细胞丝状伪足形成的呢?有研究发现Rho家族蛋白之一的Cdc42可诱导丝状伪足形成, 因此我们认为EGF很可能是通过调控Cdc42途径诱导HepG2细胞丝状伪足的形成.
Rho家族蛋白是Ras超家族中最早被克隆出来的蛋白, Rho家族蛋白主要影响细胞骨架的肌动蛋白, 异常活化的Rho家族能启动肿瘤细胞无限增殖、浸润和转移的特性, 直接参与肿瘤的进展[13], 已有研究发现Rho家族蛋白与肝癌的发病密切相关[14]. Cdc42是Rho家族蛋白是Ras超家族中小相对分子质量G蛋白的成员之一, 具有GTP酶活性. 研究证实Cdc42是细胞骨架肌动蛋白的重要调节因子, 而肌动蛋白的运动是肿瘤细胞伪足形成及肿瘤转移的关键因素. Cdc42蛋白在非活性GDP结合形式和活性GTP结合(active-Cdc42)形式之间循环. Cdc42蛋白与GDP结合形式游离于胞质中; 与GTP结合形式则作用于细胞内的效应因子. 本实验发现EGF能显著增加active-Cdc42的量, 但对Cdc42转录及蛋白表达总量影响并不十分显著. 通过siRNA干扰抑制HepG2细胞Cdc42表达后能逆转EGF诱导的细胞丝状伪足的形成, 且能显著抑制肿瘤细胞的转移能力. 本结果说明GTP结合形式Cdc42在EGF诱导的HepG2细胞伪足形成及肿瘤转移过程中发挥了关键的作用, EGF激活Cdc42的具体途径则有待于进一步研究.
总之, 深入研究EGF对肝癌细胞的生物学作用有利于揭示肝癌的发生、发展尤其是侵袭转移过程中异常的信号转导机制, 可以为肝癌的临床治疗提供新的思路和理论依据. Cdc42基因的功能特点决定其具有潜在的临床意义, 可能使其成为有用的预后指标, 本身的信号途径可能成为肿瘤治疗的新靶点.
肝癌是我国发病率最高的恶性肿瘤之一, 肝癌复发和转移一直是影响其治疗效果的重要因素. 深入研究肝癌转移和复发机制, 并针对此寻求有效治疗措施成为当今肝癌研究中的重点和难点.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科.
最新的活体内图像观察研究揭示了肿瘤细胞迁移是如何受局部微环境所调节以及肿瘤细胞在转移过程中的形状变化. 研究显示, 细胞伪足在肿瘤转移中起重要作用. 这些新发现为肿瘤浸润转移的分子机制提出了新的观点.
本研究发现, Cdc42是调控肝癌细胞丝状伪足形成的关键因子, 因此调控Cdc42的活性有可能成为治疗肝癌转移的新途径.
本研究立题具有新意, 结论具有较为重要的应用价值和一定的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Parkin DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer. 2006;118:3030-3044. [PubMed] [DOI] |
| 2. | Kuramochi H, Hayashi K, Nakajima G, Kamikozuru H, Yamamoto M, Danenberg KD, Danenberg PV. Epidermal growth factor receptor (EGFR) mRNA levels and protein expression levels in primary colorectal cancer and corresponding liver metastases. Cancer Chemother Pharmacol. 2009; Aug 22. [Epub ahead of print]. [PubMed] |
| 3. | Berasain C, Perugorria MJ, Latasa MU, Castillo J, Goñi S, Santamaría M, Prieto J, Avila MA. The epidermal growth factor receptor: a link between inflammation and liver cancer. Exp Biol Med (Maywood). 2009;234:713-725. [PubMed] [DOI] |
| 4. | Tobita K, Kijima H, Dowaki S, Kashiwagi H, Ohtani Y, Oida Y, Yamazaki H, Nakamura M, Ueyama Y, Tanaka M. Epidermal growth factor receptor expression in human pancreatic cancer: Significance for liver metastasis. Int J Mol Med. 2003;11:305-309. [PubMed] |
| 5. | Szczepanowska J. Involvement of Rac/Cdc42/PAK pathway in cytoskeletal rearrangements. Acta Biochim Pol. 2009;56:225-234. [PubMed] |
| 6. | Tsang CM, Lau EP, Di K, Cheung PY, Hau PM, Ching YP, Wong YC, Cheung AL, Wan TS, Tong Y. Berberine inhibits Rho GTPases and cell migration at low doses but induces G2 arrest and apoptosis at high doses in human cancer cells. Int J Mol Med. 2009;24:131-138. [PubMed] |
| 7. | Zhang S, Schafer-Hales K, Khuri FR, Zhou W, Vertino PM, Marcus AI. The tumor suppressor LKB1 regulates lung cancer cell polarity by mediating cdc42 recruitment and activity. Cancer Res. 2008;68:740-748. [PubMed] [DOI] |
| 8. | Greulich H, Chen TH, Feng W, Jänne PA, Alvarez JV, Zappaterra M, Bulmer SE, Frank DA, Hahn WC, Sellers WR. Oncogenic transformation by inhibitor-sensitive and -resistant EGFR mutants. PLoS Med. 2005;2:e313. [PubMed] [DOI] |
| 9. | Tönjes RR, Löhler J, O'Sullivan JF, Kay GF, Schmidt GH, Dalemans W, Pavirani A, Paul D. Autocrine mitogen IgEGF cooperates with c-myc or with the Hcs locus during hepatocarcinogenesis in transgenic mice. Oncogene. 1995;10:765-768. [PubMed] |
| 10. | Borlak J, Meier T, Halter R, Spanel R, Spanel-Borowski K. Epidermal growth factor-induced hepatocellular carcinoma: gene expression profiles in precursor lesions, early stage and solitary tumours. Oncogene. 2005;24:1809-1819. [PubMed] [DOI] |
| 11. | Faix J, Breitsprecher D, Stradal TE, Rottner K. Filopodia: Complex models for simple rods. Int J Biochem Cell Biol. 2009;41:1656-1664. [PubMed] [DOI] |
| 12. | Mattila PK, Lappalainen P. Filopodia: molecular architecture and cellular functions. Nat Rev Mol Cell Biol. 2008;9:446-454. [PubMed] [DOI] |
| 13. | Chang YW, Bean RR, Jakobi R. Targeting RhoA/Rho kinase and p21-activated kinase signaling to prevent cancer development and progression. Recent Pat Anticancer D. rug Discov. 2009;4:110-124. [PubMed] [DOI] |
| 14. | Grise F, Bidaud A, Moreau V. Rho GTPases in hepatocellular carcinoma. Biochim Biophys Acta. 2009;1795:137-151. [PubMed] |