修回日期: 2009-12-25
接受日期: 2009-12-29
在线出版日期: 2010-02-08
目的: 探讨酒精性肝病(alcoholic liver disease, ALD)患者外周血淋巴细胞染色体损伤与体内氧化应激之间的关系.
方法: 采用胞质分裂阻滞法微核实验、硫代巴比妥酸显色法和黄嘌呤氧化酶法分别检测31例ALD患者和22例健康体检者外周血淋巴细胞染色体损伤情况、血浆丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性.
结果: 病例组与对照组血浆MDA含量分别为5.88 μmol/L±2.62 μmol/L和2.89 μmol/L±1.33 μmol/L, SOD活性分别为49.28 kU/L±6.03 kU/L和57.35 kU/L±4.96 kU/L, 血浆MDA含量随着SOD活性的降低而增高, 两组各指标之间有显著性差异(P<0.01), 且病例组MDA含量与SOD活性变化之间呈负相关(r = -0.454, P<0.05). 此外, 病例组微核率高于对照组, 两组相比有显著性差异(P<0.01). 病例组MDA含量与微核率存在正相关(r = 0.493, P<0.01), 而SOD活性与微核率存在负相关(r = -0.422, P<0.05).
结论: ALD患者体内氧化应激在外周血淋巴细胞染色体损伤中起重要作用, 提示ALD患者体内的氧化应激是其外周血淋巴细胞染色体损伤的机制之一.
引文著录: 王毕娟, 王沁, 张志强. 酒精性肝病患者淋巴细胞染色体损伤与氧化应激的关系. 世界华人消化杂志 2010; 18(4): 388-391
Revised: December 25, 2009
Accepted: December 29, 2009
Published online: February 8, 2010
AIM: To explore the relationship between chromosome damage in peripheral blood lymphocytes and oxidative stress in patients with alcoholic liver disease (ALD).
METHODS: Thirty-one ALD patients (experimental group) and 22 healthy volunteers (control group) were included in the study. Chromosome damage in peripheral blood lymphocytes was detected by cytokinesis-block micronucleus test. Plasma malondialdehyde (MDA) content was determined by the thiobarbituric acid (TBA) method, and superoxide dismutase (SOD) activity was measured by the xanthine oxidase method.
RESULTS: The content of plasma MDA was significantly higher in the experimental group than in the control group (5.88 μmol/L ± 2.62 μmol/L vs 2.89 μmol/L ± 1.33 μmol/L, P < 0.01), while the activity of SOD was significantly lower in the experimental group than in the control group (49.28 kU/L ± 6.03 kU/L vs 57.35 kU/L ± 4.96 kU/L, P < 0.01). A negative correlation was noted between the content of plasma MDA and SOD activity (r = -0.454, P < 0.05) in both groups. The rate of micronucleus formation was significantly higher in the experimental group than in the control group (P < 0.01). A positive correlation between the content of MDA and the rate of micronucleus formation (r = 0.493, P < 0.01), and a negative correlation between SOD activity and the rate of micronucleus formation were found in the experimental group (r = -0.422, P < 0.05).
CONCLUSION: Oxidative stress plays an important role in chromosome damage in peripheral blood lymphocytes in patients with alcoholic liver disease, suggesting that oxidative stress is one of the mechanisms causing chromosome damage in peripheral blood lymphocytes in these patients.
- Citation: Wang BJ, Wang Q, Zhang ZQ. Relationship between chromosome damage in lymphocytes and oxidative stress in patients with alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 388-391
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/388.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.388
酒精性肝病(alcoholic liver disease, ALD)是由于长期大量饮酒导致的肝脏疾病. ALD包括轻症ALD、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化五种临床分型[1]. 目前在我国ALD发病率呈上升趋势, 其已成为仅次于病毒性肝炎的第二大肝病病因[2]. ALD的发病机制复杂, 可能与酒精及其代谢产物对肝脏的毒性作用、氧化应激、免疫反应、细胞凋亡、内毒素、遗传多态性及与病毒的叠加作用等多种因素有关[3]. 在这些因素中, 自由基介导的氧化应激逐渐成为关注焦点. 许多研究表明酒精有明显的遗传毒性作用[4-7], 其机制还不太清楚, 包括氧化应激、脂质过氧化产物和乙醛[8], 一般认为自由基的生成在酒精的遗传毒性中起着重要作用[7]. 本课题通过胞质分裂阻滞法微核实验检测ALD患者外周血淋巴细胞染色体损伤情况、硫代巴比妥酸显色法检测血浆丙二醛(malondialdehyde, MDA)水平及黄嘌呤氧化酶法检测血浆超氧化物歧化酶(superoxide dismutase, SOD)活性, 探讨ALD患者外周血淋巴细胞染色体损伤与其体内氧化应激之间的关系.
2009-03/2009-11在兰州大学第一医院消化科住院和门诊就诊的ALD患者31例(病例组), 诊断标准依据2006年酒精性肝病诊疗指南[1], 平均年龄53.58岁±9.99岁, 每天饮酒量90.6 g±55.2 g, 饮酒史22.2年±8.5年, 其中酒精性脂肪肝11例、酒精性肝炎10例、酒精性肝硬化10例. 同一时期在兰州大学第一医院体检中心体检的健康志愿者22例(对照组), 平均年龄52.82岁±9.92岁, 不吸烟、不饮酒. 两组之间年龄无显著性差异(P>0.05). 所有研究对象半年内无射线及各种有害毒物接触史, 都排除肝炎病毒感染、自身免疫性肝病、药物性肝病及代谢性肝病. SOD、MDA试剂盒均购自南京建成生物制品公司, 二甲基亚砜、细胞松弛素B均购自美国Sigma公司, 1640混合培养基购自北京易世盛达科技发展有限公司. BB16UV/BB506OUV CO2培养箱, 分光光度计, L80-2离心沉淀机, Beckman. LX. 20全自动生化分析仪.
每人抽取静脉血4.5 mL, 其中2.5 mL (EDTA抗凝)用于微核试验、血浆MDA含量和SOD活性的检测, 2 mL静脉血离心后血清用于ALT、AST检测. 用硫代巴比妥酸比色法测定MDA含量, 黄嘌呤氧化酶法测定SOD活性, LX. 20全自动生化分析仪检测ALT, AST. 胞质分裂阻滞法微核实验见文献[9], 用于检测外周血淋巴细胞微核率. 胞质分裂阻滞法微核实验方法具体包括: (1)细胞培养(需无菌操作): EDTA抗凝血0.5 mL, 在采血后24 h内种入1640混合培养基, 混匀后置37 ℃±0.5 ℃温箱内避光培养44 h后, 加终浓度为4.5 mg/L细胞松弛素B继续避光培养28 h; (2)制片和染色: 终止培养后将细胞液吸入离心管中1 000 r/min离心5 min后, 加入7 mL 4 ℃下预冷的0.075 mol/L KCl低渗后, 立即离心8 min, 弃上清. 用固定液(甲醇:冰醋酸 = 3:1)快速固定, 离心8 min, 弃上清, 再重复固定2次. 滴片后用Giemsa染色. (3)镜检: 在油镜下计数1 000个双核细胞, 计算其微核细胞率(‰).
统计学处理 结果以mean±SD表示, 用SPSS11.0统计学软件进行t检验、Mann-Whitney检验及Spearman等级相关分析, P<0.05为两者之间有显著性差异.
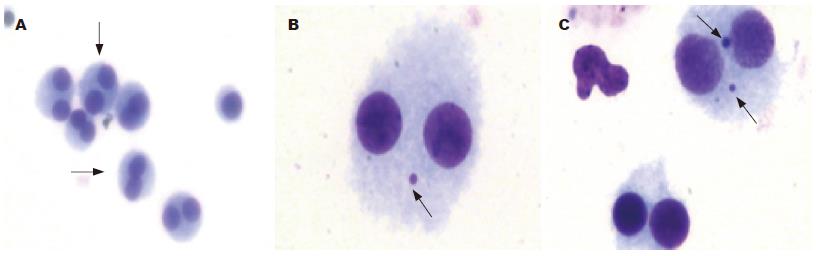
游离于胞质中, 与主核完全分开, 重叠或相切时, 能看到各自的完整核膜, 呈圆形或椭圆形, 结构与主核相同, 着色与主核一致或略浅, 不折光, 大小为主核1/3以下的小核, 即为微核(图1). 在一个视野中, 连续出现多个双核淋巴细胞(图1A), 在一个双核淋巴细胞中出现一个微核(图1B), 在一个双核淋巴细胞中也可同时出现两个微核(图1C).
由表1可以看出病例组血清ALT、AST与对照组相比均升高, 两组相比有显著性差异(P<0.01); 血浆MDA含量随着SOD活性的降低而增高, 经统计学分析, 病例组和对照组两指标之间都有显著性差异(P<0.01), 且病例组MDA含量与SOD活性变化之间呈负相关(P<0.05, r = -0.454). 此外, 病例组微核率高于对照组, 两组相比有显著性差异(P<0.01).
行Spearman等级相关分析, 病例组血浆MDA含量与外周血淋巴细胞微核率存在正相关(P<0.01, r = 0.493), SOD活性与外周血淋巴细胞微核率存在负相关(P<0.05, r = -0.422).
酒精滥用和酒精依赖已成为当今世界日益严重的公共卫生问题, 而且ALD是发达国家肝硬化的重要病因(占80%-90%), 也是青壮年死亡的主要原因, 酗酒者患肝硬化是正常人的6.8倍. 在亚洲各国, 尽管病毒性肝炎占主要地位, 但随着社会经济条件的好转和生活水平的提高, ALD有日渐增多趋势[10]. 2007年全国ALD的多中心调查分析显示我国ALD基本呈逐年上升趋势[11]. ALD的致病因素单一, 即长期大量的乙醇摄入, 但其发病机制较为复杂, 目前尚不完全清楚. 近年来, 自由基的过量产生导致的氧化应激在ALD中的作用逐渐受到重视.
在正常情况下, 自由基的产生和清除之间存在着动态平衡. 但在某些病理情况下, 机体的自由基过量生成和(或)抗氧化防御系统受损, 自由基产生和清除的动态平衡遭到破坏, 导致氧化应激(oxidative stress)的出现[12], 由氧诱发的自由基称为活性氧族(reactive oxygen species, ROS), 这包括过氧化氢(H2O2)、羟基自由基(OH-)和超氧阴离子(O2-)等[13]. 肝脏线粒体、细胞色素P450酶、中性粒细胞和激活的枯否细胞是自由基的重要来源[14]. 生物膜富含脂质和蛋白质, 膜脂是膜的基本骨架, 在维持细胞的正常结构和功能方面起重要作用, 膜脂的主要成分是多聚不饱和脂肪酸(PUFA)[15]. 自由基对细胞的损伤作用, 主要是引起生物膜不饱和脂肪酸发生脂质过氧化反应, MDA作为氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物, 其含量的变化间接反映了组织中氧自由基含量和组织损伤程度[16]. SOD是生物体内最为重要的抗氧化酶之一, 是清除ROS的第一道防线[2]. 他的变化与体内自由基的变化呈负相关, 其含量高低间接反映了清除自由基能力, 对机体的氧化和抗氧化平衡起着至关重要的作用, 能清除自由基和过氧化物, 当体内自由基产生增多时, 他与超氧阴离子(O2-)反应产生过氧化氢, 再由谷胱甘肽过氧化物酶和过氧化氢酶作用产生水, 这样使自由基得以清除, 从而降低脂质过氧化物的生成并加速其清除, 减少其对细胞和组织的损伤[17,18]. 因此, 可以通过测定MDA含量和SOD活性, 评估ALD患者体内氧自由基水平. 本实验结果显示病例组MDA含量明显高于对照组, 而SOD活性明显低于对照组(P<0.01), 且MDA含量与SOD活性变化呈负相关性(P<0.05, r = -0.454), 提示ALD患者体内存在氧化应激.
微核是由细胞分裂后期滞后的染色体断片、一个或多个染色体组成的小体. 微核游离于胞质中, 与主核完全分开, 重叠或相切时, 必须看到各自的完整核膜, 呈圆形或椭圆形, 结构与主核相同, 着色与主核一致或略浅, 不折光, 大小为主核1/3以下的小核[19]. 微核的形成是细胞受遗传毒物作用后的一种遗传学终点, 故凡能使染色体发生断裂, 并延迟到细胞分裂后期, 或使染色体和纺锤体联结遭到破坏的遗传损伤, 都可用微核实验来检测[20]. 各种理化因素作用于细胞染色体, 影响其正常功能, 使细胞的DNA的复制和染色体的分裂受到破坏. 其中氧自由基中的O2-或OH-可攻击DNA及合成DNA所需的酶, 使DNA链发生断裂, 碱基损伤, DNA-DNA、DNA-蛋白质发生交联, 染色体断裂, 这样DNA复制转录功能不能正常进行, 从而影响蛋白质合成. 由于蛋白质合成受阻, SOD含量减少, 酶活性减弱或丧失, 自由基不能有效清除. 由于自由基积累, 脂质过氧化反应进一步加强, 导致MDA和O2-浓度升高. 大量的MDA和O2-又可反作用于细胞的DNA, 则更进一步加剧了遗传物质的损伤, 结果导致畸变频率升高[21]. 本实验结果显示ALD患者外周血淋巴细胞微核率明显高于对照组(P<0.01), 血浆MDA含量与外周血淋巴细胞微核率存在正相关(P<0.01, r = 0.493), SOD活性与外周血淋巴细胞微核率存在负相关(P<0.05, r = -0.422), 提示ALD患者体内氧化应激在外周血淋巴细胞染色体损伤中起重要作用.
总之, ALD患者体内氧化应激与外周血淋巴细胞损伤有明显相关性, 提示ALD患者体内的氧化应激可能是其外周血淋巴细胞染色体损伤的机制之一.
酒精滥用和酒精依赖已成为当今世界日益严重的公共卫生问题, 而且ALD是发达国家肝硬化的重要病因(占80%-90%), 也是青壮年死亡的主要原因, 酗酒者患肝硬化是正常人的6.8倍. 在亚洲各国, 尽管病毒性肝炎占主要地位, 但随着社会经济条件的好转和生活水平的提高, ALD有日渐增多趋势.
迟宝荣, 教授, 吉林大学第一医院消化内科
ALD的致病因素单一, 即长期大量的乙醇摄入, 但其发病机制较为复杂, 目前尚不完全清楚. 可能与乙醇及其代谢产物对肝脏的毒性作用、氧化应激、免疫反应、细胞凋亡、内毒素、遗传多态性及与病毒的叠加作用等多种因素有关. 近年来, 自由基的过量产生导致的氧化应激在酒精性肝病中的作用逐渐受到重视. 乙醇有明显的遗传毒性作用其机制还不太清楚, 包括氧化应激、脂质过氧化产物和乙醛, 一般认为自由基的生成在乙醇的遗传毒性中起着重要作用.
Michael等有很多关于胞质分裂阻滞法微核实验的报道, 从他的报道中可以了解胞质分裂阻滞法微核实验操作不断完善的过程及应用的范围.
ALD患者外周血淋巴细胞DNA损伤与氧化应激存在相关性, 则氧化应激可能是酒精诱导的DNA损伤机制之一, 可以为DNA损伤的治疗提供依据, 而微核也可作为遗传损伤的敏感指标之一.
本文探讨酒精性肝病患者淋巴细胞染色体损伤与氧化应激的关系, 具有一定创新性.
编辑: 李军亮 电编:何基才
| 2. | 金 武丕, 权 修权, 孟 繁平, 崔 香丹, 朴 海今. 大鼠酒精性肝病细胞凋亡与细胞色素P4502E1和氧化应激的关系. 世界华人消化杂志. 2007;15:2181-2185. [DOI] |
| 3. | 孙 艳, 吴 阳, 刘 兵, 刘 凯, 白 靓, 迟 宝荣. 酒精性肝病的研究进展. 吉林大学学报(医学版). 2006;32:733-736. |
| 4. | Gattás GJ, Saldanha PH. Chromosomal aberrations in peripheral lymphocytes of abstinent alcoholics. Alcohol Clin Exp Res. 1997;21:238-243. [PubMed] |
| 5. | Fedeli D, Fedeli A, Luciani F, Massi M, Falcioni G, Polidori C. Lymphocyte DNA alteration by sub-chronic ethanol intake in alcohol-preferring rats. Clin Chim Acta. 2003;337:43-48. [PubMed] [DOI] |
| 6. | Maffei F, Forti GC, Castelli E, Stefanini GF, Mattioli S, Hrelia P. Biomarkers to assess the genetic damage induced by alcohol abuse in human lymphocytes. Mutat Res. 2002;514:49-58. [PubMed] |
| 7. | Guo L, Yang JY, Wu CF. Oxidative DNA damage induced by ethanol in mouse peripheral leucocytes. Basic Clin Pharmacol Toxicol. 2008;103:222-227. [PubMed] [DOI] |
| 8. | Brooks PJ. DNA damage, DNA repair, and alcohol toxicity--a review. Alcohol Clin Exp Res. 1997;21:1073-1082. [PubMed] |
| 9. | Fenech M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2007;2:1084-1104. [PubMed] [DOI] |
| 12. | 郝 志敏, 赵 洁, 巨 名飞. 氧化应激在心血管疾病中的作用. 中西医结合心脑血管病杂志. 2008;6:959-960. |
| 14. | Loguercio C, Federico A. Oxidative stress in viral and alcoholic hepatitis. Free Radic Biol Med. 2003;34:1-10. [PubMed] [DOI] |
| 21. | 康 朝英, 黄 辰, 陈 萍, 宋 士生, 倪 磊, 司 晓娥. 人淋巴细胞微核形成率、SOD活性及MDA浓度变化间的关系. 西安交通大学学报(医学版). 1995;16:128-131. |