修回日期: 2009-12-13
接受日期: 2009-12-21
在线出版日期: 2010-02-08
目的: 观察食管癌细胞系EC1和EC9706中TIMP3、E-Cadherin基因甲基化的水平及蛋白表达, 以及去甲基化药物5-Aza-CdR对其的影响.
方法: 应用甲基化特异性PCR(MSP)和免疫细胞化学的方法, 分别检测体外培养的食管癌细胞系EC1和EC9706中TIMP3和E-Cadherin基因甲基化水平及蛋白表达. 用5 μmol/L 5-Aza-CdR处理两种细胞系后, 用同样的方法检测其甲基化水平及蛋白表达, 观察药物的影响.
结果: TIMP3基因在食管癌细胞系EC1和EC9706中均表现为非甲基化, 蛋白呈现弱表达; 而E-Cadherin基因在EC1中发生甲基化, EC9706中发生半甲基化, 蛋白表达均缺失. 5-Aza-CdR作用后的两种细胞系中, TIMP3基因仍为非甲基化, 而蛋白表达似有所曾强; 但E-Cadherin基因甲基化得到了逆转, 蛋白表达由原来的不表达, 转变为强表达.
结论: 5-Aza-CdR能够有效逆转E-Cadherin基因甲基化, 并使其蛋白恢复表达; TIMP3基因的失活似与甲基化机制无关, 5-Aza-CdR对其蛋白表达的恢复作用微弱.
引文著录: 赵璇, 李沛, 马俊芬, 赵继敏, 杨洪艳, 董子明. TIMP3、E-Cadherin基因在食管癌细胞系EC1和EC9706中的甲基化及蛋白表达. 世界华人消化杂志 2010; 18(4): 379-383
Revised: December 13, 2009
Accepted: December 21, 2009
Published online: February 8, 2010
AIM: To investigate the methylation and protein expression of the tissue inhibitor of metalloproteinase-3 (TIMP-3) and E-cadherin genes in human esophageal carcinoma cell lines EC1 and EC9706 untreated or treated with the demethylating agent 5-Aza-CdR.
METHODS: Methylation-specific PCR (MSP) and immunocytochemistry were used to detect the methylation and protein expression of TIMP-3 and E-cadherin genes in EC1 and EC9706 cells untreated or treated with 5 μmol/L of 5-Aza-CdR.
RESULTS: The TIMP-3 gene was not methylated, and the TIMP-3 protein was weakly expressed in both EC1 and EC9706 cells. The E-cadherin gene was hypermethylated in EC1 cells but semi-methylated in EC9706 cells. The E-cadherin protein expression was undetectable in both cell types. After treatment with 5-Aza-CdR, the TIMP-3 gene remained non-methylated, and the expression of the TIMP-3 protein was slightly upregulated in the two cell types. In contrast, E-cadherin gene methylation was reversed, and the protein expression was strongly upregulated in both cell types.
CONCLUSION: E-cadherin gene methylation occurs in both EC1 and EC9706 cells, and 5-Aza-CdR can effectively reverse such methylation. TIMP-3 gene inactivation seems unrelated to methylation as 5-Aza-CdR can only slightly upregulate the expression of TIMP-3 protein.
- Citation: Zhao X, Li P, Ma JF, Zhao JM, Yang HY, Dong ZM. Methylation and protein expression of the TIMP-3 and E-cadherin genes in human esophageal carcinoma cell lines EC1 and EC9706. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 379-383
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/379.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.379
在肿瘤发生过程中, 甲基化模式发生逆转、相关基因的甲基化紊乱发生率很高, 是肿瘤发生中基因表达沉默的主要机制, 尤其表现在肿瘤抑制基因和错配修复基因. 近年来随着肿瘤甲基化状态研究的深入, 越来越多基因的甲基化被认为与肿瘤的发生、发展及预后有关[1-3]. 但基因的甲基化能否作为临床的相关判定指标, 去甲基化药物能否作为临床用药, 存在着争议[1], 因此我们选定与食管癌发生、发展有关的一些基因: 细胞凋亡相关基因TIMP3及与肿瘤远端转移有关的E-Cadherin基因, 在体外培养的食管癌细胞系EC1、EC9706中研究这两种基因的甲基化状态, 并对比使用去甲基化药物5-Aza-CdR作用后其甲基化逆转的情况及蛋白表达的改变, 为甲基化指标及去甲基化药物的临床应用提供依据.
人食管癌细胞株EC1和EC9706(本室留存); 5-Aza-CdR购自Sigma公司; Methylamp One-Step DNA Modification Kit购自EPIGENTEK公司; Taq酶购自TaKaRa公司; CpG甲基转移酶购自NEB公司; 引物均为Invitrogen公司合成; E-Cadherin抗体购自Santa Cruz公司; TIMP3抗体、免疫组织化学染色、DAB显色试剂盒购自北京博奥森公司.
1.2.1 细胞培养: 人食管癌细胞株EC1和EC9706, 于RPMI 1640(Gibco公司)培养液(内含100 g/L胎牛血清, 100 kU/L青霉素和100 kU/L链霉素)中贴壁培养(37 ℃, 50 mL/L CO2). 隔天换液, 取对数生长期细胞进行后续实验.
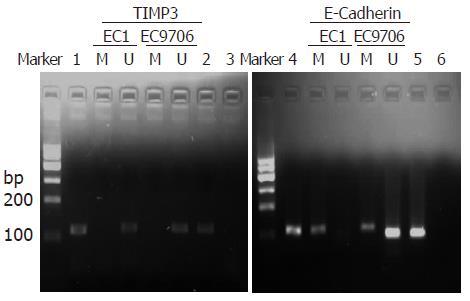
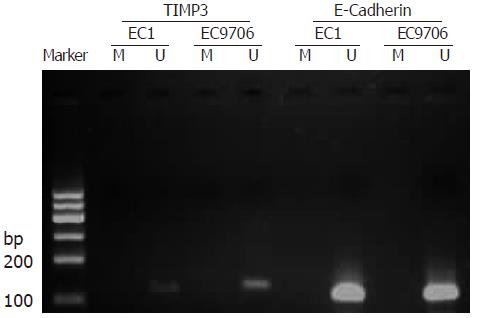
1.2.2 甲基化特异性PCR(MSP): EC1和EC9706分别按照5×105细胞数接种到培养瓶中, 在培养基中培养24 h, 细胞贴壁后, 加药组在2种细胞中分别加入含有5 μmol/L的5-Aza-CdR的培养基[4], 未加药组在正常的完全培养基中, 培养72 h后, 分别按试剂盒详细说明提取细胞DNA(基因组DNA提取试剂盒, 天根公司), 紫外分光光度计检测DNA浓度和纯度, 琼脂糖凝胶电泳检测DNA完整性. 用CpG甲基转移酶(M.SssⅠ)处理正常食管上皮DNA作为阳性对照, 未处理的作为阴性对照, 按Methylamp One-Step DNA Modification Kit说明采用亚硫酸氢钠法修饰DNA. 引物序列如表1, 反应条件为: 95 ℃预变性10 min, 95 ℃ 30 s, Tm ℃ 30 s, 72 ℃ 30 s, 35个循环, 72 ℃延伸2 min. 反应结束后取产物5 μL进行20 g/L琼脂糖凝胶电泳, 使用凝胶成像分析系统分析电泳结果. 其中出现甲基化条带, 而没有非甲基化条带的, 判定为甲基化; 出现非甲基化条带而没有甲基化条带的判定为非甲基化; 同时出现甲基化和非甲基化条带的, 判定为半甲基化.
| 基因 | 正向引物 | 反向引物 | 大小(bp) | T(℃) |
| TIMP3 | ||||
| M | 5'-CGTTTCGTTATTTTTTGTTTTCGGTTTC-3' | 5'-CCGAAAACCCCGCCTCG-3' | 116 | 59 |
| U | 5'-TTTTGTTTTGTTATTTTTTGTTTTTGGTTTT-3' | 5'-CCCCCAAAAACCCCACCTCA-3' | 122 | |
| E-cad | ||||
| M | 5'-TTAGGTTAGAGGGTTATCGCGT-3' | 5'-TAATTTTAGGTTAGAGGGTTATTGT-3 | 116 | 57 |
| U | 5'-TAACTAAAAATTCACCTACCGAC-3' | 5'-CACAACCAATCAACAACACA-3' | 97 | 53 |
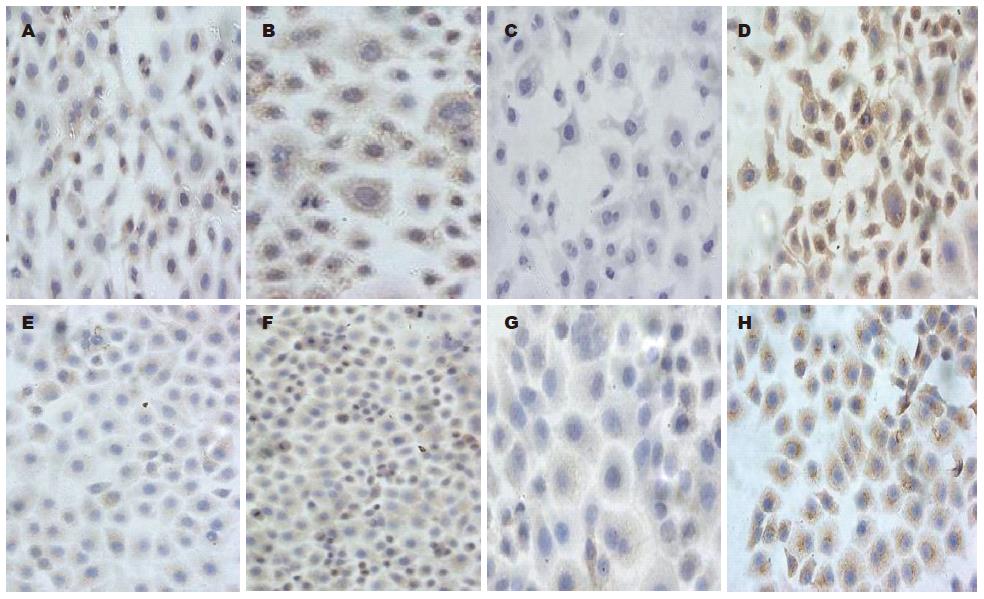
1.2.3 免疫细胞化学: 用免疫细胞化学方法分别检测TIMP3和E-Cadherin基因蛋白表达. 将细胞接种在底部放有盖玻片的24孔板中, 用1.2.2中的方法处理加药组和未加药组, 72 h后, 40 g/L多聚甲醛固定细胞后取出盖玻片, 分别使用TIMP3和E-Cadherin基因的一抗, 按照试剂盒说明进行染色. 结果依据阳性细胞所占百分比及着色深浅进行判定[3], 阳性细胞数计: <5%为0分; 5%-25%为1分; 26%-50%为2分; 51%-75%为3分; >76%为4分. 细胞着色强度计分: 无显色: 0分; 淡黄色: 1分; 棕黄色: 2分; 棕褐色: 3分. 2项评分总和为总积分, 0-1分为阴性(-), 2-3分为弱阳性(+), ≥4分为阳性(++).
TIMP3基因在食管癌细胞系EC1和EC9706中都出现非甲基化条带, 即发生了非甲基化. E-Cadherin基因在EC1中出现甲基化条带, 发生了甲基化, 而在EC9706中甲基化条带和非甲基化条带都出现, 说明发生了半甲基化. 使用去甲基化药物5-Aza-CdR分别处理2组细胞后, TIMP3基因结果仍为非甲基化, 与用药物刺激前没有差别. 而E-Cadherin基因使用5-Aza-CdR后, 2种细胞中只出现了去甲基化条带, 说明其甲基化的情况得到了逆转(图1, 2).
结果见图3, TIMP3基因在食管癌细胞系EC1和EC9706中都表现为弱阳性(+), 经5-Aza-CdR处理仍为弱阳性(+), 表达稍见增强; E-Cadherin基因在食管癌细胞系EC1和EC9706中都表现为阴性, 经5-Aza-CdR处理后, 表达均增强, 为阳性(+++).
Costello等[5]总结了甲基化与癌症的发生关系, 认为个别基因的甲基化与肿瘤的发生密切相关, 因此特殊肿瘤组织应有特异性, 且特异性基因的甲基化与肿瘤化疗反应及患者的生存有直接的关联, 故异常的DNA甲基化模式可能是有用的分子标志. 近年来, 人们通过对几种癌、癌旁组织和正常组织DNA的分析, 确定某些癌基因(H-Ras、c-Myc)低甲基化和抑癌基因(Rb、p16)的高甲基化改变是细胞癌变的一个重要特征[1-3]. 且甲基化水平与肿瘤的生物学特性密切相关, 不同肿瘤的不同期, 发生状态不同.
TIMP3是一种抑癌基因[6,7], 他可以抑制肿瘤生长、血管生成和侵袭转移, 而且可以促进凋亡. 而TIMP3表达降低或缺失往往是肿瘤发生的重要因素. 大量的文献表明[8,9], 在胃癌、乳腺癌等肿瘤中, 该基因的沉默都与自身甲基化相关. 我们对食管癌细胞系EC1和EC9706中TIMP3基因甲基化和蛋白表达的情况进行研究, 发现TIMP3基因在两种细胞中均未发生甲基化, 但其蛋白表达呈弱阳性, 可也有研究认为在食管癌腺癌中有部分出现甲基化[7].
E-Cadherin基因为钙依赖性的跨膜黏附分子, 主要参与同源细胞间的连接, 是上皮细胞间相互黏附和维持组织结构稳定的重要蛋白, E-Cadherin基因表达降低或缺失, 与肿瘤的分化、侵袭及远处转移密切相关[11,12]. 对胃癌、结直肠癌、乳腺癌及前列腺癌的研究均表明, E-Cadherin启动子区CpG岛的甲基化与该基因的表达降低有关[10,11]. 也有研究认为, 该基因的甲基化在部分食管癌患者中存在, 与食管癌分化有关[12]. 我们研究证实, 食管癌细胞系EC1中出现甲基化, 而EC9706中为半甲基化, 其蛋白表达均缺失.
甲基化抑制剂5-Aza-CdR是一种竞争性核苷酸类甲基转移酶抑制剂, 已广泛应用于各种肿瘤的甲基化逆转[13,14], 其应用于食管癌的效果并不确定. 我们经过此药物作用于两种食管癌细胞, 发现5-Aza-CdR对于已发生甲基化的E-Cadherin基因有很好的逆转作用, 而对非甲基化的TIMP3无明显影响, 相应的免疫细胞化学检测的蛋白表达也得出同样的结论.
无论哪种基因作为食管癌甲基化的诊断和预后的指标, 其敏感性一定要充分考虑, 因此, 筛选肿瘤发生的特异性甲基化基因, 用DNA甲基化诊断食管癌还需要进一步研究. 使用去甲基化药物对恶性肿瘤的治疗效果是否优于传统的化疗药、食管癌治疗的合理用药、5-Aza-CdR自身的不稳定性和高选择性都要充分的考虑. 所以, 去甲基化药物广泛应用于临床食管癌治疗还需要更深入的研究.
原发性食管癌是我国最常见的恶性肿瘤, 严重威胁人类健康. 近几年随着研究甲基化手段的进步, 使更多的食管癌相关基因的甲基化情况得以明确, 但迄今为止尚未见临床上利用上述食管癌相关基因甲基化状态的改变, 进行食管癌的早期诊断及干预甲基化的基因治疗来防治食管肿瘤的发生.
张志坚, 教授, 中国人民解放军福州总医院消化内科
食管癌的表遗传研究对于食管癌的发病机制、细胞免疫与防御、细胞分化以及预防治疗等方面具有十分重要的意义. 弄清楚食管癌中基因甲基化状态的改变及其作用方式并建立相应的筛查技术, 将为食管癌的研究带来更深入的发展.
Costello等总结了甲基化与癌症的发生关系, 认为个别基因的甲基化与肿瘤的发生密切相关, 因此特殊肿瘤组织应有特异性, 且特异性基因的甲基化与肿瘤化疗反应及患者的生存有直接的关联, 故异常的DNA甲基化模式可能是有用的分子标志.
随着首张人类表观基因组图谱绘制成功, 用基因的甲基化进行诊断和治疗越来越成为可能. 肿瘤临床治疗的目标之一就是找到早期诊断的标志物和针对患者的高效、低毒性的疗法. 研究基因的甲基化在食管癌发病中的作用以及干预后效果, 探讨食管癌中基因甲基化状态的改变及其作用方式, 将为食管癌的分子机制研究及其临床治疗和预后提供了新的思路.
本文具有一定的科学性、创新性和可读性, 能从一定程度上反映国内外这一领域的研究近况.
编辑: 李瑞敏 电编:吴鹏朕
| 1. | Esteller M. CpG island hypermethylation and tumor suppressor genes: a booming present, a brighter future. Oncogene. 2002;21:5427-5440. [PubMed] [DOI] |
| 2. | Wong ML, Tao Q, Fu L, Wong KY, Qiu GH, Law FB, Tin PC, Cheung WL, Lee PY, Tang JC. Aberrant promoter hypermethylation and silencing of the critical 3p21 tumour suppressor gene, RASSF1A, in Chinese oesophageal squamous cell carcinoma. Int J Oncol. 2006;28:767-773. [PubMed] |
| 3. | Fang JY, Lu R, Mikovits JA, Cheng ZH, Zhu HY, Chen YX. Regulation of hMSH2 and hMLH1 expression in the human colon cancer cell line SW1116 by DNA methyltransferase 1. Cancer Lett. 2006;233:124-130. [PubMed] [DOI] |
| 4. | 朱 新江, 孟 春风, 彭 过, 戴 冬秋. 5-Aza-dc和TSA对胃癌细胞系p16和hMLH-1基因甲基化水平及表达的影响. 世界华人消化杂志. 2008;16:1837-1841. [DOI] |
| 5. | Costello JF, Plass C. Methylation matters. J Med Genet. 2001;38:285-303. [PubMed] [DOI] |
| 6. | Anand-Apte B, Bao L, Smith R, Iwata K, Olsen BR, Zetter B, Apte SS. A review of tissue inhibitor of metalloproteinases-3 (TIMP-3) and experimental analysis of its effect on primary tumor growth. Biochem Cell Biol. 1996;74:853-862. [PubMed] [DOI] |
| 7. | Gu P, Xing X, Tänzer M, Röcken C, Weichert W, Ivanauskas A, Pross M, Peitz U, Malfertheiner P, Schmid RM. Frequent loss of TIMP-3 expression in progression of esophageal and gastric adenocarcinomas. Neoplasia. 2008;10:563-572. [PubMed] |
| 8. | Kang GH, Shim YH, Jung HY, Kim WH, Ro JY, Rhyu MG. CpG island methylation in premalignant stages of gastric carcinoma. Cancer Res. 2001;61:2847-2851. [PubMed] |
| 9. | Bachman KE, Herman JG, Corn PG, Merlo A, Costello JF, Cavenee WK, Baylin SB, Graff JR. Methylation-associated silencing of the tissue inhibitor of metalloproteinase-3 gene suggest a suppressor role in kidney, brain, and other human cancers. Cancer Res. 1999;59:798-802. [PubMed] |
| 10. | Chan AO, Lam SK, Wong BC, Wong WM, Yuen MF, Yeung YH, Hui WM, Rashid A, Kwong YL. Promoter methylation of E-cadherin gene in gastric mucosa associated with Helicobacter pylori infection and in gastric cancer. Gut. 2003;52:502-506. [PubMed] [DOI] |
| 11. | Yuecheng Y, Hongmei L, Xiaoyan X. Clinical evaluation of E-cadherin expression and its regulation mechanism in epithelial ovarian cancer. Clin Exp Metastasis. 2006;23:65-74. [PubMed] [DOI] |
| 12. | Corn PG, Heath EI, Heitmiller R, Fogt F, Forastiere AA, Herman JG, Wu TT. Frequent hypermethylation of the 5' CpG island of E-cadherin in esophageal adenocarcinoma. Clin Cancer Res. 2001;7:2765-2769. [PubMed] |
| 13. | Wijermans P, Lübbert M, Verhoef G, Bosly A, Ravoet C, Andre M, Ferrant A. Low-dose 5-aza-2'-deoxycytidine, a DNA hypomethylating agent, for the treatment of high-risk myelodysplastic syndrome: a multicenter phase II study in elderly patients. J Clin Oncol. 2000;18:956-962. [PubMed] |