修回日期: 2009-12-13
接受日期: 2009-12-21
在线出版日期: 2010-02-08
目的: 探讨肝脏胞外基质Matrilin-2在肝再生中与卵圆细胞的关系及作用.
方法: 采用改良的Soft-Farber建立大鼠肝脏卵圆细胞增殖模型, 对照组灌喂生理盐水. 分别取术后2、4、6、9、12、15 d大鼠肝组织, 采用免疫组织化学以及Western blot的方法动态观察大鼠卵圆细胞增殖模型中肝脏胞外基质成分Matrilin-2的变化与卵圆细胞的关系.
结果: 肝脏部分切除术(partial hepatectomy, PH)后第2天, 卵圆细胞开始向门静脉周围区域增殖, Matrilin-2主要出现在门静脉周围的肝窦状隙内; 术后第9天, 卵圆细胞进一步向肝实质内增殖, Matrilin-2表达增加; 术后第12天, 随着卵圆细胞分化为小肝细胞结节, 大多数Matrilin-2位于结节周边, 少数出现在结节内. Matrilin-2的含量自肝切除后第2天开始升高, 第9天达到高峰, 第12天后逐步恢复生理水平.
结论: 肝脏胞外基质成分Matrilin-2与卵圆细胞介导的肝脏再生存在紧密联系并发挥重要的调控作用.
引文著录: 陈中, 黄亮, 晏建军, 严以群. 胞外基质Matrilin-2在肝再生中与大鼠卵圆细胞的关系. 世界华人消化杂志 2010; 18(4): 346-349
Revised: December 13, 2009
Accepted: December 21, 2009
Published online: February 8, 2010
AIM: To investigate possible involvement of extracellular matrix (ECM) protein matrilin-2 in oval cell-mediated liver regeneration in rats.
METHODS: A rat model of hepatic oval cell proliferation was established using the modified Soft-Farber protocol. The control group was fed normal saline. On days 2, 4, 6, 9, 12 and 15 after partial hepatectomy (PH), rat liver tissue samples were collected. The dynamic relationship between matrilin-2 protein expression and oval cell distribution during the proliferation and differentiation of oval cells was analyzed using immunohistochemistry and Western blot.
RESULTS: On day 2 after PH, oval cells began to proliferate around the portal area, and matrilin-2 deposition was observed in the hepatic sinusoids in the periportal area. On day 9, proliferating oval cells were present in the hepatic acini, and matrilin-2 upregulation was noted. On day 12, as oval cells differentiated to form hepatocellular nodules, matrilin-2 was distributed mainly in the periphery of the nodules, and little protein was present in the nodules. The expression level of matrilin-2 protein began to be upregulated on day 2 after PH, and reached the peak on day 9. After day 12, the protein level returned to physiological level.
CONCLUSION: The close relationship between matrilin-2 expression and oval cell distribution suggests a role for the protein in stem cell-fed liver regeneration.
- Citation: Chen Z, Huang L, Yan JJ, Yan YQ. Involvement of extracellular matrix protein matrilin-2 in oval cell-mediated rat liver regeneration. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 346-349
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.346
近年来, 肝脏胞外基质对卵圆细胞激活和增殖的影响引起了越来越多研究者的关注. 肝脏胞外基质调控卵圆细胞的分化, 支持卵圆细胞的自我更新, 在正常生理状态下抑制其分化, 而在损伤时促进其增殖分化. Matrilin-2是新发现的非胶原型细胞外基质蛋白的新家族成员之一, 目前对其功能的认识还很不明确. 但是基于他广泛的组织分布以及对多种组织起到重塑作用, 本研究动态观察卵圆细胞增殖分化过程中, Matrilin-2与卵圆细胞的关系以及对卵圆细胞增殖分化的影响.
健康SD大鼠20只, ♂, 体质量120-150 g, 由中国人民解放军第二军医大学动物中心提供. Matrilin-2兔抗人多克隆抗体, 购自武汉华美生物工程有限公司, BCA蛋白定量试剂盒购自武汉博士德生物工程有限公司, β-actin购自Santa Cruz公司等.
1.2.1 大鼠肝卵圆细胞增殖模型的建立: 采用改良的Soft-Farber模型, 将2-乙酰氨基芴(购自Sigma公司)配成1%浓度, 通过胃管按每天15 mg/kg对实验大鼠灌喂连续4 d, 第5天停喂, 在氯胺酮麻醉下行肝脏2/3切除, 切除肝左叶和肝中叶, 第6天继续灌喂, 连续1 wk. 对照组灌喂生理盐水. 分别于术后2、4、6、9、12、15 d断颈处死大鼠, 每个时间点2只. 迅速取肝组织液氮冻存后至-80 ℃冰箱保存备用, 剩下肝组织以100 g/L甲醛溶液固定, 常规石蜡包埋, 5 μm连续切片备用.
1.2.2 免疫组织化学染色: 连续石蜡切片经常规脱蜡后, 以3%过氧化氢溶液浸泡10 min后灭活内源性过氧化物酶; 抗原热修复后以正常兔血清封闭, 然后分别加1:150稀释的抗Matrilin-2第一抗体(兔抗人多克隆抗体, 购自武汉华美生物工程有限公司)工作液4 ℃过夜; 以PBS代替第一抗体作为阴性对照. 加生物素标记的兔抗鼠第二抗体(购自Dako公司)室温30 min; 加结合过氧化物酶链霉亲和素37 ℃, 45 min; 加新鲜配制的DAB显色, 苏木素复染, 脱水、透明和封片. 显微镜下观察结果.
1.2.3 Western blot检测Matrilin-2在肝组织中的表达: 组织蛋白裂解, 在等量的肝组织各(0.1 g)在液氮中碾磨后加入裂解缓冲液中冰浴30 min, 超声破碎细胞至4 ℃恒温离心机内8 000 r/min离心15 min, 取上清, BCA蛋白定量试剂盒进行蛋白定量, 分装后-80 ℃冻存. 分别取等量蛋白裂解液, 加入上样缓冲液煮沸5 min变性, 经SDS-PAGE凝胶电泳, 电泳后将蛋白转至硝酸纤维素膜上, 50 g/L脱脂奶粉(脱脂奶粉2.5 g溶于50 mL TBST中)封闭12 h, 将膜置于Matrilin-2多抗(用TBST 1:1 000稀释, 内含50 g/L脱脂奶粉和0.02% Na3N)5 mL盒中, 室温2 h. 将膜置于抗兔二抗5 mL(用TBST 1:2 000稀释, 内含50 g/L脱脂奶粉), 室温1 h. 用ECL显色液A和B各500 μL混匀后放入膜曝光、显影和定影, X光胶片扫描后在医学图形分析系统上进行分析.
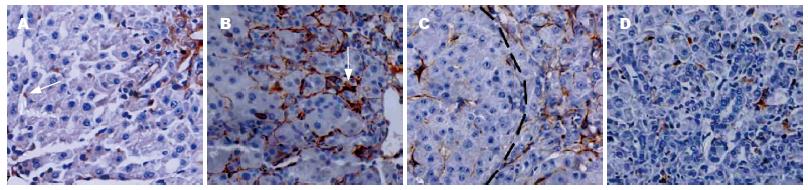
Matrilin-2在灌喂2-AAF之前的正常大鼠肝脏组织表达于胆管血管周围以及肝窦状隙内. PH后第2天, Matrilin-2主要在门静脉周围的肝窦状隙内放射状分布(图1A). 在卵圆细胞增殖的过程中, Matrilin-2染色在PH后第9天到达顶峰, 随后下降, 包含Matrilin-2的基底膜始终围绕未分化的卵圆细胞(图1B). PH后第12天由卵圆细胞分化的小肝细胞结节内(虚线部分)缺乏Matrilin-2的表达, 结节周围Matrilin-2表达逐渐减少(图1C). 15 d后, 卵圆细胞进一步减少, 小肝细胞与血管之间的联系开始重建, 肝脏结构开始恢复. 在尚未完全形成窦状隙和胞外基质的门静脉周围小肝细胞结节内出现Matrilin-2的表达(图1D).
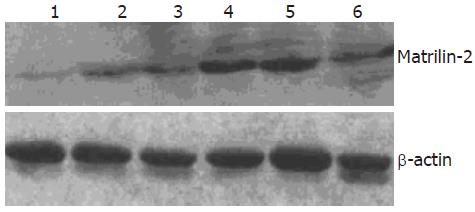
在正常肝组织中未见Matrilin-2, 肝切除后第2天即可见Matrilin-2表达, 到第9天达到高峰, 第12天后逐步恢复生理水平(图2).
本研究采用2-AAF/PH建立卵圆细胞增殖模型, 运用免疫组织化学以及Western blot的方法动态分析了肝脏胞外基质成分Matrilin-2与卵圆细胞之间的相互关系, 观察了在卵圆细胞介导的肝再生中Matrilin-2的变化, 研究表明, 在卵圆细胞增殖和分化的重建过程中, 卵圆细胞与肝脏胞外基质成分Matrilin-2具有紧密的解剖学关系. 这些结果说明胞外基质的重建对于卵圆细胞介导的肝再生具有重要作用. 肝脏胞外基质是一个动态的大分子复合物, 包括胶原、非胶原结构糖蛋白以及蛋白多糖, 在维持肝脏正常结构和细胞的增殖、迁移分化方面具有重要作用[1].
Matrilins为近年发现的一个新的细胞外基质蛋白家族, 有4个呈现出大致相同结构的家族成员. 唯独不同的是, Matrilin-2包含一个位于第2个vWFA域和寡聚合反应域之间的片段, 和其他任何已知的蛋白序列不具有同源性[9-31]. 已知生物细胞的一个基本特征就是他们与邻近细胞及ECM间有着规律性的相互作用, 这种相互间的接触和作用主要通过"ECM-黏附分子-细胞骨架"的介导途径, 进行着跨膜联系, 并决定着生物细胞的形态. 现证实ECM不仅具有连接和支持细胞、组织的作用, 而且可以影响细胞形态, 调控细胞迁移、增殖、分化、代谢及功能, 并与人类胚胎形态发生密切相关. 肝脏具有很强的再生能力, 但肝细胞的增殖受抑制, 而肝脏又有再生需求时, 卵圆细胞即活化. 2-AAF处理后可以抑制肝细胞DNA合成而抑制增殖, 然而卵圆细胞不受抑制, 开始活化. 基底膜在由卵圆细胞参与的肝脏再生过程中发挥了重要作用, 卵圆细胞在成熟肝细胞不能再生形成肝结节时被激活, 而且成熟的肝细胞周围缺乏基底膜, 而未分化的卵圆细胞具有完整的基底膜结构, 分化为成熟肝细胞后基底膜消失[2-7]. 由于抗基底膜抗体可诱导卵圆细胞快速分化, 可以推断基底膜和卵圆细胞之间的这种关系可以阻止细胞分化程序的启动. 这对于研究该分子抑制作用机制具有重要意义. 层粘连蛋白被证明是由卵圆细胞形成的胆管基底膜重要组成部分. Matrilin-2蛋白表达与层粘连蛋白表达类似[8], 表明Matrilin-2可能也是干细胞起源肝脏再生过程中产生的重要的细胞外基质成分. 充分认识基底膜组成对于研究如何启动和抑制的卵圆细胞分化机制具有重要意义.
我们通过免疫组织化学研究结果清楚地表明了Matrilin-2存在于卵圆细胞周围的基底膜区域, Matrilin-2在灌喂2-AAF之前的正常大鼠肝脏组织表达于胆管血管周围以及肝窦状隙内. PH后第2天, Matrilin-2出现在门静脉周围的肝窦状隙内放射状分布, 而且随着卵圆细胞的增殖分化, 这种蛋白几乎从小叶胆管和肝静脉基底膜消失. 同时我们通过Western blot方法比较了不同时段2-AAF/PH组的肝组织总蛋白中Matrilin-2的量, 发现肝切除后第2天即可见Matrilin-2表达, 到第9天达到高峰, 第15天后逐步恢复生理水平. 这意味Matrilin-2参与卵圆细胞介导的肝再生. 本研究动态观察了胞外基质成分Matrilin-2与卵圆细胞有紧密联系, 我们推测其可能在早期肝脏再生阶段提供卵圆细胞增殖必须的生长因子, 随着卵圆细胞向肝细胞分化, 围绕在卵圆细胞周围的基底膜逐渐减少最后消失, 胞外基质成分可能影响卵圆细胞的分化状态, 并且影响卵圆细胞的黏附、迁移和增殖. 这种不同的生物学特性和潜在的分子机制需要进一步阐明.
总之, 本研究结果表明, 在卵圆细胞增殖模型中, Matrilin-2是由卵圆细胞产生的重要的胞外基质成分, 并且参与由卵圆细胞介导的肝脏再生过程. 胞外基质的重塑可能对于调控卵圆细胞的迁移、增殖、分化以及肝再生过程有重要作用. Matrilin-2在卵圆细胞增殖中的确切作用机制需要进一步研究.
近年来, 肝脏胞外基质对卵圆细胞激活和增殖的影响引起了越来越多研究者的关注. 肝脏胞外基质调控卵圆细胞的分化, 支持卵圆细胞的自我更新, 在正常生理状态下抑制其分化, 而在损伤时促进其增殖分化. Matrilin-2是新发现的非胶原型细胞外基质蛋白的新家族成员之一, 目前对其功能的认识还很不明确.
朱亮, 副教授, 大连医科大学生理教研室
Matrilin-2是由卵圆细胞产生的重要的胞外基质成分, 并且参与由卵圆细胞介导的肝脏再生过程. 胞外基质的重塑可能对于调控卵圆细胞的迁移、增殖、分化以及肝再生过程有重要作用. Matrilin-2在卵圆细胞增殖中的确切作用机制需要进一步研究.
本研究采用2-AAF/PH建立卵圆细胞增殖模型, 运用免疫组织化学以及Western blot的方法动态分析了肝脏胞外基质成分Matrilin-2与卵圆细胞之间的相互关系, 观察了在卵圆细胞介导的肝再生中Matrilin-2的变化.
肝再生过程中, 当肝实质细胞增殖被抑制时, 肝脏微环境对卵圆细胞激活, 是该领域的热点研究之一. 有关非胶原型细胞外基质蛋白Matrilin-2与卵圆细胞的关系, 相关研究较少, 体现了该研究的创新性. 免疫组织化学和Western blot的动态观察, 较好地描述了Matrilin-2与卵圆细胞参与的肝脏再生之间的紧密联系, 有很好的启发意义和科学研究价值.
编辑: 李军亮 电编:何基才
| 1. | Tarlá MR, Ramalho FS, Ramalho LN, Silva Tde C, Brandão DF, Ferreira J, Silva Ode C, Zucoloto S. A molecular view of liver regeneration. Acta Cir Bras. 2006;21 Suppl 1:58-62. [PubMed] |
| 2. | Deák F, Wagener R, Kiss I, Paulsson M. The matrilins: a novel family of oligomeric extracellular matrix proteins. Matrix Biol. 1999;18:55-64. [PubMed] [DOI] |
| 3. | Wagener R, Ehlen HW, Ko YP, Kobbe B, Mann HH, Sengle G, Paulsson M. The matrilins--adaptor proteins in the extracellular matrix. FEBS Lett. 2005;579:3323-3329. [PubMed] [DOI] |
| 4. | Klatt AR, Paulsson M, Wagener R. Expression of matrilins during maturation of mouse skeletal tissues. Matrix Biol. 2002;21:289-296. [PubMed] [DOI] |
| 5. | Korpos E, Molnár A, Papp P, Kiss I, Orosz L, Deák F. Expression pattern of matrilins and other extracellular matrix proteins characterize distinct stages of cell differentiation during antler development. Matrix Biol. 2005;24:124-135. [PubMed] [DOI] |
| 6. | Fausto N. Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells. Hepatology. 2004;39:1477-1487. [PubMed] [DOI] |
| 7. | Forbes S, Vig P, Poulsom R, Thomas H, Alison M. Hepatic stem cells. J Pathol. 2002;197:510-518. [PubMed] [DOI] |
| 8. | Paku S, Nagy P, Kopper L, Thorgeirsson SS. 2-acetylaminofluorene dose-dependent differentiation of rat oval cells into hepatocytes: confocal and electron microscopic studies. Hepatology. 2004;39:1353-1361. [PubMed] [DOI] |
| 10. | Zhang Y, Bai XF, Huang CX. Hepatic stem cells: existence and origin. World J Gastroenterol. 2003;9:201-204. [PubMed] |
| 11. | Braun KM, Thompson AW, Sandgren EP. Hepatic microenvironment affects oval cell localization in albumin-urokinase-type plasminogen activator transgenic mice. Am J Pathol. 2003;162:195-202. [PubMed] |
| 12. | Vessey CJ, de la Hall PM. Hepatic stem cells: a review. Pathology. 2001;33:130-141. [PubMed] [DOI] |
| 13. | Ma X, Qiu DK, Peng YS. Immunohistochemical study of hepatic oval cells in human chronic viral hepatitis. World J Gastroenterol. 2001;7:238-242. [PubMed] |
| 14. | Piecha D, Wiberg C, Mörgelin M, Reinhardt DP, Deák F, Maurer P, Paulsson M. Matrilin-2 interacts with itself and with other extracellular matrix proteins. Biochem J. 2002;367:715-721. [PubMed] [DOI] |
| 15. | Frank S, Schulthess T, Landwehr R, Lustig A, Mini T, Jenö P, Engel J, Kammerer RA. Characterization of the matrilin coiled-coil domains reveals seven novel isoforms. J Biol Chem. 2002;277:19071-19079. [PubMed] [DOI] |
| 16. | Wiberg C, Klatt AR, Wagener R, Paulsson M, Bateman JF, Heinegård D, Mörgelin M. Complexes of matrilin-1 and biglycan or decorin connect collagen VI microfibrils to both collagen II and aggrecan. J Biol Chem. 2003;278:37698-37704. [PubMed] [DOI] |
| 17. | Whittaker CA, Hynes RO. Distribution and evolution of von Willebrand/integrin A domains: widely dispersed domains with roles in cell adhesion and elsewhere. Mol Biol Cell. 2002;13:3369-3387. [PubMed] [DOI] |
| 18. | Marchler-Bauer A, Anderson JB, Cherukuri PF, DeWeese-Scott C, Geer LY, Gwadz M, He S, Hurwitz DI, Jackson JD, Ke Z. CDD: a Conserved Domain Database for protein classification. Nucleic Acids Res. 2005;33:D192-D196. [PubMed] [DOI] |
| 19. | Ko YP, Kobbe B, Paulsson M, Wagener R. Zebrafish (Danio rerio) matrilins: shared and divergent characteristics with their mammalian counterparts. Biochem J. 2005;386:367-379. [PubMed] [DOI] |
| 20. | Ohno S, Murakami K, Tanimoto K, Sugiyama H, Makihira S, Shibata T, Yoneno K, Kato Y, Tanne K. Immunohistochemical study of matrilin-1 in arthritic articular cartilage of the mandibular condyle. J Oral Pathol Med. 2003;32:237-242. [PubMed] |
| 21. | Pullig O, Weseloh G, Klatt AR, Wagener R, Swoboda B. Matrilin-3 in human articular cartilage: increased expression in osteoarthritis. Osteoarthritis Cartilage. 2002;10:253-263. [PubMed] [DOI] |
| 22. | Aszódi A, Bateman JF, Hirsch E, Baranyi M, Hunziker EB, Hauser N, Bösze Z, Fässler R. Normal skeletal development of mice lacking matrilin 1: redundant function of matrilins in cartilage? Mol Cell Biol. 1999;19:7841-7845. [PubMed] |
| 23. | Mátés L, Nicolae C, Mörgelin M, Deák F, Kiss I, Aszódi A. Mice lacking the extracellular matrix adaptor protein matrilin-2 develop without obvious abnormalities. Matrix Biol. 2004;23:195-204. [PubMed] [DOI] |
| 24. | Ko Y, Kobbe B, Nicolae C, Miosge N, Paulsson M, Wagener R, Aszódi A. Matrilin-3 is dispensable for mouse skeletal growth and development. Mol Cell Biol. 2004;24:1691-1699. [PubMed] [DOI] |
| 25. | Huang X, Birk DE, Goetinck PF. Mice lacking matrilin-1 (cartilage matrix protein) have alterations in type II collagen fibrillogenesis and fibril organization. Dev Dyn. 1999;216:434-441. [PubMed] [DOI] |
| 26. | Makihira S, Yan W, Ohno S, Kawamoto T, Fujimoto K, Okimura A, Yoshida E, Noshiro M, Hamada T, Kato Y. Enhancement of cell adhesion and spreading by a cartilage-specific noncollagenous protein, cartilage matrix protein (CMP/Matrilin-1), via integrin alpha1beta1. J Biol Chem. 1999;274:11417-11423. [PubMed] [DOI] |
| 28. | Deák F, Piecha D, Bachrati C, Paulsson M, Kiss I. Primary structure and expression of matrilin-2, the closest relative of cartilage matrix protein within the von Willebrand factor type A-like module superfamily. J Biol Chem. 1997;272:9268-9274. [PubMed] [DOI] |
| 29. | Martinez-Hernandez A, Amenta PS. The extracellular matrix in hepatic regeneration. FASEB J. 1995;9:1401-1410. [PubMed] |