修回日期: 2009-12-13
接受日期: 2009-12-21
在线出版日期: 2010-02-08
目的: 观察牡蛎肝宝对大鼠酒精性肝病(alcoholic liver disease, ALD)的防治作用及其抗脂质过氧化效应.
方法: 采用给予乙醇灌胃制造酒精肝模型的方法, 75只♂Wistar大鼠随机均分为空白组、模型组以及牡蛎肝宝低剂量、中剂量、高剂量5组. 模型组仅给予500 mL/L的乙醇灌胃8 wk, 治疗组给予同等量乙醇灌胃, 同时还给分别给予低剂量、中剂量和高剂量牡蛎肝宝8 wk. 空白对照组每天仅给予等量蒸馏水灌胃8 wk. 治疗结束后, 抽取大鼠腹主动脉血液, 检测血清ALT、AST、TG、TC、GLU及丙二醛加合物抗体IgG, 同时取大鼠肝脏做冰冻切片, 用苏丹Ⅲ染色, 观察各组脂肪变程度.
结果: 空白组及牡蛎肝宝中、高剂量组血清ALT、AST、TG、TC、GLU均明显低于模型组(均P<0.01), 牡蛎肝宝中、高剂量组血清丙二醛加合物抗体IgG浓度低于模型组(P<0.01), 牡蛎肝宝低剂量组血清ALT、AST和GLU低于模型组(63.67 U/L±6.89 U/L vs 81.53 U/L±22.85 U/L, 131.2 U/L±11.63 U/L vs 156.47 U/L±32.23 U/L, 6.38 mmol/L±0.66 mmol/L vs 6.86 mmol/L±0.67 mmol/L, P<0.01或0.05); 模型组肝脏病理改变的程度高于空白对照组(P<0.01); 牡蛎肝宝中、高剂量组肝脏病理改变的程度均低于模型组(P<0.05).
结论: 牡蛎肝宝可以降低ALD的肝脏脂质蓄积, 抗脂质过氧化, 有保肝降酶作用.
引文著录: 张博, 张翠萍, 江月萍, 田字彬, 牛庆慧. 牡蛎肝宝对大鼠酒精性肝病的抗脂质过氧化作用. 世界华人消化杂志 2010; 18(4): 340-345
Revised: December 13, 2009
Accepted: December 21, 2009
Published online: February 8, 2010
AIM: To observe the protective and therapeutic effects and anti-lipid peroxidation effects of taurine ganbo in rats with alcoholic liver disease.
METHODS: A rat model of alcoholic liver disease was established by intragastric infusion of alcohol. Seventy-five male Wistar rats were randomly divided into five groups: normal control group, model group, low-dose taurine ganbo group, middle-dose taurine ganbo group, and high-dose taurine ganbo group. The model group was given dehydrated alcohol (500 mL/L) once a day for 8 weeks. The three taurine ganbo groups were treated as the model group and additionally given taurine ganbo once a day for 8 weeks. The normal control group was given equal volumes of distilled water for the same duration. After treatment, all the rats were killed. Serum alanine aminotransferase (ALT), aspartate amino transferase (AST), triglyceride (TG), total cholesterol (T-CHO), glucose (GLU), and circulating IgG against malondialdehyde-modified human serum albumin (MDA-HSA) were measured. Hepatic pathological changes were observed.
RESULTS: The levels of serum ALT, AST, TG, T-CHO, and GLU were significantly higher in the model group than in the normal control group, the middle- and high-dose taurine ganbo groups (all P < 0.0). The levels of serum ALT, AST and GLU in the low-dose taurine ganbo group were lower than those in the model group (63.67 U/L ± 6.89 U/L vs 81.53 U/L ± 22.85 U/L, 131.2 U/L ± 11.63 U/L vs 156.47 U/L ± 32.23 U/L, and 6.38 mmol/L ± 0.66 mmol/L vs 6.86 mmol/L ± 0.67 mmol/L, respectively; all P < 0.01 or 0.05). The level of circulating IgG against MDA-HSA in the model group was higher than those in the normal control group and the middle- and high-dose taurine ganbo groups (all P < 0.01). Compared to the normal control group, the model group had a much heavier lipid accumulation (P < 0.01). The hepatic pathological changes were milder in the middle- and high-dose groups than in the model group (both P < 0.05).
CONCLUSION: Taurine ganbo can attenuate alcohol-mediated increase in serum ALT, AST, TG and T-CHO levels and exert anti-lipid peroxidation effects in rats with alcoholic liver disease.
- Citation: Zhang B, Zhang CP, Jiang YP, Tian ZB, Niu QH. Anti-lipid peroxidation effects of taurine ganbo in rats with alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 340-345
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/340.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.340
酒精性肝病(alcoholic liver disease, ALD)是因长期过量饮酒引起的中毒性肝脏疾病, 包括酒精性脂肪肝、酒精性肝炎、酒精性肝硬化等5种类型[1]. ALD是西方国家导致肝硬化的最主要原因[2,3], 在我国ALD的发病率也逐年上升, 酒精已成为继病毒性肝炎后导致肝损害的第二大病因[4]. 酒精所致肝病, 除轻微病理改变者外, 最常见的是甘油三酯在肝内堆积形成脂肪肝, 影响肝脏功能, 并可发展为肝硬化. 牡蛎肝宝是从海洋生物牡蛎、扇贝、蛤蜊等提炼出的有效生物活性成分, 是卫生部审批公布的药食同源名单中的食品, 含有丰富动物性糖原、牛磺酸、B族维生素、微量元素锌等, 具有广泛的生物学作用, 对乙醇所致小鼠肝损伤有一定的防治作用[5]. 本实验通过建立实验性乙醇肝损伤大鼠动物模型, 进一步探讨牡蛎肝宝对ALD的防治作用及其可能的机制.
75只健康Wistar大鼠, ♂, 体质量232.8 g±19.9 g, 购自华中科技大学同济医学院实验动物学部. 所需辣根过氧化物酶标记的兔抗大鼠IgG购自北京博奥森生物技术有限公司, 其余试剂均购自青岛沃尔森生物技术有限公司.
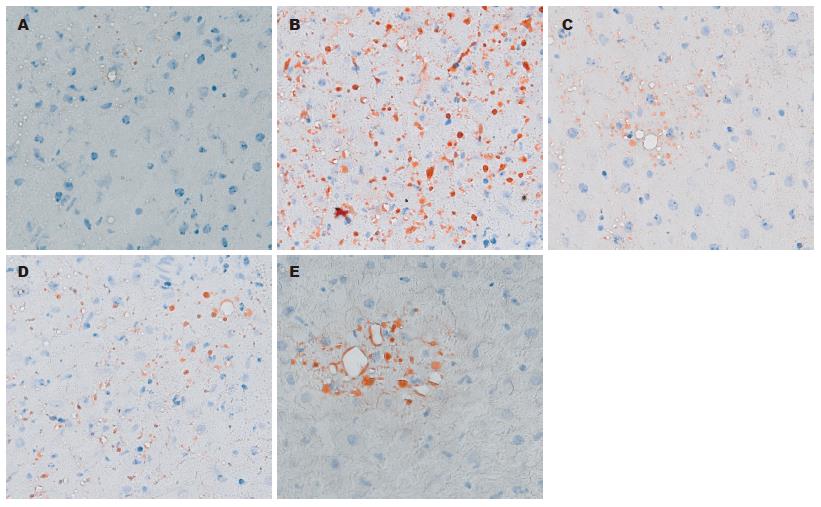
1.2.1 分组及灌胃: 参考林红等, 采用酒精灌胃方法制造大鼠酒精性肝病模型[6-9]. 75只健康♂Wistar大鼠, 按每组15只, 随机分为空白组、模型组和3个实验组, 即牡蛎肝宝低剂量组、中剂量组、高剂量组, 采用灌胃的方法, 从小剂量开始, 模型组和实验组分别给予500 mL/L的乙醇8 mL/(kg·d)2 wk、10 mL/(kg·d)2 wk增加到15 mL/(kg·d)4 wk, 此外实验组还分别给予牡蛎肝宝0.04 g/(kg·d)、0.13 g/(kg·d)、0.40 g/(kg·d)各2 wk、0.08 g/(kg·d)、0.26 g/(kg·d)、0.8 g/(kg·d)各2 wk增加到0.12 g/(kg·d)、0.4 g/(kg·d)、1.2 g/(kg·d)各4 wk(相当于人体推荐剂量的3.3、10、30倍), 各组自由饮水与进食, 空白对照组每天仅给予模型组体积相当的蒸馏水灌胃. 灌胃8 wk, 禁食12 h后处死. 用0.3%戊巴比妥钠按照1 mL/kg对大鼠行腹腔注射麻醉, 麻醉成功后, 从大鼠腹主动脉抽取血液, 静置0.5 h, 以3 000 r/min离心10 min, 吸取上层血清, 用0.5 μL离心管分装放置-70 ℃深低温冰箱备用, 行血生化检查; 同时取大鼠肝脏左叶放-70 ℃深低温冰箱备用, 做冰冻切片, 用苏丹Ⅲ染色, 观察脂肪变性.
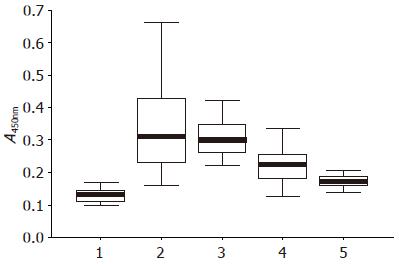
1.2.2 指标检测: (1)采用日立7600-210全自动生化分析仪检测各组血清中ALT、AST、 TG、T-CHO、GLU的含量; (2)用ELISA法, 参考Vidali等对血清中丙二醛蛋白加合物(malondialdehyde-modified human serum albumin, MDA-HSA)抗体浓度进行比较[10-13]: 在酸性条件下水解丙二醛二甲缩醛得到丙二醛(malondialdehyde, MDA)[14], 将其与白蛋白反应, 制得MDA-HSA并包被于聚乙烯板上, 然后按照ELISA的常规步骤进行封闭、加入血清标本、加入辣根过氧化物酶标记的兔抗大鼠IgG、加入显色液、最后加终止液, 用美国BIO-RAD伯乐酶标仪(型号: 550)在450 nm处检测吸光度值(A)(除了加入显色剂孵育以后不洗涤直接加终止液以外, 其余每一步操作完成后都要用含0.25% Trion-X-100的PBS严格洗涤); (3)乙醇中毒大鼠肝脏病理组织学变化与评分标准[5]: 对每张病理切片全面进行观察(不得遗漏任何视野), 观察脂肪滴在肝脏的分布、范围和面积. 并根据病变程度进行量化, 按"-(0分)、+(1分)、++(2分)、+++(3分)、++++(4分)"量化积分.
统计学处理 采用SPSS11.5统计软件, 对所获得各组生化值数据及用ELISA法所测MDA-HSA抗体IgG吸光度值(mean±SD)进行One-way ANOVA检验, 对各组肝脏病理脂肪变(各组不同阳性值个数n)进行Mann-Whitney Test非参数秩和检验, 以P<0.05为差别有统计学意义.
实验期间大鼠活动正常, 精神状态、进食以及排便情况未见异常, 75只大鼠进入结果分析.
模型组ALT、AST、TG、T-CHO均明显高于空白组(P<0.01), GLU高于空白组(P<0.01), 说明模型建立成功; 与模型组相比, 牡蛎肝宝低、中、高药物组ALT、AST及高剂量组TG均降低(P<0.01), 中、高剂量组T-CHO(均P<0.01)、GLU(均P<0.01)及中剂量组TG(P<0.01)明显降低, 低剂量组GLU比模型组降低(P<0.05, 表1).
| 分组 | ALT(U/L) | AST(U/L) | TG(mmol/L) | T-CHO(mmol/L) | GLU(mmol/L) |
| 空白组 | 55.20±3.76b | 118.13±8.64b | 0.55±0.07b | 1.16±0.11b | 6.28±0.21b |
| 模型组 | 81.53±22.85 | 156.47±32.23 | 1.26±0.44 | 1.42±0.11 | 6.86±0.67 |
| 低剂量组 | 63.67±6.89b | 131.20±11.63b | 1.07±0.36 | 1.33±0.25 | 6.38±0.66a |
| 中剂量组 | 58.40±6.37b | 119.20±5.28b | 0.90±0.33b | 1.20±0.24b | 6.36±0.37b |
| 高剂量组 | 61.87±8.17b | 123.60±7.78b | 0.79±0.15b | 1.21±0.17b | 6.29±0.50b |
模型组明显高于空白组、中剂量组和高剂量组(P<0.01, 图1).
人体摄入的酒精经胃肠道吸收后, 大部分经肝脏氧化分解, 在代谢过程中, 乙醇被氧化成乙醛, 有10%-20%被肝细胞微粒体乙醇氧化系统(microsomal ethanol oxidizing system, MEOS)催化, 产生大量自由基作用于细胞膜上的不饱和脂肪酸而诱导肝脏脂质过氧化产生MDA[15,16], 与肝脏内蛋白反应生成MDA-HSA, 该加合物不需使用佐剂就具有免疫原性, 能诱发外周血T细胞的增殖反应[17], 引发机体产生针对MDA-HSA的抗体IgG, 抗体可以直接对这些蛋白加合物和载体蛋白发生免疫作用, 从而进一步诱发机体对肝脏的自身免疫反应, MDA还能与乙醛和蛋白反应生成丙二醛-乙醛蛋白加和物, 导致新的不同的偶合物的形成[18-25]. 研究提示, 丙二醛加合物抗体IgG和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)浓度的高低影响到疾病的预后, 浓度越高, 肝损伤越严重[10,12], 同时, 脂质过氧化还可以导致线粒体功能障碍, 影响DNA的功能,并且能促进肝脏肿瘤基因的激活[26-28].
正常肝内存在具有保护性的抗氧化反应物, 如谷胱甘肽(GSH)等. 长期饮酒者, 肝细胞内GSH含量明显降低或耗竭, 肝中GSH减少在线粒体最为明显, 从而加剧对线粒体结构和功能的损害, 研究显示[5], 在给予牡蛎肝宝的小鼠肝脏内GSH的含量明显增加、MDA的含量明显下降. 本实验模型组大鼠血清MDA-HSA抗体IgG浓度明显增高, 这与Vidali等[10]结果相一致, 而给予牡蛎肝宝组IgG浓度、ALT、AST、TG、T-CHO均较模型组有不同程度降低, TG的降低则可以降低脂肪肝的相关危险[29], 说明该药具有较好的抗脂质过氧化和保肝功效.
肝脏病理结果也显示, 给予牡蛎肝宝的大鼠肝脏脂肪变明显低于模型组, 说明该药对ALD有较好的降低肝脏脂肪蓄积的作用. 牡蛎肝宝含有天然牛磺酸(含量在4%以上), 以及丰富B族维生素、微量元素锌等, 牛磺酸可以逆转ALD的脂肪变性和脂质过氧化, 给予牛磺酸可以降低血清AST、TNF-α等, 增加肝脏总蛋白, 降低肝脏内MDA含量[30-32], 补充锌可以使肝脏肝细胞核因子-4α和过氧化物酶体增生物激活受体-α的活性得到恢复, 使肝脏脂肪酸氧化和极低密度脂蛋白(very low density lipoprotein, VLDL)分泌相关基因上调, 增加肝脏游离脂肪酸的氧化和VLDL的分泌, 减轻由酒精引起的肝脏脂类蓄积, 降低脂质过氧化产物MDA的含量, 减少TNF-α在肝脏的mRNA的水平的升高, 减轻肝脏的炎症反应, 抑制酒精引起的肝细胞凋亡[33,34].
本实验结果还显示, 模型组血糖高于空白组、牡蛎肝宝中、高剂量组. 酒精摄入可抑制细胞代谢、变型和更新所需的胰岛素反应基因, 降低胰岛素与受体的结合, 导致胰岛素抵抗[27,35,36], 给予牡蛎肝宝的药物组血糖则较模型组有不同程度的降低, 但由于尚未检测空腹胰岛素和计算胰岛素抵抗指数, 因此该药是否对ALD的胰岛素抵抗有一定的治疗作用, 仍有待进一步研究.
本实验结果显示, 牡蛎肝宝可以促进酒精代谢, 降低肝脏脂肪蓄积, 降低脂质过氧化的损害, 能从多个途径保护肝脏, 减轻酒精对肝脏的损害, 对ALD的治疗有一定辅助价值.
青岛大学医学院附属医院中心实验室对本实验提供的帮助.
酒精是西方国家导致肝病的首要原因, 近年来随着我国经济的发展, 酒精性肝病已经成为我国仅次于乙型肝炎的第二大肝脏疾病, 而且发病率有逐年上升的趋势. 进一步研究其相关的发病及防治机制有利于国民的健康事业的发展.
李军祥, 教授, 北京中医药大学附属东方医院消化内科; 范建高, 教授, 上海交通大学医学院附属新华医院消化内科
对酒精性肝病的研究, 目前较多的集中在氧化应激和免疫相关机制方面, 而氧化应激可以引起脂质过氧化, 引发机体的免疫反应, 可以说脂质过氧化在酒精性肝病的发病中起了非常重要的作用, 进一步研究脂质过氧化的机制将有助于酒精性肝病的防治.
Zhou等分别用锌在动物实验中治疗酒精性肝病, 取得了较好效果, 而Wu等则用牛磺酸在大鼠酒精性肝病模型中取得了较好的效果, 不排除将来开发出以锌或牛磺酸治疗酒精性肝病的可能.
本文将酒精性肝病转氨酶变化、血脂变化、血糖及针对丙二醛加合物抗体的IgG联合进行检测, 取得了较理想的效果, 但牡蛎肝宝是否对胰岛素抵抗有一定的治疗作用还有待于进一步的研究.
本研究设计合理, 方法先进, 数据准确, 分析恰当, 学术价值较好.
编辑: 李军亮 电编:何基才
| 2. | Diehl AM. Liver disease in alcohol abusers: clinical perspective. Alcohol. 2002;27:7-11. [PubMed] [DOI] |
| 3. | Mann RE, Smart RG, Govoni R. The epidemiology of alcoholic liver disease. Alcohol Res Health. 2003;27:209-219. [PubMed] |
| 9. | French SW. Intragastric ethanol infusion model for cellular and molecular studies of alcoholic liver disease. J Biomed Sci. 2001;8:20-27. [PubMed] [DOI] |
| 10. | Vidali M, Hietala J, Occhino G, Ivaldi A, Sutti S, Niemelä O, Albano E. Immune responses against oxidative stress-derived antigens are associated with increased circulating tumor necrosis factor-alpha in heavy drinkers. Free Radic Biol Med. 2008;45:306-311. [PubMed] [DOI] |
| 11. | Xu D, Thiele GM, Beckenhauer JL, Klassen LW, Sorrell MF, Tuma DJ. Detection of circulating antibodies to malondialdehyde-acetaldehyde adducts in ethanol-fed rats. Gastroenterology. 1998;115:686-692. [PubMed] [DOI] |
| 12. | Rigamonti C, Mottaran E, Reale E, Rolla R, Cipriani V, Capelli F, Boldorini R, Vidali M, Sartori M, Albano E. Moderate alcohol consumption increases oxidative stress in patients with chronic hepatitis C. Hepatology. 2003;38:42-49. [PubMed] [DOI] |
| 13. | Rolla R, Vay D, Mottaran E, Parodi M, Traverso N, Aricó S, Sartori M, Bellomo G, Klassen LW, Thiele GM. Detection of circulating antibodies against malondialdehyde-acetaldehyde adducts in patients with alcohol-induced liver disease. Hepatology. 2000;31:878-884. [PubMed] [DOI] |
| 14. | Tinahones FJ, Gómez-Zumaquero JM, Garrido-Sánchez L, García-Fuentes E, Rojo-Martínez G, Esteva I, Ruiz de Adana MS, Cardona F, Soriguer F. Influence of age and sex on levels of anti-oxidized LDL antibodies and anti-LDL immune complexes in the general population. J Lipid Res. 2005;46:452-457. [PubMed] [DOI] |
| 15. | 金 武丕, 权 修权, 孟 繁平, 崔 香丹, 朴 海今. 大鼠酒精性肝病细胞凋亡与细胞色素P4502E1和氧化应激的关系. 世界华人消化杂志. 2007;15:2181-2185. [DOI] |
| 16. | Fernández A, Colell A, Garcia-Ruiz C, Fernandez-Checa JC. Cholesterol and sphingolipids in alcohol-induced liver injury. J Gastroenterol Hepatol. 2008;23 Suppl 1:S9-S15. [PubMed] [DOI] |
| 17. | Stewart SF, Vidali M, Day CP, Albano E, Jones DE. Oxidative stress as a trigger for cellular immune responses in patients with alcoholic liver disease. Hepatology. 2004;39:197-203. [PubMed] [DOI] |
| 18. | Viitala K, Makkonen K, Israel Y, Lehtimäki T, Jaakkola O, Koivula T, Blake JE, Niemelä O. Autoimmune responses against oxidant stress and acetaldehyde-derived epitopes in human alcohol consumers. Alcohol Clin Exp Res. 2000;24:1103-1109. [PubMed] [DOI] |
| 19. | Mottaran E, Stewart SF, Rolla R, Vay D, Cipriani V, Moretti M, Vidali M, Sartori M, Rigamonti C, Day CP. Lipid peroxidation contributes to immune reactions associated with alcoholic liver disease. Free Radic Biol Med. 2002;32:38-45. [PubMed] [DOI] |
| 20. | Duryee MJ, Klassen LW, Thiele GM. Immunological response in alcoholic liver disease. World J Gastroenterol. 2007;13:4938-4946. [PubMed] |
| 21. | Tuma DJ. Role of malondialdehyde-acetaldehyde adducts in liver injury. Free Radic Biol Med. 2002;32:303-308. [PubMed] [DOI] |
| 22. | Tuma DJ, Casey CA. Dangerous byproducts of alcohol breakdown--focus on adducts. Alcohol Res Health. 2003;27:285-290. [PubMed] |
| 23. | Kharbanda KK, Todero SL, Shubert KA, Sorrell MF, Tuma DJ. Malondialdehyde-acetaldehyde-protein adducts increase secretion of chemokines by rat hepatic stellate cells. Alcohol. 2001;25:123-128. [PubMed] [DOI] |
| 24. | Niemelä O. Distribution of ethanol-induced protein adducts in vivo: relationship to tissue injury. Free Radic Biol Med. 2001;31:1533-1538. [PubMed] [DOI] |
| 25. | Thiele GM, Worrall S, Tuma DJ, Klassen LW, Wyatt TA, Nagata N. The chemistry and biological effects of malondialdehyde-acetaldehyde adducts. Alcohol Clin Exp Res. 2001;25:218S-224S. [PubMed] |
| 26. | Yan M, Zhu P, Liu HM, Zhang HT, Liu L. Ethanol induced mitochondria injury and permeability transition pore opening: role of mitochondria in alcoholic liver disease. World J Gastroenterol. 2007;13:2352-2356. [PubMed] |
| 27. | Yao XH, Chen L, Nyomba BL. Adult rats prenatally exposed to ethanol have increased gluconeogenesis and impaired insulin response of hepatic gluconeogenic genes. J Appl Physiol. 2006;100:642-648. [PubMed] [DOI] |
| 28. | Wang Y, Millonig G, Nair J, Patsenker E, Stickel F, Mueller S, Bartsch H, Seitz HK. Ethanol-induced cytochrome P4502E1 causes carcinogenic etheno-DNA lesions in alcoholic liver disease. Hepatology. 2009;50:453-461. [PubMed] [DOI] |
| 30. | Wu G, Yang J, Sun C, Luan X, Shi J, Hu J. Effect of taurine on alcoholic liver disease in rats. Amino Acids. 2009;36:457-464. [PubMed] [DOI] |
| 31. | Kerai MD, Waterfield CJ, Kenyon SH, Asker DS, Timbrell JA. Reversal of ethanol-induced hepatic steatosis and lipid peroxidation by taurine: a study in rats. Alcohol Alcohol. 1999;34:529-541. [PubMed] [DOI] |
| 32. | Bleich S, Degner D. Reversal of ethanol-induced hepatic steatosis and lipid peroxidation by taurine: a study in rats. Alcohol Alcohol. 2000;35:215. [PubMed] [DOI] |
| 33. | Kang X, Zhong W, Liu J, Song Z, McClain CJ, Kang YJ, Zhou Z. Zinc supplementation reverses alcohol-induced steatosis in mice through reactivating hepatocyte nuclear factor-4alpha and peroxisome proliferator-activated receptor-alpha. Hepatology. 2009;50:1241-1250. [PubMed] [DOI] |
| 34. | Zhou Z, Liu J, Song Z, McClain CJ, Kang YJ. Zinc supplementation inhibits hepatic apoptosis in mice subjected to a long-term ethanol exposure. Exp Biol Med (Maywood). 2008;233:540-548. [PubMed] [DOI] |
| 35. | de la Monte SM, Yeon JE, Tong M, Longato L, Chaudhry R, Pang MY, Duan K, Wands JR. Insulin resistance in experimental alcohol-induced liver disease. J Gastroenterol Hepatol. 2008;23:e477-e486. [PubMed] [DOI] |