修回日期: 2009-12-28
接受日期: 2009-12-29
在线出版日期: 2010-02-08
目的: 探讨氯吡格雷(Clopidogrel)对人胃黏膜上皮细胞株GES-1增殖的影响.
方法: 体外培养人胃黏膜上皮细胞株GES-1, 将含不同浓度氯吡格雷(0.01、0.1、0.5和1 mmol/L)的培养液与GES-1细胞共同培养24、48及72 h, 采用MTT比色法计算细胞生长抑制率. 以药物不同浓度对GES-1细胞生长抑制率作图, 得到剂量反应曲线. 依据Bliss法, 利用SPSS15.0软件求出氯吡格雷的半数抑制浓度IC50和安全浓度IC90(存活率≥90%的药物浓度). 倒置相差显微镜观察各浓度组氯吡格雷与GES-1细胞共同培养24 h后细胞形态学变化, 用流式细胞术膜联蛋白V-异硫氰酸荧光素-碘化丙啶(Annexin V-FITC/PI)双染法检测各浓度组氯吡格雷与GES-1细胞共同培养24 h后对细胞凋亡的影响.
结果: 氯吡格雷对GES-1细胞的损伤呈浓度依赖性(F = 11.546, P = 0.002), 无时间依赖性(F = 13.455, P = 0.003). 氯吡格雷作用24 h、48 h和72 h的IC50分别为0.36、0.51和0.35 mmol/L, IC90分别为0.08、0.16和0.08 mmol/L. 光镜下可见药物作用后贴壁细胞数量减少, 细胞变圆, 悬浮, 部分细胞核浓缩, 细胞损害随药物浓度增加而增大. 流式细胞术显示: 空白对照组及0.01、0.1、0.5、1 mmol/L氯吡格雷组凋亡率为4.7%、5.3%、14.7%、51.0%、60.5%. 随着氯吡格雷药物浓度增加, GES-1细胞的凋亡率亦随之增加.
结论: 氯吡格雷可抑制人胃黏膜上皮细胞的增殖, 具有剂量依赖性, 诱导细胞发生凋亡.
引文著录: 孙沂, 樊宏伟, 王书奎, 何帮顺, 张振玉. 氯吡格雷对人胃黏膜上皮细胞株GES-1增殖作用的影响. 世界华人消化杂志 2010; 18(4): 329-334
Revised: December 28, 2009
Accepted: December 29, 2009
Published online: February 8, 2010
AIM: To investigate the effects of clopidogrel on the proliferation of human gastric epithelial GES-1 cells.
METHODS: GES-1 cells were cultured in vitro. After GES-1 cells were incubated with clopidogrel at concentrations of 0.01, 0.1, 0.5 and 1 mmol/L for 24, 48 and 72 h, the reduced proliferation rates of GES-1 cells were examined using methyl thiazolyl tetrazolium (MTT) assay. A dose-response curve was established by plotting the reduced cell proliferation rates against the concentrations of clopidogrel. The half maximal inhibitory concentration (IC50) and safe concentration (IC90, concentration that achieves 90% inhibition) of clopidogrel were calculated using the Bliss method. The morphology changes of GES-1 cells treated with clopidogrel were observed under an inverted phase contrast microscope. Flow cytometry was used to detect cell apoptosis after GES-1 cells were incubated with clopidogrel for 24 h.
RESULTS: Clopidogrel induced GES-1 cell injury in a concentration-dependent manner (F = 11.546, P = 0.002), but not in an obvious time-dependent manner (F = 13.455, P = 0.003). The IC50 and IC90 of clopidogrel at 24, 48 and 72 h were 0.36 and 0.51, 0.35 and 0.08, and 0.16 and 0.08 mmol/L, respectively. After clopidogrel treatment, the number of adherent cells was reduced, cells became round and suspended, and some cells showed nuclear condensation. Flow cytometry analysis indicated that the apoptosis rates of cells treated with clopidogrel at concentrations of 0, 0.01, 0.1, 0.5 and 1 mmol/L were 4.7%, 5.3%, 14.7%, 51.0% and 60.5%, respectively. The apoptosis rate of GES-1 cells rose with the increase in drug concentration.
CONCLUSION: Clopidogrel can inhibit the proliferation and induce the apoptosis of GES-1 cells in a concentration-dependent manner.
- Citation: Sun Y, Fan HW, Wang SK, He BS, Zhang ZY. Clopidogrel suppresses the proliferation of human gastric epithelial GES-1 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 329-334
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/329.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.329
氯吡格雷作为新型噻吩吡啶类药物, 其应用于心脑血管疾病的治疗已逾10年. CAPRIE[1]和CURE[2]实验证实, 氯吡格雷可显著减少各类缺血事件的发生, 效果优于阿司匹林. CURE、PCI-CURE[3]及CREDO[4]试验显示, 在非ST段抬高的急性冠脉综合征(acute coronary syndrome, ACS)中, 阿司匹林和氯吡格雷联合治疗能使血管事件的发生率降低20%, 在经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)中降低30%, 确定了氯吡格雷在ACS和PCI中的应用价值. 近来, 在质子泵抑制剂(proton pump inhibitor, PPI)预防氯吡格雷相关的胃肠道损伤中, 心血管事件的发生率和死亡率升高[5-9], 氯吡格雷对胃肠道的损伤引起了临床医师的广泛关注. 氯吡格雷是具有独立的损伤胃肠道黏膜作用, 还是仅影响出血黏膜的修复, 目前尚不明确[10]. 本研究拟采用人胃黏膜上皮细胞株GES-1与氯吡格雷共培养, 通过MTT法及流式细胞术研究氯吡格雷对GES-1细胞的损伤作用.
人胃黏膜上皮细胞株GES-1由江苏省人民医院消化科实验室馈赠. 氯吡格雷购自北京诺德恒信化工技术有限公司(批号: NDS0060513), 用PBS溶解配成10 mmol/L的母液, 调pH值为7.4, 用0.22 μm微孔滤膜过滤除菌, 4 ℃存放, 用时以无血清DMEM稀释成所需浓度. DMEM高糖培养液为美国Hyclone公司生产, 新生小牛血清为杭州四季青公司生产, 噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司, Annexin V FITC/PI凋亡检测试剂盒购自美国BD公司. Bio-Rad 680全自动酶标仪为美国Bio-Rad公司产品. Olympus IX51倒置相差显微镜为日本Olympus公司产品.
1.2.1 细胞培养: 将GES-1细胞置于细胞培养瓶内, 以DMEM为培养液, (含15%小牛血清, pH7.4), 置37 ℃, 50 mL/L CO2温箱中培养, 隔天更换培养液, 每3 d按1:3比例传代, 实验时取对数生长期细胞.
1.2.2 细胞生长抑制实验: 人胃黏膜上皮细胞株GES-1用含15%小牛血清的DMEM培养液常规培养. 应用MTT比色法, 将处于对数生长期的人胃黏膜上皮细胞以每孔2×105加入96孔培养板中, 每孔200 μL, 培养24 h贴壁后分别加入不同浓度(0.01、0.1、0.5和1 mmol/L)的氯吡格雷, 每组设4个复孔. 分别连续培养24、48和72 h后, 加入5% MTT 10 μL, 继续培养4 h. 小心吸出培养液, 每孔加入DMSO 100 μL, 室温震荡10 min溶解. 同时设不加药物的阴性对照组以及只加DMEM培养液的空白对照组. 以490 nm为测定波长, 用酶标仪检测吸光度(A值), 计算抑制率. 抑制率 = (阴性对照孔A值-加药孔A值)/(阴性对照组A值)×100%. 以药物的不同浓度对GES-1细胞生长抑制率作图, 可得到剂量反应曲线. 根据Bliss法, 利用SPSS15.0软件[11]求出药物的半数抑制浓度IC50和安全浓度IC90.
1.2.3 倒置相差显微镜观察细胞形态: 将含不同浓度氯吡格雷(浓度分别为0, 0.01, 0.1, 0.5和1 mmol/L)的培养液与对数生长期的GES-1细胞共同培养24 h后, 在倒置相差显微镜下观察细胞形态学变化.
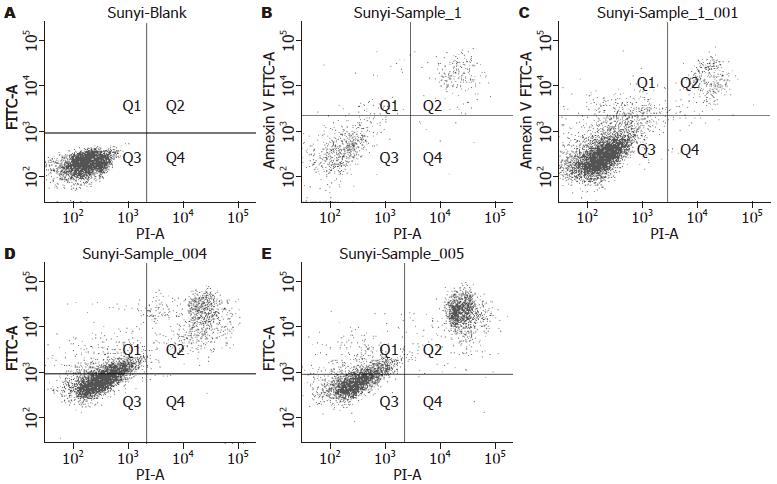
1.2.4 流式细胞术膜联蛋白V-异硫氰酸荧光素-碘化丙啶双染法检测药物对GES-1细胞凋亡的影响: 将氯吡格雷(浓度分别为0, 0.01, 0.1, 0.5和1 mmol/L)与对数生长期的GES-1细胞作用24 h后, 0.25%胰酶消化, 2 000 r/min离心5 min, 弃去上清及细胞碎片, 收集细胞悬液; 冷PBS液洗涤两遍, 调整细胞浓度至1×109 cell/L; 加入Annexin V-FITC和PI各5 μL; 旋涡混匀, 避光室温孵育15 min后立即用流式细胞仪检测细胞凋亡情况. 正常活细胞Annexin V及PI均低染(Annexin V-PI-), 分布在流式细胞分析图的左下区; 凋亡早期细胞Annexin V高染而PI低染(Annexin V+PI-), 分布在图的左上区; 凋亡晚期细胞或死亡细胞Annexin V及PI均高染(Annexin V+PI+), 分布在图的右上区[12].
统计学处理 实验数据用mean±SD表示, 多组间比较采用One-way ANOVA分析; SPSS15.0软件进行数据处理及分析, P<0.05有显著性差异.
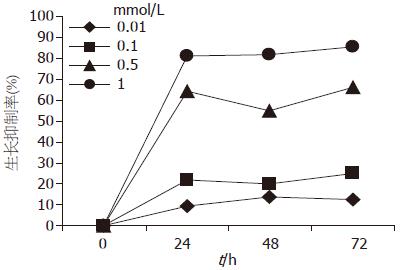
细胞生长抑制试验显示氯吡格雷对GES-1细胞具有损伤作用, 并且具有剂量依赖性, 但未显示有时间依赖性(F药物浓度 = 11.546, P = 0.002; F时间 = 13.455, P = 0.003, 表1, 图1). 根据Bliss法, 氯吡格雷作用24、48和72 h的IC50分别为0.36 mmol/L(95%CI: 0.26-0.46)、0.51 mmol/L(95%CI: 0.30-0.64)和0.35 mmol/L(95%CI: 0.24-0.44); 氯吡格雷作用24、48和72 h的IC90分别为0.08 mmol/L(95%CI: 0.03-0.13)、0.16 mmol/L(95%CI: 0.03-0.28)和0.08 mmol/L(95%CI: 0.03-0.13).
| 氯吡格雷浓度(mmol/L) | 24h | 48h | 72h |
| 0 | 0.725±0.036 | 1.506±0.051 | 2.115±0.180 |
| 0.01 | 0.658±0.030 | 1.295±0.084 | 1.857±0.186 |
| 0.1 | 0.565±0.055 | 1.203±0.063 | 1.593±0.230 |
| 0.5 | 0.261±0.074 | 0.672±0.144 | 0.717±0.162 |
| 1 | 0.134±0.014 | 0.277±0.076 | 0.299±0.008 |
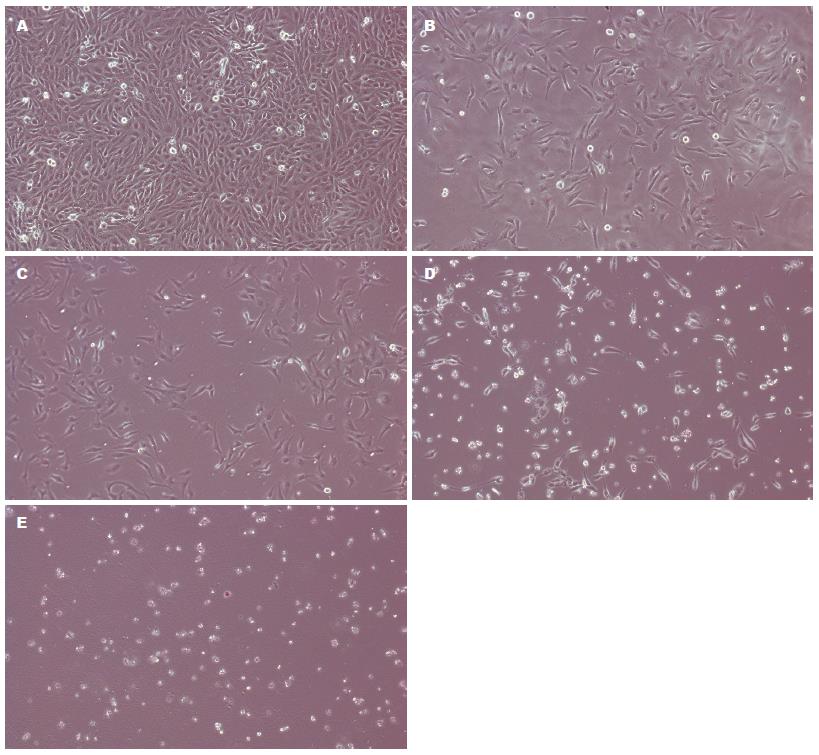
对照组GES-1细胞呈长梭形, 均一贴壁生长. 不同浓度氯吡格雷(0.01, 0.1, 0.5和1 mmol/L)作用于GES-1细胞24 h后贴壁细胞数量减少, 细胞变圆, 悬浮, 部分细胞核浓缩, 且随药物浓度增大, 悬浮细胞数量增多(图2).
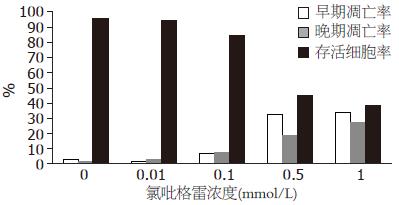
流式细胞术显示: 对照组凋亡率为4.7%(早期凋亡率为3.2%, 晚期凋亡率为1.5%); 0.01 mmol/L氯吡格雷组凋亡率为5.3%(早期凋亡率为2.0%, 晚期凋亡率为3.3%); 0.1 mmol/L氯吡格雷组凋亡率为14.7%(早期凋亡率为7.3%, 晚期凋亡率为7.4%); 0.5 mmol/L氯吡格雷组凋亡率为51.0%(早期凋亡率为32.7%, 晚期凋亡率为18.3%); 1 mmol/L氯吡格雷组凋亡率为60.5%(早期凋亡率为33.7%, 晚期凋亡率为26.8%). 随着药物浓度增加, GES-1细胞凋亡率亦随之增加(图3, 4).
氯吡格雷作为新型抗血小板药物, 具有抗血小板聚集及抗血栓形成作用[13]. 其作用机制为, 通过选择性地与血小板表面腺苷酸环化酶偶联的二磷酸腺苷(adenosine diphosphate, ADP)受体结合, 阻断ADP对腺苷酸环化酶的抑制作用, 促进血管舒张剂刺激磷蛋白(vasodilator-stimulated phosphoprotein, VASP)的磷酸化, 抑制纤维蛋白原与其血小板受体GPⅡb/Ⅲa结合而发挥作用[14]. 此外, 氯吡格雷还能阻断ADP释放后引起的血小板活化扩增, 从而抑制其他激动剂诱导的血小板聚集. 氯吡格雷对血栓素A2(thromboxane A2, TXA2)、前列环素合成及磷脂酶活性没有影响[15], 因此氯吡格雷对于有阿司匹林抵抗的患者同样有效.
阿司匹林因抑制前列腺素的生成而导致胃肠道黏膜的损害, 已为临床医师所熟知. 但是氯吡格雷对人胃肠道黏膜损害的资料报道不多. 氯吡格雷是具有直接的损害胃肠道黏膜作用, 还是仅影响损伤黏膜的修复, 目前尚不明确. 2008年美国心脏学会和美国心脏病学会基金会联合美国胃肠学会共同发布的减少抗血小板药物和非甾体类消炎药物导致胃肠道并发症的专家共识指出[16], 氯吡格雷为ADP受体拮抗剂, 可抑制血管内皮生长因子的释放, 从而延迟了胃溃疡的修复. 氯吡格雷的这种抗血管生长作用可能抑制了胃黏膜糜烂和其他药物或者H.pylori感染所致的小溃疡的愈合. 在酸存在的情况下, 这可能会导致一些较轻的没有临床症状的胃黏膜损害的延迟愈合, 甚至加重成为有明显临床症状的溃疡和出血.
本研究从细胞水平研究氯吡格雷对人胃黏膜上皮细胞是否具有直接损害作用. 利用MTT比色方法了解氯吡格雷对GES-1细胞的剂量及时间毒性情况. 实验结果显示氯吡格雷对GES-1细胞增殖具有明显抑制作用, 并且具有剂量依赖性, 但无时间依赖性. 目前, 国外诸多有关氯吡格雷相关性胃肠道损害的临床病例对照研究[17-20]中, 患者所服氯吡格雷药物剂量通常为75 mg/d. 氯吡格雷对上消化系损害的剂量及时间毒性情况, 尚需要更多大规模多中心随机对照临床研究, 以补充循证医学的证据. IC50[21]是指在用药后存活的细胞数量减少一半时所需的药物浓度. 安全浓度IC90是指用药后细胞的存活率≥90%的药物浓度. 根据Bliss创建的加权机率单位法, 采用SPSS软件计算得出氯吡格雷作用24、48和72 h的IC50分别为0.36、0.51和0.35 mmol/L, 此浓度与临床常规负荷给药剂量(300 mg)后血药浓度大致相当. 根据氯吡格雷的药代动力学, 多次口服氯吡格雷75 mg以后, 其羧酸盐衍生物血药浓度约在1 h后达峰(3 mg/L). 由Bliss法求出氯吡格雷作用24、48和72 h安全浓度IC90分别为0.08、0.16和0.08 mmol/L, 与临床常规口服剂量(75 mg)下的血药浓度相符. 实验从细胞学角度证实氯吡格雷推荐剂量75 mg/d, 绝大多数患者耐受良好, 在达到抗栓疗效的同时, 最大可能地降低出血等副作用风险. 为了研究氯吡格雷对GES-1细胞凋亡的影响, 我们对药物作用后的细胞进行流式细胞仪Annexin V FITC/PI双染法检测. 结果显示随着药物浓度增加, GES-1细胞凋亡率亦随之增加.
本研究证明, 氯吡格雷对人胃黏膜上皮细胞具有直接损害作用, 呈剂量依赖性, 诱导细胞发生凋亡. 因此, 临床医师应提高对氯吡格雷相关性上消化道出血等并发症的认识, 对需要服用氯吡格雷等抗血小板药物的患者, 应首先评估胃肠道损害风险, 且事先预防优于事后补救.
氯吡格雷作为新型噻吩吡啶类药物, 其应用于心脑血管疾病的治疗已逾十年. 最近, 随着质子泵抑制剂(PPI)在预防氯吡格雷相关的胃肠道损害中心血管事件发生率和死亡率的升高, 氯吡格雷对胃肠道的损害引起了临床医师的广泛关注.
李勇, 副教授, 上海中医药大学附属市中医医院消化科
氯吡格雷对人胃肠道黏膜损害的资料报道不多. 氯吡格雷是具有独立的损害胃肠道黏膜作用, 还是仅影响出血黏膜的修复, 目前尚不明确.
Lanas等的1项临床病例对照研究发现, 使用氯吡格雷75 mg/d者胃肠道出血风险(校正危险比为2.8, 95%CI: 1.9-4.2)与使用阿司匹林100 mg/d者出血风险(校正危险比为2.7, 95%CI: 2.0-3.6)相当. Chan等的1项前瞻性、随机、双盲临床试验显示阿司匹林联合埃索美拉唑组与氯吡格雷组相比, 再发上消化道事件的比率显著降低(0.7% vs 8.6%).
本研究从细胞水平证实氯吡格雷对人胃黏膜上皮细胞具有直接损害作用, 呈剂量依赖性, 诱导细胞发生凋亡.
临床医师应提高对氯吡格雷相关性上消化道出血等并发症的认识, 对需要服用氯吡格雷等抗血小板药物的患者, 应首先评估胃肠道损害风险, 且事先预防优于事后补救.
本文思路清晰, 实验设计合理, 技术手段以及统计学方法使用恰当, 具有一定的科学性.
编辑: 李军亮 电编:何基才
| 1. | Durand-Zaleski I, Bertrand M. The value of clopidogrel versus aspirin in reducing atherothrombotic events: the CAPRIE study. Pharmacoeconomics. 2004;22 Suppl 4:19-27. [PubMed] [DOI] |
| 2. | Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345:494-502. [PubMed] [DOI] |
| 3. | Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, Malmberg K, Rupprecht H, Zhao F, Chrolavicius S. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet. 2001;358:527-533. [PubMed] [DOI] |
| 4. | Steinhubl SR, Berger PB, Mann JT 3rd, Fry ET, DeLago A, Wilmer C, Topol EJ. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002;288:2411-2420. [PubMed] [DOI] |
| 5. | Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, Rumsfeld JS. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA. 2009;301:937-944. [PubMed] [DOI] |
| 6. | Juurlink DN, Gomes T, Ko DT, Szmitko PE, Austin PC, Tu JV, Henry DA, Kopp A, Mamdani MM. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ. 2009;180:713-718. [PubMed] [DOI] |
| 7. | Gilard M, Arnaud B, Le Gal G, Abgrall JF, Boschat J. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin. J Thromb Haemost. 2006;4:2508-2509. [PubMed] [DOI] |
| 8. | Fontana P, Senouf D, Mach F. Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochrome P450 2C19*2 allele on clopidogrel responsiveness. Thromb Res. 2008;121:463-468. [PubMed] [DOI] |
| 9. | Small DS, Farid NA, Payne CD, Weerakkody GJ, Li YG, Brandt JT, Salazar DE, Winters KJ. Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel. J Clin Pharmacol. 2008;48:475-484. [PubMed] [DOI] |
| 12. | 韩 向晖, 陈 珺明, 张 莉, 王 淼, 王 磊, 郑 培永, 季 光. 清肝活血方对酒精性肝损伤大鼠内质网应激反应性凋亡基因表达的影响. 世界华人消化杂志. 2009;17:1279-1285. [DOI] |
| 13. | Cavusoglu E, Cheng J, Bhatt R, Kunamneni PB, Marmur JD, Eng C. Clopidogrel in the management of ischemic heart disease. Heart Dis. 2003;5:144-152. [PubMed] [DOI] |
| 15. | Vane JR, Botting RM. The mechanism of action of aspirin. Thromb Res. 2003;110:255-258. [PubMed] [DOI] |
| 16. | Bhatt DL, Scheiman J, Abraham NS, Antman EM, Chan FK, Furberg CD, Johnson DA, Mahaffey KW, Quigley EM, Harrington RA. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2008;52:1502-1517. [PubMed] [DOI] |
| 17. | Lanas A, García-Rodríguez LA, Arroyo MT, Gomollón F, Feu F, González-Pérez A, Zapata E, Bástida G, Rodrigo L, Santolaria S. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006;55:1731-1738. [PubMed] [DOI] |
| 18. | Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, Andersen M, Lassen AT. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006;333:726. [PubMed] [DOI] |
| 19. | Diener HC, Bogousslavsky J, Brass LM, Cimminiello C, Csiba L, Kaste M, Leys D, Matias-Guiu J, Rupprecht HJ. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet. 2004;364:331-337. [PubMed] [DOI] |
| 20. | Bhatt DL, Topol EJ. Clopidogrel added to aspirin versus aspirin alone in secondary prevention and high-risk primary prevention: rationale and design of the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance (CHARISMA) trial. Am Heart J. 2004;148:263-268. [PubMed] [DOI] |