修回日期: 2010-11-19
接受日期: 2010-11-23
在线出版日期: 2010-12-28
目的: 观察脑室内注射瘦素对大鼠胃肠运动的影响.
方法: ♀SD大鼠52只(180-220 g), 将大鼠随机分为对照组和瘦素干预组, 根据干预的时间再分为1、3、5 h 3个亚组. 实验前1 wk行侧脑室置管, 在无麻醉状态下每只老鼠从侧脑室注射瘦素3.5 g/L, 对照组注射等量生理盐水. 大鼠(n = 28, 每组n = 7)处死前15 min以500 mg/L的酚红溶液2 mL灌胃, 取出整个鼠胃, 以蒸馏水冲洗胃内容物, 定容为20 mL, 加入20 mL 0.5 mol/L NaOH搅拌混匀, 取上清液以分光光度计于560 nm波长处测定吸光度值, 计算胃排空率. 大鼠(n = 24, 每组n = 6)处死前15 min给予5%炭粉混悬液灌胃, 计算无张力下小肠推进指数.
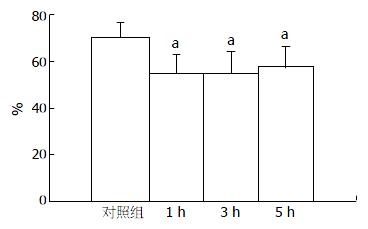
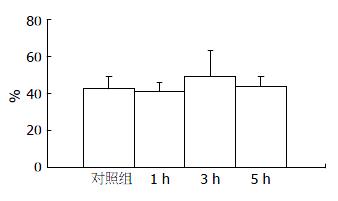
结果: 瘦素给药1、3、5 h胃排空率低于对照组, 差异有统计学意义(54.7%±8.3%, 54.6%±9.3%, 57.4%±8.9% vs 70.0%±6.1%, 均P<0.05). 瘦素给药各亚组之间相比, 差异无统计学意义. 瘦素1、3、5 h小肠推进率分别为41.1%±4.9%、49.5%±13.6%、43.6%±5.5%, 与对照组(43.0%±6.3%)相比, 差异无统计学意义.
结论: 给大鼠侧脑室微量注射瘦素抑制了大鼠的胃排空, 对大鼠的小肠推进率却没有影响.
引文著录: 赵艳军, 吴瑞芹, 乔跃兵, 刘凤芹, 李学良, 林琳, 李炳庆. 脑室内注射瘦素对大鼠胃肠运动的影响. 世界华人消化杂志 2010; 18(36): 3896-3899
Revised: November 19, 2010
Accepted: November 23, 2010
Published online: December 28, 2010
AIM: To investigate whether injection of leptin into the lateral cerebral ventricle has impact on gastrointestinal motility in rats.
METHODS: Fifty-two female Sprague-Dawley rats were randomly divided into two groups: normal control group and leptin group. The leptin group was further divided into three subgroups for detection at 1, 3, and 5 h. For intracerebroventricular infusion, a guide cannula was fixed into the lateral cerebral ventricle one week before the experiment. Under no anesthesia, leptin (3.5 g/L) was injected into the lateral cerebral ventricle through the implanted guide cannula. Equal volume of saline was injected as a control. After the injection, rats were subjected to measurement of the rate of gastric emptying and the rate of intestinal transit.
RESULTS: The rate of gastric emptying decreased more significantly in the three leptin subgroups than in the normal control group (54.7% ± 8.3%, 54.6% ± 9.3%, 57.4% ± 8.9% vs 70.0% ± 6.1%, all P <0.05). However, there is no significant difference in the rate of intestinal transit between the leptin subgroups and normal control group (41.1% ± 4.9%, 49.5% ± 13.6%, 43.6% ± 5.5% vs 43.0% ± 6.3%, all P > 0.05).
CONCLUSION: Intracerebroventricular injection of leptin inhibits gastric emptying but has no effect on intestinal transit in rats.
- Citation: Zhao YJ, Wu RQ, Qiao YB, Liu FQ, Li XL, Lin L, Li BQ. Intracerebroventricular injection of leptin inhibits gastric emptying but has no effect on intestinal transit in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3896-3899
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3896.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3896
瘦素是一种主要由白色脂肪组织分泌的蛋白质类激素, 他是肥胖(obese, ob)基因的编码产物. 1994年美国洛克菲勒大学Friedman领导的实验室成员Zhang等[1]应用定位克隆法(positional cloning)首次从肥胖和糖耐量异常的小鼠成功地克隆了ob基因及人类的同源序列. 瘦素具有广泛的生物学效应, 包括: 抑制下丘脑食欲中枢, 使食欲减退, 能量消耗增加, 从而使体质量下降[2-5]; 参与生殖功能的调节[6]; 具有刺激造血功能的活性[7]; 直接参与血压的调节[8]; 刺激骨髓细胞和改变肾功能[9]. 瘦素通过与瘦素受体结合而发挥调节食物的摄入和能量平衡等生物学功能[1-3,10]. 摄食行为是由胃执行的, 胃的运动控制摄食量[11], 因此瘦素如何调节胃肠运动并控制摄食量是目前研究的重要课题.
动物及动物饲养条件遵照"中华人民共和国实验动物管理条例"和"实验动物质量管理办法"实施, ♀SD大鼠52只. 大鼠脑立体定位仪为淮北正华生物仪器设备有限公司产品, 微量注射器为上海光正医疗仪器有限公司产品. 其余实验材料包括: 脑室置管实验使用的外管(guide cannula)、相配套的内芯(dummy cannula)和内针(internal cannula), 苯酚红, NaOH, 三氯乙酸, 活性炭, 羧甲基纤维素钠, 分光光度计, 离心机, 软尺.
1.2.1 侧脑室置管: 在10%水合氯醛麻醉下(3 mL/kg, 腹腔内注射), 将大鼠固定在脑立体定位仪上, 根据大鼠脑图, 从十字缝后方0.8 mm, 旁开1.5 mm, 深3.5 mm, 在颅盖骨上打开直径约2.0 mm的洞, 置入不锈钢导管(长13.0 mm, 外径0.64 mm, 内经0.39 mm); 用戴帽的不锈钢制导丝(长12 mm, 直径0.33 mm), 插入已经置入的不锈钢导管内用以封闭导管. 另外用2个不锈钢制的螺钉固定在置入导管两侧的头骨上, 用牙科黏合剂与导管固定. 手术后动物自由恢复1 wk.
1.2.2 分组及给药: 将置管恢复后的大鼠随机分为对照组和瘦素干预组, 根据干预的时间再分为1, 3, 5 h亚组, 每组13只(胃排空测定组n = 7, 小肠推进率组n = 6). 大鼠禁食20-24 h后, 在清醒无麻醉状态、稍微限制活动情况下每只老鼠从侧脑室注射瘦素3.5 g/L[1], 将瘦素溶液用微量注射器缓慢注入, 注射时间≥4 min, 留置针头1 min, 然后注入20 g/L的美蓝溶液0.5 μL, 确定注射位置, 药物未注入脑室不列入实验统计数内.
1.2.3 胃排空测定: 给大鼠以500 mg/L酚红溶液2 mL灌胃, 15 min后颈椎脱臼处死. 剖腹, 结扎贲门和幽门, 取出整个鼠胃, 沿胃大弯切开, 以蒸馏水冲洗胃内容物, 定容为20 mL. 加入20 mL 0.5 mol/L NaOH搅拌混匀, 静置1 h. 取5 mL上清液, 加入0.5 mL 20%三氯乙酸去蛋白, 3 500 r/min 4 ℃离心10 min, 取上清液, 以分光光度计于560 nm波长处测定吸光度值. 另取2 mL酚红溶液, 加入18 mL蒸馏水、20 mL 0.5 mol/L NaOH、4 mL 20%三氯乙酸搅拌混匀, 测定吸光度值. 大鼠胃排空率 = (1-实测酚红吸光度值/标准酚红吸光度值)×100%.
1.2.4 小肠推进率测定: 每组大鼠处死前15 min以10 mL/kg体质量给予5%炭粉混悬液(活性炭和羧甲基纤维素钠各5%)灌胃, 剖腹取出全部小肠并计算无张力下小肠推进指数: 炭粉前端至幽门括约肌距离(cm)/幽门括约肌至小肠末段距离(cm)×100%.
统计学处理 所有数据录入SPSS11.0统计软件包, 所有测定值以mean±SD表示, 统计学方法采用方差分析, P<0.05差异有统计学意义.
瘦素给药1, 3, 5 h胃排空率分别为54.7%±8.3%、54.6%±9.3%、57.4%±8.9%, 与对照组(70.0%±6.1%)相比, 差异有统计学意义(P<0.05), 瘦素给药各亚组之间差异无统计学意义(P>0.05, 图1).
瘦素给药1, 3, 5 h小肠推进率分别为41.1%±4.9%、49.5%±13.6%、43.6%±5.5%, 与对照组(43.0%±6.3%)相比, 差异无统计学意义(P>0.05, 图2).
行为学、电生理学及临床研究发现瘦素缺乏将导致机体因摄食过量而肥胖, 证明瘦素是摄食调节和维持机体能量和代谢平衡的极其重要的影响因子[3]. 在摄食过程中, 由食物消化物所激活的迷走神经可将与摄食相关的多种胃肠道信息, 如胃肠的扩张和收缩、十二指肠内的食糜刺激释放的胃肠激素和神经递质信息(如瘦素)传入孤束核和下丘脑. 在整个作用环节中, 瘦素受体及迷走神经等在饱食信号的产生和传递中发挥了重要的作用, 因此瘦素的分泌异常及其受体的改变可能影响胃肠运动. 本研究通过观察侧脑室内注射瘦素对大鼠胃肠运动的影响来进行初步的探讨.
本组给SD大鼠侧脑室注射瘦素, 抑制了大鼠注射后1、3、5 h的胃排空, 这与Smedh等[12]观察到向大鼠第4脑室注射瘦素可以抑制胃排空的结果一致. 瘦素对胃排空的抑制作用, 在中枢主要作用靶器官是下丘脑. 王礼建等[13]向下丘脑外侧区及腹内侧区注射微量瘦素研究对大鼠胃运动的作用, 观察到引起胃排空延迟时胃运动的变化, 研究发现, 当下丘脑内注射瘦素后, 使胃体和胃窦移行性运动复合波Ⅲ相振幅产生剂量反应性抑制, 切断迷走神经则阻断下丘脑瘦素对胃运动的抑制效应. 进一步对于瘦素作用途径的研究, Cakir等[14]通过中枢给药法给SD大鼠注射瘦素, 发现瘦素对胃排空的延迟作用是通过激活肾上腺素能受体途径实现的.
目前已知胃动素、瘦素、酪酷肽以及胰岛素等均可作用于脑干迷走复合体进而影响迷走神经的传出功能, 正是这一激素神经通路参与了对胃肠运动、食欲及摄食功能的调节[15]. 研究证实瘦素具有与胆囊收缩素协同调节小肠运动的作用并且二者可能是通过共同作用于迷走神经调节小肠运动[16,17]. 并且有研究证实肠黏膜中存在瘦素受体[18], 与小肠动力相关的迷走神经也含有瘦素受体[19], 提示瘦素可能与肠动力有关, 但对瘦素调节肠动力的相关研究很少. 本文通过中枢注射给药观察瘦素对大鼠小肠推进率的影响, 与对照组相比, 差异无统计学意义. 这一结果可能与迷走神经虽然支配整个胃肠系统, 但其主要实施对上消化道功能的调控, 迷走神经末梢在胃的分布最为密集, 其次为十二指肠, 随着消化道向下端的延伸, 迷走神经的分布逐渐减少有关.
本实验通过给大鼠侧脑室注射瘦素, 观察对大鼠胃肠运动的影响, 结果表明给大鼠侧脑室微量注射瘦素抑制了大鼠的胃排空, 对大鼠的小肠推进率却没有影响, 这对于瘦素参与胃肠运动调节的研究有一定的价值, 对于瘦素影响胃肠运动的可能机制还需要进一步的研究.
瘦素(Leptin)是一种主要由白色脂肪组织分泌的蛋白类激素, 在调节摄食、体质量、能量消耗和神经内分泌方面发挥着重要的作用.
任超世, 研究员, 中国医学科学院生物医学工程研究所
瘦素通过与瘦素受体结合而发挥调节食物的摄入和能量平衡等生物学功能. 摄食行为是由胃执行的, 胃的运动控制摄食量, 因此瘦素如何调节胃肠运动并控制摄食量是目前研究的重要课题.
本研究中采用中枢给药方式, 给SD大鼠侧脑室注射瘦素, 通过酚红灌胃检测胃排空率, 炭末推进检测小肠推进率, 以此观察侧脑室内注射瘦素对大鼠胃肠运动的影响.
本研究通过给大鼠侧脑室注射瘦素, 观察对大鼠胃肠运动的影响. 对于瘦素参与胃肠运动调节研究有一定的价值, 为瘦素生物学活性的进一步研究奠定了一定的基础.
本文选题恰当, 对于瘦素参与胃肠运动调节研究有一定的价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994;372:425-432. [PubMed] [DOI] |
| 2. | Kamohara S, Burcelin R, Halaas JL, Friedman JM, Charron MJ. Acute stimulation of glucose metabolism in mice by leptin treatment. Nature. 1997;389:374-377. [PubMed] [DOI] |
| 3. | Friedman JM, Halaas JL. Leptin and the regulation of body weight in mammals. Nature. 1998;395:763-770. [PubMed] [DOI] |
| 4. | Ziylan YZ, Baltaci AK, Mogulkoc R. Leptin transport in the central nervous system. Cell Biochem Funct. 2009;27:63-70. [PubMed] [DOI] |
| 5. | Woods SC, D'Alessio DA. Central control of body weight and appetite. J Clin Endocrinol Metab. 2008;93:S37-S50. [PubMed] [DOI] |
| 6. | Mise H, Yura S, Itoh H, Nuamah MA, Takemura M, Sagawa N, Fujii S. The relationship between maternal plasma leptin levels and fetal growth restriction. Endocr J. 2007;54:945-951. [PubMed] [DOI] |
| 7. | Stefanou N, Satra M, Papanikolaou V, Kalala F, Gatselis N, Germenis A, Dalekos GN, Tsezou A. Leptin receptor isoforms mRNA expression in peripheral blood mononuclear cells from patients with chronic viral hepatitis. Exp Biol Med(Maywood). 2006;231:1653-1663. [PubMed] |
| 8. | Brook RD, Bard RL, Bodary PF, Eitzman DT, Rajagopalan S, Sun Y, Depaoli AM. Blood pressure and vascular effects of leptin in humans. Metab Syndr Relat Disord. 2007;5:270-274. [PubMed] [DOI] |
| 9. | Nasri H. The association between serum leptin and blood lymphocytes in hemodialysis patients. Bratisl Lek Listy. 2007;108:122-127. [PubMed] |
| 10. | Laws SC, Stoker TE, Ferrell JM, Hotchkiss MG, Cooper RL. Effects of altered food intake during pubertal development in male and female wistar rats. Toxicol Sci. 2007;100:194-202. [PubMed] [DOI] |
| 11. | 周 吕. 胃肠生理学. 北京: 科学出版社 1991; 165-166. |
| 12. | Smedh U, Håkansson ML, Meister B, Uvnäs-Moberg K. Leptin injected into the fourth ventricle inhibits gastric emptying. Neuroreport. 1998;9:297-301. [PubMed] [DOI] |
| 14. | Cakir B, Kasimay O, Devseren E, Yeğen BC. Leptin inhibits gastric emptying in rats: role of CCK receptors and vagal afferent fibers. Physiol Res. 2007;56:315-322. [PubMed] |
| 16. | Peters JH, Ritter RC, Simasko SM. Leptin and CCK selectively activate vagal afferent neurons innervating the stomach and duodenum. Am J Physiol Regul Integr Comp Physiol. 2006;290:R1544-R1549. [PubMed] [DOI] |
| 17. | Gaigé S, Abysique A, Bouvier M. Effects of leptin on cat intestinal motility. J Physiol. 2003;546:267-277. [PubMed] [DOI] |
| 18. | Iñigo C, Patel N, Kellett GL, Barber A, Lostao MP. Luminal leptin inhibits intestinal sugar absorption in vivo. Acta Physiol(Oxf). 2007;190:303-310. [PubMed] [DOI] |
| 19. | Buyse M, Ovesjö ML, Goïot H, Guilmeau S, Péranzi G, Moizo L, Walker F, Lewin MJ, Meister B, Bado A. Expression and regulation of leptin receptor proteins in afferent and efferent neurons of the vagus nerve. Eur J Neurosci. 2001;14:64-72. [PubMed] [DOI] |