修回日期: 2010-11-09
接受日期: 2010-11-17
在线出版日期: 2010-12-28
目的: 探讨T淋巴瘤侵袭转移诱导因子1(Tiam1)及Rac GTP酶激活蛋白1(Rac1)的表达与食管鳞癌发生发展、浸润转移的关系.
方法: 62例食管癌手术切除标本于2006-02-26/03-16取自食管癌高发区河南省安阳市肿瘤医院. 应用免疫组织化学SP法检测62例食管鳞癌组织、20例癌旁不典型增生组织及20例正常食管黏膜组织中Tiam1及Rac1蛋白表达.
结果: 食管鳞癌组织中Tiam1蛋白表达与癌的组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2 = 8.779, 7.680, 4.502, 4.987; 均P<0.05); 在食管鳞癌癌变过程中Tiam1蛋白表达在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为5.0%(3/20)、55.0%(11/20)、72.6%(45/62), 组间比较有明显差异(χ2 = 20.643, P<0.05); Rac1蛋白表达也与癌的组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2 = 8.652, 6.884, 8.276, 6.371; 均P<0.05); Rac1蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为25.0%(5/20)、70.0%(14/20)、70.0%(44/62), 组间比较有明显差异(χ2 = 14.245, P<0.05). Tiam1及Rac1的表达呈正相关关系(γp = 0.642, P<0.05).
结论: Tiam1及Rac1可作为食管鳞癌早期诊断和判断预后的辅助指标.
引文著录: 刘帅, 曲蕴慧, 鄢文海. Tiam1和Rac1在食管鳞癌组织中蛋白表达的相关性及临床病理意义. 世界华人消化杂志 2010; 18(36): 3869-3873
Revised: November 9, 2010
Accepted: November 17, 2010
Published online: December 28, 2010
AIM: To detect the expression of T-cell lymphoma invasion and metastasis factor1 (Tiam1) and Rac GTPase activating protein 1 (Rac1) proteins in esophageal squamous cell carcinoma (ESCC) and to analyze their correlation with the development, progression, invasion and metastasis of ESCC.
METHODS: The expression of TIAM1 and Rac1 proteins was detected by immunohistochemistry in 62 ESCC specimens, 20 tumor-adjacent atypical hyperplastic epithelial specimens, and 20 normal esophageal epithelial specimens.
RESULTS: The expression of Tiam1 protein was closely correlated with tumor grade, infiltration, lymph node metastasis, and TNM grade in ESCC (χ2 = 8.779, 7.680, 4.502 and 4.987, all P < 0.05). There is a significant difference in the positive rate of Tiam1 protein expression among normal esophageal epithelium, tumor-adjacent atypical hyperplastic epithelium and carcinoma [15.0% (3/20), 55.0% (11/20) and 72.6% (45/62), respectively; χ2 = 20.643, P < 0.05]. The expression of Rac1 protein was closely correlated with tumor grade, infiltration, lymph node metastasis, and TNM grade in ESCC (χ2 = 8.652, 6.884, 8.276 and 6.371, all P < 0.05). There is a significant difference in the positive rate of Rac1 protein expression among normal esophageal epithelium, adjacent atypical hyperplastic epithelium and carcinoma [25.0% (5/20), 70.0% (14/20) and 70.0% (44/62), respectively; χ2 = 57.621, P < 0.01]. There is a positive correlation between the expression of Tiam1 and Rac1 proteins (γp = 0.642, P < 0.05).
CONCLUSION: Combined detection of Tiam1 and Rac1 expression can be used for early diagnosis and prognostic evaluation of ESCC.
- Citation: Liu S, Qu YH, Yan WH. Clinicopathological significance of Tiam1 and Rac1 protein expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3869-3873
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3869.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3869
T淋巴瘤侵袭转移诱导因子1(T lymphoma invasion and metastasis factor 1, Tiam1)是新近发现的一种原癌基因, 由BW5147小鼠T淋巴瘤细胞高侵袭变异株中分离鉴定, 故命名为Tiam1基因[1]. 可以调节细胞骨架结构重组, 影响细胞的形体极化过程, 促进细胞运动和迁移, 参与基因表达调控、细胞增殖与凋亡等生物学功能[2-4]. Rho家族(Ras homologue family)是与肿瘤侵袭、转移密切相关的小G蛋, Rac GTP酶激活蛋白1(Rac GTPase activating protein 1, Rac1)则是其重要成员之一[5,6]. 有关Tiam1与Rac1与食管癌浸润转移的关系及二者表达相关性的研究, 迄今国内外均未见报道. 我们采了用免疫组织化学SP法系统地检测了Tiam1与Rac1基因在62例食管鳞癌组织、20例癌旁不典型增生组织及20例正常食管黏膜组织的表达情况, 探讨Tiam1与Rac1在食管癌演变过程中的作用, 以期寻找食管癌早期诊断和判断预后的分子指标.
62例食管癌手术切除标本于2006-02-26/03-16取自食管癌高发区河南省安阳市肿瘤医院(所有62例食管癌患者均知情并同意且经医院伦理委员会批准), 所有病例术前均无化疗、放疗及免疫治疗史. 其中男36例, 女26例, 年龄38-75(平均60.6±9.5)岁. 全部病理组织学证实均为鳞状细胞癌. 其中组织学分级Ⅰ级15例, Ⅱ级25例, Ⅲ级22例; 伴淋巴结转移者20例, 无淋巴结转移者42例. 浸润深度分2组, 浸达浅层者(包括黏膜层、黏膜下层及浅肌层)7例, 浸达深者(包括深肌层及纤维膜). 全部样本分别在癌灶、癌旁3 cm以内及远端正常黏膜组织3处取材, 经40 g/L多聚甲醛液固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE和免疫组织化学染色. 兔抗人多克隆Tiam1抗体及鼠抗人Rac1单克隆抗体均购自美国Santa Cruz公司, SP免疫组织化学试剂盒购自北京中杉金桥生物技术开发公司.
1.2.1 免疫组织化学染色: 采用SP法, Tiam1与Rac1单抗稀释, 稀释倍数分别为1:100和1:120, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗体作为阴性对照.
1.2.2 结果判定方法: Tiam1与Rac1蛋白阳性信号均呈棕黄色颗粒样物质, 主要位于细胞质内. 高倍镜下随机选取5个视野(每个视野观察细胞数≥200个), 按阳性细胞所占百分比及着色深浅进行结果判定[7,8]. (1)按阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分, >70%为3分; (2)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. 取(1)(2)两项评分的乘积作为总积分, 0-1分为阴性(-), >1分为阳性(+).
统计学处理 应用SPSS13.0统计学软件, 采用χ2检验. 检验水准α = 0.05.
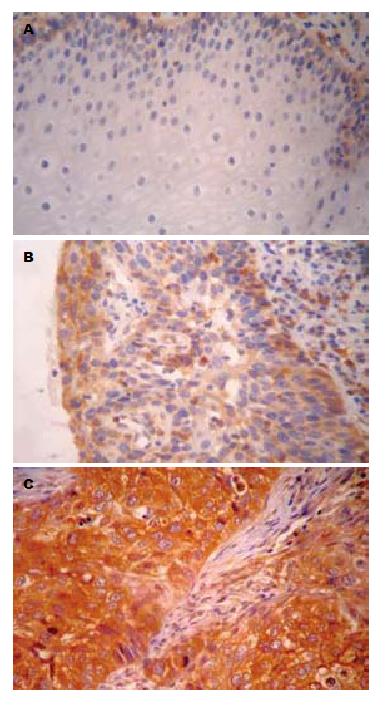
Tiam1蛋白阳性表达主要位于肿瘤细胞的胞质中, 呈浅黄色至深黄色颗粒(图1). 在食管鳞癌癌变过程中Tiam1蛋白表达在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为15.0%(3/20)、55.0%(11/20)、72.6%(45/62), 组间比较有明显差异(χ2 = 20.643, P<0.05, 表1). Tiam1蛋白表达与食管鳞癌组织学分级、浸润深度、淋巴结转移及TNM分期均有关(χ2 = 8.779, 7.680, 4.502, 4.987, 均P<0.05, 表2).
| Tiam1 | χ2值 | P值 | Rac1 | χ2值 | P值 | ||||||
| n | -(n) | +(n) | 阳性率n(%) | -(n) | +(n) | 阳性率n(%) | |||||
| 正常黏膜上皮组织 | 20 | 17 | 3 | 15.0 | 20.643 | 0.000 | 15 | 5 | 25.0 | 14.245 | 0.001 |
| 非典型增生组织 | 20 | 9 | 11 | 55.0 | 6 | 14 | 70.0 | ||||
| 鳞癌组织 | 62 | 17 | 45 | 72.6 | 18 | 44 | 71.0 | ||||
| 病理特征 | n | Tiam1 | Rac1 | ||||
| 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | ||
| 组织学分级 | |||||||
| Ⅰ | 15 | 7(46.7) | 8.779 | 0.012 | 7(73.3) | 8.652 | 0.013 |
| Ⅱ | 25 | 18(68.0) | 17(68.0) | ||||
| Ⅲ | 22 | 20(86.4) | 20(72.7) | ||||
| 浸润深度 | |||||||
| 浅层 | 7 | 2(28.6) | 7.680 | 0.006 | 2(28.6) | 6.884 | 0.009 |
| 深层 | 55 | 43(78.2) | 42(76.4) | ||||
| 淋巴结转移 | |||||||
| 无 | 42 | 27(64.3) | 4.502 | 0.034 | 25(54.2) | 8.276 | 0.004 |
| 有 | 20 | 18(90.0) | 19(85.7) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 26 | 15(57.7) | 4.987 | 0.026 | 14(53.8) | 6.371 | 0.012 |
| Ⅲ、Ⅳ | 36 | 30(83.3) | 30(83.3) | ||||
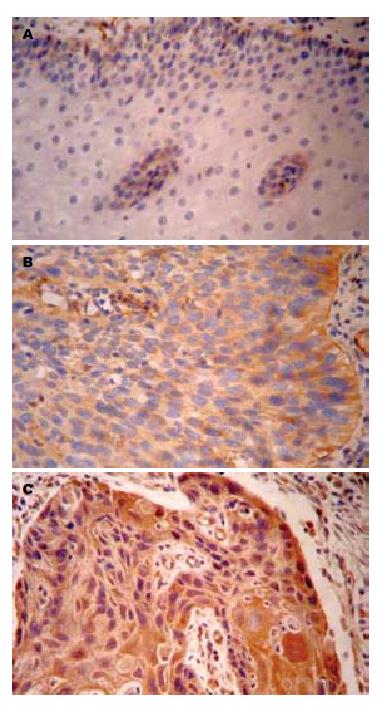
Rac1蛋白阳性着色定位于细胞质内, 呈棕黄色或深黄色颗粒(图2). 在食管鳞癌癌变过程中Rac1蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次升高, 分别为25.0%(5/20)、70.0%(14/20)、71.0%(44/62), 组间比较有明显差异(χ2 = 14.245, P<0.01, 表1). Rac1蛋白阳性表达率与食管鳞癌组织学分级、浸润深度、淋巴结转移及TNM分期均密切相关(χ2 = 8.652, 6.884, 8.276, 6.371; 均P<0.05, 表2).
恶性肿瘤的侵袭和转移是肿瘤细胞与宿主细胞和间质之间的一个多步骤、多基因参与的非常复杂的过程, 主要是因为癌基因的功能增强、突变和抑癌基因的功能的缺失、突变所导致的. 人类Tiam1基因位于21q22.1带, 含有2个7.3 kb外显子, 被一个14 kb内含子分隔. 该基因含5 521个碱基, 其编码产物的相对分子质量为177×103, 由1 591个氨基酸残基组成的蛋白质, 属于Dbl家族成员(diffuse B2 cell lymphoma oncogene family)[9,10]. Tiam1在鼠的脑和睾丸组织中呈高表达, 在其他组织如心、肺、肝、脾、肾、胸腺、淋巴结、唾液腺中低度表达或不表达, 在人的肝细胞、肾小管上皮细胞、支气管上皮细胞、心肌细胞中低度表达, 在平滑肌细胞中呈中度表达, 在其他正常组织中不表达[11]. 近年研究显示Tiam1在肝癌[9]、鼻咽癌[12]、胃癌[13]、前列腺癌[14]等多种恶性肿瘤组织中呈阳性表达并与其分化程度、侵袭转移密切相关.
Rho家族是与肿瘤侵袭、转移密切相关的小G蛋白, Rac1是其家族中的重要成员之一[5,6]. Rac1蛋白存在Rac1-GDP(失活状态)和Rac1-GTP(激活状态)两种形式[15]. Rac1的生物功能发挥依赖于此两种活性形式间的转换, 且具有调节细胞骨架重组, 影响细胞形体极化, 促进细胞运动与迁移, 抑制细胞凋亡的作用[16]. Rac1可通过激活Ⅳ型胶原酶MMP-2, 并上调Ⅰ型胶原酶的表达, 促进细胞外基质降解, 从而增强肿瘤细胞侵袭穿透能力; 也可以通过调节NF-κB活性并增加细胞内超氧化物阴离子浓度进而抑制肿瘤细胞凋亡的发生[17,18].
Tiam1基因能够调节E钙黏附素介导的细胞黏附, 并与Rho一起参与黏附复合物的组装, 诱导T淋巴瘤的侵袭. Tiam1基因表达产物还能促进整合素介导的异型细胞之间、细胞与基质之间的相互作用. Tiam1定位于细胞间的黏附处, 共同定位的还有E-cadherin等黏附复合物; 在细胞作用底物为胶原蛋白Ⅰ时, 细胞表现为运动性增强, Tiam1定位于膜皱褶和胞质. 因此, 底物通过影响Tiam1的定位, 直接或间接的调节着Rac1的活性, 决定着细胞黏附或是运动. 而肿瘤细胞的黏附和迁移运动活性的交替变换对肿瘤的侵袭转移是至关重要的[13].
本研究结果显示, Tiam1及Rac1在食管鳞癌组织中的表达远高于其在相对应的癌旁不典型增生组织及正常食管黏膜内, 说明Tiam1及Rac1高表达的食管鳞癌具有更强的侵袭能力. 本试验还发现, 随食管鳞癌组织的分化程度的降低、浸润深度的增加、TNM分期的增加及伴有淋巴结转移的发生, Tiam1蛋白染色阳性率呈逐渐增强趋势, 组间比较差异具有统计学意义(P<0.05). 我们推测Tiam1是Rac1的特异性鸟昔酸转换因子, 能够促进GDP的释放以及GTP的结合, 进而激活Rac1, 再经激酶等信号分子转导, 激活下游分子, 实现调节细胞骨架结构重组, 影响细胞的形体极化过程, 促进细胞运动和迁移, 诱导肿瘤细胞的侵袭转移, 参与基因表达调控、细胞增殖与凋亡等. Tiam1及Rac1蛋白表达呈正相关关系提示了二者在食管鳞癌发生发展过程中可能起到了协同作用. 联合检测Tiam1及Rac1蛋白的表达有利于我们进一步地了解食管癌的生物学行为, 为食管鳞癌的早期诊断和治疗提供一个新的途径.
Tiam1可以调节细胞骨架结构重组, 影响细胞的形体极化过程, 促进细胞运动和迁移, 参与基因表达调控、细胞增殖与凋亡等生物学功能.
张青云, 研究员, 北京大学临床肿瘤学院北京肿瘤医院检验科
关于Tiam1及Rac1在食管鳞癌发生发展中的作用国内外尚未见报道. 关于Tiam1及Rac1与恶性肿瘤关系的研究已成为热点.
本文首次采用免疫组织化学法检测了食管癌高发区河南安阳的食管癌患者手术切除的癌组织Tiam1及Rac1蛋白的表达情况.
联合检测Tiam1及Rac1蛋白表达可望成为食管鳞癌早期诊断、判断预后的分子指标之一.
本文实验设计较合理, 对食管鳞癌的诊断及预后有一定的参考意义.
编辑: 李薇 电编:何基才
| 1. | Habets GG, Scholtes EH, Zuydgeest D, van der Kammen RA, Stam JC, Berns A, Collard JG. Identification of an invasion-inducing gene, Tiam-1, that encodes a protein with homology to GDP-GTP exchangers for Rho-like proteins. Cell. 1994;77:537-549. [PubMed] |
| 2. | Woodcock SA, Rushton HJ, Castañeda-Saucedo E, Myant K, White GR, Blyth K, Sansom OJ, Malliri A. Tiam1-Rac signaling counteracts Eg5 during bipolar spindle assembly to facilitate chromosome congression. Curr Biol. 2010;20:669-675. [PubMed] [DOI] |
| 3. | Masuda M, Maruyama T, Ohta T, Ito A, Hayashi T, Tsukasaki K, Kamihira S, Yamaoka S, Hoshino H, Yoshida T. CADM1 interacts with Tiam1 and promotes invasive phenotype of human T-cell leukemia virus type I-transformed cells and adult T-cell leukemia cells. J Biol Chem. 2010;285:15511-15522. [PubMed] [DOI] |
| 4. | Rajagopal S, Ji Y, Xu K, Li Y, Wicks K, Liu J, Wong KW, Herman IM, Isberg RR, Buchsbaum RJ. Scaffold proteins IRSp53 and spinophilin regulate localized Rac activation by T-lymphocyte invasion and metastasis protein 1 (TIAM1). J Biol Chem. 2010;285:18060-18071. [PubMed] [DOI] |
| 5. | Lee CS, Choi CK, Shin EY, Schwartz MA, Kim EG. Myosin II directly binds and inhibits Dbl family guanine nucleotide exchange factors: a possible link to Rho family GTPases. J Cell Biol. 2010;190:663-674. [PubMed] [DOI] |
| 6. | Wang J, Lu W, Wen T. Silencing of Rho-GDIgamma by RNAi promotes the differentiation of neural stem cells. Methods Mol Biol. 2010;650:111-120. [PubMed] [DOI] |
| 7. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 8. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 9. | Choi Y, Kim H, Chung H, Hwang JS, Shin JA, Han IO, Oh ES. Syndecan-2 regulates cell migration in colon cancer cells through Tiam1-mediated Rac activation. Biochem Biophys Res Commun. 2010;391:921-925. [PubMed] [DOI] |
| 10. | Xing J, Birukova AA. ANP attenuates inflammatory signaling and Rho pathway of lung endothelial permeability induced by LPS and TNFalpha. Microvasc Res. 2010;79:56-62. [PubMed] [DOI] |
| 11. | Woodcock SA, Jones RC, Edmondson RD, Malliri A. A modified tandem affinity purification technique identifies that 14-3-3 proteins interact with Tiam1, an interaction which controls Tiam1 stability. J Proteome Res. 2009;8:5629-5641. [PubMed] [DOI] |
| 12. | Qi Y, Huang B, Yu L, Wang Q, Lan G, Zhang Q. Prognostic value of Tiam1 and Rac1 overexpression in nasopharyngeal carcinoma. ORL J Otorhinolaryngol Relat Spec. 2009;71:163-171. [PubMed] [DOI] |
| 13. | Walch A, Seidl S, Hermannstädter C, Rauser S, Deplazes J, Langer R, von Weyhern CH, Sarbia M, Busch R, Feith M. Combined analysis of Rac1, IQGAP1, Tiam1 and E-cadherin expression in gastric cancer. Mod Pathol. 2008;21:544-552. [PubMed] [DOI] |
| 14. | Engers R, Mueller M, Walter A, Collard JG, Willers R, Gabbert HE. Prognostic relevance of Tiam1 protein expression in prostate carcinomas. Br J Cancer. 2006;95:1081-1086. [PubMed] [DOI] |
| 15. | Miroshnychenko DO, Teleheiev HD, Maliuta SS. [Analysis of GEF activity of Bcr protein DH domain]. Ukr Biokhim Zh. 2007;79:116-121. [PubMed] |
| 16. | Ho HH, Chang CS, Ho WC, Liao SY, Wu CH, Wang CJ. Anti-metastasis effects of gallic acid on gastric cancer cells involves inhibition of NF-kappaB activity and downregulation of PI3K/AKT/small GTPase signals. Food Chem Toxicol. 2010;48:2508-2516. [PubMed] [DOI] |
| 17. | Hwang YP, Yun HJ, Kim HG, Han EH, Lee GW, Jeong HG. Suppression of PMA-induced tumor cell invasion by dihydroartemisinin via inhibition of PKCalpha/Raf/MAPKs and NF-kappaB/AP-1-dependent mechanisms. Biochem Pharmacol. 2010;79:1714-1726. [PubMed] [DOI] |
| 18. | Yang SF, Chen MK, Hsieh YS, Yang JS, Zavras AI, Hsieh YH, Su SC, Kao TY, Chen PN, Chu SC. Antimetastatic effects of Terminalia catappa L. on oral cancer via a down-regulation of metastasis-associated proteases. Food Chem Toxicol. 2010;48:1052-1058. [PubMed] [DOI] |