修回日期: 2010-11-28
接受日期: 2010-12-01
在线出版日期: 2010-12-28
目的: 探讨针刺促进术后肠道动力恢复的机制.
方法: 30只SD大鼠随机分为空白组、模型组(行结肠吻合术)、针刺组. 针刺组予每日针刺双侧足三针(足三里、三阴交、太冲), 连续3 d. 观察大鼠排便情况, 测量小肠推进率, 观察结肠组织Cajal间质细胞(interstitial cells of Cajal, ICC)超微结构和胆碱能神经-ICC-平滑肌细胞网络结构.
结果: 针刺组术后首次排便时间较模型组提前, 小肠推进率提高(2.00 d±0.47 d vs 2.50 d±0.53 d, 66.30%±4.21% vs 46.33%±5.56%, P<0.05). 与空白组比较, 模型组ICC超微结构损伤明显, 胆碱能神经-ICC-平滑肌细胞网络结构紊乱, ICC和小泡乙酰胆碱转移体(VAChT)阳性神经纤维数量明显减少(18.67±6.11 vs 32.33±5.51, 18.67±3.79 vs 20.67±3.21, P<0.05) 荧光强度减弱(35.00±9.54 vs 58.67±10.21, 20.33±5.13 vs 34.67±6.81, P<0.05). 而针刺组ICC超微结构损伤较模型组轻, 网络样结构维持, ICC和VAChT阳性神经纤维的数量较模型组增多(30.33±3.21 vs 18.67±6.11, 23.00±4.58 vs18.67±3.79, P<0.05), 荧光强度增强(56.67±9.45 vs 35.00±9.54, 36.00±8.19 vs 20.33±5.13, P<0.05).
结论: 针刺能促进结肠吻合术后肠动力的恢复, 这可能与其具有修复ICC超微结构, 促进ICC细胞及其网络结构再生的功能有关.
引文著录: 邓晶晶. 针刺对结肠吻合术后Cajal间质细胞修复与再生的影响. 世界华人消化杂志 2010; 18(36): 3863-3868
Revised: November 28, 2010
Accepted: December 1, 2010
Published online: December 28, 2010
AIM: To explore the mechanism by which acupuncture promotes intestinal motility.
METHODS: Thirty Sprague-Dawley rats were randomly divided into blank group, model group (receiving colocolic anastomosis) and acupuncture group. The acupuncture group underwent acupuncture at Zusanli, Sanyinjiao and Taichong daily for three continuous days. After acupuncture treatment, defecation was observed and intestinal propulsive rate was measured. Tissue samples of the colon which was 2 cm below the caecum were taken to observe the ultrastructure of interstitial cells of Cajal (ICC) and the Ache-ICC-SMC network.
RESULTS: In the acupuncture group, the time to first postoperative passage of feces was shortened and intestinal propulsive rate was improved compared with the model group [(2.00 ± 0.47) d vs (2.50 ± 0.53) d, (66.30 ± 4.21)% vs (46.33 ± 5.56)% , both P < 0.05]. Compared with the blank group, the damage of ICC ultrastructure in the model group was more significant while that in the acupuncture group was milder. In the model group, the ENS-ICC-SMC structure was disorganized, and the number of ICC and their fluorescence intensity were greatly decreased compared with the blank group [(18.67 ± 6.11) vs(32.33 ± 5.51), (35.00 ± 9.54) vs (58.67 ± 10.21), both P < 0.05]. In contrast, in the acupuncture group, the damage of the network structure was milder, and the number of ICC and their fluorescence intensity were increased compared with the model group [(30.33 ± 3.21) vs (18.67 ± 6.11), (56.67 ± 9.45) vs (35.00 ± 9.54), both P < 0.05]. Similar results were also obtained for the number of VAChT-positive nerve fibres [(18.67 ± 3.79) vs (20.67 ± 3.21), (20.33 ± 5.13) vs (34.67 ± 6.81), (23.00 ± 4.58) vs (18.67 ± 3.79), (36.00 ± 8.19) vs (20.33 ± 5.13), all P < 0.05].
CONCLUSION: Acupuncture can improve intestinal motility in rats after abdominal operation perhaps by improving the repair and regeneration of ICC.
- Citation: Deng JJ. Acupuncture improves the repair and regeneration of interstitial cells of Cajal in rats after enteroenterostomy. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3863-3868
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3863.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3863
术后肠麻痹是外科常见的并发症之一. 相关研究表明[1], 肠道术后, 胃肠起搏细胞Cajal间质细胞(interstitial cells of Cajal, ICC)数量明显减少, 结构萎缩, 信号转导功能下降. 本研究在此基础上, 以结肠吻合术大鼠为对象, 探讨针刺对术后ICC结构和数量改变的影响, 分析此影响与针刺调整肠道动力的关系.
小泡乙酰胆碱转移体(vesicular acetylcholine transporter, VAChT)兔抗人、大小鼠多克隆抗体(H-160, Santa Cruz, Biotech, USA, No. sc-15315), c-Kit羊抗人、大小鼠多克隆抗体(M-14, Santa cruz, Biotech, USA, No. sc-1494), 四甲基异硫氰酸罗丹明(tetramethyl rhodamine isothiocynate, TRITC)-牛抗兔IgG抗体(Santa Cruz, Biotech, USA, No. sc-2367), 异硫氰酸荧光素(fluorescein isothiocynate, FITC)-驴抗羊IgG抗体(北京博奥森生物技术有限公司, No. bsF-0294D), 抗荧光衰减封片剂(北京普利莱基因技术有限公司, No. 01210); JEM-1200EX型透射电镜(日本JEOL公司), UCT型超薄切片机(德国LEICA公司), HM550型冷切片机(德国Microm公司), LSM 700激光扫描共聚焦显微镜(德国Zeiss公司), 图像分析软件(Image pro plus), -80 ℃冰箱(日本SANYO公司), 恒温箱(上海跃进医疗仪器厂), 光学显微镜(日本Olympus公司).
1.2.1 分组及造模: SPF级健康SD大鼠30只, 由广州中医药大学动物实验中心提供, 合格证号: 0055935, 雌雄各半, 体质量250-300 g. 将大鼠分为雌雄两组, 每组内再以体质量作为分层因素进行区组随机化, 分为针刺组、模型组、空白组. 结肠吻合模型的制备: 术前禁食禁饮12 h, 10%水合氯醛过滤器(孔径170 μm)过滤后行腹腔注射麻醉(剂量330 mg/kg). 大鼠仰卧位固定, 常规备皮、消毒、铺无菌巾, 下腹部正中切口, 长约2 cm, 开腹后寻找到大鼠盲肠下2 cm处结肠, 切断并原位单层缝合, 连续缝合腹膜及肌层, 间断缝合皮肤. 手术当天禁食禁水, 术后第1、2天流质饮食, 第3天按16-20 g/(只•d)的1/3量供给标准鼠料. 所有动物第4天处死检测指标.
1.2.2 穴位定位与针刺方法: 取双侧足三针(后三里、三阴交、太冲), 定位参考《实验针灸学》. 针刺组动物术后清醒即予针刺, 用0.18 mm×10 mm的美容针直刺入穴位, 每5 min缓慢提插捻转2-3次, 针刺15 min/(次•d), 连续3 d. 模型组、空白组每天同一时间放于固定器中15 min.
1.2.3 排便观察: 观察并记录大鼠术后首次排便时间.
1.2.4 小肠推进率测量: 予碳素墨水灌胃, 每只1 mL, 30 min后处死, 用米尺测量小肠全长(幽门至回盲部)以及标志物在小肠从幽门向前推进的距离(从幽门至炭末前沿的长度). 计算标志物推进的距离占小肠全长的百分比.
1.2.5 电镜标本制作: 迅速用冷刀片取出盲肠下2 cm处结肠组织, 切成0.2 cm×0.5 cm小块. 用多聚甲醛和戊二醛配成的前固定液进行前固定, 漂洗, 锇酸行后固定, 漂洗, 乙醇和丙酮阶梯脱水, 环氧树脂渗透和包埋, 半薄切片, 2%甲苯胺蓝染色, 光镜定位, 修块, 超薄切片, 铀-铅双染色, 透射电镜观察及拍照.
1.2.6 激光共聚焦显微镜检测: 取盲肠下2 cm处结肠组织, Zamboni液中固定, 4 ℃ 6 h, 行冰冻切片, 将切好的冰冻组织切片(厚5 μm)放入冷丙酮固定, PBS冲洗; 用5% BSA(溶于含0.3% TritonX-100的PBST中)封闭1 h; 加入一抗(兔抗VAChT 1:100, 羊抗c-Kit 1:100), 37 ℃孵育1.5 h, 4 ℃过夜, PBS冲洗; 加入二抗(FITC-驴抗羊IgG 1:200, TRITC-牛抗兔IgG 1:200), 37 ℃避光孵育1 h, PBS冲洗; 抗荧光衰减封片剂封片, 镜检观察. 以适于FITC(490 nm)和RBITC(550 nm)的激发波长观测标本, c-Kit阳性荧光为绿色, VAChT阳性荧光为红色. 采用双通道同步扫描, 扫描分辨率1 024 dpi, 每一标本随机选取3个高倍视野, 用图像分析软件进行图像的三维重建和荧光值定量分析.
统计学处理 用SPSS16.0软件进行数据处理.
针刺组术后首次排便时间为2.00 d±0.47 d, 模型组为2.50 d±0.53 d, 采用秩和检验比较, P<0.05. 可见针刺能缩短结肠吻合术后首次排便时间.
模型组小肠推进率较空白组下降, 采用t检验比较, 两者有显著性差异(P<0.05). 针刺组与模型组比较有显著差异(P<0.05), 而针刺组与空白组比较差异不显著(P>0.05, 表1), 表明针刺治疗能提高小肠推进率.
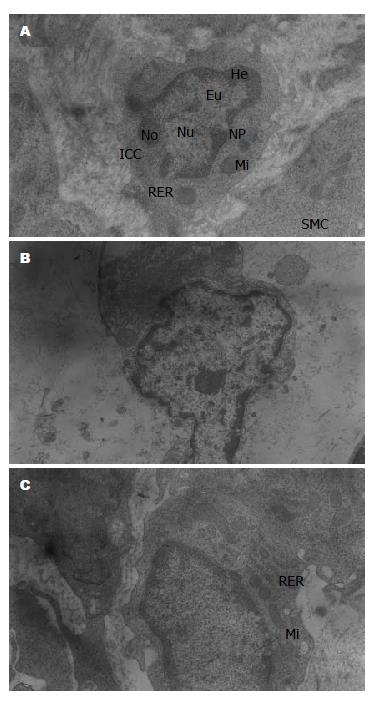
空白组ICC多为梭形或椭圆形, 核大, 不规则或椭圆, 可见核仁、核孔, 常染色质均匀分布于细胞核中央, 异染色质主要分散位于核的周边, 核膜完整; 核周胞质少, 胞质和突起内含丰富的线粒体、核糖体, 发达的内质网和高尔基体; 有较多成束的中间丝和微丝分布在核周和细胞突起, 未见粗肌丝; 胞内可见电致密胞质; 有细胞膜内陷空泡; 基底膜完整. ICC多与神经末梢和神经束伴随存在, 胞体靠近神经纤维, 与神经纤维末梢形成突触样连接(synaptic-like contacts)[2,3]. ICC相互之间、ICC与平滑肌细胞(smooth muscle cell, SMC)间可见缝隙连接(gap junctions)[4,5]. SMC形态及其相互间的缝隙连接正常. 神经纤维末梢与SMC未见紧密连接. 神经-ICC-SMC网络完整(图1A).
模型组ICC核皱缩, 常染色质变少, 分布不均匀, 异染色质趋边, 呈斑块状; 突起明显减少或消失, 许多末梢突起破裂, 失去胞质内容物; 胞质空泡形成, 胞膜泡状化; 胞质内细胞器异常: 线粒体数量减少, 出现肿胀、嵴断裂、溶解、甚至破裂; 内质网扩张, 粗面内质网脱颗粒; 次级溶酶体增多; 许多中间丝排空; 出现大的脂滴和空的膜结合泡; 基底膜缺乏或不完整. 部分细胞胞质内微细结构辨认不清. ICC与神经纤维间的突触样连接缺失, 间距增加, 其内存在大量板层体(lamellar bodies). 神经纤维末梢肿胀, 伴神经递质小泡减少或消失. SMC粗面内质网扩张, 高尔基体肿胀, 出现大量细胞膜内陷空泡. ICC相互间、ICC与SMC间及SMC相互间缝隙连接明显减少或缺如, 尚存的细胞间连接也显示不清. 组织间隙内存在大量液性物质和无序的胶原(图1B).
针刺组ICC核基本保持正常形态, 细胞突起减少但损伤不明显, 异染色质部分趋边; 胞质内细胞器形态结构尚清晰可见, 线粒体、核糖体、内质网和高尔基体数量较多, 少量线粒体肿胀、内质网扩张; 部分微丝从胞质中央向外周漂移; 基底膜维持完整. 少量神经纤维末梢肿胀, 神经递质小泡无明显减少. SMC损伤不明显, 有少量细胞膜内陷空泡. ICC与神经纤维间保持突触样连接; ICC相互间、ICC与SMC间及SMC相互间存在缝隙连接, 无明显间隙; 可见少量板层状体; 组织间隙内存在少量液性物质(图1C).
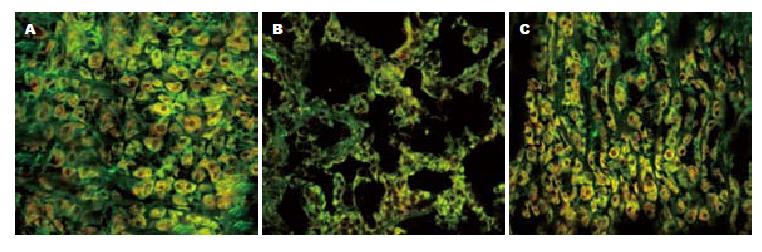
空白组ICC呈梭形, 有数个突触, ICC间通过突触彼此相互连接形成密集的网络样结构. 胆碱能神经纤维也相接成网, 网内的神经节含大量VAChT阳性神经纤维. ICC长的突触与神经纤维平行走行, 短的突触彼此相连并与平滑肌和神经纤维紧密连接, ICC网络包绕着胆碱能神经网络, 胆碱能神经-ICC-SMC网络结构完整(表2, 图2A).
模型组ICC数量较空白组明显减少, 荧光强度减弱(P<0.05). ICC细胞突起不明显, 完整的网络样结构消失, 网络出现大片空缺, ICC之间以及其与平滑肌和神经纤维之间的紧密样连接缺损. 胆碱能神经网状结构严重残缺, 呈片状分布, 神经纤维间的连接大大减少, VAChT阳性神经纤维较空白组减少明显, 荧光强度减弱(P<0.05). ICC与胆碱能神经纤维分布不均匀, 胆碱能神经-ICC-SMC网络结构紊乱(图2B).
针刺组ICC分布较为连续, 保持网络状结构, 细胞突起可见, ICC间及其与平滑肌和神经纤维之间连接较紧密, 无明显的间隙, 细胞的数量以及荧光强度比模型组有所增强(P<0.05). VAChT阳性神经纤维较模型组明显增多, 维持神经网络样结构, 胆碱能神经节之间的连接较为紧密, 荧光强度有所增强(P<0.05). ICC与胆碱能神经纤维间的长突起较模型组也有所增多, 相互间的连接结构较为完整, 胆碱能神经-ICC-SMC网络结构基本得以维持(图2C).
近年来, ICC已成为胃肠起搏机制和一些胃肠动力障碍性疾病研究的热点[6-8]. ICC是胃肠慢波活动的起搏器和传导者, 在胃肠动力的发生与调控中起着重要作用[9-13]. 研究表明, 胃肠内的ICC可根据其分布位置分为ICC-MY(位于环形肌和纵行肌之间)、ICC-IM(位于肌束间)、ICC-DMP(位于环形肌深层内的ICC-IM)和ICC-SM(位于黏膜下层)4类. 其中ICC-MY是主要的起搏细胞, 具有自动产生节律性去极化的功能, 其产生的自发性内向电流为起搏电流, 进而产生慢波[14,15]. ICC-IM也能产生持续放电活动, 形成单位电位(unitary potentials), 并凭借此电位将ICC-MY的起搏信号传递给予自身形成紧密连接的平滑肌[16], 从而完成自发性收缩过程.
ICC的功能实现是以其超微结构和网络结构为基础的. 大量内质网、高尔基体、游离核糖体均参与蛋白质合成, 代谢功能活跃; 丰富的线粒体又保证了其作为胃肠道慢波起搏细胞所需的能量供应[17]; ICC之间、ICC与SMC之间、ICC与神经细胞之间形成的缝隙连接和触突样连接, 使其作为慢波传导者和神经系统控制胃肠平滑肌运动的信息整合中转站的功能得以实现. 肠神经系统运动末梢、肌间丛ICC、SMC三者相互连接成网络, 形成伸展感受器共同感受肠腔内压力的变化, 在膨胀诱发的电位活动及其引发的潜在肠蠕动中起重要作用, 被认为是构成胃肠动力的基本功能单位 (basic functional unit of gastrointestinal motility, BFUGM)[18-22].
作为肠神经作用的首要靶细胞, ICC参与着肠神经系统信号向SMC的传送[23-27]. 相关研究表明[28], 肠道括约肌ICC-IM的丢失将导致该区域肠运动神经传递衰减. 而另一方面, 肠神经系统的信号在肠神经末梢与ICC间的传导又有赖于神经递质担当信使. 乙酰胆碱(acetylcholine, Ach)是肠壁内最主要的兴奋性神经递质, 他在胆碱能神经元末梢的胞质中由胆碱和乙酰辅酶A在乙酰胆碱转移酶(choline acetyltransferase, CHAT)的催化下合成, 然后由VAChT负责转运并包装成突触囊泡, 在囊泡中储存直至释放[29]. Ach被释放后, 与ICC结合产生兴奋性连接电位, 使SMC去极化而产生收缩. 故Ach的含量及能否被顺利转运直接影响着胃肠平滑肌的收缩运动. 由于VAChT特异性较强, 能够清楚地显示胆碱能神经元终末突触小泡的膜上及周围轴浆中的Ach, 反映运动终板功能状态, 因此被认为是目前最可靠的Ach存在及其量多少的标志物[30].
本研究采用Ach的特异性标志物VAChT抗体和ICC的特异性标志物c-Kit抗体对大鼠结肠组织进行免疫荧光双标记, 运用激光扫描共聚焦显微镜结合透射电镜, 从三维立体以及超微结构方面观测ICC和胆碱能神经-ICC-SMC网络结构的结肠吻合术术后改变及针刺治疗对其的影响, 并配合排便和小肠推进率的观察, 以探讨其与胃肠动力的关系和针刺调整术后胃肠动力的机制.
研究结果表明, 结肠吻合术后, 吻合口附近ICC的超微结构出现明显损伤, 尤其线粒体的大量破裂溶解, 造成细胞色素C释放, 引起细胞凋亡坏死[31]. ICC数量减少, 兴奋性神经递质Ach含量下降, 网络结构破坏, 细胞间信号传导受阻, 使慢波电活动的产生和扩布均受到严重影响, 故术后肠道动力减弱, 小肠推进率变小, 排便延迟. 有研究发现[32], 神经元损伤与ICC数量减少直接相关, 其恢复亦伴随ICC增殖. 在本研究中, ICC和胆碱能神经的损伤与恢复也表现出一致变化的趋势. 针刺组大鼠结肠组织的ICC超微结构损伤和胆碱能神经-ICC-SMC网络结构破坏均较模型组轻, 小肠推进率增加, 首次排便时间提前, 表明针刺能改善ICC的超微结构, 减轻线粒体损伤, 促进ICC和胆碱能神经再生, 网络结构的恢复, 这可能是针刺促进术后肠动力恢复的机制之一. 至于针刺促进ICC修复和再生的作用是否与其促进受损神经恢复的作用有关, 仍有待深入研究.
中医认为, 脾主肌肉, 司运化, 胃肠动力与脾有着密切的关系. 本研究取足阳明胃经足三里穴、足太阴脾经三阴交穴以调脾胃, 佐以足厥阴肝经太冲穴, 取肝之疏泄助脾升胃降而行气机, 故能取得较好疗效. 鉴于ICC在整个消化道均有分布, 且结肠为消化道中血供最差, 吻合术后并发症最严重的部位, 由此推测, 针刺对其他消化道如胃、小肠等手术术后的ICC修复和再生以及胃肠运动功能早期恢复亦有良好的疗效, 至于其具体疗效及相关机制尚需进一步探讨.
感谢袁青教授、唐纯志教授和刘晓嵘医师在本实验中给予的指导和帮助.
ICC是胃肠慢波活动的起搏器和传导者, 其超微结构和功能的改变可能是众多胃肠动力障碍疾病的病理生理学基础. 研究表明, 肠道术后存在ICC数量减少, 结构萎缩和功能下降. 而针刺对结肠吻合术后ICC的修复与再生有何影响, 该影响是否与其调整肠道动力的作用相关, 尚未见报道.
张春虎, 副教授, 中南大学湘雅医院中西医结合研究所
ICC是胃肠起搏机制和胃肠动力障碍性疾病研究的热点. 近年生理学和形态学研究表明, ICC参与了一系列胃肠动力性疾病的发生, 但其数量、结构或功能的改变是原发还是继发, 与其他影响因素(如药物、针刺等)之间的关系如何等的详细机制仍需深入研究.
Kobayashi等研究表明, 肠道括约肌ICC-IM的丢失将导致该区域肠运动神经传递衰减. 王广勇等发现神经元损伤与ICC数量减少直接相关, 其恢复亦伴随ICC的增殖.
本研究从三维立体以及超微结构方面观测ICC和胆碱能神经-ICC-平滑肌细胞网络结构的结肠吻合术术后改变及针刺治疗对其影响, 并配合排便和小肠推进率的观察, 以探讨其与胃肠动力的关系和针刺调整术后胃肠动力的机制.
针刺促进结肠吻合术后肠动力的恢复可能与其具有修复ICC超微结构, 促进ICC细胞及其网络结构再生的功能有关. 这为临床运用针刺调整术后肠麻痹提供了实验证据, 也为其他具有ICC改变的胃肠动力障碍疾病的治疗提供了一个值得探索的方向.
本文学术性较好, 对临床有一定的参考价值.
编辑: 李薇 电编:何基才
| 1. | Mei F, Yu B, Ma H, Zhang HJ, Zhou DS. Interstitial cells of Cajal could regenerate and restore their normal distribution after disrupted by intestinal transection and anastomosis in the adult guinea pigs. Virchows Arch. 2006;449:348-357. [PubMed] [DOI] |
| 2. | Belzer V, Kobilo T, Rich A, Hanani M. Intercellular coupling among interstitial cells of Cajal in the guinea pig small intestine. Cell Tissue Res. 2002;307:15-21. [PubMed] [DOI] |
| 3. | Chen H, Ordög T, Chen J, Young DL, Bardsley MR, Redelman D, Ward SM, Sanders KM. Differential gene expression in functional classes of interstitial cells of Cajal in murine small intestine. Physiol Genomics. 2007;31:492-509. [PubMed] [DOI] |
| 4. | Daniel EE, Thomas J, Ramnarain M, Bowes TJ, Jury J. Do gap junctions couple interstitial cells of Cajal pacing and neurotransmission to gastrointestinal smooth muscle? Neurogastroenterol Motil. 2001;13:297-307. [PubMed] [DOI] |
| 5. | Iino S, Horiguchi K, Nojyo Y. W(sh)/W(sh) c-Kit mutant mice possess interstitial cells of Cajal in the deep muscular plexus layer of the small intestine. Neurosci Lett. 2009;459:123-126. [PubMed] [DOI] |
| 9. | Camborová P, Hubka P, Sulková I, Hulín I. The pacemaker activity of interstitial cells of Cajal and gastric electrical activity. Physiol Res. 2003;52:275-284. [PubMed] |
| 10. | Dickens EJ, Edwards FR, Hirst GD. Selective knockout of intramuscular interstitial cells reveals their role in the generation of slow waves in mouse stomach. J Physiol. 2001;531:827-833. [PubMed] [DOI] |
| 11. | Ward SM, Sanders KM, Hirst GD. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles. Neurogastroenterol Motil. 2004;16 Suppl 1:112-117. [PubMed] [DOI] |
| 12. | Daniel EE. Communication between interstitial cells of Cajal and gastrointestinal muscle. Neurogastroenterol Motil. 2004;16 Suppl 1:118-122. [PubMed] [DOI] |
| 13. | Takeuchi T, Fujinami K, Fujita A, Okishio Y, Takewaki T, Hata F. Essential role of the interstitial cells of Cajal in nitric oxide-mediated relaxation of longitudinal muscle of the mouse ileum. J Pharmacol Sci. 2004;95:71-80. [PubMed] [DOI] |
| 14. | Dickens EJ, Hirst GD, Tomita T. Identification of rhythmically active cells in guinea-pig stomach. J Physiol. 1999;514:515-531. [PubMed] [DOI] |
| 15. | Ordög T, Ward SM, Sanders KM. Interstitial cells of cajal generate electrical slow waves in the murine stomach. J Physiol. 1999;518:257-269. [PubMed] [DOI] |
| 16. | Sanders KM, Ordög T, Koh SD, Torihashi S, Ward SM. Development and plasticity of interstitial cells of Cajal. Neurogastroenterol Motil. 1999;11:311-338. [PubMed] [DOI] |
| 17. | Ward SM, Ordog T, Koh SD, Baker SA, Jun JY, Amberg G, Monaghan K, Sanders KM. Pacemaking in interstitial cells of Cajal depends upon calcium handling by endoplasmic reticulum and mitochondria. J Physiol. 2000;525 Pt 2:355-361. [PubMed] [DOI] |
| 18. | Wang XY, Vannucchi MG, Nieuwmeyer F, Ye J, Faussone-Pellegrini MS, Huizinga JD. Changes in interstitial cells of Cajal at the deep muscular plexus are associated with loss of distention-induced burst-type muscle activity in mice infected by Trichinella spiralis. Am J Pathol. 2005;167:437-453. [PubMed] |
| 19. | Wang XY, Paterson C, Huizinga JD. Cholinergic and nitrergic innervation of ICC-DMP and ICC-IM in the human small intestine. Neurogastroenterol Motil. 2003;15:531-543. [PubMed] [DOI] |
| 20. | Mitsui R, Komuro T. Direct and indirect innervation of smooth muscle cells of rat stomach, with special reference to the interstitial cells of Cajal. Cell Tissue Res. 2002;309:219-227. [PubMed] [DOI] |
| 21. | Schultz T, Daniel V, Daniel EE. Does ICC pacing require functional gap junctions between ICC and smooth muscle in mouse intestine? Neurogastroenterol Motil. 2003;15:129-138. [PubMed] [DOI] |
| 22. | Altdorfer K, Bagaméri G, Donáth T, Fehér E. Nitric oxide synthase immunoreactivity of interstitial cells of Cajal in experimental colitis. Inflamm Res. 2002;51:569-571. [PubMed] [DOI] |
| 23. | Seki K, Komuro T. Immunocytochemical demonstration of the gap junction proteins connexin 43 and connexin 45 in the musculature of the rat small intestine. Cell Tissue Res. 2001;306:417-422. [PubMed] [DOI] |
| 24. | Horiguchi K, Sanders KM, Ward SM. Enteric motor neurons form synaptic-like junctions with interstitial cells of Cajal in the canine gastric antrum. Cell Tissue Res. 2003;311:299-313. [PubMed] |
| 25. | Iino S, Ward SM, Sanders KM. Interstitial cells of Cajal are functionally innervated by excitatory motor neurones in the murine intestine. J Physiol. 2004;556:521-530. [PubMed] [DOI] |
| 26. | Wang XY, Sanders KM, Ward SM. Relationship between interstitial cells of Cajal and enteric motor neurons in the murine proximal colon. Cell Tissue Res. 2000;302:331-342. [PubMed] [DOI] |
| 27. | Hanani M, Freund HR. Interstitial cells of Cajal--their role in pacing and signal transmission in the digestive system. Acta Physiol Scand. 2000;170:177-190. [PubMed] [DOI] |
| 28. | Kobayashi KS, Chamaillard M, Ogura Y, Henegariu O, Inohara N, Nuñez G, Flavell RA. Nod2-dependent regulation of innate and adaptive immunity in the intestinal tract. Science. 2005;307:731-734. [PubMed] [DOI] |
| 29. | Prado MA, Reis RA, Prado VF, de Mello MC, Gomez MV, de Mello FG. Regulation of acetylcholine synthesis and storage. Neurochem Int. 2002;41:291-299. [PubMed] [DOI] |
| 30. | Sang Q, Young HM. The identification and chemical coding of cholinergic neurons in the small and large intestine of the mouse. Anat Rec. 1998;251:185-199. [PubMed] [DOI] |