修回日期: 2010-11-14
接受日期: 2010-11-23
在线出版日期: 2010-12-28
目的: 初步探讨过氧化物酶体增殖物激活受体γ(PPARγ)、核转录因子B(NF-κB)的表达与水砷暴露致大鼠肝纤维化的相关性.
方法: 110只SD大鼠随机分成对照组(自来水)、模型组(浓度100 mg/L亚砷酸钠溶液)、自然恢复组(浓度100 mg/L亚砷酸钠溶液+自来水). 对照组和模型组分别于第l、2、3、4月末各处死10只, 自然恢复组先给予砷溶液, 分别在第l、2、3月末取出10只改给予1 mo自来水饮用后处死. 肝组织病理学检查以观察肝纤维化的动态变化, 实时荧光定量RT-PCR法和Western blot法检测PPARγ、NF-κB的mRNA及蛋白表达水平.
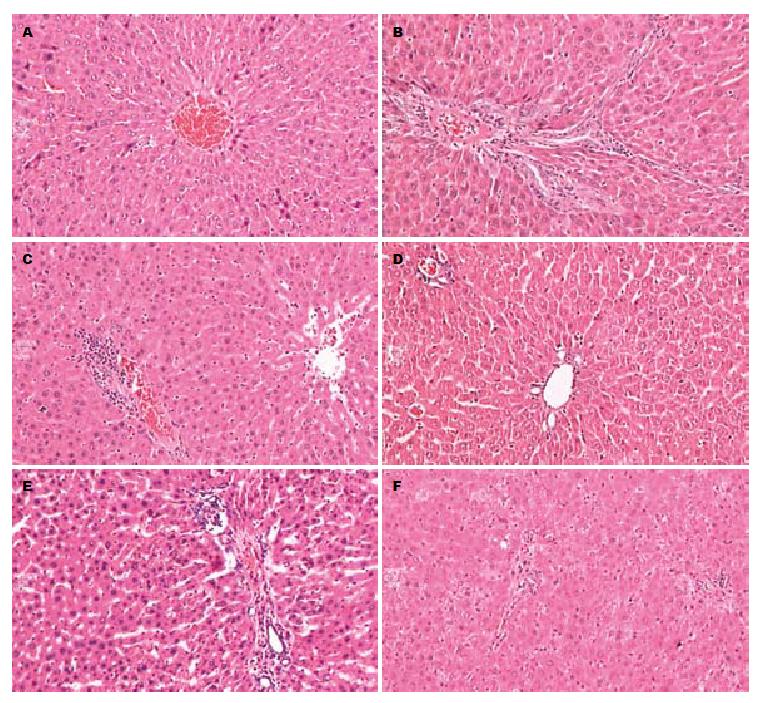
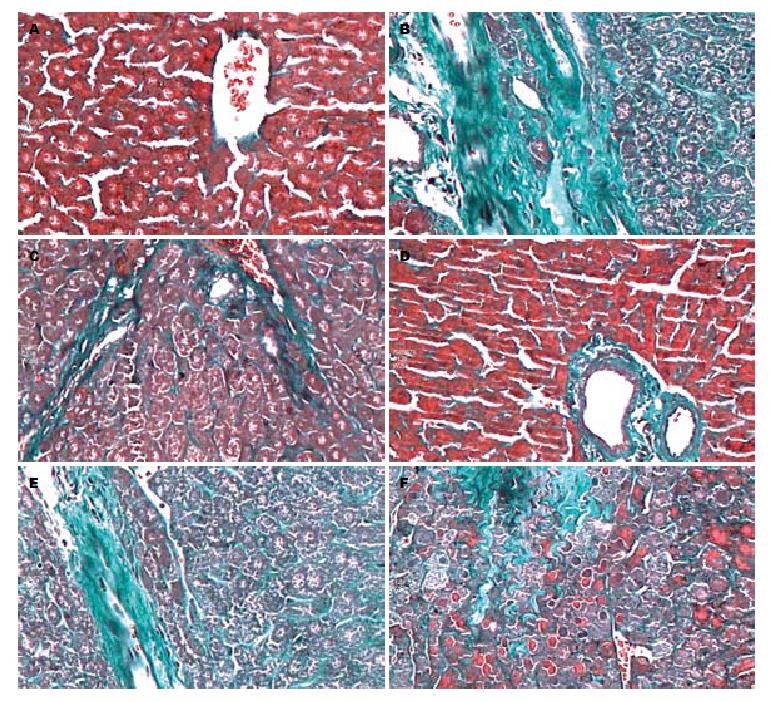
结果: (1)病理结果: HE染和Masson染色可见, 随砷暴露时间的延长, 肝细胞变性、坏死增多, 汇管区炎症细胞浸润加重, 纤维组织增生增多, 肝纤维化趋势明显. 砷暴露1 mo脱离自然恢复1 mo后较同月模型组肝细胞变性、坏死及炎细胞浸润程度明显减轻, 胶原生成减少. 砷暴露2、3 mo脱离自然恢复1 mo后较同月模型组病理结果差异不明显; (2)mRNA水平: 模型组PPARγ mRNA含量逐渐降低, 与对照组比较差异均有统计学意义(174.99±41.48, 114.55±21.30, 64.67±9.83, 19.20±16.10 vs 218.40±47.85, P<0.05), 砷暴露1、2、3 mo后分别自然恢复1 mo大鼠肝组织中PPARγ mRNA表达均低于同月造模组, 仅砷暴露1 mo自然恢复组1 mo组PPARγ mRNA降低有统计学意义(174.99±41.48 vs 215.97±45.96, P<0.05); 模型组NF-κB mRNA含量逐渐升高, 与对照组比较差异均有统计学意义(65.58±13.17, 90.23±15.68, 117.95±18.19, 172.86±32.92 vs 30.84±15.24,P<0.05), 砷暴露1、2、3 mo后分别自然恢复1 mo大鼠肝组织中NF-κB mRNA表达均高于同月造模组, 仅砷暴露1 mo自然恢复组1 mo组NF-κB mRNA升高有统计学意义(65.58±13.17 vs 40.45±19.56, P<0.05); (3)蛋白水平: 模型组大鼠肝组织中PPARγ的蛋白含量表达均低于对照组, 造模3、4 mo组与造模1 mo组比较差异有统计学意义(0.63±0.06, 0.55±0.11 vs 0.85±0.08,P<0.05); 模型组大鼠肝组织中NF-κB的蛋白含量均高于对照组, 造模3、4 mo组与造模1 mo组比较差异有统计学意义(3.25±0.89, 4.27±1.26 vs 1.6±0.57, P<0.05); (4)PPARγ和NF-κB的相关性: 两者mRNA的表达呈负相关(r = 0.847,P<0.01), 两者蛋白表达也呈负相关(r = 0.529, P<0.05).
结论: 肝纤维化程度随砷暴露时间延长而加重, 越早脱离砷环境, 肝损伤自然恢复越快; 砷暴露时间越长, PPARγ mRNA及蛋白表达越低, NF-κB mRNA及蛋白表达越高, 二者存在一反馈抑制通路; PPARγ-NF-κB信号传导通路参与砷暴露致肝纤维化形成机制.
引文著录: 刘洋, 吴君, 闫超, 刘芙蓉. PPARγ、NF-κB的表达与砷暴露致大鼠肝纤维化的相关性. 世界华人消化杂志 2010; 18(36): 3848-3856
Revised: November 14, 2010
Accepted: November 23, 2010
Published online: December 28, 2010
AIM: To investigate the significance of peroxisome proliferator activated receptor γ (PPARγ) and nuclear transcription factor kappa B (NF-κB) expression in arsenic-induced hepatic fibrosis in rats.
METHODS: One hundred and ten Sprague-Dawley rats were randomly divided into control group (tap water), model group (100 mg/L NaASO2) and spontaneous recovery group (100 mg/L NaASO2 + tap water). Ten rats of each group were sacrificed on days 30, 60, 90 and 120. Hepatic histological changes and liver fibrosis were evaluated by hematoxylin and eosin staining and Masson staining. The mRNA and protein expression of PPARγ and NF-κB was detected by real-time PCR and Western blot, respectively.
RESULTS: (1) Pathology: With the prolongation of arsenic exposure, hepatic injury became more serious. Compared with the model group, liver injury was significantly relieved on day 30 after one-month arsenic-exposure in the spontaneous recovery, but showed no significant changes on day 30 after two- or three-month arsenic-exposure. (2) mRNA: Compared with the control group, the expression levels of PPARγ mRNA were significantly reduced at different time points in the model group (174.99 ± 41.48 vs 218.40 ± 47.85, 114.55 ± 21.30 vs 218.40 ± 47.85, 64.67 ± 9.83 vs 218.40 ± 47.85, 19.20 ± 16.10 vs218.40 ± 47.85, all P < 0.05). The expression level of PPARγ mRNA on day 30 after one-month arsenic-exposure in the spontaneous recovery group was significantly higher than that in the corresponding model group (215.97 ± 45.96 vs 174.99 ± 41.48, P < 0.05). Compared with the control group, the levels of NF-κB mRNA were significantly elevated at different time points in the model group (65.58 ± 13.17 vs 30.84 ± 15.24, 90.23 ± 15.68 vs 30.84 ± 15.24, 117.95 ± 18.19 vs 30.84 ± 15.24, 172.86 ± 32.92 vs 30.84 ± 15.24, all P < 0.05). The expression of NF-κB mRNA on day 30 after one-month arsenic-exposure in the spontaneous recovery group was significantly higher than that in the corresponding model group (40.45 ± 19.56 vs 65.58 ± 13.17, P < 0.05). (3) Protein: Compared with the control group, the level of PPARγ protein was reduced in the model group. Compared with the control group, the level of NF-κB protein was elevated in the model group. (4) Correlation: There is a negative correlation between PPARγ and NF-κB mRNA expression (r = 0.847, P < 0.05) as well as between PPARγ and NF-κB protein expression (r = 0.529, P < 0.05).
CONCLUSION: Liver tissue injury is aggravated gradually with the prolongation of arsenic exposure. Earlier avoidance of arsenic exposure is associated with a quicker recovery from liver injury. In arsenic-induced hepatic fibrosis, PPARγ mRNA and protein expression is reduced, while that of NF-κB is elevated. There is a negative correlation between PPARγ and NF-κB expression in arsenic-induced hepatic fibrosis.
- Citation: Liu Y, Wu J, Yan C, Liu FR. Correlation of PPARγ and NF-κB expression with arsenic-induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3848-3856
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3848.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3848
砷是一种已知的毒物和人类致癌物, 饮用高砷水导致的慢性砷中毒会使肝脏出现变性、炎症、坏死和纤维化等病理变化, 引起严重的肝脏损害, 如慢性肝炎、肝纤维化、肝硬化, 甚至肝癌[1-4]. 肝纤维化成因是肝细胞发生坏死及炎症刺激时, 肝脏中胶原蛋白等细胞外基质的增生与降解失去平衡, 进而导致肝脏内纤维结缔组织异常沉积的病理过程[5]. 过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)是一类依赖配体调节的转录因子, 在转录水平上调控多种细胞的增殖、侵袭、分化和凋亡, 对多种促炎介质基因转录的抑制是其抗炎特性的分子基础, 在各种炎症损伤进程中具有重要作用[6,7]. 细胞核转录因子κB(nuclear factor-kappa B, NF-κB)是调控机体免疫和炎症反应因子表达的重要转录因子, 可促进多种促炎细胞因子的转录及表达[8]. 研究表明, PPARγ-NF-κB途径参与炎症反应平衡过程[9]. NF-κB的激活可能是大量炎症反应基因表达的控制点, 在炎症反应中活化后的PPARγ可以通过多种机制抑制NF-κB的表达, 因此, PPARγ-NF-κB途径是控制炎症反应的一个重要的靶点, 针对抑制NF-κB活性可能是治疗炎症的一个有效方案[10-12]. 本文拟在建立较稳定的砷致肝损伤、肝纤维化动物模型基础上, 观察在砷暴露致肝纤维化模型中PPARγ、NF-κB的mRNA和蛋白的表达差异, 并初步探讨两者表达水平的相关性, 结合肝组织病理学表现来探索砷导致大鼠肝纤维化形成的分子机制, 为砷中毒致肝纤维化的防治提供理论依据.
健康清洁级SD大鼠110只, 雌雄各半, 体质量180-200 g, 购自贵阳医学院实验动物中心, 在清洁级动物饲养室进行饲养. 荧光PCR扩增仪(广东中山, DA7600), 核酸蛋白定量仪(Thermo SCIENTIFIC), 高速低温离心机(美国, Sigma 3K15), PH仪(美国, METTLER TOLEDO Five Easy), 凝胶成像系统(美国, BIO-RAD Gel Doc XR), 电泳仪(北京, 六一仪器厂DYCZ-24DN), 扩增仪(美国, PE Applied Biosystems PE9700). 亚砷酸钠(NaAsO2, 美国Sigma chemical公司), 批号76H0240. PPARγ、NF-κB、β-actin引物委托上海捷达生物工程有限公司合成, RNA纯化试剂盒[北京, 天根生化科技(北京)有限公司], TRIzol Reagent(invitrogen Cat. No. 15596-026), RevertAid First Strand cDNA Synthesis Kit(Fermentas, Cat. No. K1622), SYBR Green(天根生化, FP202), 兔NF-κB多克隆抗体(Santa Cruz, Cat. No. sc-33022); 鼠PPARγ单克隆抗体(Santa Cruz, Cat. No. sc-7273); 小鼠β-actin单克隆抗体(Sigma, Cat. No. sc-A5441); HRP标记山羊抗兔抗体(Santa Cruz, Cat. No. sc-2030); HRP标记山羊抗鼠抗体(Santa Cruz, Cat. No. sc-2302), BCA Protein Assay Kit(Thermo SCIENTIFIC, Cat. No. 23227).
1.2.1 分组及造模: 将110只SD大鼠随机分成3组: 对照组、模型组、自然恢复组, 各组均给予普通饲料. 对照组40只, 给予自来水自由饮用; 模型组40只, 给予100 mg/L[13]的亚砷酸钠溶液自由饮用. 对照组和模型组分别予第1、2、3、4月末各处死10只. 自然恢复组30只, 给予普通饲料. 第1月给予砷溶液(100 mg/L), 月末随机取出10只改为自来水, 其余仍给予砷溶液. 第2月末处死上月分出的10只, 并再次取出10只改为自来水, 1 mo后处死, 以此类推, 第4月末将最后10只停用砷溶液的大鼠处死. 股动脉放血后脱颈处死大鼠, 剖取相同部位肝脏, 分别浸泡于40 g/L甲醛溶液中固定, 送病理科作苏木素-伊红(HE)染色及Masson染色, 光镜下观察肝脏病理变化及胶原表达情况. 另取肝组织100 mg, 迅速加入1 mL TRIzol试剂中, 立即提取肝组织总RNA. 其余肝组织置于EP管中, -80 ℃低温保存备用.
1.2.2 实时荧光定量PCR法检测PPARγ、NF-κB的mRNA: PPAR: 按参考文献设计并在GenBank进行核对, 委托上海捷达合成, 上游引物为: 5'-GCTCAAGTATGGTGTCCATGAG-3', 下游引物为5'-TGAGATGAGGACTCCATCTTTATTCA-3'; NF-κB: 按参考文献设计并在GenBank进行核对, 委托上海捷达合成. 上游引物为: 5'-CGGGCTGGTGAGGAAATTAG-3', 下游引物为5'-CCCCAAAGTACGTCGCATCTT-3'; β-actin: 按参考文献设计并在GenBank进行核对, 委托上海捷达合成, 上游引物为5'-ACCACCATGTACCCAGGCAT-3', 下游引物为5'-CCGGACTCATCGTACTCCTG-3'. 采用标准TRIzol-酚-氯仿一步法提取总RNA, 采用紫外分光光度法测定RNA在波长为260 nm和280 nm时的吸光度值(A260、A280), 以A260/A280的比值鉴定RNA的纯度(1.6-1.8), 将浓度稀释为50 μg/L, 经MMLv催化合成cDNA第一链, 以此为摸板进行实时荧光定量PCR扩增, 得出各样本末的初始拷贝数. 实验过程中严格设立内参β-actin, 以作为逆转录酶和荧光RT-PCR的质控措施. 逆转录反应体系(20 μL): 50 μg/L RNA 10 μL, 5×reaction Buffer 4.0 μL, 10 mmol/L dNTPmix 2.0 μL, 100 μmol/L Oligo(dT)18 1.0 μL, 200 U/μL M-MLV 1.0 μL, 20 U/μL RNase Inhibitor 1.0 μL, RNase-free H2O 1.0 μL. 逆转录参数设置: 42 ℃, 60 min; 70 ℃, 5 min; 反应结束后取出cDNA -20 ℃保存备用. PCR反应体系(20 μL)包括: 逆转录产物2 μL, 10 μmol/L上游引物0.5 μL, 10 μmol/L下游引物0.5 μL, 2×SYBR Green 10 μL, RNase-free H2O 7 μL. PCR扩增参数设置: 50 ℃, 2 min; 95 ℃, 预变性10 min后进入循环, 95 ℃, 15 s; 60 ℃, 1 min, 40个循环. 反应结束后, 由广东中山DA7600荧光PCR扩增仪软件自动记录荧光曲线并分析计算出Ct值, 建立β-actin作为内对照, 检测被测样品RNA的完整性和可靠性. 结果判断: Δ循环阈值(cycle threshold, Ct) = 样品Ct均值-内参照Ct均值, 然后取2-ΔΔCt代表被检样品PPARγ、NF-κB mRNA的相对表达量.
1.2.3 Western blot法检测肝组织中PPARγ、NF-κB的蛋白: 取肝组织100 mg, 按试剂盒操作提取组织总蛋白, BCA法测定蛋白浓度. 60 μg蛋白/泳道混合等体积上样缓冲液处理, 蛋白变性, 恒流100 mA电泳, 恒压100 V转膜45 min, 封闭2 h. 洗膜后加兔NF-κB抗体(1:1 000稀释)或鼠PPARγ抗体(1:1 000稀释)4 ℃过夜; 对应兔或鼠二抗(1:5 000稀释), 37 ℃孵育, 曝光、显影、定影. 抗体去除液洗膜后加入抗β-actin抗体(1:10 000)步骤同上, 检测β-actin并以其表达水平作为内参照. 结果采用BIO-RAD凝胶成像系统照相, 扫描条带灰度值, 数据采用归一法处理后即代表蛋白表达含量.
统计学处理 所有数据均用SPSS11.5统计软件分析, 计量资料以mean±SD表示, 多组间比较采用单因素方差分析(ANOVA), 方差具有齐性时用SNK及LSD检验. 方差不齐用Tamhane's T2检验进行各组间比较. P<0.05为差异有统计学意义. PPARγ、NF-κB的相关性分析采用Pearson相关分析, P<0.05为差异有统计学意义.
正常对照组大鼠状态良好, 毛发光泽; 模型组随砷暴露时间延长大鼠毛发粗糙、精神萎靡, 动作迟钝, 易激惹, 进食、进水量明显减少.
2.2.1 HE染色光镜下观察: 对照组大鼠小叶结构完整, 肝细胞索在中央静脉四周呈放射状排列, 肝细胞索间空隙为肝血窦, 胞质丰富, 无肝细胞变性、坏死及炎症细胞浸润(图1A), 模型组可见明显肝脏损伤, 大量坏死肝细胞及炎性细胞浸润, 纤维增生加重, 肝小叶结构破坏(图1B); 砷暴露1 mo自然恢复1 mo组较同月模型组比较可见轻度水样变、脂肪变性, 未见脂肪变性及气球样变性, 汇管区及肝小叶内见少量炎细胞浸润, 肝细胞坏死少, 肝小叶结构尚完整(图1C, D); 砷暴露2 mo自然恢复1 mo组较同月模型组比较可见肝细胞水样变性, 汇管区及肝小叶内可见脂肪变性及气球样变性程度减轻, 汇管区及肝小叶内可见炎细胞浸润, 肝细胞坏死减少, 肝小叶结构不完整(图1E, F). 砷暴露3、4 mo后自然恢复1 mo与同月模型组比较病理改变的变化不明显.
2.2.2 Masson染色光镜下观察: 对照组大鼠肝组织肝小叶结构完整, 未见有染成绿色的胶原纤维(图2A), 模型组可见明显的肝细胞坏死并被纤维增生修复, 增生的纤维形成细丝状或汇集成粗条索甚至片状, 包绕汇管区并向肝小叶间及叶内、肝小叶中心延伸(图2B). 砷暴露1 mo自然恢复1 mo组较同月模型组比较汇管区、小叶中央静脉周围胶原纤维增生减少(图2C, D), 肝小叶结构完整. 砷暴露2 mo自然恢复1 mo组较同月模型组比较中央静脉及门静脉有少量纤维束放散延伸, 尚无间隔形成(图2E, F). 砷暴露3、4 mo后自然恢复1 mo与同月模型组比较病理改变的变化不明显.
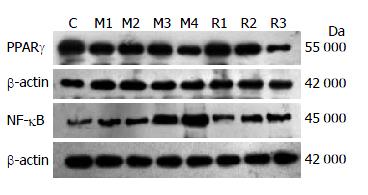
各组肝组织中PPARγ、NF-κB mRNA的荧光定量扩增曲线均呈现典型的S型(图3), 熔解曲线分析可见单峰值, 排除了非特异性扩增(图4). 模型组大鼠肝组织中PPARγ的mRNA的含量表达均低于对照组, 与同月对照组相比, 造模1、2、3、4 mo的PPARγ的mRNA均有统计学意义(P<0.05). 造模1、2、3 mo后分别自然恢复1 mo大鼠肝组织中mRNA表达均高于同月模型组, 仅造模1 mo自然恢复1 mo组PPARγ mRNA升高有统计学意义(P<0.05); 模型组大鼠肝组织中NF-κB的mRNA的含量表达均高于对照组, 与同月对照组相比, 造模1、2、3、4 mo的NF-κB的mRNA均有统计学意义(P<0.05). 造模1、2 、3 mo后分别自然恢复1 mo大鼠肝组织中mRNA表达均低于同月造模组, 仅造模1 mo自然恢复1 mo组NF-κB的mRNA降低有统计学意义(P<0.05, 表1).
模型组大鼠肝组织中PPARγ的蛋白含量表达均低于正常对照组, 与造模1 mo组比较, 造模3、4 mo的PPARγ的蛋白均有统计学意义(P<0.05), 造模1、2、3 mo后分别自然恢复1 mo大鼠肝组织中蛋白含量均低于同月造模组, 但无统计学意义(P>0.05); 模型组大鼠肝组织中NF-κB的蛋白含量均高于正常对照组, 与造模1 mo组比较, 造模3、4 mo的NF-κB的mRNA均有统计学意义(P<0.05). 造模1、2、3 mo后分别自然恢复1 mo大鼠肝组织中mRNA表达均低于同月造模组, 但均无统计学意义(P>0.05, 表2, 图5).
各组PPARγ和NF-κB mRNA的表达呈负相关(r = 0.847, P<0.01), PPARγ和NF-κB蛋白表达呈负相关(r = 0.529, P<0.05).
肝脏是毒物代谢的靶器官, 近年来动物实验和人群流行病学调查均表明砷进入机体后, 主要分布于肝脏[14,15]. 动物研究表明, 肝脏是砷的蓄积器官, 慢性砷暴露大鼠肝组织的砷含量及砷致肝脏损伤程度与砷浓度、及暴露时间呈正相关, 且高浓度砷组肝组织显微镜下观察显示有肝细胞变性、炎症及点状坏死, 呈量效关系[13,16,17]. 实验结果表明, 随砷暴露时间的延长, 大鼠肝脏肝组织炎症细胞浸润和肝细胞变性、坏死逐渐加重, 并伴有纤维组织增生进行性增多, 形成纤维间隔, 最终破坏肝小叶结构. 越早脱离砷暴露环境, 肝脏损伤甚至肝纤维化越容易修复和逆转, 而在砷暴露后期, 肝脏严重受损、肝纤维化组织大量增生, 脱离砷环境后自然恢复的意义不大, 这与以往研究结果一致[13,18]. 这一结论说明砷可引起明显肝组织损伤、肝纤维化, 且随者砷暴露时间的延长, 其纤维化趋势越明显, 对砷中毒的防治重点应在于砷污染的控制以及尽早脱离砷环境.
肝纤维化是继发于肝脏炎症或损伤后组织修复的代偿反应, 现代细胞和分子生物学研究表明, 器官纤维化形成的分子病理学基础就是细胞-细胞因子-基质间的相互作用, 其特征为成纤维细胞的增殖活化及细胞外基质(extracellular matrix, ECM)的合成与降解的失衡, 导致胶原的异常沉积过度, 形成纤维间隔, 肝脏原有结构被破坏, 形成纤维化[19,20]. 肝纤维化成因尚未完全清楚, 典型的发病机制认为, 多因素造成的肝损伤启动了肝纤维化, 包括肝细胞坏死、凋亡、炎细胞浸润和ECM改变[21]. 在肝纤维化中起决定性作用的是肝星状细胞(hepatic stellate cells, HSCs), 他不仅是炎症靶细胞, 也是肝脏炎症反应中的重要效应细胞, 他的激活是整个肝纤维化发生的开端.各种损肝因子引起肝细胞损伤、坏死、凋亡及肝组织炎症反应, 激活库普弗细胞分泌多种细胞因子, 随同肝细胞、血小板和窦内皮细胞等分泌的细胞因子、脂质过氧化产物等化学递质共同作用于HSCs, 激活一系列细胞内信号传递结构和分子, 如促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、Smad家族, 磷脂酰肌醇3-激酶(phosphatidylinositol3-kinase, PI3-K)等, 导致基因表达的变化, 最终合成分泌大量ECM, 形成纤维化[22,23].
研究表明, 各种促炎因子可不同程度的诱导HSCs的活化, 释放足以造成肝脏损伤的肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、NF-κB等炎症介质, 进而促进炎症的发生[24]. NF-κB在激活的HSCs内表达增多, 可进一步激活其下游基因环氧化酶2(cyclooxygenase 2, COX-2)、细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)、白介素-1(interleukin 1, IL-1)、IL-6、IL-8、内皮素-1(endothelin1, ET-1)等转录表达相应的产物, 触发或加剧肝脏炎症, 并通过自由基、TNF-α、转化生长因子β(transforming growth factor, TGF-β)、基质金属蛋白酶(matrix metalloproteinases, MMP)等炎性介质进一步激活NF-κB, 维持HSCs活化, 从而放大炎症反应活性, 最终促成肝脏纤维化[25-27].
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)是配体活化的核转录因子, 属Ⅱ型核受体超家族成员之一, 有PPARα、PPARβ、PPARγ 3种亚型, 三者在组织中的分布和表达不尽相同, PPARγ表达于脂肪细胞、核细胞和巨噬细胞、肺泡及气道上皮细胞和血管内皮细胞等. PPARγ具有多种生物学效应, 在脂质代谢、抑制炎症反应、细胞分化、抑制细胞增殖和诱导细胞凋亡等方面发挥重要作用[6]. PPARγ可从不同水平调控细胞内多条炎症信号转导途径, 对多种促炎介质基因转录的抑制使其抗炎特性的分子基础[28,29]. PPARγ先和DNA结合伴侣维甲酸X受体(retinoid X receptor, RXR)结合形成二聚体, 同时募集转录共激活子PPARs结合蛋白, 在辅激活因子的协同作用下, 识别靶基因启动子区的过氧化物酶体增殖子反应元件(peroxisome proliferator-activated receptorγ response elements, PPARE), 调控基因的表达, 进而调节体内糖、脂肪代谢, 参与炎症反应[30]. PPARγ还可通过抑制转录因子活性来发挥负向的间接转录调控, 包括NF-κB、激活子蛋白-1等[31]. 因此, 活化后PPARγ在抗纤维增生性疾病的有效作用成为新的研究热点.
NF-κB是一种能够与B细胞免疫球蛋白κ轻链基因的增强子κB序列特异结合的核蛋白因子, 与许多靶基因的转录启动有关, 在细胞和生物体生长、分泌、细胞系定向等过程中起非常重要的作用. 通常情况下, NF-κB二聚体与其抑制蛋白IκB结合位于细胞质中, 处于静止状态. 当有刺激信号时, 细胞内外多种刺激因素可通过一定的转导通路激活IκB激酶(IKK), 活化了的IKK能磷酸化IκB, 使NF-κB得以释放, 使其能从胞质转移到胞核, 与靶基因的κB位点结合激活相关基因的转录[32,33].
研究发现, PPARγ-NF-κB信号通路参与介导了调解炎症反应平衡过程[34]. PPARγ对各种炎症因子的抑制作用主要是通过抑制NF-κB的活化来完成的. PPARγ通过与其配体结合而成激活状态, 使NF-κB活性下降或抑制其活化, 从而减少细胞因子的基因表达, 最终缓解炎症反应[35]. PPARγ抑制NF-κB炎症的途径, 其作用机制可能有: (1)PPARγ可直接与NF-κB的亚基p65/p50结合, 发生蛋白质-蛋白质相互作用, 形成转录抑制复合物, 降低NF-κB与DNA的结合活性, 进而抑制NF-κB的表达; (2)PPARγ可作用于IκBα的基因调控区, 通过抑制IκBα的表达来抑制NF-κB的激活; (3)PPARγ还可以通过竞争结合协同活化因子CBP及p300, 抑制NF-κB的转录, 从而诱导巨噬(泡沫)细胞的凋亡[36].
实验结果表明, PPARγ mRNA和蛋白水平在正常组织均表达较高, 随砷暴露致肝损伤、肝纤维化时间越长, 其表达水平越低, 越早脱离砷暴露环境, 肝损伤、肝纤维化自然恢复得越好, 随着肝损伤的修复, PPARγ mRNA及蛋白的表达水平随之回升; NF-κB表达则刚好相反, 正常组织中其mRNA和蛋白水平较低, 随肝脏炎症程度的加重, 其表达水平逐渐增高, 而随着脱离砷暴露的自然恢复时间延长, 其表达水平又逐渐下降, 提示PPARγ、NF-κB均参与了砷暴露致肝损伤、肝纤维化发生发展过程. 与此同时, PPARγ和NF-κB mRNA和蛋白的表达之间有一定相关性, 均呈负相关, 提示二者之间存在一反馈抑制通路, 并且这一通路与砷中毒致肝纤维化密切相关, 与以往研究结果一致[37]. 而上调PPARγ表达是否对砷暴露肝损伤、肝纤维化具有拮抗作用, 还有待进一步研究探讨.
砷是一种已知的毒物和人类致癌物, 近年来动物实验和人群流行病学调查均表明砷进入机体后, 主要分布于肝脏. 饮用高砷水导致的慢性砷中毒会使肝脏出现脂肪变性、炎症、坏死和纤维化等病理变化, 引起严重的肝脏损害, 如慢性肝炎、肝纤维化、肝硬化, 甚至肝癌.
党双锁, 教授, 西安交通大学第二医院感染科
有研究表明PPARγ和NF-κB之间关系密切, 二者存在一反馈抑制通路, 且这一通路与组织炎症的发生密切相关.
PPARγ-NF-κB途径是控制炎症反应的一个重要的靶点, 针对抑制NF-κB活性可能是治疗炎症的一个有效方案.
本文拟在建立较稳定的砷致肝损伤、肝纤维化动物模型的基础上, 观察在砷暴露致肝纤维化模型中PPARγ、NF-κB的mRNA和蛋白的表达差异, 并初步探讨两者表达水平的相关性, 结合肝组织病理学表现, 来探索砷导致小鼠肝纤维化形成的分子机制, 为砷中毒致肝纤维化的防治提供理论依据.
本文科学性较好, 对于了解砷暴露致毒损伤机制有一定参考价值.
编辑: 李薇 电编:何基才
| 1. | Santra A, Maiti A, Das S, Lahiri S, Charkaborty SK, Mazumder DN. Hepatic damage caused by chronic arsenic toxicity in experimental animals. J Toxicol Clin Toxicol. 2000;38:395-405. [PubMed] [DOI] |
| 2. | Liu J, Liu Y, Goyer RA, Achanzar W, Waalkes MP. Metallothionein-I/II null mice are more sensitive than wild-type mice to the hepatotoxic and nephrotoxic effects of chronic oral or injected inorganic arsenicals. Toxicol Sci. 2000;55:460-467. [PubMed] [DOI] |
| 3. | Waalkes MP, Keefer LK, Diwan BA. Induction of proliferative lesions of the uterus, testes, and liver in swiss mice given repeated injections of sodium arsenate: possible estrogenic mode of action. Toxicol Appl Pharmacol. 2000;166:24-35. [PubMed] [DOI] |
| 4. | Brown KG, Ross GL. Arsenic, drinking water, and health: a position paper of the American Council on Science and Health. Regul Toxicol Pharmacol. 2002;36:162-174. [PubMed] [DOI] |
| 5. | 程 明亮, 杨 长青. 肝纤维化的基础研究与临床. 第2版. 北京: 人民卫生出版社 2002; 1-2. |
| 6. | Zingarelli B, Cook JA. Peroxisome proliferator-activated receptor-gamma is a new therapeutic target in sepsis and inflammation. Shock. 2005;23:393-399. [PubMed] [DOI] |
| 7. | Moraes LA, Piqueras L, Bishop-Bailey D. Peroxisome proliferator-activated receptors and inflammation. Pharmacol Ther. 2006;110:371-385. [PubMed] [DOI] |
| 8. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 9. | Kaplan J, Cook JA, O'Connor M, Zingarelli B. Peroxisome proliferator-activated receptor gamma is required for the inhibitory effect of ciglitazone but not 15-deoxy-Delta 12,14-prostaglandin J2 on the NFkappaB pathway in human endothelial cells. Shock. 2007;28:722-726. [PubMed] |
| 10. | Andresen L, Jørgensen VL, Perner A, Hansen A, Eugen-Olsen J, Rask-Madsen J. Activation of nuclear factor kappaB in colonic mucosa from patients with collagenous and ulcerative colitis. Gut. 2005;54:503-509. [PubMed] |
| 11. | Kaltschmidt C, Kaltschmidt B, Neumann H, Wekerle H, Baeuerle PA. Constitutive NF-kappa B activity in neurons. Mol Cell Biol. 1994;14:3981-3992. [PubMed] |
| 12. | Schreiber S, Nikolaus S, Hampe J. Activation of nuclear factor kappa B inflammatory bowel disease. Gut. 1998;42:477-484. [PubMed] |
| 14. | Ng JC, Wang J, Shraim A. A global health problem caused by arsenic from natural sources. Chemosphere. 2003;52:1353-1359. [PubMed] [DOI] |
| 16. | Xie Y, Trouba KJ, Liu J, Waalkes MP, Germolec DR. Biokinetics and subchronic toxic effects of oral arsenite, arsenate, monomethylarsonic acid, and dimethylarsinic acid in v-Ha-ras transgenic (Tg.AC) mice. Environ Health Perspect. 2004;112:1255-1263. [PubMed] [DOI] |
| 19. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 20. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 21. | Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis. 2007;27:413-426. [PubMed] [DOI] |
| 24. | Li Z, Yang S, Lin H, Huang J, Watkins PA, Moser AB, Desimone C, Song XY, Diehl AM. Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease. Hepatology. 2003;37:343-350. [PubMed] [DOI] |
| 25. | Elsharkawy AM, Mann DA. Nuclear factor-kappaB and the hepatic inflammation-fibrosis-cancer axis. Hepatology. 2007;46:590-597. [PubMed] [DOI] |
| 26. | Son G, Iimuro Y, Seki E, Hirano T, Kaneda Y, Fujimoto J. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis. Am J Physiol Gastrointest Liver Physiol. 2007;293:G631-G639. [PubMed] [DOI] |
| 27. | Blackwell TS, Christman JW. The role of nuclear factor-kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol. 1997;17:3-9. [PubMed] |
| 28. | Blanquart C, Barbier O, Fruchart JC, Staels B, Glineur C. Peroxisome proliferator-activated receptors: regulation of transcriptional activities and roles in inflammation. J Steroid Biochem Mol Biol. 2003;85:267-273. [PubMed] [DOI] |
| 30. | Kielian T, Drew PD. Effects of peroxisome proliferator-activated receptor-gamma agonists on central nervous system inflammation. J Neurosci Res. 2003;71:315-325. [PubMed] [DOI] |
| 32. | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. Cell 1986. 46: 705-716. J Immunol. 2006;177:7485-7496. [PubMed] |
| 33. | Chong LW, Hsu YC, Chiu YT, Yang KC, Huang YT. Anti-fibrotic effects of thalidomide on hepatic stellate cells and dimethylnitrosamine-intoxicated rats. J Biomed Sci. 2006;13:403-418. [PubMed] [DOI] |
| 34. | Shimada T, Kojima K, Yoshiura K, Hiraishi H, Terano A. Characteristics of the peroxisome proliferator activated receptor gamma (PPARgamma) ligand induced apoptosis in colon cancer cells. Gut. 2002;50:658-664. [PubMed] |
| 35. | Bassaganya-Riera J, Reynolds K, Martino-Catt S, Cui Y, Hennighausen L, Gonzalez F, Rohrer J, Benninghoff AU, Hontecillas R. Activation of PPAR gamma and delta by conjugated linoleic acid mediates protection from experimental inflammatory bowel disease. Gastroenterology. 2004;127:777-791. [PubMed] [DOI] |
| 36. | Straus DS, Pascual G, Li M, Welch JS, Ricote M, Hsiang CH, Sengchanthalangsy LL, Ghosh G, Glass CK. 15-deoxy-delta 12,14-prostaglandin J2 inhibits multiple steps in the NF-kappa B signaling pathway. Proc Natl Acad Sci U S A. 2000;97:4844-4849. [PubMed] [DOI] |