修回日期: 2010-11-19
接受日期: 2010-11-23
在线出版日期: 2010-12-28
目的: 探讨去甲基化药物5-氮杂-2'-脱氧胞苷(5-Aza-CdR)对人胃癌细胞系SGC-7901细胞株的生长及EDNRB基因启动子异常甲基化的影响.
方法: 使用1、2、5、10 μmol/L 5-Aza-CdR干预胃癌SGC-7901细胞, 甲基化特异性PCR(MSP)和逆转录聚合酶链反应(RT-PCR)分别检测药物干预前后EDNRB基因的甲基化状态和EDNRB mRNA的表达, MTT法检测细胞增殖活性, 流式细胞术分析细胞周期及细胞凋亡的改变.
结果: 未经5-Aza-CdR处理的SGC-7901细胞中EDNRB基因启动子区域CpG岛高甲基化, 且EDNRB mRNA不表达, 经1、2、5、10 μmol/L 5-Aza-CdR处理4 d后, EDNRB基因启动子区域高甲基化状态得到逆转, 细胞中EDNRB mRNA表达恢复. 4种浓度5-Aza-CdR处理的SGC-7901细胞后, 细胞增殖受到抑制, 且呈时间和剂量依赖性; 并抑制SGC-7901细胞生长周期, 其细胞周期阻滞于S期, 5、10 μmol/L 5-Aza-CdR实验组细胞凋亡率显著高于对照组, 且差异有统计学意义(7.13%±0.87%, 13.34%±1.12% vs 3.69%±0.52%, P = 0.032, P<0.001).
结论: 5-Aza-CdR能有效逆转人胃癌SGC-7901细胞EDNRB基因的异常甲基化, 从而激活因高甲基化导致EDNRB基因沉默的再转录, 诱导该基因的表达, 抑制该细胞的生长.
引文著录: 吴川清, 韩高雄, 帅晓明, 陶凯雄. 5-氮杂-2'-脱氧胞苷对人胃癌SGC-7901细胞株生长及EDNRB基因启动子异常甲基化的影响. 世界华人消化杂志 2010; 18(36): 3843-3847
Revised: November 19, 2010
Accepted: November 23, 2010
Published online: December 28, 2010
AIM: To investigate the effects of 5-Aza-2'-deoxycytidine on promoter hypermethylation of the EDNRB gene and cell proliferation in human gastric carcinoma cell line SGC-7901.
METHODS: After SGC-7901 cells were treated with different concentrations (1, 2, 5, 10 μmol/L) of 5-Aza-2'-deoxycytidine, the promoter methylation status of the EDNRB gene in SGC-7901 cells was analyzed using methylation-specific polymerase chain reaction (MSP); the expression of EDNRB gene in SGC-7901 cells was detected by reverse transcription polymerase chain reaction (RT-PCR); cell proliferation was measured by MTT assay; and cell cycle distribution and apoptosis were analyzed by flow cytometry.
RESULTS: Before treatment with 5-Aza-2'-deoxycytidine, promoter hypermethylation of the EDNRB gene was detected in SGC-7901 cells. Accordingly, the expression of EDNRB mRNA was not detected in SGC-7901 cells. After treatment of cells with 5-Aza-2'-deoxycytidine for four days, promoter demethylation of the EDNRB gene was induced and EDNRB mRNA expression was detected. Treatment with 5-Aza-2'-deoxycytidine restrained the proliferation of SGC-7901 cells in a time- and dose-dependent manner. Treatment with 5-Aza-CdR induced cell cycle arrest in S phase. The apoptosis rate was significantly higher in SGC-7901 cells treated with 5 or 10 μmol/L 5-Aza-CdR than in control cells (7.13% ± 0.87%, 13.34% ± 1.12% vs 3.69% ± 0.52%, both P < 0. 05).
CONCLUSION: 5-Aza-2'-deoxycytidine can effectively induce promoter demethylation of the EDNRB gene, activate EDNRB gene expression, and inhibit cell growth in human gastric carcinoma cell line SGC-7901.
- Citation: Wu CQ, Han GX, Shuai XM, Tao KX. Treatment with 5-Aza-2'-deoxycytidine induces promoter demethylation of the EDNRB gene and inhibits cell proliferation in human gastric carcinoma cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3843-3847
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3843.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3843
随着表遗传学的发展, 人们认识到肿瘤不仅是遗传性疾病, 同时也是由DNA甲基化异常引起的基因调控失常的表遗传性疾病. 内皮素受体B(endothelin receptor B, EDNRB)基因是候选的抑癌基因之一, 其启动子异常高甲基化与多种肿瘤的发生发展相关[1], 但在胃癌组织中对该基因的研究, 目前尚未有报道. 5-氮杂-2'-脱氧胞苷(5-aza-2-deoxycytidine, 5-Aza-CdR)是一种DNA甲基转移酶(DNA methyltransferase, DNMT)抑制剂, 通过抑制甲基化转移酶, 可使多种启动子区域高甲基化的抑癌基因重新表达或表达增高[2,3]. 为研究胃癌中EDNRB基因的甲基化状态及CpG岛去甲基化后其转录活性的表达, 我们应用5-Aza-CdR对SGC-7901细胞进行处理, 观察EDNRB基因的启动子甲基化状态、转录表达情况及细胞生物学特性的改变, 从而了解EDNRB基因启动子异常高甲基化与胃癌的关系, 并为胃癌的临床治疗提供新的靶点.
人胃癌细胞株SGC-7901由华中科技大学同济医学院附属协和医院腔镜外科腔镜实验室培养; RPMI 1640(Hyclone公司), 内含100 mL/L的胎牛血清(杭州四季青生物工程材料有限公司); 琼脂糖(Invitrogen公司); 5-Aza-CdR(Sigma公司), 用PBS充分溶解后配制成1 mol/L的母液, -20 ℃保存; DNA提取试剂盒(QIAGEN公司); EZ DNA Methylation-Gold Kit(TIANGEN公司); AMV第1链cDNA试剂盒及PCR扩增试剂盒(上海生工生物工程有限公司); TRIzol试剂(Invitrogen公司); 引物合成(Invitrogen公司); MTT及PI(BD公司).
1.2.1 细胞培养和干预: 将SGC-7901细胞用含有100 mL/L的胎牛血清的RPMI 1640培养液中, 在50 mL/L CO2、37 ℃的培养箱中培养. 另配制含1, 2, 5, 10 μmol/L 5-Aza-CdR的完全培养液. 取传代后24 h的细胞, 分别加入1、2、5、10 μmol/L 5-Aza-CdR浓度的完全培养液, 上述完全培养液每24 h更换1次, 培养4 d后回收细胞. 对照组则使用不含5-Aza-CdR的普通完全培养液.
1.2.2 MSP法检测5-Aza-CdR处理前后SGC-7901细胞中EDNRB基因甲基化状态: 取对照组和药物处理4 d后SGC-7901细胞, 用DNA提取试剂盒抽提细胞基因组DNA, 紫外分光光度计检测DNA纯度及含量. 每份标本取1 μg DNA, 参照EZ DNA Methylation-Gold Kit说明书对基因组DNA进行亚硫酸氢盐修饰. 以亚硫酸氢盐处理后的DNA为模板, 使用甲基化扩增试剂盒分别用甲基化引物和非甲基化引物进行PCR扩增, 所有PCR扩增均使用25 μL反应体系. 引物参考文献[4], 扩增片段为121 bp, PCR反应条件: 95 ℃预变性10 min; 95 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 35个循环后; 72 ℃延伸10 min. PCR产物用2%琼脂糖凝胶电泳, 成像观察甲基化与非甲基化产物条带.
1.2.3 RT-PCR检测5-Aza-CdR处理前后SGC-7901细胞中EDNRB基因的表达: 取对照组和药物处理4 d后的SGC-7901细胞, 按RNA提取试剂盒说明书中步骤提取RNA后制备cDNA模板, 反应体系包括: 2.5 μg RNA, 1 μL dNTP, 2 μL二硫苏糖醇, 5×逆转录缓冲液4 μL, 1 μL寡聚脱氧胸苷酸(Oligo dT), 1 μL核糖核酸酶抑制剂(RNaseOUT), 1 μL莫洛尼鼠白血病病毒(moloney murine leukemia virus, MMLV)逆转录酶. 反应条件: 65 ℃ 5 min, 冰上冷却5 min; 37 ℃ 50 min, 70 ℃ 15 min. RT-PCR扩增: 反应体系中包含cDNA模板1 μL(100 ng). 预变性95 ℃ 10 min, 55 ℃退火30 s, 循环40次, 72 ℃延伸10 min. 引物序列参考文献[5], 产物长度为720 bp. 产物用2%琼脂糖凝胶电泳, 成像观察到目的条带则定义为EDNRB基因mRNA的阳性表达.
1.2.4 MTT法检测5-Aza-CdR作用于SGC-7901细胞后对细胞增殖的影响: 取对数生长期后成规消化, 按每孔3×103个/L种入96孔板, 100 μL/孔, 实验组5-Aza-CdR的终浓度分别为1, 2, 5, 10 μmol/L, 每组设3个复孔, 对照组加等量PBS, 共接种5板, 每日取出1板加入5 g/L MTT液10 μL, 37 ℃孵育4 h后弃去上清液, PBS洗涤2次, 每孔加入二甲基亚砜(DMSO)100 μL, 置摇床振荡10 min后, 酶标仪上测定各孔A490孔值, 计算细胞增殖抑制率(CPTR), CPIR = (对照组A490-实验组A490)/对照组A490×100%; 并以A490值为纵坐标, 时间(d)为横坐标绘制细胞生长曲线.
1.2.5 流式细胞仪检测SGC-7901细胞周期与凋亡的影响: 取对照组和5-Aza-CdR干预4 d后SGC-7901细胞, PBS洗涤2次, 将细胞密度调整为1×109/L, 700 mL/L预冷的乙醇-20 ℃固定24 h以上, 加入RNase A至终浓度为0.1 g/L, 37 ℃温育30 min, 加PI至终浓度为50 mg/L, 室温避光染色30 min后, 用FACS流式细胞仪测定. 数据采用Modifit软件分析. 每组实验设定设定5个复孔, 重复3次.
统计学处理 SPSS17.0统计软件包处理数据, 实验数据以mean±SD表示, 多个样本均数间的两两分析采用LSD-t检验, 两组均数比较采用t检验, P<0.05差异有统计学意义, P<0.01差异有显著统计学意义.
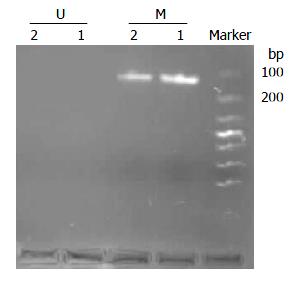
用EDNRB基因甲基化特异性引物扩增出现预期条带, 扩增产物大小为121 bp, 而未甲基化引物未扩增出相应条带(图1).
经4种浓度5-Aza-CdR分别处理后, 出现了杂合状态, 甲基化和非甲基化引物均扩增出产物, 说明甲基化和非甲基化的DNA序列均存在, 表明EDNRB基因启动子区域高甲基化发生了逆转(图2).
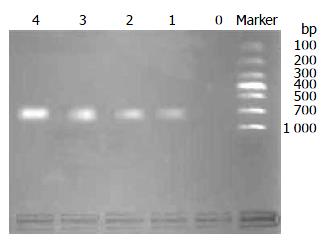
未经5-Aza-CdR处理的SGC-7901细胞中未检测出EDNRB mRNA的表达, 4种不同5-Aza-CdR处理组中均检测出EDNRB mRNA表达, 并随着浓度的增高其表达增强(图3).
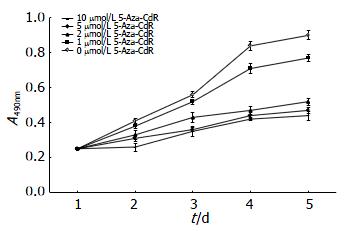
经4种不同浓度5-Aza-CdR作用后, SGC-7901细胞的生长增殖活性均有明显抑制, 与对照组比较, 细胞增殖速度出现不同程度减慢(图4). 在一定范围内5-Aza-CdR浓度越高, 对SGC-7901细胞的抑制作用越明显. 与对照组相比, 差异有统计学意义(P<0.05).
经4种不同浓度5-Aza-CdR作用4 d后, 流式细胞仪分析细胞周期结果显示: 5、10 μmol/L 5-Aza-CdR实验组S期细胞数目增多, G0/G1期细胞减少, 细胞凋亡率显著增高(表1), 说明细胞周期阻滞于S期.
EDNRB基因位于13号染色体q22, 长度大约为24 kb, 含7个外显子和6个内含子, 其编码产物EDNRB属于G蛋白偶联受体超家族, 与配体内皮素(endothelin, ET)结合传递细胞外的信号, 在胚胎发育过程中, EDNRB/ET-3在神经嵴细胞迁移发育分化成神经节细胞时候扮演着重要角色[6-10], 与巨结肠病相关联[11-14]. 有研究[15-25]显示, 在前列腺癌、肺癌、肝癌、食管癌、鼻咽癌、白血病、卵巢癌、恶性黑色素瘤、膀胱癌、子宫内膜癌及肾癌中均有存在EDNRB基因启动子异常高甲基化, 其中前列腺癌、鼻咽癌、肺癌、卵巢癌和食管癌细胞株中经5-Aza-CdR处理后EDNRB基因重新表达.
甲基化改变不像基因突变和缺失等改变, 具有可逆性[26,27]. DNA甲基化的可逆性特征为临床抗肿瘤治疗提供了一种新途径: 应用DNMT抑制剂可以使一些重要基因发生去甲基化, 恢复正常功能. 5-Aza-CdR是第1个被美国FDA批准上市治疗恶性肿瘤的去甲基化药物[2,3]. 目前, 5-Aza-CdR已成功应用于临床的一些实例, 如在急性粒细胞白血病中的应用[28].
我们的研究结果表明, 未经5-Aza-CdR处理的SGC-7901细胞中EDNRB基因启动子区域显示为高甲基化状态, 同时SGC-7901细胞中EDNRB基因mRNA不表达; 经5-Aza-CdR处理后, EDNRB基因的启动子区域高甲基化状态得到逆转, 并可检出EDNRB基因mRNA重新表达, 并且EDNRB基因mRNA的表达水平与药物作用浓度存在一定的正相关. 5-Aza-CdR干预SGC-7901细胞后, 细胞增殖速度减慢, 在一定范围内其抑制SGC-7901细胞增殖的作用呈量效关系, 并使细胞生长停滞在S期, 凋亡率显著升高. 由此可见, EDNRB mRNA表达失活与其基因启动子区域CpG岛高甲基化高度相关, 由于EDNRB基因启动子区域高甲基化而导致其表达失活, EDNRB基因的表达可通过5-Aza-CdR的去甲基化作用而被重新激活, 使其转录活性得到恢复, 从而使EDNRB基因再次发挥肿瘤抑制作用; 另外也说明5-Aza-CdR对SGC-7901细胞有显著的抑制增殖和诱导凋亡的作用, 并在一定程度上呈浓度依赖性, 究其原因, 5-Aza-CdR的去甲基化功能能诱发因高甲基化而封闭的基因重获表达, 通过逆转包括EDNRB基因在内的具有生长调控作用的基因启动子区域的高甲基化的状态, 使这些基因重新获得表达, 从而发挥抑制胃癌细胞生长及促进胃癌细胞凋亡的作用.
我们认为EDNRB基因在胃癌细胞中表达失活与该基因启动子区域CpG岛高甲基化高度相关, 而5-Aza-CdR能够逆转其启动子区域高甲基化状态并恢复EDNRB基因的表达, 使其再次发挥抑癌基因作用, 为胃癌的早期诊断和临床治疗提供了一种新的依据. 对该领域的进一步探讨有利于阐明胃癌发生发展的分子机制, 可能成为胃癌治疗新靶点.
胃癌在我国各种恶性肿瘤中居首位, 目前资料表明胃癌的癌变是一个多因素、多步骤、多阶段发展过程, 涉及癌基因、抑癌基因等的改变. EDNRB基因作为一种抑癌基因, 其启动子高甲基化可能在胃癌的发生发展中有着重要作用. DNA甲基化的可逆性特征可能为临床治疗胃癌提供了一种新途径, 应用DNA甲基转移酶抑制剂可以使EDNRB基因发生去甲基化, 恢复正常功能.
郑鹏远, 教授, 郑州大学第二附属医院消化科
本文首次报道了5-Aza-CdR能有效逆转人胃癌SGC-7901细胞EDNRB基因的异常甲基化, 从而激活因高甲基化导致EDNRB基因沉默的再转录, 诱导该基因的表达, 抑制该细胞的生长.
EDNRB基因可能成为胃癌早期诊断的分子标志物, 同时由于DNA甲基化具有可逆性, 也可为胃癌提供新的治疗靶点.
本文设计合理, 具有一定的理论意义和潜在的实用价值.
编辑: 李薇 电编:何基才
| 2. | Yang AS, Doshi KD, Choi SW, Mason JB, Mannari RK, Gharybian V, Luna R, Rashid A, Shen L, Estecio MR. DNA methylation changes after 5-aza-2'-deoxycytidine therapy in patients with leukemia. Cancer Res. 2006;66:5495-5503. [PubMed] [DOI] |
| 3. | Mossman D, Kim KT, Scott RJ. Demethylation by 5-aza-2'-deoxycytidine in colorectal cancer cells targets genomic DNA whilst promoter CpG island methylation persists. BMC Cancer. 2010;10:366. [PubMed] [DOI] |
| 4. | Lo KW, Tsang YS, Kwong J, To KF, Teo PM, Huang DP. Promoter hypermethylation of the EDNRB gene in nasopharyngeal carcinoma. Int J Cancer. 2002;98:651-655. [PubMed] [DOI] |
| 5. | Pao MM, Tsutsumi M, Liang G, Uzvolgyi E, Gonzales FA, Jones PA. The endothelin receptor B (EDNRB) promoter displays heterogeneous, site specific methylation patterns in normal and tumor cells. Hum Mol Genet. 2001;10:903-910. [PubMed] [DOI] |
| 6. | Saldana-Caboverde A, Kos L. Roles of endothelin signaling in melanocyte development and melanoma. Pigment Cell Melanoma Res. 2010;23:160-170. [PubMed] |
| 7. | Roberts RR, Bornstein JC, Bergner AJ, Young HM. Disturbances of colonic motility in mouse models of Hirschsprung's disease. Am J Physiol Gastrointest Liver Physiol. 2008;294:G996-G1008. [PubMed] [DOI] |
| 8. | Druckenbrod NR, Powers PA, Bartley CR, Walker JW, Epstein ML. Targeting of endothelin receptor-B to the neural crest. Genesis. 2008;46:396-400. [PubMed] [DOI] |
| 9. | Nagy N, Goldstein AM. Endothelin-3 regulates neural crest cell proliferation and differentiation in the hindgut enteric nervous system. Dev Biol. 2006;293:203-217. [PubMed] [DOI] |
| 10. | Barlow A, de Graaff E, Pachnis V. Enteric nervous system progenitors are coordinately controlled by the G protein-coupled receptor EDNRB and the receptor tyrosine kinase RET. Neuron. 2003;40:905-916. [PubMed] [DOI] |
| 11. | Sánchez-Mejías A, Fernández RM, López-Alonso M, Antiñolo G, Borrego S. New roles of EDNRB and EDN3 in the pathogenesis of Hirschsprung disease. Genet Med. 2010;12:39-43. [PubMed] [DOI] |
| 12. | Duan XL, Zhang XS, Li GW. Clinical relationship between EDN-3 gene, EDNRB gene and Hirschsprung's disease. World J Gastroenterol. 2003;9:2839-2842. [PubMed] |
| 13. | Lin YC, Lai HS, Hsu WM, Lee PI, Chen HL, Chang MH. Mutation analysis of endothelin-B receptor gene in patients with Hirschsprung disease in Taiwan. J Pediatr Gastroenterol Nutr. 2008;46:36-40. [PubMed] [DOI] |
| 14. | Sangkhathat S, Chiengkriwate P, Kusafuka T, Patrapinyokul S, Fukuzawa M. Novel mutation of Endothelin-B receptor gene in Waardenburg-Hirschsprung disease. Pediatr Surg Int. 2005;21:960-963. [PubMed] [DOI] |
| 15. | Jerónimo C, Henrique R, Campos PF, Oliveira J, Caballero OL, Lopes C, Sidransky D. Endothelin B receptor gene hypermethylation in prostate adenocarcinoma. J Clin Pathol. 2003;56:52-55. [PubMed] [DOI] |
| 16. | Chen SC, Lin CY, Chen YH, Fang HY, Cheng CY, Chang CW, Chen RA, Tai HL, Lee CH, Chou MC. Aberrant promoter methylation of EDNRB in lung cancer in Taiwan. Oncol Rep. 2006;15:167-172. [PubMed] |
| 17. | Hsu LS, Lee HC, Chau GY, Yin PH, Chi CW, Lui WY. Aberrant methylation of EDNRB and p16 genes in hepatocellular carcinoma (HCC) in Taiwan. Oncol Rep. 2006;15:507-511. [PubMed] |
| 18. | Zhao BJ, Sun DG, Zhang M, Tan SN, Ma X. Identification of aberrant promoter methylation of EDNRB gene in esophageal squamous cell carcinoma. Dis Esophagus. 2009;22:55-61. [PubMed] [DOI] |
| 19. | Zhou L, Feng X, Shan W, Zhou W, Liu W, Wang L, Zhu B, Yi H, Yao K, Ren C. Epigenetic and genetic alterations of the EDNRB gene in nasopharyngeal carcinoma. Oncology. 2007;72:357-363. [PubMed] [DOI] |
| 20. | Hsiao PC, Liu MC, Chen LM, Tsai CY, Wang YT, Chen J, Hsu LS. Promoter methylation of p16 and EDNRB gene in leukemia patients in Taiwan. Chin J Physiol. 2008;51:27-31. [PubMed] |
| 22. | Kumasaka MY, Yajima I, Hossain K, Iida M, Tsuzuki T, Ohno T, Takahashi M, Yanagisawa M, Kato M. A novel mouse model for de novo Melanoma. Cancer Res. 2010;70:24-29. [PubMed] [DOI] |
| 23. | Yates DR, Rehman I, Abbod MF, Meuth M, Cross SS, Linkens DA, Hamdy FC, Catto JW. Promoter hypermethylation identifies progression risk in bladder cancer. Clin Cancer Res. 2007;13:2046-2053. [PubMed] [DOI] |
| 25. | Pflug BR, Zheng H, Udan MS, D'Antonio JM, Marshall FF, Brooks JD, Nelson JB. Endothelin-1 promotes cell survival in renal cell carcinoma through the ET(A) receptor. Cancer Lett. 2007;246:139-148. [PubMed] [DOI] |
| 26. | Luczak MW, Jagodziński PP. The role of DNA methylation in cancer development. Folia Histochem Cytobiol. 2006;44:143-154. [PubMed] |