修回日期: 2010-11-05
接受日期: 2010-11-17
在线出版日期: 2010-12-28
目的: 探讨人参皂甙Rh2诱导人食管癌Eca-109细胞凋亡过程中caspase3、caspase8凋亡调节基因的相互关系及可能的作用机制.
方法: 应用MTT法测定其对细胞的生长抑制作用, 流式细胞术分析人参皂甙Rh2作用后细胞凋亡及增殖的变化, 应用免疫细胞化学及Western blot技术检测用药前后凋亡相关基因caspase3、caspase8蛋白表达的变化.
结果: 人参皂甙Rh2对人食管癌Eca-109细胞有生长抑制作用, 并呈时效和量效依赖关系. 流式细胞仪分析结果发现, 食管癌Eca-109细胞在DNA组方图上出现典型的亚二倍体峰即凋亡峰, 在细胞周期中的分布也发生了明显的变化, 其48 h凋亡率明显高于对照组(19.10%±2.12% vs 2.10%±0.87%, P<0.01). 免疫细胞化学及Western blot技术结果显示, 20 mg/L人参皂甙Rh2作用72 h后食管癌Eca-109细胞caspase3、caspase8蛋白表达明显升高(0.35±0.04 vs 0.10±0.02, 0.84±0.06 vs 0.31±0.11, 均P<0.05).
结论: 人参皂甙Rh2具有诱导食管癌Eca-109细胞凋亡和抑制细胞分化的作用, 其分子机制可能是上调caspase3、caspase8蛋白表达.
引文著录: 彭林涛, 许欣. 人参皂甙Rh2对食管癌Eca-109细胞caspase3、caspase8基因的影响. 世界华人消化杂志 2010; 18(36): 3838-3842
Revised: November 5, 2010
Accepted: November 17, 2010
Published online: December 28, 2010
AIM: To investigate the effect of ginsenoside Rh2 on the expression of caspase 3 and caspase 8 in human esophageal cancer cell line Eca-109 to explore possible mechanisms underlying the apoptosis-inducing activity of ginsenoside Rh2.
METHODS: After Eca-109 cells were treated with ginsenoside Rh2, cell growth was detected by MTT assay; cell apoptosis was determined by flow cytometry; and the expression of apoptosis-associated proteins caspase 3 and caspase 8 was measured by immunocytochemistry and Western blot.
RESULTS: Ginsenoside-Rh2 inhibited the growth of Eca-109 cells in a dose- and time-dependent manner. Apoptotic cells were observed on a DNA histogram as a subdiploid or pre-G1 peak. Treatment with ginsenoside Rh2 significantly altered cell cycle distribution, and the apoptosis rate of cells treated with ginsenoside Rh2 was significantly higher than that of control cells (19.10% ± 2.12% vs 2.10% ± 0.87%, P < 0.01). Compared with control cells, the expression of caspase 3 and caspase 8 proteins was up-regulated significantly in Eca-109 cells treated with 20 mg/L ginsenoside Rh2 for 72 h (0.35 ± 0.04 vs 0.10 ± 0.02, 0.84 ± 0.06 vs 0.31 ± 0.11, both P < 0.05).
CONCLUSION: Ginsenoside Rh2 induces the apoptosis of Eca-109 cells possibly by up-regulating the expression of caspase 3 and caspase 8.
- Citation: Peng LT, Xu X. Ginsenoside Rh2 up-regulates caspase 3 and caspase 8 expression in human esophageal cancer cell line Eca-109. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3838-3842
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3838
人参是我国传统的名贵药材, 人参中含有多种类型的化学成分[1], 人参皂甙具有抗肿瘤、抗衰老、抗辐射等多种生物学活性, 其中人参皂甙单体Rh2(ginsenoside-Rh2, GS-Rh2)是从人参中分离出的原人参二醇型低糖链皂甙单体, 多项研究证实, GS-Rh2、Rg3抑制癌细胞的能力最强[2-6], 并且对正常细胞的毒性甚低. GS-Rh2可以通过诱导细胞凋亡或分化, 有效地抑制多种肿瘤细胞的增殖活性[7-10], 对食管癌细胞的作用研究报道在国内外尚少见. 本研究通过体外培养食管癌Eca-109细胞, 研究GS-Rh2作用后细胞凋亡及其调控基因表达的变化, 探讨GS-Rh2在食管癌细胞中的作用机制, 为食管癌的化学预防提供实验依据.
人食管癌细胞株Eca-109, 由中国人民解放军第四军医大学实验中心提供. GS-Rh2吉林大学基础医学院有机化学教研室, RPMI 1640购自美国Gibco公司, 二甲基亚砜(DMSO)购自美国Sigma公司, 胎牛血清购自天津灏洋生物公司, 考马斯亮蓝蛋白测定试剂盒购自南京建成生物工程研究所, 聚偏二氟乙烯膜(PVDF)购自美国Milipore公司, caspase3兔抗人多克隆抗体购自北京中杉金桥生物技术有限公司进口分装, caspase8鼠抗人单克隆抗体购自美国Abcam公司, SP试剂盒购自北京中杉金桥生物技术有限公司. Epics-XL-Ⅱ型流式细胞仪, 美国Beckman Coulter公司, LDZ5-2型离心机, 北京医用离心机厂, CO2培养箱, 日本SANYO公司, DG5031型酶联免疫检测仪, 华东电子集团医疗装备公司.
1.2.1 细胞实验及分组: 食管癌细胞株Eca-109用含100 mL/L胎牛血清(FBS)的RPMI 1640培养基常规培养. 正常传代, 随机分为不加药的对照组及用5、10、20、40 mg/L的人参皂甙Rh2处理24、48、72 h组, 分别收获细胞进行相关实验.
1.2.2 细胞的生长抑制: 取对数生长期的人食管癌Eca-109细胞, 用0.25%胰蛋白酶+0.02% EDTA消化, 细胞计数, 接种于96孔培养板中, 每孔滴加单细胞悬液200 μL, 培养细胞完全贴壁生长后, 加药GS-Rh2(0、5、10、20、40 mg/L), 培养24、48和72 h. 同时设不含药物的阴性对照组和等体积DMSO的溶剂对照组, 每浓度每时间点设6组, 每孔滴加MTT溶液(5 g/L)20 μL, 继续孵育4 h, 吸弃上清液. 每孔滴加DMSO 200 μL, 酶联免疫检测仪测定, 绘制细胞生长曲线.
1.2.3 FCM检测细胞凋亡和周期变化: 用5、10、20、40 mg/L的GS-Rh2处理细胞24、48、72 h后终止培养, 分别收获细胞. 采用碘化丙啶(propidium iodide, PI)一步插入性DNA荧光染色方法. DNA染液中含PI 50 mg/L、RNA酶10 mg/L及1% Triton-X 100. 先用0.01 mol/L PBS离心洗涤2次, 去除样品中的70%乙醇. 每份样品中加入DNA染液1 mL, 在4 ℃冰箱中染色30 min. 上机检测前以500目筛网过滤, 应用流式细胞仪进行检测. 根据亚G1峰的分布组方图计算细胞凋亡率. 应用DNA细胞周期分析软件, 计算出DNA组方图各时相分布的百分比.
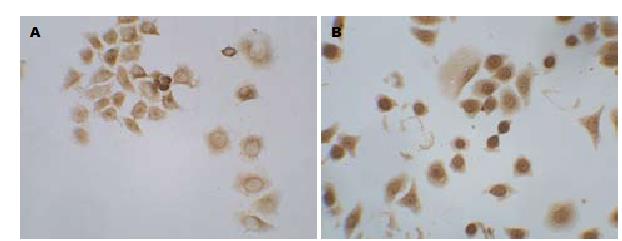
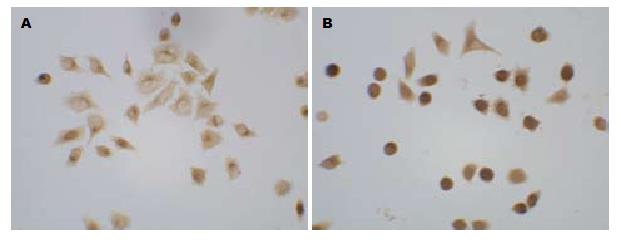
1.2.4 免疫细胞化学检测: 将细胞接种到预先放置了消毒盖玻片的6孔板, 置CO2培养箱孵育, 进行细胞培养. 20 mg/L的GS-Rh2处理细胞分别培养24、48、72 h后终止培养, 每组6孔细胞, 取出盖玻片, 浸入0.01 mol/L PBS洗涤3次, 每次3 min. 加冷丙酮于室温固定10 min, 分别对caspase3、caspase8的表达进行检测. 按SP试剂盒操作说明进行. DAB显色后每张切片取10个高倍视野, 每个视野大约20个细胞, 采用图像分析软件Image-pro Plus 5.0分析积分吸光度值(IA), 以平均值作为最终结果.
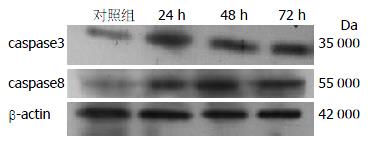
1.2.5 Western blot检测细胞凋亡基因蛋白的表达: 收集细胞, PBS洗涤2次, 加入200 mL蛋白裂解液, 冰浴1 h, 4 ℃ 10 000×g离心20 min, 吸取上清液, 考马斯亮蓝试剂盒测定蛋白浓度. -70 ℃保存. 每份取30 μg细胞总蛋白进行10%变性蛋白的SDS聚丙烯酰胺凝胶电泳, 电泳后, 转至PVDF膜, 37 ℃用5%脱脂奶粉封闭2 h, 加入一抗caspase8、caspase3(1:200稀释), β-actin(1:200稀释), 加辣根过氧化物酶标记的羊抗兔或小鼠IgG(1:5 000稀释), 37℃孵育2 h, 洗膜后加入ECL发光试剂, 在X线胶片上曝光, 显影, 定影. Western blot图片应用凝胶成像系统(美国UVP公司)测定光密度值, 目的基因与β-actin光密度值的比值作为其基因的相对含量.
统计学处理 实验数据均用mean±SD表示, 采用SPSS11.5统计软件进行统计分析, 两组间均数比较采用t检验, 检验水准α = 0.05.
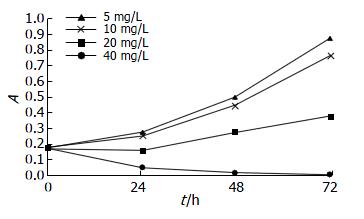
结果显示GS-Rh2对Eca-109细胞有生长抑制作用, 其抑制作用随药物浓度增加、作用时间延长而增强, 呈现时效和量效关系, GS-Rh2对细胞生长的半数抑制浓度(IC50)为20 mg/L(图1).
GS-Rh2能诱导Eca-109细胞发生凋亡, 凋亡率随浓度的增高及时间的延长而明显升高, 与对照组相比, 差异有显著性(P<0.05). GS-Rh2将Eca-109细胞阻滞于G0/G1期, 随着浓度的增高及作用时间的延长, G0/G1期细胞数逐渐增加, S和G2/M期细胞数逐渐减少. 与对照组比较, 差异具有统计学意义(P<0.01或0.05), 有明显的量效及时效关系(表1).
caspase3、caspase8蛋白阳性物质主要位于细胞质. 采用图像分析软件Image-pro Plus 5.0分析阳性区域IA值, 对照组中, caspase3和caspase8蛋白在细胞中表达于20 mg/L GS-Rh2处理后表达水平明显降低, 差异具有统计学意义(P<0.05, 图2, 3, 表2).
大量的研究表明, 虽然大多数化疗药物都具有诱导肿瘤细胞凋亡的作用, 但化疗药物的不良反应限制了其临床应用, 而植物抗癌成分越来越受到人们关注, 人参具有抗肿瘤、抗衰老、抗辐射等多种生物活性作用[11-14]. 人参抗肿瘤的活性成分主要是人参皂甙, GS-Rh2是由人参中提取的天然活性成分, 属于二醇组皂甙. 可直接作用于癌细胞, 通过诱导其凋亡抑制肿瘤的生长. 自从Odashima等[15]报道了从红参中提取的有效成分Rh2在体外对鼠黑色素瘤B16细胞具有分化诱导作用后, 各国学者先后通过多种体内外实验证实[16], Rh2可以通过诱导分化或凋亡, 抑制多种肿瘤细胞的增殖与生长, 并证明对正常细胞的毒性甚低. Fei等[17]研究发现人参皂甙Rh2诱导黑色素瘤细胞A375-S2凋亡的机制部分依赖于caspase-8和caspase-3通路. 李殿友等[18]2000年发表文章首次报道了Rh2对C6胶质瘤细胞的增殖影响, 在该实验中发现: Rh2作用72 h后, 浓度为4 μmol/L的Rh2对C6胶质瘤细胞诱导凋亡作用最为明显. 日本学者研究发现Rh2在体外浓度为10-60 μmol/L间能够以剂量依赖方式抑制各种已知的人类卵巢癌细胞株的增殖, 并且在IC50浓度左右导致细胞凋亡[19]. Kim等[20]研究发现GS-Rh2诱导人神经母细胞瘤SK-N-BE(2)细胞凋亡过程中, 需要caspase1和caspase3的激活和Bax的表达增加. 本研究通过体外培养食管癌Eca-109细胞, 观察GS-Rh2对其细胞凋亡的影响, 以及细胞凋亡相关调控因子caspase8和caspase3基因表达的变化, 以探讨其抗癌作用的机制. 结果表明GS-Rh2能够抑制Eca-109细胞的增殖, 并且呈现出明显的时效和量效关系, 结果与GS-Rh2在其他肿瘤中的作用类似[21-29], 是GS-Rh2抗肿瘤机制的理论基础之一.
近年来研究发现许多肿瘤药物作用于肿瘤细胞的G0/G1期, 本实验用流式细胞仪分析细胞凋亡和细胞周期, 结果显示GS-Rh2能诱导Eca-109细胞发生凋亡, 凋亡率随浓度的增高及时间的延长而明显升高. 随着浓度的增高及作用时间的延长, G0/G1期细胞数逐渐增加, S和G2/M期细胞数逐渐减少. 提示GS-Rh2将Eca-109细胞阻滞于G0/G1期, 从而抑制其DNA合成. 我们的实验结果与其他报道相一致[30-33].
本研究观察并检测了GS-Rh2作用前后Eca-109细胞中细胞凋亡调控因子caspase8和caspase3蛋白的表达, 结果显示20 mg/L GS-Rh2处理细胞后caspase8和caspase3基因表达水平增高, 而且有较明显的时效关系, 这与在其他肿瘤细胞系中的研究结果类似, 可能通过启动细胞凋亡信号传导系统, 凋亡信号通过细胞质信号蛋白传递至细胞凋亡的执行者caspase, 再由激活的caspase对其特异性底物进行降解, 最终caspase3的活化导致细胞DNA的裂解造成细胞凋亡[34,35]. 进一步证实了caspase8-caspase3通路在细胞凋亡中的重要作用.
总之, 本研究为阐明GS-Rh2的抗癌机制, 指导临床应用GS-Rh2治疗食管癌及其他恶性肿瘤提供实验依据.
人参皂甙单体Rh2可直接作用于癌细胞, 通过诱导其凋亡, 抑制肿瘤的生长, 包括对胃癌、肺癌、前列腺癌、卵巢癌等多种肿瘤细胞, 其中对食管癌细胞的作用研究报道在国内外尚少见.
李晟磊, 副主任医师, 郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室、郑州大学医学院病理教研室
自从发现人参抗肿瘤的活性成分主要是人参皂甙Rh2, 各国学者先后通过多种体内外实验证实, Rh2通过诱导分化或凋亡, 抑制多种肿瘤细胞的增殖与生长, 对多种癌细胞作用机制的探讨成为研究重点.
Santini等检测了99例结肠直肠肿瘤原发灶和转移灶中的K-ras突变情况, 发现仅有4例(4%)表达不一致.
细胞凋亡的不足是肿瘤发生的重要原因, 而通过多种途径诱导肿瘤细胞凋亡是人参皂甙抗肿瘤的重要机制之一, 其中对食管癌细胞的作用研究报道尚少见. 本研究阐明GS-Rh2对食管癌的作用机制, 证实caspase8-caspase3通路在细胞凋亡中的重要作用.
本文研究证明, GS-Rh2可通过诱导食管癌细胞凋亡而抑制肿瘤的生长. 为临床指导应用GS-Rh2治疗食管癌及其他恶性肿瘤提供实验依据.
本文实验设计合理, 具有一定的科学意义及临床应用价值.
编辑: 李薇 电编:何基才
| 4. | 何 芳. 人参皂甙Rg3抗肿瘤作用的实验研究进展. 河南科技大学学报(医学版). 2005;23:155-156. |
| 6. | 简 捷, 刘 利珍, 李 小燕, 胡 志方, 王 韬, 黄 缘. 人参皂苷Rg3对人肝癌细胞Pim-3及Bad凋亡蛋白表达的影响. 世界华人消化杂志. 2008;16:2229-2233. [DOI] |
| 7. | Popovich DG, Kitts DD. Ginsenosides 20(S)-protopanaxadiol and Rh2 reduce cell proliferation and increase sub-G1 cells in two cultured intestinal cell lines, Int-407 and Caco-2. Can J Physiol Pharmacol. 2004;82:183-190. [PubMed] [DOI] |
| 8. | Oh JI, Chun KH, Joo SH, Oh YT, Lee SK. Caspase-3-dependent protein kinase C delta activity is required for the progression of Ginsenoside-Rh2-induced apoptosis in SK-HEP-1 cells. Cancer Lett. 2005;230:228-238. [PubMed] [DOI] |
| 9. | Cheng CC, Yang SM, Huang CY, Chen JC, Chang WM, Hsu SL. Molecular mechanisms of ginsenoside Rh2-mediated G1 growth arrest and apoptosis in human lung adenocarcinoma A549 cells. Cancer Chemother Pharmacol. 2005;55:531-540. [PubMed] [DOI] |
| 14. | Park E. 人参皂甙Rh2的抗过敏活性. 国外医学·中医中药分册. 2005;27:35-36. |
| 15. | Odashima S, Ohta T, Kohno H, Matsuda T, Kitagawa I, Abe H, Arichi S. Control of phenotypic expression of cultured B16 melanoma cells by plant glycosides. Cancer Res. 1985;45:2781-2784. [PubMed] |
| 17. | Fei XF, Wang BX, Tashiro S, Li TJ, Ma JS, Ikejima T. Apoptotic effects of ginsenoside Rh2 on human malignant melanoma A375-S2 cells. Acta Pharmacol Sin. 2002;23:315-322. [PubMed] |
| 19. | Nakata H, Kikuchi Y, Tode T, Hirata J, Kita T, Ishii K, Kudoh K, Nagata I, Shinomiya N. Inhibitory effects of ginsenoside Rh2 on tumor growth in nude mice bearing human ovarian cancer cells. Jpn J Cancer Res. 1998;89:733-740. [PubMed] |
| 20. | Kim YS, Jin SH. Ginsenoside Rh2 induces apoptosis via activation of caspase-1 and -3 and up-regulation of Bax in human neuroblastoma. Arch Pharm Res. 2004;27:834-839. [PubMed] [DOI] |
| 25. | 周 桂华, 孟 艳, 李 扬, 赵 雪俭, 陈 燕萍, 马 兴元. 人参单体皂甙Rh2对体外培养的前列腺癌细胞株PC-3M抑制效应的研究. 白求恩医科大学报. 2001;27:595-597. |
| 30. | Lee KY, Park JA, Chung E, Lee YH, Kim SI, Lee SK. Ginsenoside-Rh2 blocks the cell cycle of SK-HEP-1 cells at the G1/S boundary by selectively inducing the protein expression of p27kip1. Cancer Lett. 1996;110:193-200. [PubMed] [DOI] |
| 31. | Ota T, Kohno H, Maeda M, Tanino M, Odashima S. Involvement of peanut agglutinin-binding sugar chains in experimental metastasis of B16 melanoma cells. Oncol Res. 1993;5:235-243. [PubMed] |