修回日期: 2010-11-16
接受日期: 2010-11-23
在线出版日期: 2010-12-18
目的: 研究survivin在活化的肝星状细胞(HSC)中的表达及反义寡核苷酸(ASODN)对HSC-T6细胞株凋亡的影响.
方法: 实验设置空白对照组(脂质体和寡核苷酸均不加), 空脂质体组(只加脂质体不加寡核苷酸), 正义链转染对照组(SODN 1 000 nmol/L)和不同浓度的反义链转染组(ASODN分为400、800和1 000 nmol/L组), 共6组. 用细胞免疫荧光检测survivin在活化的HSC中的表达, 并以肝癌细胞和肝细胞为对照. 脂质体介导survivin寡核苷酸(ODN)转染HSC-T6细胞6 h后, 倒置荧光纤维镜下观察转染效率. survivin的ODN转染HSC-T6细胞48 h后, 通过RT-PCR, Western blot检测survivin基因表达的改变, PI单染流式细胞仪测定细胞凋亡率.
结果: 细胞免疫荧光显示survivin在活化的HSC中高表达, 其阳性率明显高于肝细胞, 两者比较有显著性差异(66.07%±8.55% vs 9.74%±2.68%, P<0.05). 在肝癌细胞中表达率最高, 阳性率可达69.41%±9.10%. 倒置荧光显微镜下观察可见, ASODN各浓度组细胞内均可见到清晰的绿色荧光, 转染效率均达到80%. RT-PCR及Western blot结果显示: 与空白组、空脂质体组、SODN组比较, ASODN各浓度组survivin mRNA(分别为0.94±0.03, 0.95±0.04, 0.92±0.04, 0.64±0.02, 0.54±0.02和0.26±0.01)及蛋白表达(分别为0.84±0.02, 0.82±0.03, 0.81±0.02, 0.53±0.02, 0.38±0.01和0.20±0.01)均低于各对照组, 且差异有显著性(均P<0.01); PI单染流式细胞仪检测显示: 与空白组、脂质体组、SODN组比较, ASODN各浓度组的细胞凋亡率明显提高(19.00%±0.53%, 29.80%±1.54%, 48.70%±2.00% vs 5.21%±0.41%, 5.24%±2.23%, 6.35%±1.95%; 均P<0.01), 以上检测指标呈剂量依赖性. 且空白对照组、空脂质体组、SODN组(1 000 nmol/L)之间比较无统计学差异(均P>0.05).
结论: survivin在活化的HSC中有明显表达, 可能与活化的HSC中抑凋亡基因survivin过度表达有关. 因此, 抑制survivin表达就能抑制激活的HSC增殖、促进其凋亡. survivin ASODN能下调HSC-T6细胞中survivin基因的表达, 从而诱导HSC-T6细胞的凋亡.
引文著录: 彭安邦, 张秀梅, 丁由. Survivin在活化的肝星状细胞中的表达及反义寡核苷酸对其凋亡的影响. 世界华人消化杂志 2010; 18(35): 3724-3731
Revised: November 16, 2010
Accepted: November 23, 2010
Published online: December 18, 2010
AIM: To investigate the expression of survivin in activated hepatic stellate cell (HSC) and the effect of transfection of antisense oligonucleotide (ASODN) targeting the survivin gene on apoptosis of HSC-T6 cells.
METHODS: The experiment set the control group which not added liposome and oligonucleotide (ODN), liposome group which only added liposome, sense oligonucleotide (SODN) group (1 000 nmol/L) and 400, 800, 1 000 nmol/L ASODN group. The expression of survivin protein in activated HSC, hepatic carcinoma cells, and normal liver cells was detected by immunofluorescence. ASODN targeting the survivin gene was transfected into HSC-T6 cells with LipofectamineTM 2000, and transfection efficiency was detected by fluorescence microscopy. Forty-eight hours after transfection, the changes in survivin mRNA and protein expression were assessed by RT-PCR and Western blot, respectively, and cell apoptosis was measured by PI staining and flow cytometry.
RESULTS: The positive rate of survivin expression in activated HSC was significantly higher than that in normal liver cells (66.07% ± 8.55% vs 9.74% ± 2.68%, P < 0.05). The positive rate of survivin expression was highest in hepatic carcinoma cells among the three groups of cells (69.41% ± 9.10%). Strong green fluorescence was observed by fluorescence microscopy in cells transfected with different concentrations of ASODN, and the transfection efficiency reached 80%. Compared with blank control cells and cells transfected with empty lipofectamineTM 2000 or control oligonucleotide, the expression levels of survivin mRNA (0.94 ± 0.03, 0.95 ± 0.04 and 0.92 ± 0.04 vs 0.64 ± 0.02, 0.54 ± 0.02 and 0.26 ± 0.01) and protein (0.84 ± 0.02, 0.82 ± 0.03 and 0.81 ± 0.02 vs 0.53 ± 0.02, 0.38 ± 0.01 and 0.20 ± 0.01) were significantly decreased (all P < 0.01), and the apoptosis rate (19.00% ± 0.53%, 29.80% ± 1.54% and 48.70% ± 2.00%, respectively) significantly increased (all P < 0.01) in cells transfected with different concentrations of ASODN.
CONCLUSION: Survivin is highly expressed in activated HSC-T6 cells. Down-regulation of survivin expression by transfection of ASODN targeting the survivin gene can induce apoptosis of HSC-T6 cells.
- Citation: Peng AB, Zhang XM, Ding Y. Expression of survivin in activated hepatic stellate cells and effect of transfection of antisense oligonucleotide targeting the survivin gene on apoptosis of HSC-T6 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(35): 3724-3731
- URL: https://www.wjgnet.com/1009-3079/full/v18/i35/3724.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i35.3724
肝纤维化(hepatic fibrosis, HF)是各种慢性肝病向肝硬变发展的必经阶段, 能否将病变终止于HF阶段或者逆转正常是治疗慢性肝病的关键[1-3]. HF发生最终共同途径是肝星状细胞(hepatic stellate cell, HSC)的激活, HSC活化是HF形成的中心环节[4,5]. 在各种治疗HF的方法中, 以HSC为靶点成为目前的研究热点[6-14]. 但目前尚未在HSC上找到任何完全特异的基因和受体分子, 仍无有效却特异性治疗.
最近有研究报道survivin在激活的HSC中有表达[15]. 为探讨survivin表达是否与激活的HSC凋亡相关, 本研究以大鼠HSC细胞株HSC-T6为对象, 设计并合成靶向survivin的反义寡核苷酸(antisense oligonucleotide, ASODN), 转染HSC-T6细胞, 检测survivin的ASODN对survivin基因表达的影响, 及其对HSC-T6细胞增殖及凋亡的影响, 期望为HF的基因治疗提供实验依据.
HSC细胞株HSC-T6, 由上海中医药大学徐列明教授提供, 系SV40转染的大鼠HSC, 具有活化HSC的表型. 使用含100 mL/L胎牛血清的高糖DMEM培养基, 37 ℃, 33 mL/L CO2培养箱中静置培养, 取对数生长期细胞进行实验. 人肝癌细胞株(human hepatoma cells)HepG2由中南大学湘雅细胞库提供, 大鼠肝细胞(buffalo rat liver, BRL)细胞株购自中科院上海细胞库.
1.2.1 细胞培养: HSC-T6、HepG2与BRL接种在含100 mL/L胎牛血清的高糖DMEM培养液中, 置37 ℃ 33 mL/L CO2孵育箱中培养, 每2-3 d更换培养液, 待细胞生长至贴满培养瓶壁时, 用0.25%胰酶消化传代, 传代后冻存. 细胞密度: 细胞密度(个/mL) = (细胞计数总和/4)×104.
1.2.2 分组: 本实验设置空白对照组(脂质体和寡核苷酸均不加), 空脂质体组(只加脂质体不加寡核苷酸), 正义链转染对照组(sense oligonucleotide, SODN 1 000 nmol/L)和不同浓度的反义链转染组(ASODN分为400、800和1 000 nmol/L组), 共6组.
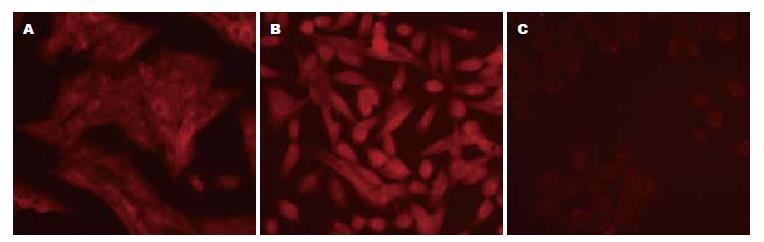
1.2.3 免疫荧光法检测survivin蛋白: 将状态良好的HSC-T6、HepG2与BRL细胞处理后按试剂盒说明书逐步进行. 在荧光显微镜下观察结果, 在绿光激发下发红光为有表达, 各组细胞均随机取10个不同的高倍镜视野, 计算阳性细胞百分率.
1.2.4 脂质体转染试剂与survivin寡核苷酸复合物的制备及转染: 倒置显微镜下观察细胞生长情况, 取对数生长期的HSC-T6细胞进行转染. 取1×109/L单细胞混悬液以1 mL每孔加入6孔板中, 置于37 ℃、浓度为33 mL/L的CO2培养箱培养, 待细胞达到70%-80%聚集密度时, 准备转染. 按照LipofectamineTM 2000转染试剂盒说明书进行转染. 清洗板中细胞2次, 每孔分别加入800 μL不含青、链霉素的无血清DMEM培养基, 然后将各不同实验组200 μL溶液C分别轻铺于6个孔, 每组设3个复孔, 并标记. 37 ℃, 33 mL/L CO2培养箱中静置培养6 h后, 各组换有血清培养基培养致48 h.
1.2.5 survivin ASODN转染效率的检测: 于转染作用后6 h去掉培养基, 用PBS冲洗2次, 1.44 mol/L甲醛固定20 min, 再用冷D-PBS液洗3次, 然后在荧光显微镜检测转染效率. 每孔随机取5个视野(×400), 在可见光下记数视野内细胞总数, 在紫外光下记数被转染细胞数, 取平均值, 按计算转染效率: 转染效率 = 被转染细胞数/细胞总数×100%. 各实验组均设3个复孔, 实验重复3次.
1.2.6 总RNA提取: 总RNA提取按Omega公司试剂盒说明书逐步进行. 用紫外分光光度计测量260 nm和280 nm的吸光值. 若所提取样品A260/A280 = 1.8-2.0, 则提取成功, 根据公式(40 mg/L×A260nm×稀释倍数)计算样品RNA浓度.
1.2.7 逆转录cDNA第一链的合成: 逆转录cDNA第一链的合成按Omega公司逆转录-多聚酶链反应试剂盒说明书逐步进行.
1.2.8 PCR: 依据文献[16]寡核苷酸序列如下: ASODN: 5'-CCCAGCCTTCCAGCTCCTTG-3'; SODN: 5'-CAAGGAGCTGGAAGGCTGGG-3'; 由上海生工生物有限公司合成, 2组寡核苷酸均采用全程硫代修饰, 部分ASODN经5'-FITC标记. 依据文献[17], PCR序列如下: survivin上游: 5'-CAACCTGGACCTGAGTGACAT-3'; 下游: 5'-CCACCCATAGATCCTGTCAGA-3', 扩增片段长度为260 bp. GAPDH上游: 5'-CCATCACCATCTTCCAGGAG-3'; 下游: 5'-CCTGCTCACCACCTTCTTG-3', 扩增片段长度为575 bp. PCR引物序列由上海生工生物有限公司合成. 配置的25 μL体积PCR扩增体系: 2×PCR Master, 12.5 μL; RNase-free ddH2O 9.5 μL; cDNA 1 μL; survivin或GAPDH上下游引物各1 μL, 轻轻混匀并1 000 r/min离心10 s使溶液沉积在离心管底. PCR扩增: 94 ℃预变性4 min后进入PCR循环, survivin和GAPDH, 94 ℃变性30 s, 57 ℃复性30 s, 72 ℃延伸30 s, 共35个循环, 即得PCR扩增产物.
1.2.9 电泳检测: 制备琼脂糖凝胶, 检测PCR产物, 透射紫外灯下观察电泳带, 再置入凝胶成像分析系统Total Lab软件测定条带平均灰度值并拍照留底, 计算mRNA灰度比值: mRNA灰度比值 = 产物电泳条带密度/GAPDH产物条带密度×100%.
1.2.10 Western blot检测各组细胞survivin蛋白表达: 提取细胞的总蛋白, 用酶标仪进行蛋白定量. SDS-PAGE电泳, 暗室中用蛋白荧光检测试剂盒显示结果于X光片, 凝胶图像分析.
1.2.11 流式细胞仪(FCM)检测细胞凋亡率: 处理48 h后, 收集6孔板各组细胞, 用PBS吹打细胞成单细胞悬液, 各组取1×106细胞, 1 000 r/min离心5 min, 弃上清, 冷PBS 3 mL洗2遍, 4 ℃ 13.1 mol/L冷乙醇固定1-2 h. 离心弃固定液, 3 mL PBS重悬5 min. 加1 g/L 20 µL RNaseA 37 ℃水浴30 min. 用100 mg/L 1 mL PI染液染色, 4 ℃避光30 min. 上机检测细胞凋亡情况, 重复3次, 取平均数.
统计学处理 所有实验结果采用mean±SD表示, 组间比较用单向方差分析, 用软件SPSS13.0进行统计, P<0.05为差异有显著性意义.
在HSC中可见survivin蛋白明显表达明显, 其荧光强度显著强于BRL细胞, 而稍弱于肝癌细胞. HSC、HepG2、BRL的survivin免疫荧光阳性表达率分别为66.07%±8.55%、69.41%±9.10%和9.74%±2.68%. HSC的阳性表达率明显高于BRL, 两者比较有显著性差异(P<0.05). HSC与HepG2之间比较无统计学意义(P>0.05, 图1).
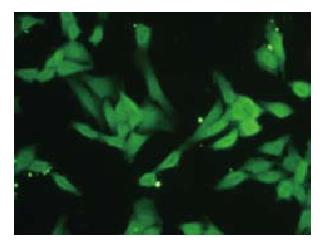
FITC标记的ASODN各浓度组转染作用后6 h, 于倒置荧光显微镜下均可见到细胞内清晰的绿色荧光, 转染效率均达到80%(图2).
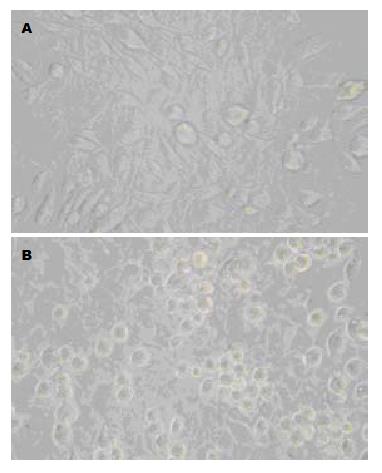
survivin ASODN转染作用HSC-T6细胞48 h后, 倒置显微镜下观察: 各对照组细胞形态基本正常, 贴壁性良好, 生长旺盛(图3A); ASODN组细胞体积减小, 形态不整或鼓泡、细胞周围有透明圈, 一些细胞变圆、皱缩, 细胞数量减少, 间隙增大, 脱壁悬浮细胞增多, 细胞生长缓慢(图3B).
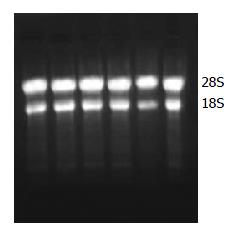
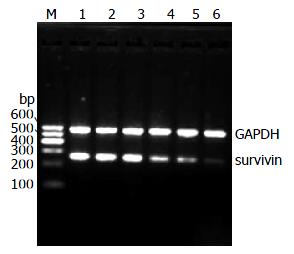
2.4.1 总RNA的鉴定: 经1.0%琼脂糖凝胶电泳, 紫外投射仪下可见2条清晰的条带, 由上到下分别为28S、18S, 且28S/18S>1.5, 提示RNA无明显降解(图4).
2.4.2 survivin ASODN对HSC-T6细胞survivin mRNA表达的影响: RT-PCR产物电泳结果显示, 在576 bp处各组均可见到均匀一致的GAPDH基因的条带; 在260 bp处各组细胞均出现不同程度的特异性survivin基因条带. 用图像分析仪对扩增产物进行分析. 结果显示, ASODN 400、800和1 000 nmol/L转染组、SODN 1 000 nmol/L转染组、空脂质体组及空白对照组survivin/GAPDH吸光度比值分别为: 0.94±0.03, 0.95±0.04, 0.92±0.04, 0.64±0.02, 0.54±0.02和0.26±0.01. 各ASODN组survivin mRNA表达量均低于各对照组survivin mRNA表达量且差异有显著性(P<0.01), 并且随着ASODN转染浓度的增大, survivin mRNA表达量逐渐降低, 呈现剂量依赖性. 空白对照组、空脂质体组及正义对照组中HSC-T6细胞survivin mRNA表达量差异无显著性(P>0.05, 图5).
Western blot结果显示, ASODN 400、800和1 000 nmol/L转染组、SODN 1 000 nmol/L转染组、空脂质体组及空白对照组survivin/GAPDH灰度值比值分别为: 0.84±0.02, 0.82±0.03, 0.81±0.02, 0.53±0.02, 0.38±0.01和0.20±0.01. 各ASODN组survivin蛋白表达量均低于各对照组survivin蛋白表达量且差异有显著性(P<0.01), 并且随着ASODN转染浓度的增大, survivin蛋白表达量逐渐降低, 呈现剂量依赖性. 空白对照组、空脂质体组及正义对照组中HSC-T6细胞survivin蛋白表达量差异无显著性(P>0.05, 图6).
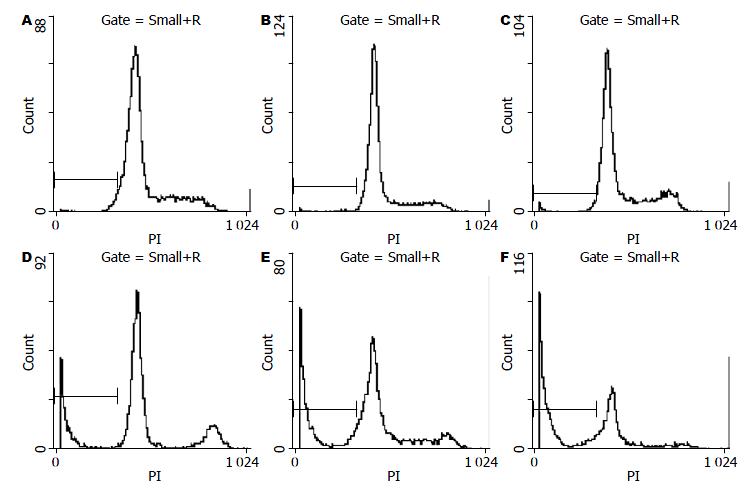
细胞凋亡时, FCM检测细胞DNA含量可在2倍体峰(G1峰)左侧呈现亚二倍体核型峰(Ap峰)特征. 在空白对照组和SODN组未见明显Ap峰型; 而ASODN组细胞, 可见明显Ap峰出现, 并且随着ASODN较染浓度增加而增加, 呈现剂量依赖性(表1, 图7).
HF是肝脏对各种原因所致肝损伤的创伤愈合反应, 表现为肝内结缔组织增生与沉积, 是各种慢性肝病向肝硬变发展的必经阶段. 各种不同病因引起肝脏慢性损伤的病理过程不同, 但HF发生最终共同途径是HSC的激活, 活化的HSC可以合成大量的胶原(除Ⅴ型胶原)、透明质酸、层粘连蛋白、纤维连接蛋白等, 并参与胶原酶及其抑制物的合成及调节[18-20]. HSC合成胶原的量是肝细胞的10多倍, 是窦状隙内皮细胞的20余倍. HSC还可通过分泌金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, TIMPs)[21]、转化生长因子β(transforming growth factor β, TGF-β)[22]等阻碍细胞外基质(extracellular matrix, ECM)的降解及进一步激活静止的HSC, 形成恶性循环, 很难逆转. 随着HSC活化机制的阐明, 以HSC为靶点成为治疗HF的重要策略[23-26], 寻找HSC特异的基因或受体分子, 可有望成为HF治疗突破口.
近年研究发现凋亡蛋白抑制因子(inhibitor of apoptosis protein, IAP)家族在细胞凋亡的基因调控中发挥着重要作用. IAP家族是一类进化中高度保守的凋亡抑制蛋白, 在体外能够直接抑制细胞凋亡. survivin基因表达有明显的组织选择性, 在胚胎组织及恶性肿瘤中普遍高表达, 如胃癌、结直肠癌、乳腺癌、肺癌等[27-36], 但在分化成熟的组织(除胎盘、增殖期子宫内膜、分泌期子宫内膜有微量表达外)及癌旁正常组织中无表达. 目前, 众多学者认为, survivin是作用最强的凋亡抑制因子, 主要通过直接抑制caspase级联反应下游的终末子caspase-3和7的活性, 阻止由caspase激活剂或凋亡诱导剂诱导的细胞DEVD cleaving自杀酶的累积, 从而发挥抗凋亡作用. 由此可见survivin是活性很强的凋亡抑制蛋白, 加上其特异的组织选择性, 将survivin作为肿瘤治疗耙点备受关注.
现已知HF可以逆转[3], 在HF恢复期, 激活状态的HSC减少主要通过凋亡机制而不是表型的转化, 凋亡的细胞可以在数小时内被周围的细胞所吞噬, 很少引起微环境的炎症损伤, 是一种理想清除增值的HSC[37], 活化的HSC凋亡是HF逆转的关键[38]. 本课题探讨HSC中survivin的表达, 是否与HSC凋亡有关.
最近研究报道活化的HSC中survivin蛋白表达明显高于静止的HCS[15]. 我们在实验中用免疫荧光染色技术, 证实了活化的HSC-T6细胞中survivin基因有较高的表达, 明显高于肝细胞, 略弱于肝癌细胞. 本实验用人工合成的特定survivin ASODN分子, 通过脂质体为载体转染HSC-T6细胞, 抑制HSC-T6细胞中survivin基因表达. 实验结果表明利用OligofectamineTM Reagent脂质体法转染的ASODN, 于转染6 h后荧光倒置显微镜下观察发现, ASODN各浓度组细胞内均可见到清晰的绿色荧光, 转染效率均达到80%.
survivin ASODN转染作用HSC-T6细胞48 h后, 本实验用RT-PCR及Western blot检测survivin基因表达的变化, 结果显示: 与对照组相比, 随着ASODN转染浓度的增加, survivin mRNA和蛋白表达量呈递减趋势(P<0.01), 而各对照组之间相互比较, survivin mRNA表达量差异无显著性(P>0.05). Grossman等[39]将survivin ASODN转染角质形成细胞株Halat细胞, 导致内源性survivin水平下降. 我们得出的结果与该文献报道相符.
本实验转染作用48 h后于倒置显微镜下观察了细胞形态变化, 发现各对照组细胞形态基本正常, 贴壁性良好, 生长旺盛; ASODN组细胞体积减小, 形态不整或鼓泡、细胞周围有透明圈, 一些细胞变圆、皱缩, 细胞数量减少, 间隙增大, 脱壁悬浮细胞增多, 细胞生长缓慢.
为了进一步研究survivin ASODN抑制survivin基因的表达, 是否能诱导HSC-T6细胞的凋亡, 在survivin ASODN作用HSC-T6细胞48 h后, 本实验还对HSC-T6细胞凋亡进行了检测. 流式结果表明: 与各对照组比较, 各ASODN浓度组凋亡率明显增高, 差异存在统计学意义(P<0.01). 以上结果与Ambrosini等[40]、Mesri等[41]研究反义survivin诱导Hela细胞及内皮细胞凋亡结果相似.
总之, 本实验研究结果表明抑凋亡基因survivin在活化的HSC-T6细胞中有较高的表达, 明显高于肝细胞, 略弱于肝癌细胞. 激活HSC中为什么会有survivin表达呢? 是否与甲状腺、胸腺及生殖腺细胞一样在正常生理情况下也有survivin表达? 或者是HSC激活后, 某种机制作用于survivin基因而大量表达, 使其增殖和凋亡特性发生变化, 活跃程度介于一般生理细胞与肿瘤细胞之间, 要回答这些问题还有待进一步深入研究. survivin ASODN能下调HSC survivin基因表达, 并诱导HSC的凋亡, 为HF基因治疗可能提供了新的方法.
肝星状细胞(HSC)是导致肝纤维化的主要细胞, 是产生细胞外基质的主要来源, HSC的激活是形成肝纤维化的中心环节, 抑制HSC增殖与诱导其凋亡是治疗肝纤维化的关键所在. survivin是凋亡抑制蛋白家族作用最强的一个新成员, 最近研究发现激活增殖的HSC, survivin蛋白表达明显增加. 设计合成高特异性的survivin反义寡核苷酸序列, 抑制survivin表达, 诱导HSC凋亡, 抑制细胞增殖, 从而达到治疗目的.
黄晓东, 主任医师, 武汉市中心医院消化内科
HSC活化是HF形成的中心环节. 在各种治疗HF的方法中, 以HSC为靶点成为目前的研究热点. 但目前尚未在HSC上找到任何完全特异的基因和受体分子, 仍无有效却特异性的治疗方法.
Grossman等将survivin ASODN转染角质形成细胞株Halat细胞, 导致内源性survivin水平下降.
本文采用细胞荧光免疫、细胞转染、RT-PCR及Western blot等技术联合检测转染survivin反义寡核苷酸抑制肝星状细胞中survivin蛋白的表达, 流式细胞仪检测survivin反义寡核苷酸转染后细胞凋亡.
抑制survivin表达就能抑制激活的HSC增殖、促进其凋亡. survivin ASODN能下调HSC-T6细胞中survivin基因的表达, 从而诱导HSC-T6细胞的凋亡.
本文新颖性较好, 具有一定的临床参考意义.
编辑: 李薇 电编:何基才
| 1. | Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis. 2001;5:315-334, v-vi. [PubMed] [DOI] |
| 2. | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S73-S78. [PubMed] [DOI] |
| 3. | Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009;8:283-291. [PubMed] |
| 4. | Kisseleva T, Brenner DA. Hepatic stellate cells and the reversal of fibrosis. J Gastroenterol Hepatol. 2006;21 Suppl 3:S84-S87. [PubMed] [DOI] |
| 5. | Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis. Apoptosis. 2005;10:927-939. [PubMed] [DOI] |
| 6. | Eng FJ, Friedman SL. Fibrogenesis I. New insights into hepatic stellate cell activation: the simple becomes complex. Am J Physiol Gastrointest Liver Physiol. 2000;279:G7-G11. [PubMed] |
| 7. | Mòdol T, Natal C, Pérez de Obanos MP, Domingo de Miguel E, Iraburu MJ, López-Zabalza MJ. Apoptosis of hepatic stellate cells mediated by specific protein nitration. Biochem Pharmacol. 2010; Nov 4. [Epub ahead of print]. [PubMed] |
| 8. | Qian J, Zhang JS, Wang XQ, Ji JL, Mei S. Fenretinide stimulates the apoptosis of hepatic stellate cells and ameliorates hepatic fibrosis in mice. Hepatol Res. 2009;39:1229-1247. [PubMed] [DOI] |
| 9. | Tang X, Yang J, Li J. Sensitization of human hepatic stellate cells to tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis by leflunomide. Biol Pharm Bull. 2009;32:963-967. [PubMed] [DOI] |
| 10. | Shu JC, He YJ, Lv X, Ye GR, Wang LX. Curcumin prevents liver fibrosis by inducing apoptosis and suppressing activation of hepatic stellate cells. J Nat Med. 2009;63:415-420. [PubMed] [DOI] |
| 11. | Moreno M, Gonzalo T, Kok RJ, Sancho-Bru P, van Beuge M, Swart J, Prakash J, Temming K, Fondevila C, Beljaars L. Reduction of advanced liver fibrosis by short-term targeted delivery of an angiotensin receptor blocker to hepatic stellate cells in rats. Hepatology. 2010;51:942-952. [PubMed] |
| 12. | Shu JC, He YJ, Lv X, Zhao JR, Zhao J, Shen Y, Ye GR, Wang LX. Effect of curcumin on the proliferation and apoptosis of hepatic stellate cells. Braz J Med Biol Res. 2009;42:1173-1178. [PubMed] [DOI] |
| 13. | Hao LS, Zhang XL, An JY, Yao DM, Karlin J, Fang SM, Jiang HQ, Bai WY, Chen S. Adenoviral transduction of PTEN induces apoptosis of cultured hepatic stellate cells. Chin Med J (Engl). 2009;122:2907-2911. [PubMed] |
| 14. | Greupink R, Bakker HI, Bouma W, Reker-Smit C, Meijer DK, Beljaars L, Poelstra K. The antiproliferative drug doxorubicin inhibits liver fibrosis in bile duct-ligated rats and can be selectively delivered to hepatic stellate cells in vivo. J Pharmacol Exp Ther. 2006;317:514-521. [PubMed] [DOI] |
| 15. | De Minicis S, Seki E, Uchinami H, Kluwe J, Zhang Y, Brenner DA, Schwabe RF. Gene expression profiles during hepatic stellate cell activation in culture and in vivo. Gastroenterology. 2007;132:1937-1946. [PubMed] [DOI] |
| 16. | Xu YG, Zhou SH, Li YG, Zheng CH, Li XP, Liu QM, Xu DM, Chen S. The mechanism underlying vascular smooth muscle cell apoptosis induced by atorvastatin may be mainly associated with down-regulation of survivin expression. Cardiovasc Drugs Ther. 2007;21:145-153. [PubMed] [DOI] |
| 17. | Hu Z, Sayeed MM. Activation of PI3-kinase/PKB contributes to delay in neutrophil apoptosis after thermal injury. Am J Physiol Cell Physiol. 2005;288:C1171-C1178. [PubMed] [DOI] |
| 18. | Blomhoff R, Wake K. Perisinusoidal stellate cells of the liver: important roles in retinol metabolism and fibrosis. FASEB J. 1991;5:271-277. [PubMed] |
| 19. | Gressner AM. Transdifferentiation of hepatic stellate cells (Ito cells) to myofibroblasts: a key event in hepatic fibrogenesis. Kidney Int Suppl. 1996;54:S39-S45. [PubMed] |
| 20. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenterol Hepatol. 1999;14:618-633. [PubMed] [DOI] |
| 21. | Suzuki A, Ito T, Kawano H, Hayashida M, Hayasaki Y, Tsutomi Y, Akahane K, Nakano T, Miura M, Shiraki K. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death. Oncogene. 2000;19:1346-1353. [PubMed] [DOI] |
| 22. | Reed JC. The Survivin saga goes in vivo. J Clin Invest. 2001;108:965-969. [PubMed] [DOI] |
| 23. | Paik YH, Kim JK, Lee JI, Kang SH, Kim DY, An SH, Lee SJ, Lee DK, Han KH, Chon CY. Celecoxib induces hepatic stellate cell apoptosis through inhibition of Akt activation and suppresses hepatic fibrosis in rats. Gut. 2009;58:1517-1527. [PubMed] |
| 24. | Park SJ, Sohn HY, Yoon J, Park SI. Down-regulation of FoxO-dependent c-FLIP expression mediates TRAIL-induced apoptosis in activated hepatic stellate cells. Cell Signal. 2009;21:1495-1503. [PubMed] [DOI] |
| 25. | Chen X, Wang YZ, Xiu HM, Jiang HQ. [The effects of nerve growth factor-induced apoptosis on hepatic stellate cells of fibrotic rat liver]. Zhonghua Yixue Zazhi. 2006;86:1985-1988. [PubMed] |
| 26. | He YJ, Shu JC, Lü X, Fang L, Sheng Y. [Prophylactic effect of curcumin on hepatic fibrosis and its relationship with activated hepatic stellate cells]. Zhonghua Ganzangbing Zazhi. 2006;14:337-340. [PubMed] |
| 28. | 倪 金良, 陈 晓星, 张 国新, 郝 波, 施 瑞华, 王 学浩. 胰腺癌组织Survivin的表达与细胞凋亡、增殖的关系. 世界华人消化杂志. 2008;16:1425-1429. [DOI] |
| 29. | Yang Y, Zhu J, Gou H, Cao D, Jiang M, Hou M. Clinical significance of Cox-2, Survivin and Bcl-2 expression in hepatocellular carcinoma (HCC). Med Oncol. 2010; Apr 17. [Epub ahead of print]. [PubMed] |
| 30. | Ranade KJ, Nerurkar AV, Phulpagar MD, Shirsat NV. Expression of survivin and p53 proteins and their correlation with hormone receptor status in Indian breast cancer patients. Indian J Med Sci. 2009;63:481-490. [PubMed] [DOI] |
| 31. | Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki T, Moriyama S, Kudo J. Expression of survivin in esophageal cancer: correlation with the prognosis and response to chemotherapy. Int J Cancer. 2001;95:92-95. [PubMed] [DOI] |
| 32. | Chakravarti A, Noll E, Black PM, Finkelstein DF, Finkelstein DM, Dyson NJ, Loeffler JS. Quantitatively determined survivin expression levels are of prognostic value in human gliomas. J Clin Oncol. 2002;20:1063-1068. [PubMed] [DOI] |
| 33. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 34. | Takeno S, Yamashita S, Takahashi Y, Ono K, Kamei M, Moroga T, Kawahara K. Survivin expression in oesophageal squamous cell carcinoma: its prognostic impact and splice variant expression. Eur J Cardiothorac Surg. 2010;37:440-445. [PubMed] |
| 36. | Atlasi Y, Mowla SJ, Ziaee SA. Differential expression of survivin and its splice variants, survivin-DeltaEx3 and survivin-2B, in bladder cancer. Cancer Detect Prev. 2009;32:308-313. [PubMed] [DOI] |
| 37. | Fowell AJ, Iredale JP. Emerging therapies for liver fibrosis. Dig Dis. 2006;24:174-183. [PubMed] [DOI] |
| 38. | Friedman SL, Bansal MB. Reversal of hepatic fibrosis -- fact or fantasy? Hepatology. 2006;43:S82-S88. [PubMed] [DOI] |
| 39. | Grossman D, McNiff JM, Li F, Altieri DC. Expression of the apoptosis inhibitor, survivin, in nonmelanoma skin cancer and gene targeting in a keratinocyte cell line. Lab Invest. 1999;79:1121-1126. [PubMed] |
| 40. | Ambrosini G, Adida C, Sirugo G, Altieri DC. Induction of apoptosis and inhibition of cell proliferation by survivin gene targeting. J Biol Chem. 1998;273:11177-11182. [PubMed] [DOI] |
| 41. | Mesri M, Morales-Ruiz M, Ackermann EJ, Bennett CF, Pober JS, Sessa WC, Altieri DC. Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting. Am J Pathol. 2001;158:1757-1765. [PubMed] |