修回日期: 2010-11-04
接受日期: 2010-11-10
在线出版日期: 2010-12-08
上皮-间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞在形态学上发生向间质细胞表型的转变. EMT在肿瘤的侵袭和转移过程中起着非常重要的作用, 其机制到目前为止尚未研究清楚, 主要与其复杂的信号通路有关, microRNA(miRNA)也可能参与了其过程. 近年来已有大量关于肿瘤EMT的信号通路及其与miRNA关系的研究, 本文就此予以综述.
引文著录: 王宏刚, 黄晓丹, 季国忠. EMT的信号通路及microRNA在肿瘤中的研究进展. 世界华人消化杂志 2010; 18(34): 3672-3678
Revised: November 4, 2010
Accepted: November 10, 2010
Published online: December 8, 2010
Epithelial-mesenchymal transition (EMT) refers to the process by which cells transit from epithelial phenotype to mesenchymal phenotype. EMT is critical for tumor invasion and metastasis, however, the underlying mechanism is little known so far. It has been known that complex signaling pathways are involved in this process. MicroRNAs also play an important role in tumors via many EMT-related signaling pathways. Numerous studies have established that there is a link between EMT-related signaling pathways and microRNAs in tumors. This review focuses on the action mechanism of various EMT-related signaling pathways and their relationship with microRNAs in tumors.
- Citation: Wang HG, Huang XD, Ji GZ. EMT- and microRNA-related signaling pathways in tumors. Shijie Huaren Xiaohua Zazhi 2010; 18(34): 3672-3678
- URL: https://www.wjgnet.com/1009-3079/full/v18/i34/3672.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i34.3672
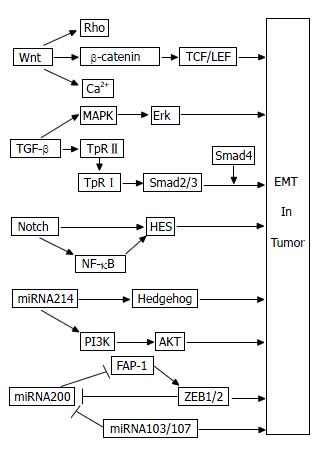
上皮-间质转化(epithelial-mesenchymal transition, EMT)的概念最初是在1982年被提出的. Greenburg和Hay[1]发现晶状体上皮细胞可暂时失去细胞极性, 在胶原凝胶中转化为间质细胞样形态, 获得了移行能力, 从而提出了EMT这一说法. 随后的大量研究发现, EMT不仅在多细胞生物胚胎发育过程中起作用[2], 而且在器官纤维化(如肝脏纤维化、肾脏纤维化等)[3]以及肿瘤侵袭和转移中也起着重要作用[4,5]. 在肿瘤EMT过程中, 上皮标志物E-钙粘蛋白(E-cadherin)、紧密连接蛋白ZO-1(zonula occluden-l)等表达下调, 间质标志物波形蛋白(vimentin)、N型钙黏蛋白(N-cadherin)等表达上调, 表现为上皮源性的肿瘤细胞失去细胞极性, 细胞间的连接变得疏松, 胞内骨架蛋白发生重组. 这一系列的改变导致肿瘤细胞的黏附能力下降, 迁移运动能力增加, 使得肿瘤细胞更易于离开原有位置, 发生原位浸润或者随血行、淋巴等途径转移到体内远隔部位, 重新定位于新的器官或组织, 最终导致肿瘤患者死亡. 大量研究发现, 多种信号通路参与了肿瘤细胞的EMT过程, 如Wnt、转化生长因子-β(transforming growth factor-β, TGF-β)、Notch信号通路等. 近年来研究较热的microRNA(miRNA)也可能通过多种信号通路参与肿瘤EMT过程, 在此我们一并予以综述, 并绘制简要示意图(图1), 以了解其最新研究进展.
Wnt基因最早是由Nusse等[6]于1982年发现并报道的, 当时被称为int-1基因. 后来, 又有研究发现int-1基因与1973年Sharma报道的果蝇Wingless基因为同源基因, 因此两者又被合并命名为Wnt基因. Wnt基因在肿瘤细胞中形成一条繁杂的信号通路, 至少包括3条分支: Wnt/β-连环蛋白(β-catenin)通路, Wnt/平面细胞极性(the planar cell polarity, PCP)通路和Wnt/钙离子通路. Wnt/PCP通路主要是通过激活Rho家族蛋白(Ras超家族中小分子量G蛋白), 指导非对称细胞骨架形成及细胞形态的协同极化, 参与胃癌等肿瘤细胞的迁移和侵袭过程[7]. Wnt/钙离子通路通过G蛋白激活磷脂酶C(phospholipase C), 导致胞内钙离子增加, 能促进肿瘤形成[8]. 然而, 也有研究认为, Wnt/钙离子通路在一定条件下却拮抗了Wnt/β-catenin通路, 在肿瘤中发挥着抑制性作用[9]. Wnt/β-catenin通路又称经典Wnt通路[10], β-catenin在其中起关键调节作用, 其可与E-cadherin胞内区结合, 形成β-catenin/E-cadherin复合体, 再与肌动蛋白骨架相连, 介导细胞间黏附, 调节肿瘤细胞的侵袭和转移能力. Wnt基因在肿瘤中被异常激活, 其蛋白与胞膜卷曲蛋白(frizzled, Fz)受体结合, 激活松散蛋白(dishevelled, Dsh), 进而抑制糖原合成激酶/结直肠腺瘤性息肉/轴蛋白(GSK3β/APC/Axin)复合物对β-catenin的磷酸化, 降低了β-catenin的磷酸化降解, 胞质中聚集增多的β-catenin转进入细胞核, 与核内转录因子T淋巴细胞因子(T-cell-specific transcription factor, TCF)/淋巴样增强因子(lymphoid enhancer factor, LEF)发生作用, 激活下游众多靶基因过度表达, 从而诱导结肠癌[11-13]、肝癌[14]、卵巢癌[15]等肿瘤的EMT过程. Yook等[16]认为在Wnt/β-catenin通路中, 下游的Axin2与GSK3β形成复合物, 使锌指转录因子Snail1稳定表达, 进而诱导乳腺癌细胞EMT形成. 卷曲蛋白Fz受体作为Wnt/β-catenin信号通路中的重要受体蛋白, 能与Wnt蛋白结合, 启动下游的信号传导. 而分泌性卷曲相关蛋白(secreted frizzled-related protein, SFRP)作为可溶性的分泌性糖蛋白, 可与Fz受体竞争性结合Wnt蛋白, 抑制Wnt信号通路, 在抗肿瘤及细胞凋亡等过程中发挥作用. 韧粘素-C(tenascin-C, TN-C)是一种六聚体大分子糖蛋白, 是细胞外基质的重要组分, 能诱导肿瘤EMT形成. 分化良好的结肠癌边缘常具有侵袭性, 而此处TN-C常常高表达, 参与结肠癌EMT过程. Beiter等[17]发现TN-C是Wnt/β-catenin通路的下游靶基因. 在人结肠腺癌中, 癌组织周围基质中的TN-C随着β-catenin表达增加而增加. 在结肠癌DLD-1、Lovo和LS174T 3种细胞系中, TN-C呈阳性表达, 然而敲除β-catenin基因后, 这3种细胞系中的TN-C基因表达减弱, 进一步说明了Wnt/β-catenin信号通路可能通过下游靶基因TN-C而调控结肠癌EMT过程. EMT是一个可逆性过程, 应用Wnt信号通路抑制剂可以逆转EMT, 这在小鼠体内实验已经得到了验证. Yee等[18]研究发现Wnt抑制因子1(Wnt inhibitory factor 1, WIF1)对异种移植瘤裸鼠模型肿瘤生长抑制率达到63%, 用免疫组织化学方法分析裸鼠体内肿瘤组织发现E-cadherin表达增加, 而vimentin表达降低. 转入WIF1后的前列腺癌PC3细胞迁移和侵袭能力大大降低, 其机制可能是降低了基质金属蛋白酶(matrix metalloproteinases, MMPs)2和9的活性, 下调了调控EMT的转录因子Slug和Twist的表达, 使肿瘤EMT发生逆转. 这提供给我们一个重要的思路: 研发针对Wnt信号通路中各个靶点的有效抑制药物将有可能遏制肿瘤EMT的发生或者逆转EMT, 进而阻断恶性肿瘤细胞的侵袭和转移, 提高肿瘤患者生存率.
De Larco与Todaro于1978年在小鼠肉瘤病毒转化的细胞株条件培养基中鉴定出肉瘤生长因子(sarcoma growth factor, SGF), 因其具有转化细胞的特性, 故又被称为转化生长因子(transforming growth factor, TGF). TGF-β是TGF的一个重要亚类, 其家族庞大, 包括9个亚族, 共27类因子, 不仅调节胚胎发育过程中的EMT现象[19], 在肿瘤EMT过程中也起着重要作用[20-22]. 目前已有大量关于TGF-β参与肿瘤EMT过程的研究报道, 其机制主要是通过Smad依赖通路[23,24]和非Smad依赖通路[25,26]完成的. Smad蛋白存在于胞质中, 是由Smad基因编码的相对分子质量为42 000-60 000 Da的蛋白质分子. 作为TGF-β受体复合物的下游信号调节蛋白, Smads蛋白家族可将信号由胞膜传导至胞核, 从而调控基因转录. 目前已发现至少9种Smad蛋白, 从结构和功能上分为3个亚型: 受体调节性Smad(receptor-activated smad, R-smad), 包括Smad1, 2, 3, 5, 8; 共同介导性Smad(common-mediator smad, Co-smad), 如Smad4; 抑制性Smad(inhibitory smads, I-smads), 包括Smad6, Smad7等. 不同的Smad蛋白在结肠癌、肝癌、乳腺癌等肿瘤过程中发挥着不同的作用[27-30]. 典型的Smad依赖通路诱导的EMT过程如下: TGF-β首先与肿瘤细胞膜上的TGF-βⅡ型受体(TpRⅡ)结合, 通过TpRⅡ激酶使TGF-βⅠ型受体(TpRⅠ)磷酸化后激活下游的Smad2/3, 磷酸化的Smad2/3再与胞内的Smad4结合形成三聚体, 进入细胞核, 并与DNA结合而发生相互作用, 促使EMT形成[31]. 显然, Smad4在TGF-β诱导EMT过程中起着"中间人"的作用. 然而, Smad4作为抑癌基因, 也可上调上皮标志物E-cadherin的表达, 加强了结肠癌细胞SW480的细胞间连接[32]. Zhao等[33]选用不同Smad4表达水平的胰腺癌细胞株研究Smad4与EMT关系时, 发现TGF-β/Smad4信号通路可以降低信号转导和转录活化因子3(signal transducers and activators of transcription 3, STAT3)的磷酸化水平, 而磷酸化的STAT3却参与了TGF-β诱导的肿瘤EMT过程, 因此推断胰腺癌中Smad4基因的缺失可能导致STAT3异常激活, 进而促进了TGF-β诱导胰腺癌EMT发生. 可见, TGF-β/Smad4通路与肿瘤EMT的关系复杂, 到底是促进还是抑制肿瘤EMT过程, 仍需进一步研究. 除了Smad依赖的通路外, TGF-β也可通过非Smad依赖的通路对肿瘤EMT进行调节. TGF-β可通过丝裂原活化的蛋白激酶(mitogen activated protein kinase, MAPK)途径激活下游的细胞外调节蛋白激酶(extracellular regulated protein kinase, Erk), 从而诱导肿瘤EMT形成[34]. 此外, Wnt通路也能与TGF-β/Smad通路相"对话", 上调EMT诱导因子Snail和Twist, 抑制E-cadherin的表达, 同时激活了β-catenin/TCF/LEF复合物, 间接导致vimentin等间质标志物的表达[35], 共同协调对肿瘤EMT的调节. 目前大多观点认为TGF-β通过多种途径诱导肿瘤EMT发生, 然而TGF-β在肿瘤早期阶段也可诱导肿瘤细胞发生凋亡[36], 这使我们不得不深入研究TGF-β与肿瘤的确切关系. TGF-β信号通路调控肿瘤EMT过程是否受肿瘤类型等条件的限制? 这一问题吸引着众多学者对其进行更广泛更深层次的探讨.
Notch基因最初由Morgan于1917年报道, 当时人们认为他主要参与胚胎发育过程, 近年研究发现EMT过程与Notch信号通路密切相关. 在肿瘤中, Notch受体在其配体刺激下发生裂解, 其胞内结构域(intracellular portion of Notch, NICD)被释放出来, 从胞质易位入核, 调控碱性螺旋-环-螺旋类转录因子(basic helix-loop-helix, bHLH), HES(hairy and enhancer of split)和HES相关抑制蛋白家族以及锌指转录因子Snail、Slug等下游靶基因的转录, 不仅能调控肝癌[37,38]、胰腺癌[39]等肿瘤的形成, 在肿瘤EMT过程中也有着重要作用. Wang等[40]发现对吉西他滨耐药(gemcitabine-resistant, GR)的胰腺癌细胞发生了EMT现象, 其机制是通过Notch信号通路实现的. 他们检测到Notch-2及其配体Jagged-1(第1个被发现的Notch受体配体)在胰腺癌细胞中高表达, 而当Notch-2和Jagged-1被其特异性的小干扰RNA干扰后, Notch信号通路下游的靶基因vimentin, Slug, Snail以及核因子-κB(nuclear factor kappa B, NF-κB)的表达发生下调, 出现了MET现象, 同时降低了胰腺癌细胞的侵袭能力, 证实Notch信号通路参与了胰腺癌的EMT过程. Shah等[41]的研究也能证明这个观点. 低氧诱导的肿瘤EMT过程也有可能是通过Notch信号通路完成的. Chen等[42]研究发现低氧诱导因子(hypoxia inducible factor, HIF)与Notch信号通路的靶基因HES1的启动子相结合, 诱导乳腺癌EMT发生. 而敲除HIF-1基因后, HES1的表达受到抑制. 应用Notch信号通路抑制剂阻断了HIF-1诱导的EMT过程, 下调了Snail、Slug的表达, 增加了E-cadherin的表达, 同时也降低了乳腺癌细胞的迁移和侵袭能力. Notch信号通路不一定独立行使其功能, 有时也必须同其他信号通路协同作用才能诱导肿瘤EMT发生[43]. 虽然目前已有部分关于Notch信号通路诱导肿瘤EMT的报道, 但这方面的研究还不够深入, 其诱导肿瘤EMT的具体分子机制鲜为人知, 尚待进一步研究.
除了Wnt、TGF-β、Notch信号通路外, 还有其他一些信号通路也参与肿瘤EMT的过程, 如Hedgehog、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinases, PI3K)、NF-κB等通路. Feldmann等[44]认为Hedgehog信号通路被阻断后, 胰腺癌细胞的EMT过程受到了抑制, 降低了胰腺癌的侵袭和转移. Yan等[45]发现肝癌细胞在低氧时会发生EMT现象, 其机制可能是激活PI3K下游的蛋白激酶B(protein kinase B, PKB), 使其磷酸化, 而这个过程却可以被PI3K抑制剂LY294002阻断, 这个结果推断低氧诱导肝癌细胞发生EMT是通过PI3K/AKT通路完成的. NF-κB是一类重要的转录调节因子, 静息状态时, NF-κB与其抑制蛋白IκB结合, 以无活性的形式存在于胞质内. 在刺激因素作用下, 胞质中的IκB发生磷酸化降解, 解除了对NF-κB的抑制, 释放其进入核内参与调节多种基因的转录表达, 在肿瘤EMT过程中起着重要作用[46]. 此外, 其他信号(如TGF-β等)引起的EMT也或多或少是通过NF-κB活性介导的[47].
肿瘤EMT的发生除了与各类信号通路有关外, 许多细胞因子、转录因子、MMPs、病毒癌基因等也参与了肿瘤EMT过程, 而新近研究的miRNA在肿瘤EMT及其信号通路中也起着相当重要的作用, 成为近年来研究的热点. miRNA是一类新发现的长度为19-25个核苷酸的非编码单链小分子RNA, 其与目标mRNA配对, 导致目的mRNA发生降解. 如果两者只有部分区段互补(即不完全互补)时, miRNA则负向调控翻译过程, 阻遏蛋白质翻译, 而对目的mRNA无影响[48]. 由此可见, miRNA通过诱导靶mRNA降解或抑制靶mRNA翻译在转录后水平调控基因表达, 扮演着促癌或抑癌形成的双重角色, 同时也参与到疾病的进展[49]以及肿瘤EMT过程的各个环节, 显示了其作为诊断、预后标记物以及肿瘤治疗新靶向的可能性.
研究发现miRNA-200家族、miRNA-103/107等多种miRNA参与调控肿瘤EMT的过程. 作为miRNA200家族一员, miRNA200c可能通过上调E-cadherin的表达而抑制肿瘤EMT过程. Yu等[50]检测了14种胰腺癌细胞系和99例胰腺癌术后切除标本中miRNA200c和E-cadherin的mRNA表达水平, 发现两者呈正相关, 且高表达miRNA200c的患者生存率较高. 然而, 进一步研究发现上调miRNA200c后, 胰腺癌细胞的增殖能力增强, 而侵袭力却下降. 也有研究[51]发现, miRNA200在胰腺癌GR细胞中表达降低, 而EMT间质标志物vimentin表达增加. 在转入miRNA200后的GR细胞中, miRNA200发生过表达, 而vimentin和slug表达减低, 说明胰腺癌EMT过程发生逆转. Schickel等[52]认为miRNA-200通过下调Fas(肿瘤坏死因子受体家族的一种蛋白)相关磷酸酯酶-1(Fas-associated phosphatase-1, FAP-1)抑制了转录抑制因子锌指E-盒结合同源异形盒(zinc-finger E-box binding homeobox 1, ZEB1), 从而阻遏肿瘤EMT的发生. miRNA-200家族也可不通过FAP-1而直接抑制ZEB1/2[53]. ZEB1/2也可负性调节miRNA-200家族, 两者形成负反馈回路, 协同调节肿瘤侵袭和转移[54]. miRNA-103/107也能诱导肿瘤EMT发生, 有趣的是, 其机制是通过下调miRNA-200水平实现的[55], 这表明不同miRNA之间可能会发生相互作用, 共同调节肿瘤EMT的过程. 总之, miRNA200具有抑制肿瘤EMT的能力, 但也能促进胰腺癌细胞增殖, 其具体机制有待进一步研究.
然而, miRNA参与肿瘤EMT过程的具体机制目前尚未研究清楚, 可能是通过多种信号通路完成的, 这或将成为未来几年肿瘤EMT的研究方向. Kong等[56]认为miRNA-155在TGF-β/Smad4信号通路诱导肿瘤EMT的过程中起作用. 而敲除miRNA-155后, TGF-β/Smad4诱导的EMT受到显著抑制. 在未分化型甲状腺癌中, 低表达的miRNA-30上调了Smad2和TpRⅠ的表达, 在TGF-β信号通路诱导肿瘤EMT过程中起着重要作用[57]. Ma等[58]报道了在表达miRNA-9的乳腺癌SUM149细胞系中, miRNA-9下调了E-cadherin的表达, 并激活了Wnt/β-catenin信号通路, 使β-catenin转入核内, 诱导乳腺癌EMT发生. 也有报道称miRNA-214在Hedgehog信号通路诱导EMT的过程中起作用[59], 但新的研究却发现miRNA-214诱导卵巢癌EMT是通过PI3K/AKT信号通路完成的[60]. 以上研究证明, 许多miRNA参与了肿瘤EMT过程, 而其机制是通过不同的信号通路调节肿瘤EMT过程, 并且各信号通路之间也可能形成复杂的信号交叉, 共同调控肿瘤的侵袭和转移过程. 目前, miRNA与非消化系肿瘤EMT的报道日益增加, 现在也有不少关于miRNA参与消化系肿瘤发生和转移的最新研究[61,62], 但miRNA与消化系肿瘤EMT及其信号通路的关系研究甚少. miRNA是否通过EMT调控消化系肿瘤的侵袭和转移, 这或将成为下一个研究热点, 消化系肿瘤的转移机制也将日益明确.
近年来, 肿瘤EMT已成为最热门的医学科学议题之一. 肿瘤EMT的信号通路更是吸引了不少学者对其研究探讨, 其复杂的信号网络及其相互间的"对话"更增加了他的神秘性. 本文综述了近几年文献, 着重总结了Wnt、TGF-β、Notch等信号通路和miRNA-200家族等miRNA在肿瘤EMT过程中的作用, 当然还存在着其他尚未被发现的信号通路或新的miRNA也参与了肿瘤EMT的过程, 或者这些信号通路之间存在更为复杂的协同或拮抗效应. 这些信号通路具体是通过什么机制调控肿瘤EMT过程的, 信号通路之间又是如何合作的? 除了E-cadherin, vimentin等经典的EMT标志分子外, 还有哪些新的肿瘤EMT相关分子有待发现? 这些问题都昭示着我们需更深入地研究探索肿瘤, 尤其是消化系肿瘤的EMT的发生机制, 这将为揭秘肿瘤侵袭和转移的神秘面纱提供更为可靠的理论依据, 为肿瘤患者的治疗提供新的希望.
上皮-间质转化(EMT)是指上皮性的细胞(包括正常上皮和肿瘤上皮)表现出间质细胞的特征, 获得了迁徙、运动能力, 在胚胎发育和器官纤维化过程中有重要作用. 近年研究发现, EMT与肿瘤的侵袭和转移过程密切相关, miRNA可通过多种信号通路调控肿瘤EMT过程.
丁士刚, 教授, 北京大学第三医院消化科
目前, 转移仍是肿瘤患者死亡的主要原因. 肿瘤细胞通过EMT而实现转移过程, 是近年来肿瘤领域的研究热点. 因此, 明确EMT信号通路, 研发针对信号通路中相应靶点的抗肿瘤药物, 将有利于预防或限制肿瘤转移, 从而提高肿瘤患者的生存率.
Zhao等选用不同Smad4表达水平的胰腺癌细胞株研究Smad4与EMT关系时, 发现TGF-β/Smad4信号通路可以降低信号转导和转录活化因子3(STAT3)的磷酸化水平, 而磷酸化的STAT3却参与了TGF-β诱导的肿瘤EMT过程, 因此推断胰腺癌中Smad4基因的缺失可能导致STAT3异常激活, 进而促进了TGF-β诱导胰腺癌EMT发生.
本文创新性地综述了EMT的信号通路及miRNA在肿瘤, 特别是在消化系肿瘤中的作用, 着重介绍了Wnt、TGF-β、Notch信号通路和miRNA-200家族与肿瘤EMT的研究进展, 并提出目前研究热点及今后可能的研究方向, 如TGF-β/Smad4信号通路与肿瘤EMT的关系, miRNA与消化系肿瘤EMT的关系等, 明确了EMT的信号通路及miRNA在肿瘤侵袭和转移中的重要作用.
本文内容丰富、全面, 对于预防和治疗肿瘤有一定的参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells. J Cell Biol. 1982;95:333-339. [PubMed] [DOI] |
| 2. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] |
| 3. | Liu Y. New insights into epithelial-mesenchymal transition in kidney fibrosis. J Am Soc Nephrol. 2010;21:212-222. [PubMed] [DOI] |
| 4. | López-Novoa JM, Nieto MA. Inflammation and EMT: an alliance towards organ fibrosis and cancer progression. EMBO Mol Med. 2009;1:303-314. [PubMed] [DOI] |
| 5. | Savagner P. The epithelial-mesenchymal transition (EMT) phenomenon. Ann Oncol. 2010;21 Suppl 7:vii89-vii92. [PubMed] [DOI] |
| 6. | Nusse R, Varmus HE. Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell. 1982;31:99-109. [PubMed] |
| 7. | Kurayoshi M, Oue N, Yamamoto H, Kishida M, Inoue A, Asahara T, Yasui W, Kikuchi A. Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion. Cancer Res. 2006;66:10439-10448. [PubMed] [DOI] |
| 8. | Dissanayake SK, Wade M, Johnson CE, O'Connell MP, Leotlela PD, French AD, Shah KV, Hewitt KJ, Rosenthal DT, Indig FE. The Wnt5A/protein kinase C pathway mediates motility in melanoma cells via the inhibition of metastasis suppressors and initiation of an epithelial to mesenchymal transition. J Biol Chem. 2007;282:17259-17271. [PubMed] [DOI] |
| 9. | Liang H, Chen Q, Coles AH, Anderson SJ, Pihan G, Bradley A, Gerstein R, Jurecic R, Jones SN. Wnt5a inhibits B cell proliferation and functions as a tumor suppressor in hematopoietic tissue. Cancer Cell. 2003;4:349-360. [PubMed] [DOI] |
| 10. | Huelsken J, Behrens J. The Wnt signalling pathway. J Cell Sci. 2002;115:3977-3978. [PubMed] [DOI] |
| 11. | Deka J, Wiedemann N, Anderle P, Murphy-Seiler F, Bultinck J, Eyckerman S, Stehle JC, André S, Vilain N, Zilian O. Bcl9/Bcl9l are critical for Wnt-mediated regulation of stem cell traits in colon epithelium and adenocarcinomas. Cancer Res. 2010;70:6619-6628. [PubMed] [DOI] |
| 12. | Hlubek F, Spaderna S, Schmalhofer O, Jung A, Kirchner T, Brabletz T. Wnt/FZD signaling and colorectal cancer morphogenesis. Front Biosci. 2007;12:458-470. [PubMed] [DOI] |
| 13. | Brabletz T, Hlubek F, Spaderna S, Schmalhofer O, Hiendlmeyer E, Jung A, Kirchner T. Invasion and metastasis in colorectal cancer: epithelial-mesenchymal transition, mesenchymal-epithelial transition, stem cells and beta-catenin. Cells Tissues Organs. 2005;179:56-65. [PubMed] [DOI] |
| 14. | Jain S, Singhal S, Lee P, Xu R. Molecular genetics of hepatocellular neoplasia. Am J Transl Res. 2010;2:105-118. [PubMed] |
| 15. | Su HY, Lai HC, Lin YW, Liu CY, Chen CK, Chou YC, Lin SP, Lin WC, Lee HY, Yu MH. Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway. Int J Cancer. 2010;127:555-567. [PubMed] [DOI] |
| 16. | Yook JI, Li XY, Ota I, Hu C, Kim HS, Kim NH, Cha SY, Ryu JK, Choi YJ, Kim J. A Wnt-Axin2-GSK3beta cascade regulates Snail1 activity in breast cancer cells. Nat Cell Biol. 2006;8:1398-1406. [PubMed] [DOI] |
| 17. | Beiter K, Hiendlmeyer E, Brabletz T, Hlubek F, Haynl A, Knoll C, Kirchner T, Jung A. beta-Catenin regulates the expression of tenascin-C in human colorectal tumors. Oncogene. 2005;24:8200-8204. [PubMed] |
| 18. | Yee DS, Tang Y, Li X, Liu Z, Guo Y, Ghaffar S, McQueen P, Atreya D, Xie J, Simoneau AR. The Wnt inhibitory factor 1 restoration in prostate cancer cells was associated with reduced tumor growth, decreased capacity of cell migration and invasion and a reversal of epithelial to mesenchymal transition. Mol Cancer. 2010;9:162. [PubMed] [DOI] |
| 19. | Mercado-Pimentel ME, Runyan RB. Multiple transforming growth factor-beta isoforms and receptors function during epithelial-mesenchymal cell transformation in the embryonic heart. Cells Tissues Organs. 2007;185:146-156. [PubMed] [DOI] |
| 20. | Micalizzi DS, Christensen KL, Jedlicka P, Coletta RD, Barón AE, Harrell JC, Horwitz KB, Billheimer D, Heichman KA, Welm AL. The Six1 homeoprotein induces human mammary carcinoma cells to undergo epithelial-mesenchymal transition and metastasis in mice through increasing TGF-beta signaling. J Clin Invest. 2009;119:2678-2690. [PubMed] [DOI] |
| 21. | Lei W, Zhang K, Pan X, Hu Y, Wang D, Yuan X, Shu G, Song J. Histone deacetylase 1 is required for transforming growth factor-beta1-induced epithelial-mesenchymal transition. Int J Biochem Cell Biol. 2010;42:1489-1497. [PubMed] [DOI] |
| 22. | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature. 2003;425:577-584. [PubMed] [DOI] |
| 23. | Deckers M, van Dinther M, Buijs J, Que I, Löwik C, van der Pluijm G, ten Dijke P. The tumor suppressor Smad4 is required for transforming growth factor beta-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells. Cancer Res. 2006;66:2202-2209. [PubMed] [DOI] |
| 24. | Watanabe Y, Itoh S, Goto T, Ohnishi E, Inamitsu M, Itoh F, Satoh K, Wiercinska E, Yang W, Shi L. TMEPAI, a transmembrane TGF-beta-inducible protein, sequesters Smad proteins from active participation in TGF-beta signaling. Mol Cell. 2010;37:123-134. [PubMed] [DOI] |
| 25. | Cho HJ, Baek KE, Saika S, Jeong MJ, Yoo J. Snail is required for transforming growth factor-beta-induced epithelial-mesenchymal transition by activating PI3 kinase/Akt signal pathway. Biochem Biophys Res Commun. 2007;353:337-343. [PubMed] [DOI] |
| 26. | Pino MS, Kikuchi H, Zeng M, Herraiz MT, Sperduti I, Berger D, Park DY, Iafrate AJ, Zukerberg LR, Chung DC. Epithelial to mesenchymal transition is impaired in colon cancer cells with microsatellite instability. Gastroenterology. 2010;138:1406-1417. [PubMed] [DOI] |
| 27. | Sjöblom T, Jones S, Wood LD, Parsons DW, Lin J, Barber TD, Mandelker D, Leary RJ, Ptak J, Silliman N. The consensus coding sequences of human breast and colorectal cancers. Science. 2006;314:268-274. [PubMed] [DOI] |
| 28. | Levy L, Hill CS. Alterations in components of the TGF-beta superfamily signaling pathways in human cancer. Cytokine Growth Factor Rev. 2006;17:41-58. [PubMed] [DOI] |
| 29. | Broderick P, Carvajal-Carmona L, Pittman AM, Webb E, Howarth K, Rowan A, Lubbe S, Spain S, Sullivan K, Fielding S. A genome-wide association study shows that common alleles of SMAD7 influence colorectal cancer risk. Nat Genet. 2007;39:1315-1317. [PubMed] [DOI] |
| 30. | Heikkinen PT, Nummela M, Jokilehto T, Grenman R, Kähäri VM, Jaakkola PM. Hypoxic conversion of SMAD7 function from an inhibitor into a promoter of cell invasion. Cancer Res. 2010;70:5984-5993. [PubMed] [DOI] |
| 31. | Vincent T, Neve EP, Johnson JR, Kukalev A, Rojo F, Albanell J, Pietras K, Virtanen I, Philipson L, Leopold PL. A SNAIL1-SMAD3/4 transcriptional repressor complex promotes TGF-beta mediated epithelial-mesenchymal transition. Nat Cell Biol. 2009;11:943-950. [PubMed] [DOI] |
| 32. | Müller N, Reinacher-Schick A, Baldus S, van Hengel J, Berx G, Baar A, van Roy F, Schmiegel W, Schwarte-Waldhoff I. Smad4 induces the tumor suppressor E-cadherin and P-cadherin in colon carcinoma cells. Oncogene. 2002;21:6049-6058. [PubMed] [DOI] |
| 33. | Zhao S, Venkatasubbarao K, Lazor JW, Sperry J, Jin C, Cao L, Freeman JW. Inhibition of STAT3 Tyr705 phosphorylation by Smad4 suppresses transforming growth factor beta-mediated invasion and metastasis in pancreatic cancer cells. Cancer Res. 2008;68:4221-4228. [PubMed] [DOI] |
| 34. | Secker GA, Shortt AJ, Sampson E, Schwarz QP, Schultz GS, Daniels JT. TGFbeta stimulated re-epithelialisation is regulated by CTGF and Ras/MEK/ERK signalling. Exp Cell Res. 2008;314:131-142. [PubMed] [DOI] |
| 35. | Xu J, Lamouille S, Derynck R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 2009;19:156-172. [PubMed] [DOI] |
| 36. | Franco DL, Mainez J, Vega S, Sancho P, Murillo MM, de Frutos CA, Del Castillo G, López-Blau C, Fabregat I, Nieto MA. Snail1 suppresses TGF-beta-induced apoptosis and is sufficient to trigger EMT in hepatocytes. J Cell Sci. 2010;123:3467-3477. [PubMed] [DOI] |
| 37. | Qi R, An H, Yu Y, Zhang M, Liu S, Xu H, Guo Z, Cheng T, Cao X. Notch1 signaling inhibits growth of human hepatocellular carcinoma through induction of cell cycle arrest and apoptosis. Cancer Res. 2003;63:8323-8329. [PubMed] |
| 38. | Xu J, Yun X, Jiang J, Wei Y, Wu Y, Zhang W, Liu Y, Wang W, Wen Y, Gu J. Hepatitis B virus X protein blunts senescence-like growth arrest of human hepatocellular carcinoma by reducing Notch1 cleavage. Hepatology. 2010;52:142-154. [PubMed] |
| 39. | Wang Z, Zhang Y, Banerjee S, Li Y, Sarkar FH. Notch-1 down-regulation by curcumin is associated with the inhibition of cell growth and the induction of apoptosis in pancreatic cancer cells. Cancer. 2006;106:2503-2513. [PubMed] [DOI] |
| 40. | Wang Z, Li Y, Kong D, Banerjee S, Ahmad A, Azmi AS, Ali S, Abbruzzese JL, Gallick GE, Sarkar FH. Acquisition of epithelial-mesenchymal transition phenotype of gemcitabine-resistant pancreatic cancer cells is linked with activation of the notch signaling pathway. Cancer Res. 2009;69:2400-2407. [PubMed] [DOI] |
| 41. | Shah AN, Summy JM, Zhang J, Park SI, Parikh NU, Gallick GE. Development and characterization of gemcitabine-resistant pancreatic tumor cells. Ann Surg Oncol. 2007;14:3629-3637. [PubMed] [DOI] |
| 42. | Chen J, Imanaka N, Chen J, Griffin JD. Hypoxia potentiates Notch signaling in breast cancer leading to decreased E-cadherin expression and increased cell migration and invasion. Br J Cancer. 2010;102:351-360. [PubMed] [DOI] |
| 43. | Veenendaal LM, Kranenburg O, Smakman N, Klomp A, Borel Rinkes IH, van Diest PJ. Differential Notch and TGFbeta signaling in primary colorectal tumors and their corresponding metastases. Cell Oncol. 2008;30:1-11. [PubMed] |
| 44. | Feldmann G, Dhara S, Fendrich V, Bedja D, Beaty R, Mullendore M, Karikari C, Alvarez H, Iacobuzio-Donahue C, Jimeno A. Blockade of hedgehog signaling inhibits pancreatic cancer invasion and metastases: a new paradigm for combination therapy in solid cancers. Cancer Res. 2007;67:2187-2196. [PubMed] [DOI] |
| 45. | Yan W, Fu Y, Tian D, Liao J, Liu M, Wang B, Xia L, Zhu Q, Luo M. PI3 kinase/Akt signaling mediates epithelial-mesenchymal transition in hypoxic hepatocellular carcinoma cells. Biochem Biophys Res Commun. 2009;382:631-636. [PubMed] [DOI] |
| 46. | Strippoli R, Benedicto I, Pérez Lozano ML, Cerezo A, López-Cabrera M, del Pozo MA. Epithelial-to-mesenchymal transition of peritoneal mesothelial cells is regulated by an ERK/NF-kappaB/Snail1 pathway. Dis Model Mech. 2008;1:264-274. [PubMed] [DOI] |
| 47. | Maier HJ, Schmidt-Strassburger U, Huber MA, Wiedemann EM, Beug H, Wirth T. NF-kappaB promotes epithelial-mesenchymal transition, migration and invasion of pancreatic carcinoma cells. Cancer Lett. 2010;295:214-228. [PubMed] [DOI] |
| 48. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 49. | 马 兆龙, 杨 炼, 陈 立波, 黄 金明, 王 冬冬, 王 国斌. miRNA在HBV从感染经由肝硬化到肝癌进程中表达谱的变化. 世界华人消化杂志. 2009;17:2112-2116. [DOI] |
| 50. | Yu J, Ohuchida K, Mizumoto K, Sato N, Kayashima T, Fujita H, Nakata K, Tanaka M. MicroRNA, hsa-miR-200c, is an independent prognostic factor in pancreatic cancer and its upregulation inhibits pancreatic cancer invasion but increases cell proliferation. Mol Cancer. 2010;9:169. [PubMed] [DOI] |
| 51. | Li Y, VandenBoom TG 2nd, Kong D, Wang Z, Ali S, Philip PA, Sarkar FH. Up-regulation of miR-200 and let-7 by natural agents leads to the reversal of epithelial-to-mesenchymal transition in gemcitabine-resistant pancreatic cancer cells. Cancer Res. 2009;69:6704-6712. [PubMed] [DOI] |
| 52. | Schickel R, Park SM, Murmann AE, Peter ME. miR-200c regulates induction of apoptosis through CD95 by targeting FAP-1. Mol Cell. 2010;38:908-915. [PubMed] [DOI] |
| 53. | Korpal M, Lee ES, Hu G, Kang Y. The miR-200 family inhibits epithelial-mesenchymal transition and cancer cell migration by direct targeting of E-cadherin transcriptional repressors ZEB1 and ZEB2. J Biol Chem. 2008;283:14910-14914. [PubMed] [DOI] |
| 54. | Bracken CP, Gregory PA, Kolesnikoff N, Bert AG, Wang J, Shannon MF, Goodall GJ. A double-negative feedback loop between ZEB1-SIP1 and the microRNA-200 family regulates epithelial-mesenchymal transition. Cancer Res. 2008;68:7846-7854. [PubMed] [DOI] |
| 55. | Martello G, Rosato A, Ferrari F, Manfrin A, Cordenonsi M, Dupont S, Enzo E, Guzzardo V, Rondina M, Spruce T. A MicroRNA targeting dicer for metastasis control. Cell. 2010;141:1195-1207. [PubMed] |
| 56. | Kong W, Yang H, He L, Zhao JJ, Coppola D, Dalton WS, Cheng JQ. MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA. Mol Cell Biol. 2008;28:6773-6784. [PubMed] [DOI] |
| 57. | Braun J, Hoang-Vu C, Dralle H, Hüttelmaier S. Downregulation of microRNAs directs the EMT and invasive potential of anaplastic thyroid carcinomas. Oncogene. 2010;29:4237-4244. [PubMed] [DOI] |
| 58. | Ma L, Young J, Prabhala H, Pan E, Mestdagh P, Muth D, Teruya-Feldstein J, Reinhardt F, Onder TT, Valastyan S. miR-9, a MYC/MYCN-activated microRNA, regulates E-cadherin and cancer metastasis. Nat Cell Biol. 2010;12:247-256. [PubMed] |
| 59. | Flynt AS, Li N, Thatcher EJ, Solnica-Krezel L, Patton JG. Zebrafish miR-214 modulates Hedgehog signaling to specify muscle cell fate. Nat Genet. 2007;39:259-263. [PubMed] [DOI] |
| 60. | Yang H, Kong W, He L, Zhao JJ, O'Donnell JD, Wang J, Wenham RM, Coppola D, Kruk PA, Nicosia SV. MicroRNA expression profiling in human ovarian cancer: miR-214 induces cell survival and cisplatin resistance by targeting PTEN. Cancer Res. 2008;68:425-433. [PubMed] [DOI] |
| 61. | Zhang J, Yang Y, Yang T, Liu Y, Li A, Fu S, Wu M, Pan Z, Zhou W. microRNA-22, downregulated in hepatocellular carcinoma and correlated with prognosis, suppresses cell proliferation and tumourigenicity. Br J Cancer. 2010;103:1215-1220. [PubMed] [DOI] |
| 62. | Wang HJ, Ruan HJ, He XJ, Ma YY, Jiang XT, Xia YJ, Ye ZY, Tao HQ. MicroRNA-101 is down-regulated in gastric cancer and involved in cell migration and invasion. Eur J Cancer. 2010;46:2295-2303. [PubMed] [DOI] |