修回日期: 2010-08-20
接受日期: 2010-08-31
在线出版日期: 2010-11-28
目的: 研究现阶段门静脉血栓的真实发生率和目前术后抗凝治疗的效果, 并探讨血栓形成的原因及治疗方法.
方法: 对2008-06/2010-10收集的58例患者进行回顾性研究, 根据患者术后是否发生血栓分为血栓组和非血栓组, 对血栓发生率、部位、危险因素及抗凝效果进行了分析.
结果: 58例患者中, 共有22例患者在术后发生了血栓, 其中1例患者形成肠系膜上静脉血栓, 5例患者术后形成脾静脉血栓, 13例患者在门静脉系统的多个部位同时形成了血栓(混合性血栓). 血栓的总体发生率为37.93%. 血栓组和非血栓组患者在脾脏质量和术后门脉流速上存在显著差别(1 464 g±521 g vs 1 071 g±349 g; 7.74 cm/s±1.92 cm/s vs 15.59 cm/s±2.84 cm/s; 均P<0.05), 血栓组血小板计数术虽然高于未发生血栓组, 但差异不显著(P>0.05).
结论: 血小板计数和脾脏质量是术后患者发生门静脉血栓的重要因素. 早期使用低分子肝素、华法林进行全身抗凝能有效地预防肝炎肝硬化门静脉高压症脾切除术后门静脉系统血栓的形成, 并极大地改善了这类患者的预后.
引文著录: 孟健, 卢实春, 王孟龙, 高峰. 脾切断流术后门脉血栓形成22例. 世界华人消化杂志 2010; 18(33): 3584-3589
Revised: August 20, 2010
Accepted: August 31, 2010
Published online: November 28, 2010
AIM: To determine the incidence rate of portal vein thrombosis (PVT) in cirrhotic patients after splenectomy for hypersplenism and to assess the efficacy of low molecular weight heparin (LMWH) for the treatment of PVT.
METHODS: A total of 58 consecutive cirrhotic patients who underwent splenectomy for hypersplenism from January 2008 to December 2010 were enrolled into this study. All the patients received prophylactic anticoagulation therapy after the operation. Based on the presence of thrombus or not, the patients were divided into thrombosis group and non-thrombosis group. The incidence rate of PVT, thrombophilic factors, and thrombus location were analyzed in these patients.
RESULTS: All patients developed thrombosis, Thrombosis of the splenic vein, superior mesenteric vein and multiple veins was found in 5, 1 and 13 patients, respectively. Above 37.93% of the patients developed PVT. Identified risk factors for the development of PVT included high platelet count, low blood flow and increased spleen weight.
CONCLUSION: Blood platelet count and spleen weight are important risk factors for the development of PVT. Prophylactic treatment with low molecular weight heparin and Warfarin is likely to prevent the development of PVT in cirrhotic patients after splenectomy.
- Citation: Meng J, Lu SC, Wang ML, Gao F. Portal vein thrombosis after splenectomy for hypersplenism in patients with liver cirrhosis: an analysis of 22 cases. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3584-3589
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3584.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3584
最初人们认为脾切除术后发生门静脉血栓(portal vein thrombosis, PVT)是一种较少见的病症, 但随着诊断技术的提高和对该病的认识不断深入, 人们发现PVT发生率远高于先前的判断[1]. 以前人们一般认为PVT发生率在10%左右. 但各家报导不一样. 同时各医院为了防止术后门脉血栓形成, 已普遍采取了肝素或者华法林的治疗方案[2,3], 为了研究现阶段PVT的真实发生率和目前术后抗凝治疗的效果, 我们对近2年来, 门脉高压患者PVT形成发生率进行了回顾性研究, 并对血栓的形成原因治疗方法进行了进一步探讨, 旨在现有的情况下为门脉血栓的防治提供治疗依据.
患者入选标准: 18岁及以上年龄的肝炎肝硬化的患者入组, 这些患者行脾切+断流手术, 在这些患者入组前, 签订同意书, 剔除标准为: (1)术前已发生静脉血栓; (2)对血管造影剂敏感; (3)肾功能不全; (4)肝功能C级或者有凝血功能障碍. 2008-06/2010-10共随机抽取符合要求的58例患者进行研究组. 为防止血栓形成, 所有患者术后均进行抗凝治疗, 方案为: 低分子肝素+华法林. 对部分血小板升高明显的患者加用了双潘哒莫或者阿斯匹林, 根据术后是否发生血栓, 分为血栓组(PVT, n = 22和无血栓组(NO PVT, n = 36). (开腹脾切除术过程略)所有的患者手术前行CT检查, 术后根据病情多次行彩色多普乐检查, 判断PVT的位置, 包括肠系膜上、脾、及门静脉.
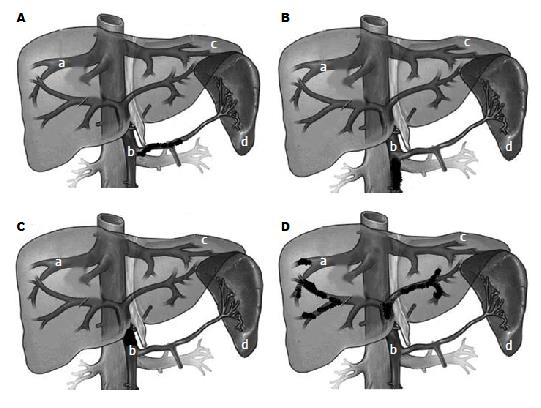
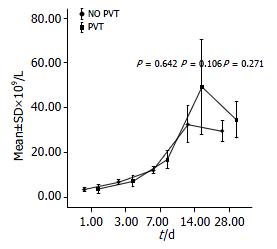
血栓诊断依据及分类: 根据PVT发生部位进行分类测量, (1)脾静脉血栓(splenic vein thrombosis, SVT); (2)肠系膜上静脉血栓(superior mesenteric vein thrombosis, SMT); (3)肝外门静脉主干血栓(extrahepatic vein thrombosis, EVT); (4)混合性血栓. 肝功能指标和血小板的检测: 围手术期肝功能检查分为4次: 术前最近1次肝功能检, 查报告为术前结果, 术后1、3、7、11 d分别进行肝功能检测, 项目包括血清ALT(U/L)、AST(U/L)、TBIL(µmol/L). 血小板于1、3、4、14、28 d进行检测, 对2组患者术前, 术后肝功能、血小板进行配对对比研究, 观察术后肝功能和血小板变化, 观察时间为术后2-3 wk.
统计学处理 连续数据的表达使用mean±SD, 对于计数资料的检验使用χ2检验或者Fisher exact检验, 对于计量资料的统计使用t检验, 所应用的软件为SPSS10.0, P<0.05有统计学意义.
在所行的58例患者中, 共有22例患者在术后发生了血栓, 见表1, 其中1例患者形EVT, 5例患者术后形成了SVT, 3例患者形成单独的SMT, 13例患者形成在门静脉系统的多个部位同时形成了血栓(图1, 表1). 血栓的总体发生率为37.93%. 对形成PVT患者均进行了溶栓治疗, 抗凝方案为尿激酶, (3-5)×104 U/h, 持续3 d. 华法林用量一般保持PTA在50%-70%. 这些患者在抗凝及溶栓过程中未发生出血等严重的并发症.
| 时间 | SVT | SMT | EVT | 混合血栓 | 症状 |
| 1 wk | 2 | 0 | 0 | 2 | 发热、腹痛 |
| 2 wk | 2 | 2 | 1 | 9 | 发热、腹痛 |
| 3 wk | 1 | 1 | 0 | 2 | 发热 |
| 合计 | 5 | 3 | 1 | 13 |
2组患者在术后门脉流速上存在显著差别, 门脉流速减慢、脾脏偏大是血栓发生的危险因素, 在手术时间和失血量上未发现有明显差异(表2).
| 一般情况 | NO PVT(n = 36) | PVT(n = 22) | P值 |
| 性别(男:女) | 23:13 | 14:8 | 0.538 |
| 年龄(岁) | 42±11.33 | 45±9.73 | 0.517 |
| BMI(kg/m2) | 20±5.59 | 22±6.14 | 0.271 |
| Child-Plug分级(A/B) | 28/8 | 17/5 | 0.416 |
| PT(s) | 15.14±3.46 | 14.81±1.22 | 0.320 |
| 手术时间(min) | 365.66±57.81 | 391.25±51.92 | 0.173 |
| 出血量(mL) | 306.88±84.51 | 361±104.41 | 0.379 |
| 脾脏质量(g) | 1 071±349 | 1 464±521 | 0.028 |
| 输血量(mL) | 361.66±173.28 | 391.66±126.02 | 0.317 |
| 门脉流速(cm/s) | 15.59±2.84 | 7.74±1.92 | 0.043 |
2组患者在近期肝功能指标变化方面相差不显著, 但在临床中, 从患者远期预后(6 mo以上)来看, NO PVT组肝功能要好于PVT组(表3).
| 分组 | ALT(U/L) | TBIL(μmol/L) | ||||
| 第1次 | 第2次 | 第3次 | 第1次 | 第2次 | 第3次 | |
| PVT组 | 44.00±12.21 | 31.00±14.31 | 39.00±14.53 | 27.21±4.29 | 23.00±3.68 | 31.00±10.41 |
| NO PVT组 | 44.00±13.88 | 40.00±12.77 | 31.00±10.71 | 23.00±4.64 | 22.16±3.72 | 19.51±6.73 |
| t值 | 0.123 | 0.746(-) | 0.484 | 0.109 | 0.080 | 0.342 |
| P值 | 0.808 | 0.462 | 0.170 | 0.811 | 0.912 | 0.310 |
在以前的研究中, PVT的发生率为6.3%-10%[4], 但是我们现在的研究发现, 脾切除术后的血栓发生率为37.93%(22/58), 远高于先前的研究, 这因主要因为检查手段的不断进步, 同时也是对术后血栓的重视, 需要指出的是: CT检查在术后血栓诊断中有重要价值[5], 因为许多患者术后有肠胀气, 或者肥胖患者超声诊断不清, 很多血栓未被及时发现, 因此CT特别是三维血管造影对术后血栓的阳性率要高于门脉彩超, 同时CT也可以提供更为具体的影像学诊断, 排除腹腔并发症[6,7]. 通过与超声检查的对比研究, Skarsgard在无症状患者中发现了2例门脉左支血栓[8], Chaffanjon也通过CT诊断了3例门脉主干血栓和1例肠系膜静脉血栓[9], 以上6例血栓均较小而且不连续, 这说明目前阶段性的门脉血栓不易被超声诊断[10]. 在我们的临床工作中, 也发生过患者超声诊断正常, 但CT检查却发现有门脉分支的血栓的病例. 这一方面和操纵者有关, 另一方面也说明术后B超在诊断门脉血栓有一定的局限性.
大多数学者认为[11,12]: 脾切除术后门脉血栓减少, 血流减少, 凝固因子(如血小板)增加是发生门脉血栓的主要原因[13,14], 本研究同样也证实了这一观点. 在脾肿大的患者中, 宽大的脾静脉可以导致出现血液湍流, 形成局部血栓, 除此之外, 我们认为手术本身也可能是形成血栓的一个原因[15,16], 比如说脾门的大范围结扎可以导致局部循环血流进一步减少, 操纵不仔细, 损伤周围组织, 门脉侧支广泛时血管内膜的损伤, 这些可以激活外源性或者内源性的凝血机制, 术中即可产生门脉系统的广泛微血栓的发生[17]. 因此, 对于不同的手术者来说, 血栓形成率可能不一样.
对于血栓的来源, Valla等[18]通过尸体检验, 证实了门脉血栓是主要是起源于脾静脉远端, 逐渐发展到肠系膜及门静脉, 这是起病的关键. 据此我们推测很多门脉主干和肝内血栓的发生很多是因为起源于脾静脉远端的血栓, 被肠系膜血管血流回流冲入门脉主干, 而且由于门脉右支比左支粗, 故右支发生血栓的可能性也较大. 脾切术后血小板增加到原来的10倍以上, 大部分患者明显高于术前, 一般在2-3 wk达到高峰[19], 虽然二组患者在血小板统计上未发现明显差异, 但也可以看出, PVT组还是略高于NO PVT组. 对于脾切除术后机体凝血和纤溶状况变化可能是多种因素综合作用的结果[20], 其中血液中血小板数量变化是其中最明显的, 也可能是非常重要的一个环节. 而且由于血小板计数简单、易行, 目前仍是临床上了解机体凝血机制和防治血栓形成的有力指标[19]. 因此, 我们还是认为血小板升高是术后血栓形成的另一个重要原因, 建议对各种原因所致脾切除术患者进行血小板监测, 了解血小板数量变化, 必要时进行治疗, 对预防血栓形成等并发症至关重要. 此外我们也发现血栓的发生也和一些潜在的病症有关, 比如说脾功能亢进, 溶血性贫血等, 这些患者也应加强监测.
从临床上观察到大部分血栓患者无明显表现, 部分患者仅表现为腹痛, 食欲不振或者是低热, 而且近期对患者肝功能影响也不大[20]. 说明门脉血栓发生后症状较为隐匿. Loring报道过2例未治疗自行溶解的血栓患者, Skarsgard也报道了2例血栓自发性溶解的患者, 也有报道有的患者因PVT致肠梗死, 这种情况比较罕见[21]. 一旦发生PVT就应立刻进行治疗. 因为从远期的预后来看, 形成血栓后, 肝功能恢复可能会受到一定的影响, 另外为以后行肝移植术带来一定的操纵难度. 血栓对患者远期生存率的影响目前也无相关报道[22].
在我们的研究中发现, 两组患者血流速度有显著差别, 可以作为一个的预测指标. 这是因为脾脏越大则脾切除后经脾静脉进人门静脉系统的血流量减少的就越多, 短期内门静脉压力下降就越明显, 术后门脉流速也越慢, 对门静脉系统的血流动力学影响越大[23], 此时门静脉系统血流状态改变明显, 形成局部涡流, 有利于门静脉系统血栓形成. 国外学者Pietrabissa的研究亦发现, 门静脉高压症脾脏越大, 脾脏切除后, 门静脉系统越容易形成血栓, 这和本研究是一致的.
很多专家推荐术后使用肝素, 华法林预防血栓形成, 通过随访, 我们发现接受华法林治疗的患者, 可以阻止血栓继续发生, 而有部分PVT患者可自行溶解, 充分说明了这一方法有效性[24], 但也应当看到, 尽管使用了肝素和化法林治疗, 也有相当一部分患者发生了血栓[25,26], Chaffanjon报道, 即使应用了华法林, 也有6.7%的患者发生PVT, Skarsgard报道, 未应用抗凝治疗, 有6.3%的患者发生PVT. 这说明, 目前抗凝的效果还不十分完善, 血栓发生与一些别的因素有关, 如血流动力学的改变有关.
我们认为: (1)脾切断流术后血栓的发生率约为38%, 发生部位多为混合性血栓; (2)血小板计数偏高和血流缓慢是发生门脉血栓的重要原因, 对这部分患者术后应加强监测; (3)CT在血栓的诊断中灵敏度要高于常规B超, 对高度可疑患者必要时可行CT检查, 有利于早期发现血栓, 并采取治疗措施; (4)早期、持续的全身抗凝能有效的预防肝炎肝硬化门静脉高压症脾切除术后门静脉系统血栓的形成, 并极大地改善了这类患者的预后.
本研究有存在一定的局限性, 主要是: (1)本试验为单中心研究, 且数量较少, 可能存在抽样误差, 如能同时开展多中心研究, 则结果更有说服力; (2)目前资料缺乏对血栓形成后的远期生存率观察, 且随访受到一定的限制; (3)对血栓形成的原因仅为临床回顾性研究, 而血栓形成可能多种因素, 如能开展前瞻性的多因素研究, 则能对血栓形成原因进行更深一步的探讨, 为脾切术后血栓的预防和治疗带来更有效的方案.
门静脉血栓形成是脾切除、断流术后常见的一种并发症, 术后门静脉血栓形成后, 多半为不完全阻塞, 一般无明显症状. 但如果门静脉阻塞严重或合并感染、可引起广泛性小肠坏死或严重的肝功能衰竭, 常常导致患者死亡. 因此术后预防门静脉血栓形成是有其临床意义的.
杨家和, 教授, 中国人民解放军第二军医大学附属东方肝胆外科医院综合三科
Valla等通过尸体检验, 证实了门脉血栓是主要是起源于脾静脉远端, 逐渐发展到肠系膜及门静脉, 这是起病的关键.
本文通过对脾切术后门脉血栓的发生率和部位详细研究, 分析了血栓发生的原因和治疗方法. 对可能发生血栓的高危人群提供了临床治疗的理论依据.
通过本研究可知, 脾切术后的血栓发生率较高, 应引起临床医生的注意, 对部分可能发生血栓的人群, 术前和术后都应加强抗凝治疗.
本文方法合理, 实用性强, 对门静脉血栓形成的预后有一定的参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Amitrano L, Guardascione MA, Brancaccio V, Margaglione M, Manguso F, Iannaccone L, Grandone E, Balzano A. Risk factors and clinical presentation of portal vein thrombosis in patients with liver cirrhosis. J Hepatol. 2004;40:736-741. [PubMed] [DOI] |
| 2. | Francoz C, Belghiti J, Vilgrain V, Sommacale D, Paradis V, Condat B, Denninger MH, Sauvanet A, Valla D, Durand F. Splanchnic vein thrombosis in candidates for liver transplantation: usefulness of screening and anticoagulation. Gut. 2005;54:691-697. [PubMed] |
| 3. | Amitrano L, Brancaccio V, Guardascione MA, Margaglione M, Iannaccone L, D'Andrea G, Marmo R, Ames PR, Balzano A. Inherited coagulation disorders in cirrhotic patients with portal vein thrombosis. Hepatology. 2000;31:345-348. [PubMed] [DOI] |
| 4. | Wu CC, Cheng SB, Ho WM, Chen JT, Yeh DC, Liu TJ, P'eng FK. Appraisal of concomitant splenectomy in liver resection for hepatocellular carcinoma in cirrhotic patients with hypersplenic thrombocytopenia. Surgery. 2004;136:660-668. [PubMed] [DOI] |
| 5. | Kercher KW, Carbonell AM, Heniford BT, Matthews BD, Cunningham DM, Reindollar RW. Laparoscopic splenectomy reverses thrombocytopenia in patients with hepatitis C cirrhosis and portal hypertension. J Gastrointest Surg. 2004;8:120-126. [PubMed] [DOI] |
| 6. | Shimada M, Ijichi H, Yonemura Y, Harada N, Shiotani S, Ninomiya M, Terashi T, Yoshizumi T, Soejima Y, Suehiro T. The impact of splenectomy or splenic artery ligation on the outcome of a living donor adult liver transplantation using a left lobe graft. Hepatogastroenterology. 2004;51:625-629. [PubMed] |
| 7. | Hashizume M, Tomikawa M, Akahoshi T, Tanoue K, Gotoh N, Konishi K, Okita K, Tsutsumi N, Shimabukuro R, Yamaguchi S. Laparoscopic splenectomy for portal hypertension. Hepatogastroenterology. 2002;49:847-852. [PubMed] |
| 8. | Winslow ER, Brunt LM, Drebin JA, Soper NJ, Klingensmith ME. Portal vein thrombosis after splenectomy. Am J Surg. 2002;184:631-635; discussion 635-636. [PubMed] [DOI] |
| 9. | Ikeda M, Sekimoto M, Takiguchi S, Kubota M, Ikenaga M, Yamamoto H, Fujiwara Y, Ohue M, Yasuda T, Imamura H. High incidence of thrombosis of the portal venous system after laparoscopic splenectomy: a prospective study with contrast-enhanced CT scan. Ann Surg. 2005;241:208-216. [PubMed] [DOI] |
| 10. | Soyer T, Ciftci AO, Tanyel FC, Senocak ME, Büyükpamukçu N. Portal vein thrombosis after splenectomy in pediatric hematologic disease: risk factors, clinical features, and outcome. J Pediatr Surg. 2006;41:1899-1902. [PubMed] [DOI] |
| 11. | Hanazaki K, Kajikawa S, Adachi W, Amano J. Portal vein thrombosis may be a fatal complication after synchronous splenectomy in patients with hepatocellular carcinoma and hypersplenism. J Am Coll Surg. 2000;191:341-342. [PubMed] [DOI] |
| 12. | Condat B, Pessione F, Helene Denninger M, Hillaire S, Valla D. Recent portal or mesenteric venous thrombosis: increased recognition and frequent recanalization on anticoagulant therapy. Hepatology. 2000;32:466-470. [PubMed] [DOI] |
| 13. | Condat B, Pessione F, Hillaire S, Denninger MH, Guillin MC, Poliquin M, Hadengue A, Erlinger S, Valla D. Current outcome of portal vein thrombosis in adults: risk and benefit of anticoagulant therapy. Gastroenterology. 2001;120:490-497. [PubMed] [DOI] |
| 14. | Sarin SK, Agarwal SR. Extrahepatic portal vein obstruction. Semin Liver Dis. 2002;22:43-58. [PubMed] [DOI] |
| 15. | Egesel T, Büyükasik Y, Dündar SV, Gürgey A, Kirazli S, Bayraktar Y. The role of natural anticoagulant deficiencies and factor V Leiden in the development of idiopathic portal vein thrombosis. J Clin Gastroenterol. 2000;30:66-71. [PubMed] [DOI] |
| 16. | Denninger MH, Chaït Y, Casadevall N, Hillaire S, Guillin MC, Bezeaud A, Erlinger S, Briere J, Valla D. Cause of portal or hepatic venous thrombosis in adults: the role of multiple concurrent factors. Hepatology. 2000;31:587-591. [PubMed] [DOI] |
| 17. | Valla D, Casadevall N, Huisse MG, Tulliez M, Grange JD, Muller O, Binda T, Varet B, Rueff B, Benhamou JP. Etiology of portal vein thrombosis in adults. A prospective evaluation of primary myeloproliferative disorders. Gastroenterology. 1988;94:1063-1069. [PubMed] |
| 18. | Valla DC, Condat B. Portal vein thrombosis in adults: pathophysiology, pathogenesis and management. J Hepatol. 2000;32:865-871. [PubMed] [DOI] |
| 19. | Primignani M, Martinelli I, Bucciarelli P, Battaglioli T, Reati R, Fabris F, Dell'era A, Pappalardo E, Mannucci PM. Risk factors for thrombophilia in extrahepatic portal vein obstruction. Hepatology. 2005;41:603-608. [PubMed] [DOI] |
| 20. | Mack CL, Superina RA, Whitington PF. Surgical restoration of portal flow corrects procoagulant and anticoagulant deficiencies associated with extrahepatic portal vein thrombosis. J Pediatr. 2003;142:197-199. [PubMed] [DOI] |
| 21. | Dubuisson C, Boyer-Neumann C, Wolf M, Meyer D, Bernard O. Protein C, protein S and antithrombin III in children with portal vein obstruction. J Hepatol. 1997;27:132-135. [PubMed] [DOI] |
| 22. | Fisher NC, Wilde JT, Roper J, Elias E. Deficiency of natural anticoagulant proteins C, S, and antithrombin in portal vein thrombosis: a secondary phenomenon? Gut. 2000;46:534-539. [PubMed] |
| 23. | Pabinger I, Allaart CF, Hermans J, Briët E, Bertina RM. Hereditary protein C-deficiency: laboratory values in transmitters and guidelines for the diagnostic procedure. Report on a study of the SSC Subcommittee on Protein C and Protein S. Protein C Transmitter Study Group. Thromb Haemost. 1992;68:470-474. [PubMed] |
| 24. | Gürgey A, Mesci L. The prevalence of factor V Leiden (1691 G-->A) mutation in Turkey. Turk J Pediatr. 1997;39:313-315. [PubMed] |
| 25. | Gürgey A, Hicsönmez G, Parlak H, Balta G, Celiker A. Prothrombin gene 20210 G-A mutation in Turkish patients with thrombosis. Am J Hematol. 1998;59:179-180. [PubMed] [DOI] |
| 26. | Harmanci O, Bayraktar Y. Portal hypertension due to portal venous thrombosis: etiology, clinical outcomes. World J Gastroenterol. 2007;13:2535-2540. [PubMed] |