修回日期: 2010-09-14
接受日期: 2010-09-20
在线出版日期: 2010-11-28
目的: 探讨白细胞介素-8(interleukin-8, IL-8)基因启动子区-251A/T多态性位点与急性胰腺炎(acute pancreatitis, AP)的相关性.
方法: 严格按照诊断标准, 选取无亲缘关系的轻型胰腺炎(mild acute pancreatitis, MAP)患者83例、重型胰腺炎(severe acute pancreatitis, SAP)患者36例及健康对照组236例, 提取基因组DNA, 采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术检测-251A/T多态性位点的基因型, 采用HaploView4.0及SPSS11.5软件分析各位点基因型、等位基因频率及组间差异.
结果: IL-8基因-251A/T位点的基因型及等位基因频率分布在AP与正常对照组存在显著性差异(TT: 40.34% vs 48.73%; AT: 47.06% vs 46.61%; AA: 12.61% vs 4.66%; T: 63.87% vs 72.03%; A: 36.13% vs 27.97%; 均P<0.01), AP组-251A/T位点的等位基因A频率显著高于正常对照组(χ2 = 4.962, P = 0.026, OR = 1.457, 95%CI 1.045-2.032), SAP组的AA基因型与对照组相比有统计学差异(χ2 = 8.244, P = 0.004, OR = 4.273, 95%CI 1.473-12.392). IL-8基因-251A/T位点的基因型及等位基因频率分布在MAP与正常对照组以及MAP组与SAP组均无显著性差异(P>0.05).
结论: IL-8基因-251A/T多态性可能与AP有关, 是AP病情进展的危险因素. 携带有-251A/T多态性位点A等位基因的个体可能更容易患急性胰腺炎.
引文著录: 曹德清, 肖春珍. 白介素-8基因启动子区-251A/T多态性与急性胰腺炎的相关性. 世界华人消化杂志 2010; 18(33): 3580-3583
Revised: September 14, 2010
Accepted: September 20, 2010
Published online: November 28, 2010
AIM: To investigate possible association between an interleukin-8 (IL-8) gene promoter polymorphism (-251A/T) and susceptibility to acute pancreatitis (AP).
METHODS: Genomic DNA was isolated from venous blood leukocytes of 36 unrelated patients with mild acute pancreatitis (MAP), 83 unrelated patients with severe acute pancreatitis (SAP) and 236 unrelated healthy individuals (control group). The -251A/T polymorphism was genotyped by PCR-restriction fragment length polymorphisms (PCR-RFLP). Genotype and allele frequencies were analyzed using HaploView4.0 and SPSS11.5 software.
RESULTS: There were significant differences in both allele and genotype frequencies of the -251A/T polymorphism between AP patients and healthy controls (TT: 40.34% vs 48.73%; AT: 47.06% vs 46.61%; AA: 12.61% vs 4.66%; T: 63.87% vs72.03%; A: 36.13% vs 27.97%; all P < 0.01). The frequency of A allele was significantly higher in AP patients than in healthy controls (χ2 = 4.962, P = 0.026, OR = 1.457, 95%CI 1.045-2.032). A significant difference was also noted in AA frequency between SAP patients and healthy controls (χ2 = 8.244, P = 0.004, OR = 4.273, 95%CI 1.473-12.392).
CONCLUSION: There is an association between the -251A/T polymorphism and susceptibility to AP. Individuals with A allele at the -251A/T locus are susceptible to AP.
- Citation: Cao DQ, Xiao CZ. Association between an interleukin-8 promoter polymorphism (-251A/T) and susceptibility to acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3580-3583
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3580.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3580
急性胰腺炎(acute pancreatitis, AP)是由于胰管阻塞, 胰管内压突然增高以及胰腺缺血等原因引起的胰腺急性炎症. 他是一种潜在的致命性疾病, 其发病急、病情重、病程发展快, 临床上分为轻型胰腺炎(mild acute pancreatitis, MAP)和重型胰腺炎(severe acute pancreatitis, SAP). 其在发生发展过程中常合并全身炎性反应综合征(systemic inflammatory response syndrome, SIRS)及多器官功能不全综合征, 病死率高, 一直以来是临床值得进一步探讨的课题[1]. 研究表明, 在AP时伴有促炎细胞因子的升高, 并且升高的幅度与AP的严重程度密切相关, 白细胞过渡激活学说提出以来的大量证据表明, AP发病的早期即存在炎性细胞因子的过度释放和过度的全身炎性反应综合征, 进而导致多器官功能综合征, 并成为AP急性反应的核心问题[2]. IL-8是一种能激活嗜中性粒细胞的趋化性细胞因子, 对炎症和免疫应答过程有重要的调节作用. IL-8在AP时期的中性粒细胞的激活和随后的中性粒细胞弹性蛋白酶的释放中起着重要的作用, 促进AP由局部损害向全身并发症发展[3]. IL-8是诱发中性粒细胞在肺部聚集的重要介质, 并能活化胞内G蛋白释放弹性蛋白酶, 引起肺组织损伤; 通过化学吸附和增强胞内黏附分子对内皮细胞的作用, 加剧内皮细胞的损害; 诱发中性粒细胞变形及L-选择素从中性粒细胞表面脱落, 便于中性粒细胞游走至炎症区域. 因此, IL-8在AP的发病机制中扮演着重要的角色[4]. 大量临床病例研究发现对不同的个体, 即便在同一致病因素的作用下, AP的发生存在着个体差异. IL-8与AP的发生发展有密切相关性, IL-8基因启动子区-251A/T多态性位点可能通过影响转录造成其表达量的差异, 从而影响AP的发生和病情程度[5]. 我们通过采用聚合酶链反应-限制性片段长度多态性(PCR-polymorphism restriction fragment, PCR-RFLP)技术检测-251A/T多态性位点的基因型, 对355例个体进行了基因分型, 用病例-对照研究方法对IL-8基因启动子区-251A/T功能多态性位点的基因型及等位基因与AP的相关性进行了研究, 现报道如下.
选择2005-03/2010-01住院患者119例, 其中男67例, 女52例. 年龄22-74(平均年龄46.1±13.8)岁. Balthazar CT评分≥4分[6]. 具备AP的临床表现和生化改变,且具下列之一者: 局部并发症(胰腺坏死, 假性囊肿, 胰腺脓肿); 器官衰竭, 急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)≥8分[7,8]者为SAP, 共36例; 其余为MAP患者, 共83例. AP诊断依据中华医学会外科学会胰腺学组制定的《急性胰腺炎的临床诊断及分级标准》. 收集236名无亲缘关系的健康体检者作为健康对照组, 其中男130名, 女106名, 年龄20-62(平均年龄38.8±6.7)岁. 以上355例研究对象均为江西汉族个体.
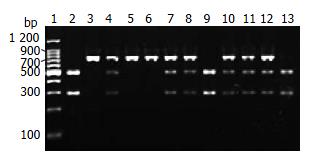
用EDTA抗凝真空采血管收集外周血3-5 mL, 采用TIANamp Blood DNA Kit全血基因组DNA提取试剂盒(天根, 中国北京)提取基因组DNA, -20 ℃储存备用. PCR扩增采用24 μL反应体系, 含50-300 ng基因组DNA, 1×PCR缓冲液, 15 mmol/L MgCl2, 5 μmol/L引物, 1.5 U Tag酶. PCR及酶切产物用2%琼脂糖凝胶电泳, 经凝胶成像仪系统处理后进行基因型判读, 保存结果. -251A/T参照文献[9]引物, 上游5'-CACTGGAATTAATGTCTTAGTACCA-3', 下游5'-AAGCTTGTGTGCTCTGCTGTCTCT-3'. PCR扩增循环参数如下: 95 ℃预变性4 min, 95 ℃变性30 s, 60 ℃退火35 s, 72 ℃延伸40 s, 30个循环, 72 ℃总延伸15 min, 4 ℃保存. 10 μL PCR反应产物用5 U MunⅠ限制性内切酶37 ℃过夜消化. TT型, 酶切后仅有798 bp片断; AT型, 酶切后即有798 bp、500 bp及298 bp 3个片段为杂合子突变; AA型, 可产生500 bp及298 bp两个片段, 为纯合子突变.
统计学处理 采用HaploView4.0软件进行Hardy-Weinberg平衡检验, 计算病例组和对照组间基因型频率和等位基因频率. 采用SPSS 11.50软件进行χ2检验, 统计分析等位基因及基因型频率分布差异, P<0.05为差异有显著性意义.
IL-8基因-251A/T多态性位点的基因型及等位基因频率分布均符合Hard-Weinberg平衡定律. 其基因型、等位基因频率在正常与疾病组中的分布及统计结果见表1. IL-8基因-251A/T位点的AA基因型及A等位基因频率分布在AP与正常对照组存在显著性差异(P<0.01), AP组-251A/T位点的等位基因A频率显著高于正常对照组(χ2 = 4.962, P = 0.026, OR = 1.457, 95%CI = 1.045-2.032); SAP组的AA基因型与对照组相比有统计学差异(χ2 = 8.244, P = 0.004, OR = 4.273, 95%CI = 1.473-12.392). IL-8基因-251A/T位点的基因型及等位基因频率分布在MAP与正常对照组以及MAP组与SAP组均无显著性差异(P>0.05, 图1).
IL-8具有诱导单核细胞趋化及激活单核细胞的双重功能, 对机体的防御, 炎症恢复等发挥重要的作用[10]. 不论是在动物模型还是人体组织的急慢性胰腺炎中都发现IL-8表达上调, 是AP中重要的炎性介质之一[11].
临床病例研究表明, 对不同的个体, 即便在同一致病因素的作用下, 只有部分患者发生AP且严重程度不一. IL-8在AP时表达明显增加, 有合并SIRS的尤为明显, 与疾病严重程度相关[12], IL-8基因-251A/T多态性与AP发病机制密切相关[13].
我们的结果表明, IL-8基因-251A/T位点的AA基因型及A等位基因频率分布在AP与正常对照组存在显著性差异(P<0.01). 其结果显示, IL-8基因-251A/T多态性的基因型和等位基因与AP有关联. 我们的数据表明, AP组-251A/T位点的等位基因A频率显著高于正常对照组(P = 0.005, OR = 1.618), 说明, 携带有等位基因A的个体可能更容易患AP. 进一步对SAP、MAP与对照组进行多重比较分析发现, SAP组的AA基因型与对照组相比有统计学差异(P = 0.004, OR = 4.273). 说明, SAP中携带基因型AA的个体使IL-8表达量增高, 加重了全身炎性反应, 成为AP病情加重的一个危险因素. 这与李赟等[5]对我国汉族群体这一多态性位点与AP的研究结果一致. 然而, 有研究报道却得到了不同的结论[13]. 出现有争议的原因可能与以下因素有关. 首先, 不同报道采用病例对照的关联研究受到潜在疾患者群分层误差的影响, 从而产生假阳性结果或者使真正的IL-8基因-251A/T位点多态性与AP的关联被忽视. 其次, 所选取的疾病群体的样本量和样本遗传背景可能会对实验结果产生影响, 样本量是影响群体关联分析研究结果的一个重要因素. IL-8基因在其转录起始点上游-251位点处存在A/T基因多态性, 通过转录调控影响IL-8的合成, 在基因水平发挥着调节作用[14]. 因此, IL-8基因-251A/T位点可能与AP有关, 等位基因A可能是AP病情进展的一个危险因素.
然而, IL-8基因-251A/T位点多态性是否会影响蛋白的表达, 功能是否改变, 有待于进一步实验加以证实. 我们的研究结果或许会为后续更为深入的研究作出重要的提示. -251A/T位点序列多态性与AP的研究, 尚需更大的样本量以及其他地域和民族的基础数据, 故其与AP的关系还需在不同人种、地区及人群中进行进一步研究证实.
研究表明, 对不同的个体, 即便在同一致病因素的作用下, 只有部分患者发生急性胰腺炎且严重程度不一. 白介素-8在AP时表达明显增加, 有合并SIRS的尤为明显, 与疾病严重程度相关, IL-8基因-251A/T多态性与急性胰腺炎发病机制密切相关.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
本文用病例-对照研究方法对IL-8基因启动子区-251A/T功能多态性位点的基因型及等位基因与AP的相关性进行了研究.
IL-8基因-251A/T多态性可能与AP有关, 是AP病情进展的危险因素. 携带有-251A/T多态性位点A等位基因的个体可能更容易患急性胰腺炎.
本文选题新颖, 学术价值较好, 对急性胰腺炎发病机制的研究有一定的参考价值.
编辑: 曹丽鸥 电编:李薇
| 1. | Talukdar R, Vege SS. Recent developments in acute pancreatitis. Clin Gastroenterol Hepatol. 2009;7:S3-S9. [PubMed] [DOI] |
| 3. | 费 书珂, 张 树友. 细胞因子在重症急性胰腺炎中的作用. 南华大学学报: 医学版. 2004;32:527-529. |
| 4. | Ryschich E, Kerkadze V, Deduchovas O, Salnikova O, Parseliunas A, Märten A, Hartwig W, Sperandio M, Schmidt J. Intracapillary leucocyte accumulation as a novel antihaemorrhagic mechanism in acute pancreatitis in mice. Gut. 2009;58:1508-1516. [PubMed] |
| 6. | Leung TK, Lee CM, Lin SY, Chen HC, Wang HJ, Shen LK, Chen YY. Balthazar computed tomography severity index is superior to Ranson criteria and APACHE II scoring system in predicting acute pancreatitis outcome. World J Gastroenterol. 2005;11:6049-6052. [PubMed] |
| 8. | Jáuregui-Arrieta L, Alvarez-López F, Cobián-Machuca H, Solís-Ugalde J, Torres-Mendoza B, Troyo-Sanromán R. [Effectiveness of the modify tomographic severity index in patients with severe acute pancreatitis.]. Rev Gastroenterol Mex. 2008;73:144-148. [PubMed] |
| 9. | 张 立玮, 都 超群, 牛 巍巍, 于 卫芳, 艾 军, 申 玉霞, 王 顺平, 王 士杰. IL-8基因多态性与高发区食管癌发病风险的关联研究. 中国肿瘤临床. 2008;35:591-595. |
| 10. | Skov L, Beurskens FJ, Zachariae CO, Reitamo S, Teeling J, Satijn D, Knudsen KM, Boot EP, Hudson D, Baadsgaard O. IL-8 as antibody therapeutic target in inflammatory diseases: reduction of clinical activity in palmoplantar pustulosis. J Immunol. 2008;181:669-679. [PubMed] |
| 11. | Motoo Y, Xie MJ, Mouri H, Sawabu N. Expression of interleukin-8 in human obstructive pancreatitis. JOP. 2004;5:138-144. [PubMed] |
| 12. | McKay CJ, Gallagher G, Brooks B, Imrie CW, Baxter JN. Increased monocyte cytokine production in association with systemic complications in acute pancreatitis. Br J Surg. 1996;83:919-923. [PubMed] [DOI] |
| 13. | Chen WC, Nie JS. Genetic polymorphism of MCP-1-2518, IL-8-251 and susceptibility to acute pancreatitis: a pilot study in population of Suzhou, China. World J Gastroenterol. 2008;14:5744-5748. [PubMed] [DOI] |
| 14. | Jiang ZD, Okhuysen PC, Guo DC, He R, King TM, DuPont HL, Milewicz DM. Genetic susceptibility to enteroaggregative Escherichia coli diarrhea: polymorphism in the interleukin-8 promotor region. J Infect Dis. 2003;188:506-511. [PubMed] [DOI] |