修回日期: 2010-10-20
接受日期: 2010-10-26
在线出版日期: 2010-11-28
目的: 探讨肝脏滤泡树突状细胞肉瘤患者的临床病理学特征、诊断、鉴别诊断、治疗方法和预后.
方法: 以中国解放军南京军区福州总医院收治的3例肝脏滤泡树突状细胞肉瘤患者为对象, 分析其临床表现及诊疗经过, 并进行随访, 同时对送检标本进行病理学检查, 结合有关文献探讨该病的临床病理学特点.
结果: 肿瘤位于肝脏左叶或右叶, 呈浸润性生长. 组织学上可见梭形细胞肉瘤成分与炎性细胞成分混合存在; 局灶见大片凝固性坏死. 免疫组织化学染色显示肿瘤细胞呈CD21、CD23、CD35、vimentin强阳性, CD45、EMA呈弱阳性表达, 反应性炎症细胞呈CD20、CD79a、CD2、CD3、CD45RO、CD38阳性. 例3肿瘤细胞呈EBER、EBV阳性表达. 免疫组织化学染色阴性抗体有: CK7、CK8、CK18、CK(H)、CD34、CD117、Dog-1、actin、SMA、caldesmon、desmin、CD10、CD21、CD23、CD35、CD1a、CD2、CD3、CD20、CD45、ALK、CD68、CD163、CD30、CD15、HMB45、S-100. 病理诊断为肝脏滤泡树突状细胞肉瘤.
结论: 肝脏滤泡树突状细胞肉瘤是一种罕见恶性肿瘤, 临床与病理上需要与指突状树突细胞肉瘤、肝肉瘤样癌、炎性肌纤维母细胞瘤、胃肠道外间质瘤、组织细胞肉瘤等相鉴别, 预后不定.
引文著录: 黄海建, 余英豪, 郑智勇. 肝脏滤泡树突状细胞肉瘤临床病理特征. 世界华人消化杂志 2010; 18(33): 3520-3526
Revised: October 20, 2010
Accepted: October 26, 2010
Published online: November 28, 2010
AIM: To investigate the clinicopathologic features, diagnosis, treatment and prognosis of hepatic follicular dendritic cell sarcoma.
METHODS: The clinical, pathological and immunohistochemical data for three patients with hepatic follicular dendritic cell sarcoma who were treated at our hospital were collected to analyze the clinicopathologic features, diagnosis, treatment and prognosis of the disease. A literature review was also performed to reveal the characteristics of the disease.
RESULTS: All the tumors showed an infiltrative growth pattern. Two tumors were located in the left lobe of the liver, and one in the right lobe. Histopathology revealed co-existence of the components of spindle cell sarcoma and inflammatory cells. Coagulation necrosis was noted in some areas. Immunohistochemically, tumor cells were strongly positive for CD21, CD23, CD35, vimentin, weakly positive for CD45 and EMA, but negative for CK (Pan), CD34, CD117, Dog-1, actin, SMA, caldesmon, desmin, CD10, CD15, CD30, CD1a, ALK, CD68, CD163, HMB45 and S-100. Inflammatory cells were positive for CD20, CD79a, CD2, CD3, CD45RO and CD38. In all three cases, tumor cells were positive for EBER and EBV. A diagnosis of hepatic follicular dendritic cell sarcoma was made.
CONCLUSION: Hepatic follicular dendritic cell sarcoma is a rare tumor with a high degree of malignancy and should be differentiated from interdigitating dendritic cell sarcoma, sarcomatoid hepatocellular carcinoma, inflammatory myofibroblastoma, extra-gastrointestinal stromal tumor, and histiocytosarcoma.
- Citation: Huang HJ, Yu YH, Zheng ZY. Clinicopathologic features of hepatic follicular dendritic cell sarcoma. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3520-3526
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3520.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3520
树突状细胞是人体内一类将抗原提呈给B淋巴细胞的专职抗原呈递细胞, 因具有典型的树突状或伪足状突起而得名, 主要分布于人体淋巴造血系统[1]. 但近年研究显示肝脏中也有少量分布, 主要位于汇管区淋巴组织, 因其表达CD21和CD35等抗原, 故称为滤泡树突状细胞[2,3]. 滤泡树突状细胞肉瘤(follicular dendritic cell sarcoma, FDCS)系由滤泡树突状细胞发生的一类恶性肿瘤的总称, 由Monda等于1986年首先报道[4]. FDCS主要发生于淋巴结, 也可发生于淋巴结外脏器或组织[5], 结外者见于口腔、扁桃体、上颚、鼻咽部、乳腺、胸膜、胃肠道、肝脏、胰腺、脾脏、软组织、骨盆、后腹膜等部位[6]. Shek等于1996年首先报道了1例肝脏FDCS, 目前国内外仅有零星报道, 肝脏FDCS罕见, 恶性度高[7]. 我们收集了3例FDCS病例, 并复习文献, 探讨该病的发生发展、临床表现、病理学特征及诊断, 以提高对该病的认识, 为治疗及预后提供依据.
收集中国解放军南京军区福州总医院病理科2007-2010年3例肝脏FDCS标本, 其中例1来自2007-09外院会诊病例, 例2、3分别为本院2010-02、2010-04存档蜡块. 其中例1乙肝小三阳5年, 例2及例3乙肝均阴性. 例3诊断为Evans综合征1年, 自身抗体IgG阳性. 3例肿瘤标志物检查甲胎蛋白(alpha fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖链抗原19-9(carbohydrate antigen 19-9、CA19-9)均正常.
手术结合术中超声, 将肝脏病灶完整切除. 手术标本经40 g/L甲醛溶液固定, 常规石蜡包埋, 4 μm厚切片, HE染色; 采用EliVision法分别进行CD21、CD23、CD35、波形蛋白(vimentin)、CD45、上皮膜抗原(epithelial membrane antigen, EMA)、CD20、CD79a、CD2、CD3、CD45RO、CD38、Ki-67、HbsAg、HbcAg、CK7、CK8、CK18、CK(Pan)、CD34、CD117、Dog-1、肌动蛋白(actin)、抗平滑肌抗体(smooth muscle antibody, SMA)、钙调蛋白(caldesmon)、desmin、CD10、CD15、CD30、CD1a、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、CD68、CD163、HMB45、S-100、EB病毒(epstein-barr virus, EBV)抗原等免疫组织化学染色. 光镜观察. 所用的一抗和EliVision试剂盒均购自福建迈新公司. EBV编码小的RNA(Epstein-Barr virus-encoded small RNA, EBER)探针(T4100F)试剂盒购自Triplex公司, 方法按说明书进行: 石蜡切片脱蜡水化, 蛋白酶K消化, 10 g/L多聚甲醛后固定, 900 mL/L冰乙醇脱水. 每片滴加20 μL杂交液, 37 ℃杂交16 h. 经2×PBS液洗涤, 链卵白素偶联的碱性磷酸酶(1:500)室温孵育1 h, 缓冲液PBS洗涤, DAB法显色, 苏木素复染细胞核. 阴性对照采用正义RNA探针替代, 阳性对照采用1例已知EBER阳性NKT细胞淋巴瘤. 结果分析: 胞核内黑蓝色颗粒为阳性信号.
3例肝脏FDCS的临床资料如表1所示. 核磁共振影像学(magnetic resonance imaging, MRI)检查示3例FDCS均为高密度阴影, 其中例1和例2肿物界限尚清, 例2中肿物呈多结节状, 例3肿物界不清, 累及周围软组织.
| 病例 | 性别/年龄(岁) | HBV | EBV | 主要症状 | MRI | 部位 | 肿物最大直径(cm) | 治疗 | 随访(mo) |
| 1 | 男/54 | + | - | 无诱因发现上腹部包块1 mo | 高密度影, 界线尚清 | 左叶 | 11.0 | 手术 | 35- |
| 2 | 女/45 | - | - | 左上腹胀伴腹痛1 mo | 多发性结节状影, 界清 | 左叶 | 16.5 | 手术 | 6- |
| 3 | 女/40 | - | + | 皮肤淤斑伴面色 苍白11 mo | 高密度影, 界不清 | 右叶 | 18.5 | 手术+化疗, 术后2 mo脾脏转移 | 4 |
肿物均位于肝被膜下, 直径11-18.5(中位直径14.75) cm, 无包膜, 切面灰白灰红, 质地中等偏硬. 例1、2肿物界清, 周围肝灰黄色, 质韧; 例3肿物界不清, 周围肝灰黄色, 质地细腻, 部分胆管轻度扩张伴胆汁淤积.
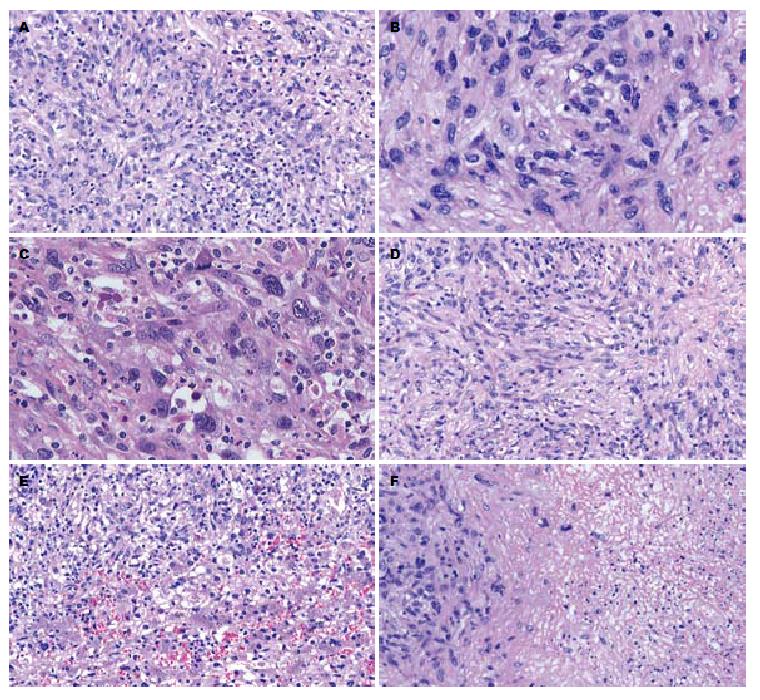
3例肿物组织学表现相似. 肿瘤组织由数量不等的肉瘤样梭形细胞与反应性的炎细胞构成(图1A); 肿瘤细胞大部分呈梭形、卵圆形, 胞质丰富嗜伊红, 胞质界不清, 核深染, 异型性小, 核分裂像少见(图1B); 在肿瘤的其他区域, 细胞呈上皮样、星状、多边形, 核大深染, 核浆比增高, 细胞异型性明显, 可见较多病理性核分裂像, 类似软组织的梭形细胞肉瘤或低分化肝癌, 并可见两类细胞之间移行过程(图1C); 肿瘤背景中散在反应性增生的炎症细胞浸润, 如淋巴细胞、组织细胞、浆细胞等, 部分淋巴细胞有轻度异型, 似淋巴瘤表现; 肿瘤细胞排列呈漩涡状、束状或不规则状(图1D); 局灶间质纤维化伴玻璃样变性; 例3肿瘤呈浸润性生长, 侵及周围肝组织(图1E), 灶性区肿瘤侵犯肝被膜及周围软组织; 例3中肿瘤部分区可见大片凝固性坏死及出血(图1F); 例1周围肝组织轻-中度慢性乙型肝炎改变, 例2、3周围肝组织呈轻-中度慢性肝炎及轻度淤胆表现.
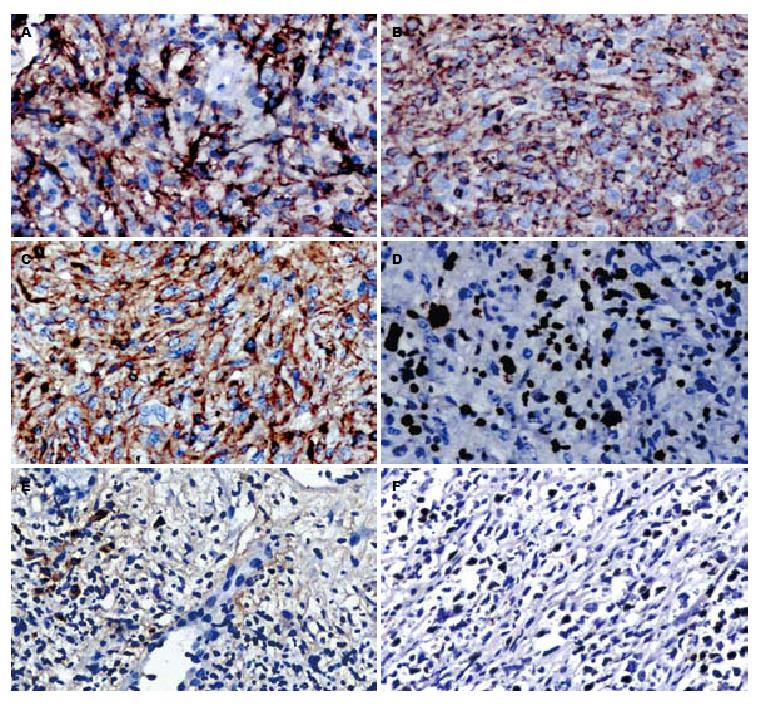
3例FDCS肿瘤细胞的免疫表型一致, 肿瘤细胞均呈CD21(图2A)、CD23、CD35(图2B)、vimentin(图2C)强阳性, CD45、EMA呈弱阳性表达, 反应性炎症细胞呈CD20、CD79a、CD2、CD3、CD45RO、CD38阳性. vimentin阳性分布与肿瘤细胞的形态有关, 梭形伴肉瘤样变区域, 呈弱阳性表达, 而在细胞分化好的区域, 呈强阳性表达. Ki-67增殖指数25%-50%(图2D). 例1周围肝组织HbsAg和HbcAg阳性, 例2、3周围肝组织HbsAg和HbcAg阴性, EB病毒抗原检测示例3肿瘤细胞EBV(图2E)呈弱阳性, 而例1、2肿瘤细胞均阴性. 免疫组织化学染色阴性抗体有: CK7、CK8、CK18、CK(Pan)、CD34、CD117、Dog-1、actin、SMA、caldesmon、desmin、CD10、CD15、CD30、CD1a、ALK、CD68、CD163、HMB45、S-100.
例3中肿瘤细胞核呈EBER阳性表达(约10%)(图2F), 而例1和例2中肿瘤细胞均阴性.
肝脏FDCS, 其中例1和例2为低级别FDCS, 例3为高级别FDCS.
肝脏FDCS约占肝脏恶性肿瘤的0.1%, 常发生于30-65(中位年龄47.5)岁青中年人, 女性多于男性患者(1.4:1), 临床表现有上腹不适, 食欲减退、贫血、体质量下降、上腹痛、低热等, 但都不具特异性. 实验室检查可有贫血、碱性磷酸酶水平升高等[8]. 肝脏FDCS病因不明, 部分病例开始以肝炎为主要表现, 病理学表现似炎性假瘤, 而这类FDCS称为炎性假瘤样FDCS, 其发生和炎症有关, 但是具体机制尚不清楚[9]. 约76.5%的肝脏FDCS可检测到EBV抗原表达, FDCS可能和EBV感染有关, 但是文献报道并不一致[10]. 新近的研究发现部分FDCS患者伴有自身免疫性疾病, 如桥本甲状腺炎等, 提示自身免疫可能和FDCS有关[11]. 遗传学研究显示, 部分病例检测到21q11.2异位[12], 其次一些病例观察到染色体不平衡现象: 如3q, 7p, 8q和9q获得性增加及Xp, 8p, 9p和10p的丢失[13].
大体上, 肿物常位于肝脏被膜下, 肝实质内, 呈实性占位, 大小9.5-20 cm, 切面结节状, 灰白色, 质中, 可有出血及坏死而呈灰红色, 肿瘤可侵破肝包膜, 累及临近脏器及组织.
2008年WHO将组织细胞和树突状细胞的肿瘤分为: 组织细胞肉瘤、Langerhans细胞增生症、Langerhans细胞肉瘤、FDCS、指突状树突细胞肉瘤(interdigitating dendritic cell sarcoma, IDCS)、纤维网状细胞肿瘤、未定型树突状细胞肿瘤, 播散性幼年性黄色肉芽肿[14]. 肝脏FDCS和淋巴结内者形态学相似, 其病理学特点包括[8,15]: 异常增生的树突状细胞, 呈梭形, 卵圆形, 胞质界不清, 低级别FDCS者, 细胞异型性小, 核分裂像少见, 高级别FDCS者, 细胞多形性, 核不规则, 核分裂像多见(≥5/10 HPF); 肿瘤背景中常有反应性增生的炎症细胞浸润, 如淋巴细胞、组织细胞、浆细胞等, 淋巴细胞可有轻度异型, 似淋巴瘤表现; 肿瘤细胞排列成漩涡状、束状及不规则状, 间质可有纤维化; 部分病例肿瘤细胞丰富, 生长活跃, 可呈浸润性生长, 可有出血及坏死, 出现时提示肿瘤向高级别转化; 周围肝组织可有程度不等的肝炎(乙型肝炎等)表现. 免疫表型: 肿瘤细胞表达树突状细胞标记, 如CD21(93%)、CD23(63%)、CD35(89%)、FDC1p(88%)、Ki-M4(94%), 但是大多数病例表达2个或2个以上(92%)的树突状细胞抗原, 也可表达HLA-DR(57%)、S-100(31%)、CD45(21%)、CD68(61%)、vimentin(61%)、EMA(41%), Ki-67增值指数(5-50%)等[16]. CD21阳性是成熟FDCS的特征, 但部分病例CD21阴性, 可能是肿瘤细胞介于树突状细胞与网状细胞之间的一种细胞, 其次部分病例肿瘤细胞表达vimentin抗原, 似间叶源性肿瘤表现[12]. 肿瘤细胞一般不表达CK(Pan)、CD1a、CD34、CD117、CD163、HMB45等抗原[17,18]. 文献报道FDCS电镜观察常可见瘤细胞表面具有大量相互交错的长指状突起, 胞质内无Birbeck颗粒[19], 而Langerhans细胞相关肿瘤常可见胞质内Birbeck颗粒, 此有助两类肿瘤的鉴别. 低、高级别FDCS根据细胞异型性、核分裂像、凝固性坏死和组织浸润的不同进行鉴别[20].
肝脏FDCS的诊断主要依赖临床、影像学及病理组织学, 确诊需病理形态学和免疫表型. AFP及CA19-9检测有助鉴别肝癌. 计算机断层扫描(computerized tomography, CT)检查是早期发现病灶的主要方法, CT扫描示FDCS表现为均质性肿块, 内部可有坏死、钙化, 可伴有淋巴结累及[21]. FDCS在冰冻时不易诊断, 细胞学可做初步诊断, 但大都需活检证实[22], 活检具备FDCS的形态学典型特征时, 结合免疫组织化学染色结果可做诊断[7].
本组病例中, 临床及影像学均支持肝脏原发肿瘤, 考虑肝癌可能, 形态学主要是异型性明显的梭形细胞及炎症性背景, 病理诊断时曾考虑FDCS、炎性肌纤维母细胞瘤、肝癌等, 但结合免疫表型诊断为FDCS. 本组3例术前CA19-9、AFP均正常, 提示FDCS的发生与AFP、CA19-9无明显关系; 其次例1有乙肝小三阳5年, 提示HBV感染与FDCS可能有关, 但仅限于个例, 尚无法分析其相关性. 病理学分析显示: 例1、2肿瘤无浸润及出血坏死, 细胞分化好, 为低级别FDCS, 预后较好; 但例3影像学及病理学均表现为浸润性生长, 细胞异型明显, 并可见出血坏死, 为高级别FDCS; 例3患者有Evans综合征病史1年, Evans综合征是温抗体自身免疫性溶血性贫血伴血小板减少的简称, 这提示Evans综合征可能与FDCS发生有关[23], 患者术后2 mo出现脾脏转移灶, 并于术后4 mo死亡, 提示FDCS合并自身免疫疾病或高级别FDCS进展较快, 易转移, 预后差[11]; 高级别FDCS可能继发于低级别FDCS的基础上, 或是肿瘤发生一开始就为高级别FDCS, 当前病例中分化好的与分化差的FDCS区域同时存在, 且二者之间有移行过程, 支持第一种假设. 本组仅有例3肿瘤细胞检测到EBER及EBV抗原表达, 支持FDCS与EBV相关的观点, 然而例1和例2肿瘤细胞均呈阴性, 尚不能证实FDCS与EBV感染相关, 这与文献报道一致[15,24].
肝脏FDCS因含有梭形细胞, 辅以反应性增生淋巴细胞、组织细胞、纤维母细胞等, 临床与病理学上需和以下肝脏肿瘤相鉴别[25]: (1)IDCS形态学表现与FDCS几乎一致, 但IDCS通常表达S-100蛋白, 但不表达CD21、CD35、CD1a抗原, 可资鉴别[26]; (2)肝肉瘤样癌是一种罕见的肝恶性上皮性肿瘤, 形态学上可见恶性上皮成分和间叶成分, 且二者之间有移行, 间叶成分较多时可表现为梭形细胞肿瘤, 与FDCS相似, 但前者梭形细胞表达上皮性标记(CK, EMA), 间叶性标记(vimentin)及CD21、CD35阴性的结果有助鉴别[27,28]; (3)炎性肌纤维母细胞瘤, 以往又称炎性假瘤, 形态学表现为炎性背景中梭形细胞瘤样增生, 后者主要为纤维母细胞、肌纤维母细胞, 免疫组织化学染色显示梭形细胞表达肌源性标记, 如actin、SMA、caldesmon、desmin等. 部分病例可检测到ALK基因的突变, 后者致ALK蛋白过度表达, 是炎性肌纤维母细胞瘤较为特异的标记, 可资诊断[29,30]; (4)胃肠道外间质瘤, 形态学表现为梭形细胞、上皮样细胞或二者混合细胞形成的肿瘤, 常表达CD117、CD34蛋白, 有助诊断[31]; (5)组织细胞肉瘤, 细胞异型性明显, 核分裂多, 肿瘤细胞表达vimentin及组织细胞标记CD68、CD163等, 可与之鉴别[32]. 此外, 还应根据肿瘤形态学表现及免疫组织化学染色结果与其他肿瘤鉴别, 如肝脏癌肉瘤[33]、淋巴瘤、异位脑膜瘤、异位胸腺瘤等[34].
手术完整切除是治疗肝脏FDCS主要手段, 必要时辅以化疗[35]. 化疗药物包括环磷酰胺、阿霉素、长春新碱和强的松等, 因为限于个例报道, 放疗对FDCS治疗的有效性还不清楚. 由于肝脏独特的解剖学结构, FDCS易复发及远处转移, 手术切除不彻底时, 复发率高达50%, 复发后肿瘤的治疗缺少经验, 有报道认为手术可作为有效的治疗方法[15]. 肝脏FDCS的预后不定, 但总体上2年及5年生存率分别为62.3%和27.4%. 病理形态学可为预后提供依据, 低级别肝脏FDCS预后较好, 而中高度恶性的肝脏FDCS预后差[20]. 另外肿瘤出现远处转移[36]或伴有自身免疫性疾病时, 提示预后不佳[23,37,38], 本组例1和例2分别随访35 mo和6 mo, CT检查无肿瘤复发及残留, 一般状况尚可. 例3术后4 mo因恶病质及反复感染死亡.
肝脏滤泡树突状细胞肉瘤(FDCS)系由肝组织内滤泡树突状细胞发生的一类恶性肿瘤, 与肝细胞癌或其他的肝脏恶性肿瘤相比, FDCS的临床表现、形态学特征及预后等均有显著差异, 因此肝脏FDCS的准确诊断对于提高该类肿瘤的认识显得尤为重要.
王鲁平, 主任医师, 中国人民解放军北京军区总医院病理科
文献报道FDCS电镜观察常可见瘤细胞表面具有大量相互交错的长指状突起, 胞质内无Birbeck颗粒.
Shek等于1996年首先报道了1例肝脏FDCS, 目前国内外仅有零星报道, 肝脏FDCS罕见, 恶性度高. 我们收集了3例FDCS病例, 并复习文献, 探讨该病的发生发展、临床表现、病理学特征及诊断, 以提高对该病的认识, 为治疗及预后提供依据.
FDCS的病理形态学表现及免疫表型均有一定的特征性, 梭形细胞肉瘤样成分伴有炎症性背景, 两者以多少不等的比例混合, 免疫组织化学染色肿瘤细胞呈CD21、CD23、CD35阳性, 需病理形态学和免疫组织化学支持方能确诊, EBER原位杂交检查有助于了解肿瘤发生学.
自身免疫性溶血性贫血: 系免疫调节功能紊乱, 自身抗体吸附于红细胞表面而引起的一种溶血性贫血, 依据自身抗体作用于红细胞膜表面需要的温度不同, 将其分为温抗体型和冷抗体型两种.
本文选题恰当, 实用性强, 有较好的临床指导意义.
编辑: 李薇 电编:何基才
| 1. | Chemnitz J, Turza N, Hauber I, Steinkasserer A, Hauber J. The karyopherin CRM1 is required for dendritic cell maturation. Immunobiology. 2010;215:370-379. [PubMed] [DOI] |
| 2. | Shu SA, Lian ZX, Chuang YH, Yang GX, Moritoki Y, Comstock SS, Zhong RQ, Ansari AA, Liu YJ, Gershwin ME. The role of CD11c(+) hepatic dendritic cells in the induction of innate immune responses. Clin Exp Immunol. 2007;149:335-343. [PubMed] [DOI] |
| 3. | Tanis W, Mancham S, Binda R, Janssen HL, Bezemer G, IJzermans JN, Tilanus HW, Laman JD, de Wit H, Drexhage HA. Human hepatic lymph nodes contain normal numbers of mature myeloid dendritic cells but few plasmacytoid dendritic cells. Clin Immunol. 2004;110:81-88. [PubMed] [DOI] |
| 4. | De Pas T, Spitaleri G, Pruneri G, Curigliano G, Noberasco C, Luini A, Andreoni B, Testori A, de Braud F. Dendritic cell sarcoma: an analytic overview of the literature and presentation of original five cases. Crit Rev Oncol Hematol. 2008;65:1-7. [PubMed] [DOI] |
| 5. | Duan GJ, Wu F, Zhu J, Guo DY, Zhang R, Shen LL, Wang SH, Li Q, Xiao HL, Mou JH. Extranodal follicular dendritic cell sarcoma of the pharyngeal region: a potential diagnostic pitfall, with literature review. Am J Clin Pathol. 2010;133:49-58. [PubMed] [DOI] |
| 6. | Ioachim HL, Medeiros LJ. IOACHIM'S Lymph Node Pathology. 4ed. Philadelphia: Lippincott Williams & Wilkins 2009; 531-532. |
| 7. | Granados R, Aramburu JA, Rodríguez JM, Nieto MA. Cytopathology of a primary follicular dendritic cell sarcoma of the liver of the inflammatory pseudotumor-like type. Diagn Cytopathol. 2008;36:42-46. [PubMed] [DOI] |
| 8. | Torres U, Hawkins WG, Antonescu CR, DeMatteo RP. Hepatic follicular dendritic cell sarcoma without Epstein-Barr virus expression. Arch Pathol Lab Med. 2005;129:1480-1483. [PubMed] |
| 9. | Cheuk W, Chan JK, Shek TW, Chang JH, Tsou MH, Yuen NW, Ng WF, Chan AC, Prat J. Inflammatory pseudotumor-like follicular dendritic cell tumor: a distinctive low-grade malignant intra-abdominal neoplasm with consistent Epstein-Barr virus association. Am J Surg Pathol. 2001;25:721-731. [PubMed] [DOI] |
| 10. | Li L, Shi YH, Guo ZJ, Qiu T, Guo L, Yang HY, Zhang X, Zhao XM, Su Q. Clinicopathological features and prognosis assessment of extranodal follicular dendritic cell sarcoma. World J Gastroenterol. 2010;16:2504-2519. [PubMed] [DOI] |
| 11. | Yu L, Yang SJ. Primary Follicular Dendritic Cell Sarcoma of the Thyroid Gland Coexisting With Hashimoto's Thyroiditis. Int J Surg Pathol. 2009; May 15. [Epub ahead of print]. [PubMed] |
| 12. | Suzuki N, Katsusihma H, Takeuchi K, Nakamura S, Ishizawa K, Ishii S, Moriya T, DeCoteau JF, Miura I, Ichinohasama R. Cytogenetic abnormality 46,XX,add(21)(q11.2) in a patient with follicular dendritic cell sarcoma. Cancer Genet Cytogenet. 2008;186:54-57. [PubMed] [DOI] |
| 15. | Cyriac S, Praveenkumar D, Majhi U, Sagar TG. Follicular dendritic cell sarcoma of the neck with an aggressive and fatal course. J Cancer Res Ther. 2010;6:114-116. [PubMed] [DOI] |
| 16. | Bai LY, Kwang WK, Chiang IP, Chen PM. Follicular dendritic cell tumor of the liver associated with Epstein-Barr virus. Jpn J Clin Oncol. 2006;36:249-253. [PubMed] [DOI] |
| 17. | Sohn BS, Kim T, Kim JE, Bae E, Park CJ, Huh J, Lee SO. A case of histiocytic sarcoma presenting with primary bone marrow involvement. J Korean Med Sci. 2010;25:313-316. [PubMed] [DOI] |
| 18. | Jorge-Buys DL, Lastra-Camacho G, Campos-Martínez J, Romero-Guadarrama M, Ortiz-Hidalgo C. [Follicular dendritic cell sarcoma: an unusual tumor with nodal and extranodal presentation. Clinicopathological and immunohistochemical study of five cases]. Cir Cir. 2008;76:145-152. [PubMed] |
| 19. | Eun YG, Kim SW, Kwon KH. Follicular dendritic cell sarcoma of the tonsil. Yonsei Med J. 2010;51:602-604. [PubMed] [DOI] |
| 20. | Choi BS, Baek JH, Shin YM, Kim JH, Kim HW, Lee SJ, Cha HJ. Follicular dendritic cell sarcoma: a case report and review of the literature. Cancer Res Treat. 2010;42:121-124. [PubMed] [DOI] |
| 21. | Kang TW, Lee SJ, Song HJ. Follicular dendritic cell sarcoma of the abdomen: the imaging findings. Korean J Radiol. 2010;11:239-243. [PubMed] [DOI] |
| 22. | Gaffney RL, Feddersen RM, Bocklage TJ, Joste NE. Fine needle aspiration cytology of follicular dendritic cell sarcoma. Report of a case with cytologic detection in an extranodal site. Acta Cytol. 2000;44:809-814. [PubMed] |
| 23. | Lee SE, Kim HR, Hashimoto T, Kim SC. Paraneoplastic pemphigus developed shortly after resection of follicular dendritic cell sarcoma. Acta Derm Venereol. 2008;88:410-412. [PubMed] |
| 24. | Tu XY, Sheng WQ, Lu HF, Wang J. [Clinicopathologic study of intraabdominal extranodal follicular dendritic cell sarcoma]. Zhonghua Binglixue Zazhi. 2007;36:660-665. [PubMed] |
| 26. | Efune G, Sumer BD, Sarode VR, Wang HY, Myers LL. Interdigitating dendritic cell sarcoma of the parotid gland: case report and literature review. Am J Otolaryngol. 2009;30:264-268. [PubMed] [DOI] |
| 27. | Nishie W, Iitoyo M, Koshiyama T, Kusama T. Sarcomatoid carcinoma of the liver with skin and pleural metastases. Br J Dermatol. 2003;148:1069-1071. [PubMed] [DOI] |
| 28. | Nam HS, Kim HK, Ma SU, Yu BH, Jung KM, Gong KT, Lee YJ, Park TI, Hu BW, Park SH. [A case of sarcomatoid hepatocellular carcinoma in a young female without risk factor]. Korean J Gastroenterol. 2006;47:458-462. [PubMed] |
| 29. | Park JS, Federle MP, Sass DA. Education and imaging. Hepatobiliary and pancreatic: Budd-Chiari syndrome presenting as a caudate lobe pseudotumor. J Gastroenterol Hepatol. 2010;25:219. [PubMed] [DOI] |
| 30. | Sevinç AI, Unek T, Astarcioğlu H. Inflammatory myofibroblastic tumour (IMT) of the liver: a report of two cases. Acta Chir Belg. 2010;110:87-89. [PubMed] |
| 31. | Yamamoto H, Miyamoto Y, Nishihara Y, Kojima A, Imamura M, Kishikawa K, Takase Y, Ario K, Oda Y, Tsuneyoshi M. Primary gastrointestinal stromal tumor of the liver with PDGFRA gene mutation. Hum Pathol. 2010;41:605-609. [PubMed] [DOI] |
| 32. | Kim HS, Kim GY, Lim SJ, Lee SM, Kim YW. Undifferentiated pleomorphic sarcoma of the liver presenting as a unilocular cyst. Hepatobiliary Pancreat Dis Int. 2009;8:541-543. [PubMed] |
| 33. | Park MY, Kim KR, Park HS, Park BH, Choi HN, Jang KY, Chung MJ, Kang MJ, Lee DG, Moon WS. Expression of the serum response factor in hepatocellular carcinoma: implications for epithelial-mesenchymal transition. Int J Oncol. 2007;31:1309-1315. [PubMed] |
| 34. | Heim-Hall J, Yohe SL. Application of immunohistochemistry to soft tissue neoplasms. Arch Pathol Lab Med. 2008;132:476-489. [PubMed] |
| 35. | Pisani F, Marino M, Sentinelli S, Petti MC. Follicular dendritic cell sarcoma of the neck: report of a case treated by surgical excision and COP plus (PEG)-liposomal doxorubicin. J Exp Clin Cancer Res. 2008;27:33. [PubMed] [DOI] |
| 36. | Geerts A, Lagae E, Dhaene K, Peeters M, Waeytens A, Demetter P, Cuvelier C, Defreyne L, De Vos M, Pattyn P. Metastatic follicular dendritic cell sarcoma of the stomach: a case report and review of the literature. Acta Gastroenterol Belg. 2004;67:223-227. [PubMed] |
| 37. | Hartert M, Ströbel P, Dahm M, Nix W, Marx A, Vahl CF. A follicular dendritic cell sarcoma of the mediastinum with immature T cells and association with myasthenia gravis. Am J Surg Pathol. 2010;34:742-745. [PubMed] |
| 38. | Jiang L, Admirand JH, Moran C, Ford RJ, Bueso-Ramos CE. Mediastinal follicular dendritic cell sarcoma involving bone marrow: a case report and review of the literature. Ann Diagn Pathol. 2006;10:357-362. [PubMed] [DOI] |