修回日期: 2010-11-09
接受日期: 2010-11-17
在线出版日期: 2010-11-28
目的: 探讨内毒素血症时大鼠肠组织免疫分子的改变及中药通腑颗粒对其的影响.
方法: 120只♂Wistar大鼠随机分为正常对照(A)组、内毒素血症(B)组及中药治疗(C)组, 各组按造模后预设的取材时间点(2、6、12、24 h)分为4小组. 通过尾静脉注射的方法建立内毒素血症模型, 采用酶联免疫吸附(ELISA)法及放射免疫分析的方法, 检测肠组织中的免疫分子及肠内容物中的分泌性免疫球蛋白(sIgA).
结果: A、C组INF-γ含量在24 h明显高于B组(32.93 ng/L±13.17 ng/L, 37.14 ng/L±6.70 ng/L vs 23.21 ng/L±8.65 ng/L, 均P<0.05), C组INF-γ含量在12 h明显高于A组(39.96 ng/L±8.26 ng/L vs 29.64 ng/L±10.78 ng/L, P<0.05). A、C组IL-4含量在6 h明显高于B组(115.56 ng/L±17.67 ng/L, 124.39 ng/L±26.02 ng/L vs 83.36 ng/L±27.24 ng/L, P<0.05或0.01), 但B组IL-4含量在24 h较A组明显升高(107.96 ng/L±10.86 ng/L vs 92.21 ng/L±17.62 ng/L, P<0.05). B组Foxp3含量在12、24 h较A组明显增加(0.28 g/L±0.037 g/L vs 0.24 g/L±0.041 g/L; 0.26 g/L±0.029 g/L vs 0.22 g/L±0.041 g/L, 均P<0.05), C组Foxp3含量24 h明显低于B组(0.23 g/L±0.030 g/L vs 0.26 g/L±0.029 g/L, P<0.05). A、C组sIgA含量2、12、24 h明显高于B组(2.43×10-11±0.23×10-11, 2.18×10-11±0.27×10-11vs 1.66×10-11±0.25×10-11; 2.76×10-11±0.22×10-11, 2.64×10-11±0.22×10-11vs 2.09×10-11±0.20×10-11; 2.48×10-11±0.31×10-11, 2.25×10-11±0.44×10-11vs 1.88×10-11±0.45×10-11, 均P<0.05), C组与A组进行对比在2 h明显降低.
结论: 内毒素血症时肠黏膜损伤, 肠道产生sIgA减少, 肠组织中抑炎因子IL-4先减少后增多, Foxp3增多, 而促炎因子INF-γ减少, 肠免疫功能发生由炎症反应向抗炎反应的转变, 免疫功能出现抑制. 应用中药通腑颗粒可以减轻肠黏膜损伤, 双向调节炎症反应, 保护肠免疫功能.
引文著录: 刘冲, 段美丽, 李昂, 翁以炳, 王宝恩, 张淑文. 内毒素血症大鼠肠组织免疫分子的变化及通腑颗粒的干预作用. 世界华人消化杂志 2010; 18(33): 3515-3519
Revised: November 9, 2010
Accepted: November 17, 2010
Published online: November 28, 2010
AIM: To observe the changes in the levels of intestinal cytokines in rats with endotoxemia and to investigate the effects of treatment with Tongfu Granules on intestinal cytokine levels.
METHODS: One hundred and twenty male Wistar rats were randomly divided into three groups: control group, endotoxemia group and treatment group. Endotoxemia was induced by a single injection of LPS via the caudal vein. The levels of intestinal cytokines were measured by ELISA and radioimmunoassay.
RESULTS: The level of IFN-γ at 24 h was significantly lower in the endotoxemia group than in the control and treatment groups (32.93 ng/L ± 13.17 ng/L, 37.14 ng/L ± 6.70 ng/L vs 23.21 ng/L ± 8.65 ng/L, both P < 0.05). The level of IFN-γ at 12 h was significantly higher in the treatment group than in the control group (39.96 ng/L ± 8.26 ng/L vs 29.64 ng/L ± 10.78 ng/L, P < 0.05). The level of IL-4 significantly decreased in the endotoxemia group at 6 h but increased at 24 h compared with the control and treatment groups (115.56 ng/L ± 17.67 ng/L, 124.39 ng/L ± 26.02 ng/L vs 83.36 ng/L ± 27.24 ng/L, both P < 0.05 or 0.01). IL-4 level at 24 h was significantly higher in the endotoxemia group than in the control group (107.96 ng/L ± 10.86 ng/L vs 92.21 ng/L ± 17.62 ng/L, P < 0.05). The levels of Foxp3 at 12 and 24 h were significantly higher in the endotoxemia group than in the control group (0.28 g/L ± 0.037 g/L vs 0.24 g/L ± 0.041 g/L; 0.26 g/L ± 0.029 g/L vs 0.22 g/L ± 0.041 g/L, both P < 0.05). The level of Foxp3 at 24 h was significantly lower in the treatment group than in the endotoxemia group (0.23 g/L ± 0.030 g/L vs 0.26 g/L ± 0.029 g/L, P < 0.05). The levels of sIgA at 2, 12 and 24 h was significantly lower in the endotoxemia group than in the control and treatment groups (2.43 × 10-11 ± 0.23 × 10-11, 2.18 × 10-11 ± 0.27 × 10-11vs 1.66 × 10-11 ± 0.25 × 10-11; 2.76 × 10-11 ± 0.22 × 10-11, 2.64 × 10-11 ± 0.22 × 10-11vs 2.09 × 10-11 ± 0.20 × 10-11; 2.48 × 10-11 ± 0.31 × 10-11, 2.25 × 10-11 ± 0.44 × 10-11vs 1.88 × 10-11 ± 0.45 × 10-11, all P < 0.05). The level of sIgA at 2 h was significantly lower in the treatment group than in the control group.
CONCLUSION: Small intestinal mucosa injury and deregulated inflammatory reaction can result in intestinal immunodepression in rats with endotoxemia. Treatment with Tongfu Granules can protect intestinal immune function in rats with endotoxemia by reducing small intestinal mucosa injury and bidirectionally regulating inflammatory reaction.
- Citation: Liu C, Duan ML, Li A, Weng YB, Wang BE, Zhang SW. Effects of treatment with Tongfu Granules on intestinal cytokine levels in rats with endotoxemia. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3515-3519
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3515
胃肠道在多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)时最易受损[1], 其损伤发生率占40.5%[2]. 胃肠道屏障功能损伤后导致肠道细菌和内毒素移位[3], 促进MODS的发生发展. 胃肠道免疫屏障是胃肠道黏膜屏障的一部分, 是防御病菌在肠道黏膜黏附和定植的第一道防线[4]. 本研究通过动物实验观察内毒素血症时肠免疫分子的改变及中药通腑颗粒的干预作用, 为临床治疗提供实验依据.
SPF级健康♂Wistar大鼠120只, 体质量200.5 g±12.3 g, 购自北京维通利华实验动物技术有限公司. 纯化的脂多糖冻干粉剂(lipopolysaccharide, LPS, 大肠杆菌, O55:B5)购自美国Sigma公司. 大鼠肠组织白介素-4(interleukin-4, IL-4)、干扰素-γ(interferon-γ, IFN-γ)及叉头样转录因子3(forkhead box P3, Foxp3)含量酶联免疫吸附法(enzyme-linked immunosorbent assays, ELISA)检测用试剂盒购自北京环亚泰克生物医学技术有限公司. 大鼠肠内容物分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)含量放射免疫法检测用试剂盒购自北京原子能研究所. 中药通腑颗粒(批号20050901)购自北京长城制药厂.
1.2.1 造模: 按给药不同, 实验动物随机分为正常对照组、内毒素血症组及中药治疗组, 每组40只. 采用Cheng等[5]的方法建立内毒素血症模型, 尾静脉注射方法给予内毒素, 给药量为10 mg/kg, B组及C组注射LPS溶液, A组注射等量生理盐水(1 mL/kg). 注射内毒素后即刻给予药物灌胃, C组给予通腑颗粒溶液(浓度为0.5 kg/L), A组及B组给予等量蒸馏水. 造模后按预设时间点2、6、12及24 h麻醉后处死动物, 取小肠组织及肠内容物进行检测.
1.2.2 常规病理学检测: 常规苏木素-伊红(hematoxylin and eosin, HE)染色观察不同组别肠黏膜病理改变.
1.2.3 肠免疫分子IL-4、IFN-γ及Foxp3检测: 取小肠组织制作为匀浆, 离心后取上清液, 采用ABC-ELISA法检测肠免疫分子含量.
1.2.4 肠内容物sIgA检测: 取小肠内容物0.2 g, 加入4.8 mL生理盐水充分溶解, 离心后取上清, 采用放射免疫方法检测肠内容物中的sIgA含量. 使用全自动生化分析仪(美国Beckman公司)检测肠内容物中的总蛋白含量. 以肠内容物中sIgA含量与总蛋白含量的比值为最终结果, 以排除饮水量及肠道外分泌功能状态对结果的影响.
统计学处理 使用SPSS18.0软件处理数据, 计量资料采用mean±SD表示, 数据统计使用完全随机设计资料的方差分析, 组间均数比较用S-N-K检验方法. P<0.05认为差异有显著性.
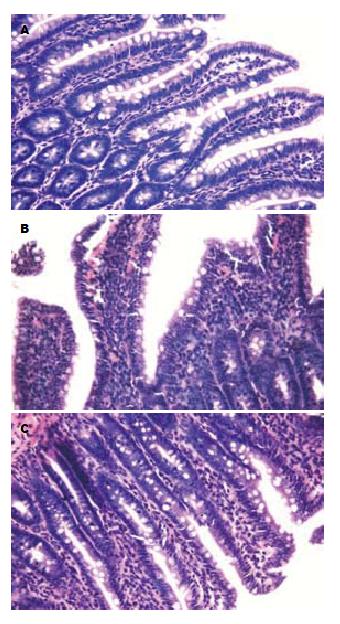
正常对照组大鼠肠黏膜组织完整, 绒毛整齐, 上皮细胞形态正常, 未见黏膜充血水肿及炎细胞浸润等表现; 内毒素血症组大鼠肠黏膜绒毛稀疏、萎缩, 上皮细胞坏死, 黏膜水肿伴有炎性细胞浸润; 中药治疗组大鼠肠黏膜组织基本完整, 绒毛整齐, 但可见轻度萎缩, 黏膜水肿不明显, 可见少量炎性细胞浸润(图1). B组及C组均在12-24 h肠黏膜损伤性改变最明显.
2.2.1 促炎因子: 内毒素血症组肠组织INF-γ含量在24 h明显降低; 中药治疗组在12 h明显升高, 且在24 h比内毒素血症组明显升高(表1).
2.2.2 抑炎因子: 内毒素血症组肠组织IL-4含量在6 h明显降低, 但在24 h明显升高; 中药治疗组无明显改变, 但在6 h比内毒素血症组明显升高. 内毒素血症组肠组织Foxp3含量在12及24 h明显升高; 中药治疗组无明显改变, 但在24 h比内毒素血症组明显降低(表2, 3).
2.2.3 肠内容物sIgA改变: 内毒素血症组在2、12及24 h明显降低; 中药治疗组在2 h有明显降低, 但在2、12及24 h比内毒素血症组有明显增加(表4).
通腑颗粒, 是由大黄、黄芪等8味中药组成的以通理攻下、清热解毒、舒肝理气、补气养血为主要功效的中药方剂, 其中的大黄及黄芪均具有调节免疫的作用[6-9]. 研究发现, 通腑颗粒对肠道黏膜屏障有明显的保护作用[10-14]. 本研究观察到内毒素血症组大鼠肠黏膜发生损伤性改变, 提示肠道为MODS时受损的器官之一, 其损伤原因与免疫分子、炎性介质、蛋白酶类和氧自由基等破坏肠黏膜上皮细胞, 加重肠黏膜微循环障碍等有关. 而中药治疗组大鼠应用中药后这种损伤性改变较内毒素血症组大鼠减轻, 说明中药通腑颗粒可以减轻内毒素血症时氧化应激对肠黏膜的损伤.
肠道黏膜免疫屏障是肠黏膜屏障的重要组成部分. 肠道黏膜免疫反应主要依靠分泌至黏膜表面及肠腔中的免疫球蛋白(以sIgA为主)和肠道黏膜内以淋巴细胞为主体的免疫活性细胞, 共同完成肠道的局部免疫功能[15-17]. sIgA是肠道免疫的主要效应分子, 本研究观察到内毒素血症组大鼠肠内容物中sIgA含量明显减低, 这是由于应激时肠道产生sIgA的功能明显受到抑制[18], 而应用通腑颗粒后sIgA水平回升, 说明通腑颗粒可以促进sIgA的产生, 从而起到保护肠免疫功能的作用.
sIgA的合成、分泌受T淋巴细胞的调节. T淋巴细胞依其表面标志物可分为不同亚群, 其中辅助型T淋巴细胞(helper T cell, Th)及调节型T淋巴细胞(regulatory T cell, Tr)具有重要免疫调节作用. Th细胞的两种亚型Th1和Th2之间的动态平衡对维持机体的正常功能十分重要[19]. Th1细胞主要分泌促炎因子IL-2及INF-γ, 介导细胞免疫应答和迟发性超敏反应; Th2细胞主要分泌抑炎因子IL-4及IL-10, 介导体液免疫应答[20]. 本研究发现内毒素血症组大鼠肠组织IL-4水平先降低而后增加, INF-γ水平在后期降低, 提示内毒素血症时肠道Th2细胞功能先减低后增强, Th1细胞功能逐渐减低, 即抑炎反应先减低后增强, 而促炎反应逐渐减低, 炎症反应由强转弱, 最终导致肠免疫功能减低. 既往有研究[21]观察了内毒素血症时Th1、Th2细胞的变化, 也得到相似结果. 应用中药通腑颗粒后, 中药治疗组大鼠肠组织IL-4及INF-γ水平均较对照组无显著改变, 而与内毒素血症组大鼠呈相反的变化, 说明通腑颗粒在内毒素血症早期可促进抗炎反应, 而晚期促进炎症反应, 对炎症反应变化起到双向调节作用, 从而恢复异常的肠免疫功能.
有研究显示内毒素血症时Th1向Th2的漂移是由Tr细胞介导的[22], 同时Tr细胞还可以抑制B淋巴细胞的增殖及抗体的产生[23,24]. Tr细胞可表达Foxp3, 其表达状况直接影响着Tr细胞的表型及功能活性的发挥[25]. 本研究发现内毒素血症组大鼠肠组织Foxp3含量增高, 提示内毒素血症时肠道Tr细胞活性增强, 导致免疫抑制. 而中药治疗组大鼠Foxp3增加不明显, 说明中药通腑颗粒可以影响Tr细胞功能, 起到保护肠免疫的作用.
内毒素血症可导致多器官功能障碍综合征(MODS), 是内科ICU中除冠心病外最常见的死因. 胃肠道因其血流供应、组织结构、组织酶及细胞分布特点, 成为机体应激、MODS时最易受损的靶器官. 胃肠道损伤后, 肠道黏膜屏障损害、肠道微生态紊乱导致肠道细菌和内毒素移位, 可以作为"第二打击"使MODS加重. 因而胃肠道是MODS的枢纽器官, 是炎性介质的扩增器. 加强胃肠道的保护对控制MODS具有重要的临床意义.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室
既往研究详细报道了通腑颗粒促进胃肠道蠕动及改善胃肠道通透性的作用, 但内毒素血症时胃肠免疫屏障功能的改变及中药通腑颗粒的干预作用尚无报道. 本研究通过观察免疫分子的变化来了解内毒素血症时肠黏膜免疫功能的改变及通腑颗粒的干预作用.
通过观察内毒素血症时肠黏膜免疫分子的改变及通腑颗粒对他的干预作用, 了解内毒素血症时胃肠功能障碍的机制, 及中药保护作用的机制, 为临床防治胃肠功能障碍提供实验依据.
本文选题较好, 对临床防治胃肠功能障碍有一定的借鉴意义.
编辑: 李军亮 电编:何基才
| 1. | Wilmore DW, Smith RJ, O'Dwyer ST, Jacobs DO, Ziegler TR, Wang XD. The gut: a central organ after surgical stress. Surgery. 1988;104:917-923. [PubMed] |
| 3. | Wood JD. Enteric nervous control of motility in the upper gastrointestinal tract in defensive states. Dig Dis Sci. 1999;44:44S-52S. [PubMed] |
| 4. | Reilly PM, Wilkins KB, Fuh KC, Haglund U, Bulkley GB. The mesenteric hemodynamic response to circulatory shock: an overview. Shock. 2001;15:329-343. [PubMed] [DOI] |
| 5. | Cheng PY, Lee YM, Wu YS, Chang TW, Jin JS, Yen MH. Protective effect of baicalein against endotoxic shock in rats in vivo and in vitro. Biochem Pharmacol. 2007;73:793-804. [PubMed] [DOI] |
| 6. | Park MY, Kwon HJ, Sung MK. Evaluation of aloin and aloe-emodin as anti-inflammatory agents in aloe by using murine macrophages. Biosci Biotechnol Biochem. 2009;73:828-832. [PubMed] [DOI] |
| 9. | Shao P, Zhao LH, Zhi-Chen , Pan JP. Regulation on maturation and function of dendritic cells by Astragalus mongholicus polysaccharides. Int Immunopharmacol. 2006;6:1161-1166. [PubMed] [DOI] |
| 11. | 董 军, 张 淑文, 段 美丽, 王 宝恩, 王 红, 阴 赪宏, 文 艳. 通腑颗粒对多器官功能障碍综合征胃肠功能障碍患者病情严重程度的影响. 中国中西医结合急救杂志. 2006;13:327-330. |
| 12. | 胡 森, 段 美丽, 夏 斌. 通腑颗粒对犬缺血/再灌注损伤小肠黏膜血液灌流和通透性的影响. 中国中西医结合急救杂志. 2006;13:331-334. |
| 15. | Werther JL. The gastric mucosal barrier. Mt Sinai J Med. 2000;67:41-53. [PubMed] |
| 16. | Nagler-Anderson C. Man the barrier! Strategic defences in the intestinal mucosa. Nat Rev Immunol. 2001;1:59-67. [PubMed] [DOI] |
| 17. | Johansson M, Lycke NY. Immunology of the human genital tract. Curr Opin Infect Dis. 2003;16:43-49. [PubMed] |
| 18. | Van Leeuwen PA, Boermeester MA, Houdijk AP, Meyer S, Cuesta MA, Wesdorp RI, Rodrick ML, Wilmore DW. Pretreatment with enteral cholestyramine prevents suppression of the cellular immune system after partial hepatectomy. Ann Surg. 1995;221:282-290. [PubMed] [DOI] |
| 19. | Liau LM, Black KL, Prins RM, Sykes SN, DiPatre PL, Cloughesy TF, Becker DP, Bronstein JM. Treatment of intracranial gliomas with bone marrow-derived dendritic cells pulsed with tumor antigens. J Neurosurg. 1999;90:1115-1124. [PubMed] [DOI] |
| 20. | 卢 巍, 梁 标. 白介素-4与支气管哮喘. 国外医学·呼吸系统分册. 2001;21:125-126, 129. |
| 22. | Purcell EM, Dolan SM, Kriynovich S, Mannick JA, Lederer JA. Burn injury induces an early activation response by lymph node CD4+ T cells. Shock. 2006;25:135-140. [PubMed] [DOI] |
| 23. | Zhao DM, Thornton AM, DiPaolo RJ, Shevach EM. Activated CD4+CD25+ T cells selectively kill B lymphocytes. Blood. 2006;107:3925-3932. [PubMed] [DOI] |
| 24. | Lim HW, Hillsamer P, Banham AH, Kim CH. Cutting edge: direct suppression of B cells by CD4+ CD25+ regulatory T cells. J Immunol. 2005;175:4180-4183. [PubMed] |
| 25. | Fontenot JD, Rudensky AY. A well adapted regulatory contrivance: regulatory T cell development and the forkhead family transcription factor Foxp3. Nat Immunol. 2005;6:331-337. [PubMed] [DOI] |