修回日期: 2010-10-24
接受日期: 2010-11-02
在线出版日期: 2010-11-28
目的: 比较经门静脉和股静脉注入扩血管药物后对肝硬化大鼠门脉血流动力学紊乱的差异, 从而寻找更合适的途径降低门脉压力, 改善肝脏血流.
方法: 采用酒精联合CCl4法建立肝硬化门脉高压大鼠模型, 42只大鼠随机化平均分成6组, 分别为硝酸甘油门脉组和硝酸甘油股静脉组(NG门和NG股)、前列腺素E1门脉组和前列腺素E1股静脉组(PGE1门和PGE1股)、生理盐水门脉组和生理盐水股静脉组(NaCl门和NaCl股). 使用超声多普勒测定给药前后不同时间段门静脉内径(PVD)、门静脉血流速度(PFR)和肝门静脉血流量(PVF)的变化情况.
结果: NaCl门组和NaCl股组给药前后PVD、PFR、PVF均无显著性差异(P = 0.1742, P = 0.2372, P = 0.6566), 而NG门、NG股和PGE1门、PGE1股4组给药后PVD均明显扩张, 但不同给药方式和不同药物之间无显著差异(P = 0.0516, P = 0.1225); 给药后PVF增加, NG股和PGE1股组增加量明显大于NG门和PGE1门组, 且差异具有显著性(P<0.0001); 较给药前, 给药后10、20 minNG股和PGE1股组PFR明显增加, 而NG门和PGE1门组却显著减少, 差异具有显著性[NG股: 4.98 mm/(s•100 g)±0.62 mm/(s•100 g), 4.31 mm/(s•100 g)±0.46 mm/(s•100 g) vs 3.62 mm/(s•100 g)±0.38 mm/(s•100 g); PGE1股: 3.96 mm/(s•100 g)±0.56 mm/(s•100 g), 4.18 mm/(s•100 g)±0.50 mm/(s•100 g) vs 3.63 mm/(s•100 g)±0.47 mm/(s•100 g), P<0.0001; NG门: 2.93 mm/(s•100 g)±0.22 mm/(s•100 g), 3.13 mm/(s•100 g)±0.21 mm/(s•100 g) vs 3.70 mm/(s•100 g)±0.48 mm/(s•100 g); PGE1门: 3.65 mm mm/(s•100 g)±0.22 mm/(s•100 g), 3.36 mm/(s•100 g)±0.21 mm/(s•100 g) vs 3.84 mm/(s•100 g)±0.19 mm/(s•100 g), P<0.001].
结论: 硝酸甘油和前列腺素E1可以明显增加经门静脉入肝血流量, 但门静脉直接注药方式并不优于股静脉注药方式.
引文著录: 马骁, 孙立涛, 牛芳芳, 张晓卉, 刘冰熔. 门静脉注入扩血管药物对肝硬化大鼠门脉血流动力学的影响. 世界华人消化杂志 2010; 18(33): 3508-3514
Revised: October 24, 2010
Accepted: November 2, 2010
Published online: November 28, 2010
AIM: To compare the effects of femoral versus portal vein administration of vasodilators on portal hemodynamics in rats with liver cirrhosis.
METHODS: Forty-two male Wistar rats with liver cirrhosis induced with carbon tetrachloride and alcohol were divided randomly and equally into six groups, which underwent femoral or portal vein injection of nitroglycerol (NG), prostaglandin E1(PGE1) or isotonic sodium chloride (NaCl), respectively. Hemodynamic parameters, including portal vein diameter (PVD), portal flow rate (PFR) and portal vein inflow (PVF), were measured after drug injection.
RESULTS: There were no significant differences in PVD, PVF and PFR between rats undergoing femoral and portal vein injection of NaCl (P = 0.1742, 0.2372 and 0.6566). PVD was increased significantly in cirrhotic rats that were given vasodilator agents, however, there were no significant differences in PVD changes between rats undergoing portal and femoral vein administration (P = 0.0516 and 0.1225). PVF was less increased in rats undergoing portal vein administration of NG and PGE1than in those undergoing femoral vein administration of NG and PGE1 (P < 0.0001). Comparing with pre-injection, PFR increased in rats undergoing femoral vein administration of NG and PGE1, but decreased in rats undergoing portal vein administration NG and PGE1 after dosed 10, 20 min [NGf: 4.98 mm/(s•100 g) ± 0.62 mm/(s•100 g), 4.31 mm/(s•100 g) ± 0.46 mm/(s•100 g) vs 3.62 mm/(s•100 g) ± 0.38 mm/(s•100 g); PGE1f: 3.96 mm/(s•100 g) ± 0.56 mm/(s•100 g), 4.18 mm/(s•100 g) ± 0.50 mm/(s•100 g) vs 3.63 mm/(s•100 g) ± 0.47 mm/(s•100 g) P < 0.0001; NGp: 2.93 mm/(s•100 g) ± 0.22 mm/(s•100 g), 3.13 mm/(s•100 g) ± 0.21 mm/(s•100 g) vs 3.70 mm/(s•100 g) ± 0.48 mm/(s•100 g); PGE1p: 3.65 mm mm/(s•100 g) ± 0.22 mm/(s•100 g), 3.36 mm/(s•100 g) ± 0.21 mm/(s•100 g) vs 3.84 mm/(s•100 g) ± 0.19 mm/(s•100 g), P< 0.001].
CONCLUSION: NG and PGE1 are able to increase portal vein flow in cirrhotic rats with portal hypertension. Administration of vasodilators via the portal vein is not superior to that via the femoral vein in increasing PVF in cirrhotic rats with portal hypertension.
- Citation: Ma X, Sun LT, Niu FF, Zhang XH, Liu BR. Comparison of the effects of femoral versus portal vein administration of vasodilators on portal hemodynamics in cirrhotic rats with portal hypertension. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3508-3514
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3508
目前, 在治疗肝硬化门脉高压的药物中唯有血管活性药物疗效确切, 且应用于临床, 主要包括血管收缩剂和血管扩张剂[1,2]. 血管收缩剂的作用机制主要是收缩内脏血管, 减少胃肠和脾回流入门静脉的血流量, 从而降低门脉压力. 但是, 减少门静脉血流量虽然能够降低部分门脉压力, 可并没有降低肝窦内阻力, 肝细胞仍然处在缺血的状态下, 肝细胞和肝血窦之间仍然得不到充分的的物质交换, 所以血管收缩剂无法改善肝细胞的功能, 没有从根本上治疗肝硬化门脉高压. 扩血管药物的机制是作用于肝脏内部, 扩张肝窦, 降低肝窦压力, 从而降低门脉高压. 所以他能够增加肝内血流, 改善肝细胞和肝血窦之间的营养物质交换, 改善肝细胞功能. 但是目前对于降低门脉高压的扩血管药研究的结果显示: 多数扩血管药物长期应用都存在低血压、肾功损害等不良反应. 使用扩血管药的远期生存率与缩血管药物相比没有明显差异[3], 目前实验证明扩血管药联合缩血管药与单纯缩血管药对肝硬化患者远期生存率的影响没有差异[4]. 随着消化学科微创和介入技术的发展, 经门静脉直接注入药物治疗已经成为可能. 吴汉平等[5]使用扩血管药物分别经门静脉和下腔静脉注药后证明门静脉注药方式可以在降低肝硬化大鼠门脉压力的同时, 较小影响平均动脉压和心率. 但是, 该实验并没有对肝门静脉入肝血流量进行测定; 降低门脉压力, 本质上是为了增加入肝血流, 减少分流, 改善肝脏功能, 减少门脉高压所致的并发症. 所以, 我们设计该实验, 从肝硬化门脉高压大鼠的门静脉注入扩血管药物, 从门脉入肝血流量方面观察扩血管药物对门脉血流动力的影响.
健康♂Wistar大鼠65只, 体质量为200-250 g, 购自哈尔滨医科大学动物实验中心. 65只大鼠购于哈尔滨医科大学实验动物中心后在室温环境下正常饲养3 d以适应环境, 其中5只大鼠使用营养均衡的正常饲料饲养作为对照组, 60只给予40%CCl4-橄榄油溶剂皮下注射0.03 mL/kg(如注入皮内短时间会出现皮肤大片坏死), 每周2次, 共16次(如大鼠体质量下降20%以上暂时停止给药1次, 待体质量增加后继续给药至16次); 且以10%食用白酒为唯一饮用水. 至所有大鼠给药均达16次后, 共死亡16只(多数是继发于皮肤坏死), 存活44只. 在存活的44只大鼠中随机选择42只大鼠进行完全随机化分组, 共分成6组, 分别为门静脉给生理盐水(NaCl门)组、门静脉注前列腺素E1(prostaglandin E1, PGE1门)组、门静脉注硝酸甘油(NG门)组; 股静脉注生理盐水(NaCl股)组、股静脉注PGE1(PGE1股)组、股静脉注硝酸甘油(NG股)组.
1.2.1 模型成功的初步判定: 使用30 g/L戊巴比妥钠溶液35 mg/kg给予大鼠腹腔注射麻醉[6], 开腹分离门静脉后测定门静脉压力(portal vein pressure, PVP)以及直接肉眼观察大鼠肝脏形态(大小、边缘、质地、表面是否有结节等). PVP的测量使用24G套管针穿刺门静脉后通过压力传感器连接单通道生理记录仪直接读取数值, 操作后10 min读取数值. 测定后迅速关腹, 正常饲养(注意大鼠保暖, 因麻醉后体温下降明显会致大鼠死亡).
1.2.2 给药: 按剂量换算公式dB = dA×RB/RA×(WA/WB)1/3(dA是人的常规用药剂量mg/kg, dB是大鼠的预计剂量mg/kg, RB、RA分别是大鼠的体型系数, WA、WB分别是人和大鼠的体质量)求得硝酸甘油剂量为1 μg/kg; PGE1剂量为21 μg/kg. 每只大鼠所需注射药物均使用生理盐水稀释至1 mL后, 使用30 g/L戊巴比妥钠溶液35 mg/kg给予大鼠腹腔注射麻醉, 门静脉注药需开腹分离门静脉后使用24G套管针头穿刺门静脉, 通过1 mL注射器将1 mL药物全部缓慢匀速注入; 股静脉注药需切开腹股沟分离股静脉后使用相同方式注入. 注药时间均为10 min. 给药后迅速关腹测定指标.
1.2.3 指标检测: 给药前、给药后10 min、给药后20 min的门静脉血流速度(portal flow rate, PFR)通过超声多普勒测定, 而门静脉内径(portal vein diameter, PVD)通过二维超声测定, 肝门静脉血流量(portal vein inflow, PVF)通过公式: Q = ABπ/4×0.57Vmax/cosθ×60(mL/min)[7]. Q为血流量, A、B是血管长径和横径, 超声探头所测长径恒定, 只需测定血管内径即可; Vmax认为是血管最大流速, θ为超声声束与血流长轴夹角. 指标测定前大鼠禁食水8 h, 超声声束与血流长轴夹角θ<60度, 且保持给药前后θ值不变, 超声的测定均由同一位医师完成, 每次每只大鼠测定2次取平均值.
1.2.4 模型最终判定: 所有大鼠开腹切取肝脏中叶, 10%乙醛溶液固定, 切片HE染色. 光镜下观察肝脏结构, 即是否有肝脏广泛的纤维化以及假小叶的形成.
统计学处理 数据由mean±SD表示, 各组比较运用重复测量分析法分析PVF、PFR和PVD, 运用配对t检验方法分析造模组和正常对照组门脉压力的差异, 上述方法均使用SPSS软件处理. P<0.05认为具有统计学意义.
2.1.1 大鼠的一般状态: 造模开始后, 大鼠表现为开始第1周体质量明显下降20-30 g, 且有个别大鼠死亡现象; 3-4 wk大鼠体质量缓慢增加, 但体质量明显小于相同周数的正常大鼠; 5-6 wk大鼠体质量又再次下降, 个别大鼠体质量下降达30 g, 大鼠开始出现皮毛蓬乱, 无光泽, 脱毛, 懒散, 反应迟钝, 精神萎靡, 嗜睡, 拒食水, 个别大鼠还产生腹水, 死亡率明显增加; 7-8 wk大鼠体质量相对稳定, 但增加非常缓慢. 造模结束后, 死亡16只, 存活44只, 死亡率为26.6%; 形成肝硬化门脉高压大鼠44只, 成模率为73.3%.
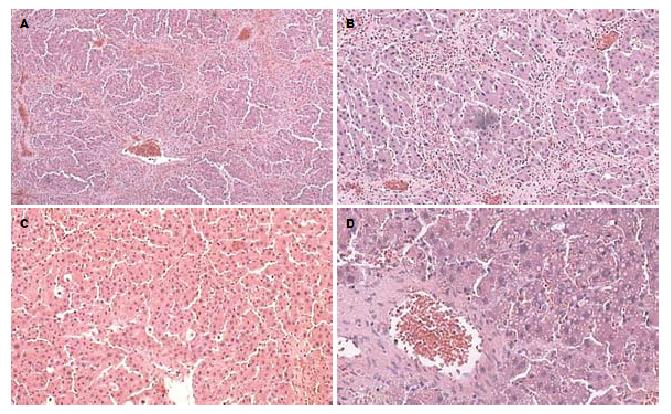
2.1.2 大鼠肝脏改变: 第1周死亡的大鼠肝脏明显充血, 水肿, 镜下肝细胞大量坏死; 第3-4周死亡的大鼠肝脏色泽暗淡, 充血水肿, 镜下中央静脉周围肝细胞点、片状坏死, 有少量纤维组织增生; 第6-7周死亡的大鼠镜下肝内弥漫性纤维结缔组织增生, 肝小叶结构紊乱, 少量不典型假小叶形成; 第8周大鼠肝脏颜色略显灰白色, 表面凸凹不平, 出现小结节, 镜下可见肝细胞广泛坏死, 从中央静脉和汇管区放射出的胶原纤维组织交织成网, 肝细胞排列紊乱, 典型假小叶广泛形成(图1).
2.1.3 PVP的测定: 第8周后, 肝硬化模型组大鼠和对照组大鼠分别开腹后通过门静脉穿刺, 连接单通道生理记录仪测定后发现肝硬化大鼠的PVP明显高于对照组大鼠的PVP(9.86 mmHg±0.35 mmHg vs 4.22 mmHg±0.12 mmHg). 且有显著性差异.
两种药物与生理盐水对照组相比, 对PFR、流量和内径均具有明显作用, 而且不同给药方式作用间也有差异.
2.2.1 PFR: NG股组给药后PFR明显增快, 在10 min时间点高于20 min时间点, 而NG门组给药后PFR明显减慢, 在10 min时间点低于20 min时间点, 两种给药方式在不同的时间点门脉流速的变化差异具有统计学意义(P<0.0001); PGE1股组给药后从10-20 min呈明显递增, PGE1门组给药后从10-20 min呈明显递减, 两种给药方式在不同的时间点门脉流速的变化差异具有统计学意义(P<0.001); NaCl门和NaCl股组在10-20 min两种给药方式在不同的时间点门脉流速的变化无差异(P = 0.2372).
2.2.2 PVF: NG股和NG门组给药后PVF均明显增加, 且PVF在10 min时高于20 min时, 但NG门组增加量少于NG股组, 且有显著性差异(P = 0.0031); PGE1股和PGE1门组给药后PVF均明显增加, 但PGE1门组增加量少于PGE1股组, 且有显著性差异(P<0.0001); NaCl门和NaCl股组在10 min和20 min两个时间点间变化无明显差异(P = 0.6566).
2.2.3 PVD: NaCl门和NaCl股组PVD在10 min和20 min两个时间点变化无明显差异(P = 0.1742), 而NG和PGE1组给药后PVD均有显著扩张, 但是不同给药方式间无显著性差异(P = 0.5125, P = 0.8556, 表1-3).
| NaCl指标 | NG股 | NG门 | ||||
| 给药前 | 给药后10 min | 给药后20 min | 给药前 | 给药后10 min | 给药后20 min | |
| PFR[mm/(s·100g)] | 3.44±0.54 | 3.57±0.44 | 3.39±0.55 | 3.06±0.85 | 3.09±0.81 | 3.03±0.79 |
| PVF[mL/min·100 g)] | 4.47±1.07 | 4.52±1.07 | 4.58±1.05 | 3.73±0.95 | 3.79±0.98 | 3.81±0.93 |
| PVD(cm) | 0.1586±0.0069 | 0.1486±0.0107 | 0.1514±0.009 | 0.1600±0.0115 | 0.1600±0.0082 | 0.1571±0.0076 |
肝硬化门静脉高压形成的机制为目前公认的两个学说: "后向血流学说"和"前向血流学说". 前者认为肝硬化门脉高压始动因素是肝内阻力增加, 导致门脉血液回流受阻, 压力增高. 肝内高阻力的形成有机械性因素和动力性因素. 机械性因素指肝脏广泛纤维化和假小叶形成使肝内结构紊乱, 肝血窦阻力增加, 肝脏微循环障碍; 动力性因素是指肝血窦周围的星状细胞(hepatic satellite cell, HSC)活化[8,9], 活化后的HSC表达α-平滑肌肌动蛋白, 转化为肌成纤维样细胞具有收缩功能; 对缩血管物质的敏感性增加和对舒血管物质敏感性下降; 以及缩血管物质和舒血管物质浓度不平衡, 这些因素最终导致肝血窦阻力增加, 这种变化被认为是可以逆转的. 实验证明血管扩张药物如硝酸酯类[10,11]、内皮素受体拮抗剂[12,13]、前列腺素[14,15]等都可以明显抑制HSC的收缩, 降低门脉压力. "前向血流学说"认为门脉高压形成之后全身扩血管物质代偿性增加导致"高动力循环"状态[16], 使回流入门脉的血流量增多, 这被认为是维持和加重门脉高压的主要机制. 上述两种机制也可以通过Ohm's定律[17]: ΔP = Q×R(ΔP是门脉压力, Q是门脉血流量, R是血流阻力)解释. PVP与PVF、门脉阻力成正比关系, 肝内阻力和血流量的增加均导致PVP升高.
国内外大多数动物实验研究以直接测定门脉压力证明干预措施对门脉高压的作用[18-21]. 我们认为直接测定门脉压力的下降并不能完全证明其干预措施能改善肝细胞缺血、乏氧, 以及营养障碍, 而且侧支循环的大量形成和血管的广泛扩张是可以减低门脉压力, 代偿门脉高压, 影响门脉压力测定的准确性. 如果直接测定经门脉主干血流量则可以排除侧支循环的影响, 充分验证扩血管药物的作用, 反映其对门静脉和肝窦压力的影响; 本实验结果显示, 给予硝酸甘油和PGE1能够明显扩张PVD, 增加经门脉入肝血流量, 但差别是经门静脉直接给药时门脉入肝血流量的增加程度低于股静脉给药组; 门脉给药方式降低门脉血流流速, 而股静脉给药方式增加血流流速. 我们认为经门脉入肝血流量的增加充分证明血管扩张剂降低肝硬化门脉高压的作用, 反映了其对肝窦的扩张作用; 但是经股静脉注药后门脉主干血流量增加更明显, 这可能反映了股静脉注药途径更能充分的扩张门静脉和肝窦, 使其阻力下降更加明显, 所以PVF增加更多; 但是股静脉注药后PFR明显增快, 而血管内径扩张, 血流流速应该减慢. 我们认为其血流速度增快的可能机制是给予扩血管药物后, 全身的扩血管物质增加, 增加了内脏血管的扩张程度, 刺激了压力感受器, 反射性引起心率增快, 加剧了高动力循环状态, 使内脏血流速度相应增快, 汇入肝门静脉血流速度因此增快. 而通过Ohm's定律ΔP = Q×R, 血流速度的增快也会导致血流量相应的增加, 这也是股静脉给药途径引起PVF增加更显著的可能原因. 那么主要原因究竟是扩张肝窦作用还是以加重高动力循环导致血流速度增快的作用, 还需要进行长期给药观察门脉血流动力学的变化.
扩血管药物扩张肝窦, 抑制HSC的收缩, 能够降低肝内血管阻力, 从而降低PVP. 但是, 目前众多临床试验研究得出的结果不能令人满意, 因为血管扩张剂的扩血管作用不仅扩张肝窦, 同时也扩张全身血管, 外周血管阻力下降, 血压下降; 血液淤滞在小血管, 导致有效循环血容量不足, 加重高动力循环状态以及诱发肾功能不全等严重并发症[11,22]. 扩血管药物在心血管疾病中的广泛应用也已经证明其明显降低循环血压和反射性引起心率增快. 吴汉平等[5]使用扩血管药物分别经门静脉和下腔静脉注药后证明门静脉注药方式可以在降低肝硬化大鼠门脉压力的同时, 较小影响平均动脉压和心率. 因此, 我们认为门静脉注入血管扩张剂可能对外周血管扩张的影响较股静脉给药途径小.
硝酸酯类扩血管药-硝酸甘油是通过释放一氧化氮(nitrogen monoxidum, NO), 发挥血管扩张作用. NO是一种较强的扩血管物质, 普遍存在于各系统中. 他由一氧化氮合酶(nitricoxide synthase, NOS)催化L-精氨酸转化为瓜氨酸时产生的, 通过旁分泌的方式直接刺激鸟甘酸环化酶, 引起环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)水平增加[23], 致Ca2+内流, 血管扩张, 所以起效快, 且作用持续时间短. 肝硬化肝窦内皮细胞损伤导致NO减少, 血管收缩因子和舒张因子的失衡表现为肝窦血管收缩, 肝内阻力增加. 经门静脉直接注入硝酸甘油, 不仅直接扩张肝门静脉、肝窦, 还可以补充肝内本身扩血管物质浓度的不足, 纠正血管收缩因子和舒张因子的失衡; 而且硝酸甘油起效快, 作用时间短, 满足局部注入, 局部起效, 对全身血管影响小等要求. PGE1是一种公认的扩血管物质, 而且能够通过一下机制抑制HSC的活化: 抑制活化的HSC分泌的生长因子的正反馈作用; 抑制HSC转化成肌成纤维细胞; 抑制细胞器合成功能; 减少胶原的合成; 减轻纤维化程度. PGE1能够抑制假小叶的形成和毛细胆管和血管的增殖[24,25]. PGE1可以减轻炎症反应[26,27]减少血小板增殖和活化. 从实验结果中可见PGE1起效较快, 但作用维持时间较长. 如果经门静脉长期给予小剂量且半衰期短、起效快的血管扩张剂, 可能会降低肝窦阻力, 抑制形状细胞的收缩作用, 且对全身扩血管的作用较弱, 减少全身的不良反应. 所以, NG可以用于经门静脉注入, 有效发挥降压作用, 且优于PGE1.
使用超声多普勒测定肝PVF的优点在于他可以重复测定以及随时监测给药前后的血流动力学改变的情况, 而且无创、便捷的特点也使其广泛应用于临床[28,29]; 有文章报道其在测定肝硬化门脉压力方面也能够发挥优势作用[30]; 而且超声多普勒技术早已应用于对大鼠的脏器测定, 如大鼠心脏多普勒测定, 数值准确, 且具有可重复性的优点, 已经得到肯定. 但这种方法也有其不足之处, 指标测定受医生水平和经验的影响, 声束受呼吸和腹腔气体的干扰, 血流量数值受声束与血流方向夹角变化的影响等.
总之, 通过门静脉注药方式注入硝酸甘油和PGE1可以明显增加经门静脉入肝血流, 但其增加量并不优于股静脉给药途径; 而门静脉注药途径可能对外周血管扩张影响较小, 可能的机制是股静脉给药方式使全身扩血管物质更多, 加重高动力循环状态. 但这还需要进一步实验验证.
目前治疗肝硬化门脉高压的药物甚少, 且不良反应明显, 使用受限. 大多数国内实验数据都是以门脉压力的下降为目标, 但是, 单纯追求门脉压力下降, 虽然能够降低并发症发生率, 但是并不能彻底改善肝脏功能, 且没有实验证实其对远期生存率和病死率的影响; 我国消化内镜及介入技术的高速发展使经门静脉直接注药成为可能.
吴泰璜, 教授, 山东省立医院肝胆外科
肝硬化门脉高压的血流动力学紊乱是目前研究的热点问题, 全身给予血管活性药物可能引起相关并发症, 靶向给药和基因治疗也得到一定的认可, 但是临床使用仍然受到限制.
吴汉平等使用扩血管药物分别经门静脉和下腔静脉注药后证明门静脉注药方式可以在降低肝硬化大鼠门脉压力的同时, 较小影响平均动脉压和心率.
本实验直接测定经门脉主干血流量则可以排除侧支循环的影响, 充分验证扩血管药物的作用, 反映其对门静脉和肝窦压力的影响.
本实验证明了血管扩张药物对肝硬化门脉高压的治疗作用, 而且局部给药也可以明显增加肝门脉入肝血流.
本文条理清晰, 分析得当, 科学性及可读性较强.
编辑: 李薇 电编:何基才
| 3. | Angelico M, Carli L, Piat C, Gentile S, Rinaldi V, Bologna E, Capocaccia L. Isosorbide-5-mononitrate versus propranolol in the prevention of first bleeding in cirrhosis. Gastroenterology. 1993;104:1460-1465. [PubMed] |
| 4. | Kamath PS. Esophageal variceal bleeding: primary prophylaxis. Clin Gastroenterol Hepatol. 2005;3:90-93. [PubMed] [DOI] |
| 6. | Lee SS, Girod C, Valla D, Geoffroy P, Lebrec D. Effects of pentobarbital sodium anesthesia on splanchnic hemodynamics of normal and portal-hypertensive rats. Am J Physiol. 1985;249:G528-G532. [PubMed] |
| 8. | Reynaert H, Urbain D, Geerts A. Regulation of sinusoidal perfusion in portal hypertension. Anat Rec (Hoboken). 2008;291:693-698. [PubMed] [DOI] |
| 9. | Reynaert H, Thompson MG, Thomas T, Geerts A. Hepatic stellate cells: role in microcirculation and pathophysiology of portal hypertension. Gut. 2002;50:571-581. [PubMed] |
| 10. | Borroni G, Salerno F, Cazzaniga M, Bissoli F, Lorenzano E, Maggi A, Visentin S, Panzeri A, de Franchis R. Nadolol is superior to isosorbide mononitrate for the prevention of the first variceal bleeding in cirrhotic patients with ascites. J Hepatol. 2002;37:315-321. [PubMed] [DOI] |
| 11. | Angelico M, Carli L, Piat C, Gentile S, Capocaccia L. Effects of isosorbide-5-mononitrate compared with propranolol on first bleeding and long-term survival in cirrhosis. Gastroenterology. 1997;113:1632-1639. [PubMed] [DOI] |
| 12. | Chan CC, Wang SS, Lee FY, Chang FY, Lin HC, Hou MC, Huang HC, Lee SD. Effects of endothelin-1 on portal-systemic collaterals of common bile duct-ligated cirrhotic rats. Eur J Clin Invest. 2004;34:290-296. [PubMed] [DOI] |
| 13. | Thirunavukkarasu C, Yang Y, Subbotin VM, Harvey SA, Fung J, Gandhi CR. Endothelin receptor antagonist TAK-044 arrests and reverses the development of carbon tetrachloride induced cirrhosis in rats. Gut. 2004;53:1010-1019. [PubMed] |
| 14. | Hossain MA, Izuishi K, Maeta H. Effect of short-term administration of prostaglandin E1 on viability after ischemia/reperfusion injury with extended hepatectomy in cirrhotic rat liver. World J Surg. 2003;27:1155-1160. [PubMed] [DOI] |
| 15. | Zou WL, Yang Z, Zang YJ, Li DJ, Liang ZP, Shen ZY. Inhibitory effects of prostaglandin E1 on activation of hepatic stellate cells in rabbits with schistosomiasis. Hepatobiliary Pancreat Dis Int. 2007;6:176-181. [PubMed] |
| 16. | Gatta A, Bolognesi M, Merkel C. Vasoactive factors and hemodynamic mechanisms in the pathophysiology of portal hypertension in cirrhosis. Mol Aspects Med. 2008;29:119-129. [PubMed] [DOI] |
| 17. | Sanyal AJ, Bosch J, Blei A, Arroyo V. Portal hypertension and its complications. Gastroenterology. 2008;134:1715-1728. [PubMed] [DOI] |
| 18. | Vlachogiannakos J, Tang AK, Patch D, Burroughs AK. Angiotensin converting enzyme inhibitors and angiotensin II antagonists as therapy in chronic liver disease. Gut. 2001;49:303-308. [PubMed] |
| 21. | Tu CT, Guo JS, Wang M, Wang JY. Antifibrotic activity of rofecoxib in vivo is associated with reduced portal hypertension in rats with carbon tetrachloride-induced liver injury. J Gastroenterol Hepatol. 2007;22:877-884. [PubMed] [DOI] |
| 22. | Gentilini P, Vizzutti F, Gentilini A, Zipoli M, Foschi M, Romanelli RG. Update on ascites and hepatorenal syndrome. Dig Liver Dis. 2002;34:592-605. [PubMed] [DOI] |
| 23. | Hennenberg M, Trebicka J, Sauerbruch T, Heller J. Mechanisms of extrahepatic vasodilation in portal hypertension. Gut. 2008;57:1300-1314. [PubMed] |
| 24. | Cattaneo MG, Pola S, Dehò V, Sanguini AM, Vicentini LM. Alprostadil suppresses angiogenesis in vitro and in vivo in the murine Matrigel plug assay. Br J Pharmacol. 2003;138:377-385. [PubMed] [DOI] |
| 25. | Komori K, Furuyama T, Shoji T, Kume M, Mori E, Yamaoka T, Sugimachi K. Inhibitory effect of prostaglandin E 1 on intimal thickening caused by poor runoff conditions in the canine autologous vein grafts. J Cardiovasc Pharmacol. 2001;38:686-692. [PubMed] [DOI] |
| 26. | Takahashi HK, Iwagaki H, Mori S, Yoshino T, Tanaka N, Nishibori M. Prostaglandins E1 and E2 inhibit lipopolysaccharide-induced interleukin-18 production in monocytes. Eur J Pharmacol. 2005;517:252-256. [PubMed] [DOI] |
| 27. | Nakazawa K, Narumi Y, Ishikawa S, Yokoyama K, Nishikage T, Nagai K, Kawano T, Makita K. Effect of prostaglandin E1 on inflammatory responses and gas exchange in patients undergoing surgery for oesophageal cancer. Br J Anaesth. 2004;93:199-203. [PubMed] [DOI] |
| 30. | Singal AK, Ahmad M, Soloway RD. Duplex Doppler ultrasound examination of the portal venous system: an emerging novel technique for the estimation of portal vein pressure. Dig Dis Sci. 2010;55:1230-1240. [PubMed] [DOI] |