修回日期: 2010-09-18
接受日期: 2010-09-25
在线出版日期: 2010-11-18
目的: 研究食管癌患者外周血淋巴细胞亚群的变化及其与预后的关系.
方法: 用流式细胞仪检测171例食管癌首诊患者外周血的淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD25+、CD44+及NK细胞, 与正常参考值(健康体检96例)对照, 并结合临床及随访资料进行Kaplan-Meier分析.
结果: (1)与健康对照组相比, 食管癌患者淋巴细胞亚群8项指标均呈显著性差异. 表现CD3+、CD4+、CD8+及CD19+明显低于健康对照组(66.28±12.46 vs 73.32±7.65, 37.84±11.16 vs 39.74±6.51; 21.93±10.06 vs 28.68±4.83; 6.57±4.75 vs 7.91±2.98, P<0.05); CD4+/CD8+、CD25+、CD44+及NK细胞明显高于健康对照组(2.18±1.35 vs 1.44±0.42; 26.82±9.39 vs 17.10±5.21; 67.53±16.33 vs 45.81±13.50; 24.07±12.83 vs 17.10±8.00, P<0.05). 食管癌患者淋巴细胞亚群与分化程度、淋巴结转移及病理分期均无关(P>0.05); (2)CD44+表达低于健康对照者, 平均存活时间高于健康对照者, 有显著性差异(20.32 mo±3.01 mo vs 11.50 mo±0.98 mo, P<0.05). 但对于不同的CD8+表达水平来说, 患者生存无显著性差异.
结论: 食管癌患者外周血淋巴细胞亚群普遍发生显著性变化, CD44+的表达与患者预后明显相关, CD44+低表达具有显著的生存优势.
引文著录: 王长春, 凌志强, 毛伟敏. 外周血CD44+低表达与食管鳞癌患者预后的关系. 世界华人消化杂志 2010; 18(32): 3462-3466
Revised: September 18, 2010
Accepted: September 25, 2010
Published online: November 18, 2010
AIM: To investigate the changes in the percentages of lymphocyte subsets in the peripheral blood of patients with esophageal carcinoma and to analyze their relationship with survival.
METHODS: Flow cytometry was used to examine the subgroups of lymphocytes (CD3+, CD4+, CD8+, CD4+/CD8+, CD19+, CD25+, CD44+ and NK cells) in the peripheral blood of 171 esophageal carcinoma patients without any therapy and 96 healthy controls. The clinical and follow-up data for each patient were collected and subjected to Kaplan-Meier analysis.
RESULTS: The percentages of CD3+, CD4+, CD8+ and CD19+ lymphocytes in the peripheral blood of patients with esophageal cancer were significant lower than those in healthy controls (66.28 ± 12.46 vs 73.32 ± 7.65, 37.84 ± 11.16 vs 39.74 ± 6.51; 21.93 ± 10.06 vs 28.68 ± 4.83; 6.57 ± 4.75 vs 7.91 ± 2.98, all P < 0.05). The percentages of CD4+/CD8+, CD25+, CD44+ lymphocytes and NK cells were significant higher in patients with esophageal cancer than in healthy controls (2.18 ± 1.35 vs 1.44 ± 0.42; 26.82 ± 9.39 vs 17.10 ± 5.21; 67.53 ± 16.33 vs 45.81 ± 13.50; 24.07 ± 12.83 vs 17.10 ± 8.00, all P < 0.05). The percentages of lymphocyte subsets in the peripheral blood of esophageal cancer patients had no significant association with tumor stage, differentiation and lymph node metastasis (all P > 0.05). The mean survival time of patients with lower percentage of CD44+ lymphocytes was significantly higher than that of patients with higher percentage of CD44+ lymphocytes (20.32 mo ± 3.01 mo vs 11.50 mo ± 0.98 mo, P < 0.05). There is no significant difference in the survival between patients with low and high percentage of CD8+ lymphocytes.
CONCLUSION: There is a significant correlation between the percentage of CD44+ lymphocytes and survival in patients with esophageal carcinoma. Decreased percentage of CD44+ lymphocytes in the peripheral blood is associated with a remarkable survival advantage in patients with esophageal carcinoma.
- Citation: Wang CC, Ling ZQ, Mao WM. Decreased percentage of CD44+ lymphocytes in the peripheral blood correlates with a remarkable survival advantage in patients with esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3462-3466
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3462.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3462
食管癌总体上预后不佳, 近10年的研究发现食管癌常伴有机体免疫机能低下和紊乱. 已有众多的学者报道了不同病理分期食管癌的3年及5年生存率, 鲜有外周血的免疫学指标与预后关系的报道. 本研究用流式细胞仪检测食管癌首诊患者的淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD25+、CD44+及自然杀伤(natural killer, NK)细胞, 与正常参考值对照, 并结合临床病理及随访资料进行分析. 试图寻找淋巴细胞亚群与患者预后的关系.
收集2006-08/2010-05在浙江省肿瘤医院住院治疗的食管癌首诊患者171例, 所有病例抽血化验前均未行放、化治疗, 并均经胃镜活检证实诊断为食管鳞癌. 患者年龄38-86(平均年龄63.26)岁, 男154例, 女17例. 其中34例患者经手术治疗并有相应的术后病理结果, 137例患者因肿瘤位置高或局部晚期等原因未手术治疗、而行放化疗. 未手术者取影像学分期, 以96名健康成年人作为对照组. 随访截止日期2010-05-31, 失访2例. 肿瘤分期根据胸腹部CT、腹腔及锁骨上B超及手术后病理结果采用UICC 2002版的TNM分期标准, 其中Ⅰ期2例、Ⅱ期27例、Ⅲ期41例、Ⅳ期54例; 没有分期资料47例. 淋巴结阴性27例、阳性84例(其中远处转移35例), 无法确定是否有淋巴结转移的60例. 未分化、低分化、中低分化及低未分化30例、中分化及中高分化65例、高分化4例、分化程度未知的72例. 美国Becton Dickinson公司FACS Calibur流式细胞仪, 采用美国Becton Dickinson公司配套的淋巴细胞亚群检测试剂盒(Smultest IMK-Lymphocyte), 试剂盒中的双色荧光抗体是异硫氰酸荧光素(fluorescein isothiocyanate, FITC)和藻红蛋白(phycoerythrin, PE)标记的鼠抗人单克隆抗体(Catalog No. 340182).
171例患者和健康对照组于入院进行治疗之前清晨空腹抽静脉血2 mL, EDTA钾盐抗凝. 获得标本后立即送检. 真空灭菌注射器采集血液2 mL, 用肝素抗凝, 2 h内送达实验室. (1)用加样枪在流式试管内加相应单抗20 µL; (2)加入肝素抗凝的待测血浆100 µL; (3)混匀后室温避光30 min使样品与试剂充分反应; (4)加2 mL溶血素2次震荡混匀, 再室温避光5 min后, 1 200 r/min离心5 min; (5)倒去上清后加PBS震荡混匀, 1 200 r/min离心5 min倒去上清; (6)加固定液300 µL, 震荡混匀后上机. 流式细胞仪分析使用Couter公司配套的SystemⅡ系统软件数据处理系统. 先进行光路流路的较准, 较准后进行荧光补偿, 然后上样本检测.
统计学处理 检测结果以mean±SD表示. 利用SPSS17.0处理试验结果, 两组之间均数比较采用独立样本的双侧t检验, P<0.05为有显著性差异; 生存分析中, 淋巴细胞亚群8项指标均以健康参考值为界分为两组, 进行Kaplan-Meier分析.
与健康对照组相比, 食管癌患者淋巴细胞亚群8项指标均呈显著性差异(P<0.05). 表现为CD3+%总T淋巴细胞、CD4+%辅助T淋巴细胞、CD8+%细胞毒T淋巴细胞及CD19+%B淋巴细胞明显低于健康对照组; CD4+/CD8+比值、NK%细胞、CD25+%白介素2受体及CD44+%黏附分子明显高于健康对照组(表1). 而Ⅰ/Ⅱ期与Ⅲ/Ⅳ期相比、淋巴结阴性与淋巴结阳性相比、低/未分化与中/高分化相比, 食管癌患者淋巴细胞亚群8项指标均无显著性差异(P>0.05).
| 分组 | 样本(n) | CD3+ | CD4+ | CD8+ | CD4+/CD8+ | NK细胞 | CD19+ | CD25+ | CD44+ |
| 对照组 | 96 | 73.32± 7.65a | 39.74± 6.51a | 28.68± 4.83a | 1.44± 0.42a | 17.10± 8.00a | 7.91±2.98a | 17.10± 5.21a | 45.81±13.50a |
| 食管癌组 | 171 | 66.28±12.46 | 37.84±11.16 | 21.93±10.06 | 2.18± 1.35 | 24.07±12.83 | 6.57±4.75 | 26.82± 9.39 | 67.53±16.33 |
| Ⅰ/Ⅱ期 | 29 | 67.18±12.82 | 39.57±10.37 | 22.79± 9.84 | 2.18± 1.46 | 22.64±12.59 | 7.14±5.11 | 29.00± 8.76 | 63.07±18.28 |
| Ⅲ/Ⅳ期 | 95 | 66.06±12.53 | 36.48±10.79 | 23.27±10.80 | 1.99± 1.23 | 25.14±12.99 | 5.86±3.97 | 25.5± 9.77 | 68.04±15.36 |
| 淋巴结阴性 | 27 | 68.48±14.63 | 39.33±11.68 | 24.15± 9.73 | 1.98± 1.31 | 20.74±14.39 | 7.00±5.45 | 28.52±10.17 | 61.81±21.43 |
| 淋巴结阳性 | 84 | 66.00±12.29 | 37.08±10.46 | 23.13±10.77 | 2.02± 1.22 | 25.07±12.89 | 6.18±4.13 | 26.45±10.03 | 68.79±14.26 |
| 低/未分化 | 30 | 64.5±11.30 | 36.63±11.08 | 21.23±10.65 | 2.34± 1.73 | 26.9±11.15 | 6.13±2.85 | 26.47± 6.31 | 70.40±14.54 |
| 中/高分化 | 69 | 67.08±13.48 | 37.97±12.23 | 23.25±10.34 | 2.03± 1.29 | 23.49±13.63 | 6.32±4.46 | 28.13±11.52 | 66.75±16.17 |
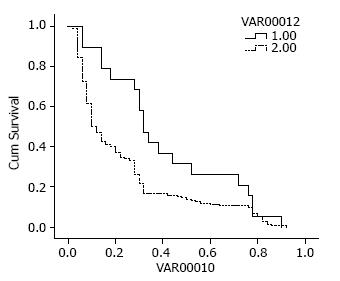
CD44+%黏附分子表达低于健康对照者有显著生存优势(P = 0.024), 而其余7项指标与患者预期生存无关(P>0.05, 表2, 图1).
| 淋巴细胞亚群 | 平均存活时间(mo) | P值 | |
| 检测值<对照组 | 检测值>对照组 | ||
| CD3+ | 12.07±1.13 | 13.60±1.80 | 0.50 |
| CD4+ | 11.01±1.20 | 14.30±1.51 | 0.12 |
| CD8+ | 12.19±1.07 | 13.66±2.16 | 0.47 |
| NK细胞 | 14.36±1.79 | 11.59±1.12 | 0.25 |
| CD19+ | 12.98±1.15 | 11.25±1.68 | 0.29 |
| CD25+ | 11.88±2.08 | 12.59±1.06 | 0.92 |
| CD44+ | 20.32±3.02 | 11.50±0.98 | 0.02 |
肿瘤免疫是一个复杂的过程, 恶性肿瘤患者往往免疫功能状态紊乱和低下, 发挥免疫功能的淋巴细胞约占白细胞总量的20%, 可分为T、B淋巴细胞、NK细胞、巨噬细胞和树突状细胞. 通常采用单克隆抗体来分析细胞表面抗原分子, 并对其分化群进行了定义, 用CD来描述白细胞表面抗原的不同成分, T淋巴细胞及表面抗原主要包括CD4+、CD8+、CD3+, B淋巴细胞及表面抗原主要包括CD19+、CD20+, NK细胞及表面抗原主要包括CD16+、CD56+, CD25+属活化淋巴细胞, CD44+为黏附分子.
绝大多数研究认为肿瘤患者的CD8+ T淋巴细胞升高, CD4+/CD8+下降, 而本研究结果恰恰相反, 是CD8+ T淋巴细胞下降, CD4+/CD8+上升. 众所周知, CD8+ T细胞从功能上表现为杀伤性T(cytotoxic T lymphocyte, Tc或CTL)与抑制性T(supressor T cell, Ts)淋巴细胞两种. CD8+ Tc被公认为是抗肿瘤的主要效应细胞, 而CD4+的辅助性T淋巴细胞(helper T cell, TH)细胞亚群则被认为与机体产生特异性抗肿瘤免疫有关, 如致敏的TH细胞再次接触肿瘤细胞时, 通过表面特异性受体识别并结合癌细胞表面抗原, 产生一系列淋巴因子, 并激活其他效应细胞Tc细胞、巨噬细胞、NK和B淋巴细胞等共同发挥其抗肿瘤效应. 胡振东等[1]在1997年首次报道了CD8+降低与恶性肿瘤转移有关, 推测肿瘤转移患者的CD8+降低可能是循环血中CD8+ Tc减少, 导致对肿瘤细胞杀伤功能降低, 瘤块释放到血中的肿瘤细胞得以存活而引起血行转移. 本研究比较了淋巴结阴性与淋巴结阳性患者的CD8+ Tc细胞, 并无显著性差异, 有可能在食管癌患者中CD8+ Tc减少占主导地位. Olioso等[2]报道进展性淋巴瘤、转移性肾癌、肝细胞癌在经细胞因子诱导的杀伤细胞治疗后CD8+上升, 提示在初始状态下CD8+是下降的, 与本研究相一致. 但作者并未阐述CD8+在体内的免疫作用机制. 可见CD8+ T淋巴细胞在抗肿瘤效应中机制不明, 尚需进一步研究. 本研究中, 其他6项指标的改变与众多报道一致[3-7], 不加赘述. Patel等[8]研究发现人乳头状瘤病毒存在免疫逃避, CD4+在早期宫颈癌占主要地位, CD8+在进展期宫颈癌占主要地位, 可见淋巴细胞亚群的多因子联合检测才能完整反映机体的免疫状态.
本研究比较了不同分期、不同分化程度及淋巴结转移与否的食管癌外周血淋巴细胞亚群, 发现上述8项指标均无显著性差异. 这一结果与多数报道不完全一致. 秦子敏等[9]报道外周血T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+比值这4项指标与食管癌淋巴结微转移均显著相关, 有微转移组CD3+、CD4+水平及CD4+/CD8+比值明显低于无微转移组, CD8+水平明显高于无微转移组, 差异均有统计学意义(均P<0.05). 沈玉光等[10]报道早期(0、Ⅰ期)食管癌、贲门癌患者和健康对照组之间T淋巴细胞各亚群相比没有统计学差异; 中、晚期( Ⅰ、Ⅱ、Ⅲ期)食管癌、贲门癌患者和健康对照组相比, CD4+明显降低(P = 0.023); CD8+则明显升高(P = 0.021); CD4+/CD8+较正常有所下降, 但是没有显著性差异; 淋巴结阴性患者和淋巴结阳性患者比较T淋巴细胞各亚群没有明显差异. 可见, 淋巴细胞亚群与肿瘤分期、分化程度、淋巴结转移的关系目前尚无定论, 值得进一步研究. 在本研究中, CD44+%黏附分子表达低于健康对照者, 有显著生存优势(P = 0.024), 而其余7项指标与患者预期生存无关(P>0.05).
CD44+指白细胞分化抗原分化簇第44号, 存在于人类CD44基因位于11号染色体短臂上, CD44基因的外显子按表达方式分为2种类型: 仅含组成型外显子的CD44转录子, 称为标准型CD44(standard CD44, CD44S), 另一种是V区变异型外显子, 含有V区外显子的CD44转录子统称为CD44拼接变异体(CD44 alternative splice variant, CD44V). CD44蛋白的主要功能可归纳为: (1)介导淋巴细胞与毛细血管后小静脉中的高柱状内皮细胞结合, 使淋巴细胞穿过血管壁回到淋巴组织; (2)参与淋巴细胞的激活过程; (3)与细胞外基质中的透明质酸、层粘连蛋白等基质分子结合; (4)能与细胞骨架蛋白结合, 参与细胞伪足形成, 并与细胞的迁移运动有关. CD44与肿瘤浸润转移关系的研究已有大量报道[11-13]. 已在人类各种恶性肿瘤的研究中发现CD44S普遍存在, CD44V在恶性肿瘤组织中阳性表达率高低不一但阳性表达者较易发生脉管浸润和远处转移, 本研究恰好从预后的角度印证了CD44的上述特点.
Nozoe等[14]及Cho等[15]报道CD4+、CD8+与食管癌患者的生存有关, 具有高百分比CD4+、CD8+细胞的患者生存率高. 从免疫学观点看, 抗肿瘤免疫是整个免疫系统的协同作用, 各种免疫组分的免疫细胞会随着免疫状态的改变而发生变化, 联合多因子检测才能较完整的反映机体的免疫状态.
本实验报道了食管癌患者会出现CD8+降低, 并且报道了CD44+黏附分子低表达者有显著生存优势. 有望为临床治疗策略提供一些帮助.
肿瘤是一种全身性疾病, 机体的免疫状况与肿瘤的发生、发展、转移和预后密切相关. T淋巴细胞亚群、B淋巴细胞和NK细胞的功能变化已经成为评价人体免疫功能的重要指标, 业已成为临床肿瘤学研究的热点. 大量文献报道了头颈鳞癌、乳腺癌、结肠癌、宫颈癌、卵巢癌及肝癌等患者外周血淋巴细胞亚群改变及其临床意义, 但有关食管癌的研究鲜有报道.
陈洪, 副教授, 东南大学附属中大医院消化科
胡振东等在1997年首次报道了CD8+降低与恶性肿瘤转移有关, 推测肿瘤转移患者的CD8+降低可能是循环血中CD8+ Tc减少, 导致对肿瘤细胞杀伤功能降低, 瘤块释放到血中的肿瘤细胞得以存活而引起血行转移.
本研究用流式细胞仪检测食管癌首诊患者的淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+、CD19+、CD25+、CD44+及NK细胞, 研究食管癌患者淋巴细胞亚群的变化规律, 并研究淋巴细胞亚群与患者预后的关系.
本实验报道了食管癌患者会出现CD8+降低, 并且报道了CD44+黏附分子低表达者有显著生存优势. 有望为临床治疗策略提供一些帮助.
本文选题尚可, 对食管鳞癌患者的治疗提供临床参考.
编辑 李军亮 电编 何基才
| 2. | Olioso P, Giancola R, Di Riti M, Contento A, Accorsi P, Iacone A. Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours: a pilot clinical trial. Hematol Oncol. 2009;27:130-139. [PubMed] [DOI] |
| 5. | Nakamura T, Shima T, Saeki A, Hidaka T, Nakashima A, Takikawa O, Saito S. Expression of indoleamine 2, 3-dioxygenase and the recruitment of Foxp3-expressing regulatory T cells in the development and progression of uterine cervical cancer. Cancer Sci. 2007;98:874-881. [PubMed] [DOI] |
| 6. | Fabre-Guillevin E, Tabrizi R, Coulon V, Monnereau A, Eghbali H, Soubeyran I, Soubeyran P. Aggressive non-Hodgkin's lymphoma: concomitant evaluation of interleukin-2, soluble interleukin-2 receptor, interleukin-4, interleukin-6, interleukin-10 and correlation with outcome. Leuk Lymphoma. 2006;47:603-611. [PubMed] [DOI] |
| 7. | 赵 松, 付 明倜, 胡 伟, 田 川, 李 文才, 李 惠翔, 高 冬玲, 赵 高峰. 食管癌患者血清中SCD44V6及组织中CD44V6表达的临床意义. 中华医学杂志. 2003;83:1919-1920. |
| 8. | Patel S, Chiplunkar S. Host immune responses to cervical cancer. Curr Opin Obstet Gynecol. 2009;21:54-59. [PubMed] [DOI] |
| 11. | Liu WK, Fu Q, Li YM, Jiang XY, Zhang MP, Zhang ZX. The relationship between cyclooxygenase-2, CD44v6, and nm23H1 in esophageal squamous cell carcinoma. Onkologie. 2009;32:574-578. [PubMed] [DOI] |
| 12. | Pozdnyakova O, Hoang MM, Dresser KA, Mahalingam M. Prognostic value of E-cadherin, beta-catenin, CD44v6, and HER2/neu in metastatic cutaneous adenocarcinoma. Arch Pathol Lab Med. 2009;133:1285-1290. [PubMed] |
| 13. | Li DM, Li SS, Zhang YH, Zhang HJ, Gao DL, Wang YX. Expression of human chorionic gonadotropin, CD44v6 and CD44v4/5 in esophageal squamous cell carcinoma. World J Gastroenterol. 2005;11:7401-7404. [PubMed] |
| 14. | Nozoe T, Maehara Y, Sugimachi K. Preoperative sorting of circulating T lymphocytes in patients with esophageal squamous cell carcinoma: its prognostic significance. World J Gastroenterol. 2005;11:6689-6693. [PubMed] |
| 15. | Cho Y, Miyamoto M, Kato K, Fukunaga A, Shichinohe T, Kawarada Y, Hida Y, Oshikiri T, Kurokawa T, Suzuoki M. CD4+ and CD8+ T cells cooperate to improve prognosis of patients with esophageal squamous cell carcinoma. Cancer Res. 2003;63:1555-1559. [PubMed] |