修回日期: 2010-09-18
接受日期: 2010-09-27
在线出版日期: 2010-11-18
目的: 探讨葱白提取物影响脂肪变性肝细胞NF-κB、TNF-α表达的分子机制.
方法: 用游离脂肪酸诱导HepG2细胞, 油红O染色观察细胞内的脂滴, 检测TG含量确定建立肝细胞脂肪变模型; MTT检测细胞活性. RT-PCR法和Western blot法分别检测NF-κB mRNA和蛋白的表达, 电泳迁移率改变分析(EMSA)检测NF-κB活性; ELISA检测TNF-α含量.
结果: 游离脂肪酸诱导24 h后, 油红O染色显示脂肪变性; 模型组TG含量较对照组显著升高, 差异有统计学意(0.22 mmoL/L±0.03 mmoL/L vs 0.07 mmoL/L±0.05 mmoL/L, P<0.01). 葱白提取物可明显改善细胞活性(0.35±0.04, 0.38±0.03, 0.43±0.07 vs 0.29±0.07, P<0.05或0.01); 模型组胞内NF-κB mRNA、蛋白的表达及其活性均高于正常对照组, 差异有统计学意(1.10±0.06 vs 0.67±0.06; 0.41±0.03 vs 0.27±0.04, P<0.01), 同时上清TNF-α水平显著上升(P<0.01); 而葱白提取物不同剂量药物作用组的上述指标则低于模型组(0.97±0.05, 0.94±0.09, 0.88±0.08 vs 1.10±0.06; 0.33±0.06, 0.24±0.06, 0.26±0.05 vs 0.41±0.03; 65.38 ng/L±9.55 ng/L, 59.93 ng/L±7.52 ng/L, 45.05 ng/L±9.22 ng/L vs 76.92 ng/L±8.40 ng/L, P<0.05或0.01).
结论: 葱白提取物对脂肪变性肝细胞有明显的保护作用, 其机制可能与抑制NF-κB表达降低其活性及TNF-α分泌有关.
引文著录: 时昭红, 林丽莉, 冯云霞, 郑娅琼. 葱白提取物对脂肪变性肝细胞NF-κB及TNF-α表达的影响. 世界华人消化杂志 2010; 18(32): 3457-3461
Revised: September 18, 2010
Accepted: September 27, 2010
Published online: November 18, 2010
AIM: To investigate the effects of fistular onion stalk extract on NF-κB expression and TNF-α secretion in steatotic HepG2 cells and to explore possible molecular mechanisms involved.
METHODS: HepG2 cells were induced with free fatty acids to create a cell model of hepatic steatosis. Intracellular lipid droplets were detected by oil red O staining. Cell proliferation was determined by MTT assay. The expression of NF-κB mRNA and protein was detected by RT-PCR and Western blot, respectively. NF-κB activity was detected by electrophoretic mobility shift assay (EMSA). TNF-α level was measured by ELISA.
RESULTS: After treatment with free fatty acids for 24 h, steatosis was successfully induced in HepG2 cells. Triglyceride (TG) content was significantly higher in model cells than in control cells (0.22 mmoL/L ± 0.03 mmoL/L vs 0.07 mmoL/L ± 0.05 mmoL/L, P < 0.01). Treatment with different doses of fistular onion stalk extract significantly improved cell proliferation (0.35 ± 0.04, 0.38 ± 0.03, 0.43 ± 0.07 vs 0.29 ± 0.07, all P < 0.05 or 0.01). The levels of NF-κB mRNA and protein expression (1.10 ± 0.06 vs 0.67 ± 0.06; 0.41 ± 0.03 vs 0.27 ± 0.04, P < 0.01) as well as TNF-α secretion (P < 0.01) were significantly higher in model cells than in control cells. Treatment with different doses of fistular onion stalk extract significantly reduced the levels of the above parameters (0.97 ± 0.05, 0.94 ± 0.09, 0.88 ± 0.08 vs 1.10 ± 0.06; 0.33 ± 0.06, 0.24 ± 0.06, 0.26 ± 0.05 vs 0.41 ± 0.03; 65.38 ng/L ± 9.55 ng/L, 59.93 ng/L ± 7.52 ng/L, 45.05 ng/L ± 9.22 ng/L vs 76.92 ng/L ± 8.40 ng/L, all P < 0.05 or 0.01).
CONCLUSION: Fistular onion stalk extract has significant protective effects against steatosis in HepG2 cells possibly by inhibiting NF-κB expression and reducing TNF-α secretion.
- Citation: Shi ZH, Lin LL, Feng YX, Zheng YQ. Fistular onion stalk extract reduces NF-κB expression and TNF-α secretion in steatotic HepG2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3457-3461
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3457
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是一种无过量饮酒史, 肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征. 目前, NAFLD的发病率和早期诊断率逐年上升, 发病年龄年轻化, 已成为全球性的公共卫生问题[1,2]. 其发病机制较为复杂, 至今尚未完全明确, 多数人认为与脂质代谢紊乱、胰岛素抵抗(insulin resistance, IR)、细胞因子, 氧应激及脂质过氧化反应等因素密切相关. 葱白提取物是从葱科植物细香葱成熟茎的下端葱白中提取的一类活性成分. 前期研究表明[3], 华夏小葱制剂能改善脂肪肝大鼠体内的脂质代谢, 对脂肪肝有一定的防治作用. 本实验旨在观察葱白提取物对脂变性HepG2细胞的核因子NF-κB mRNA和蛋白的表达及其活性, 以及测定TNF-α含量水平, 初步探讨葱白提取物对肝细胞脂质变性的防治作用及其可能机制.
人肝癌细胞株HepG2, 购于华中科技大学同济医学院. 胎牛血清(FBS)为四季青产品. 高糖DMEM培养基为美国Gibco公司产品; 棕榈酸(palmitate)、油酸(oleate)均为美国Sigma公司产品. 油红O试剂盒, 为武汉谷歌生物技术有限公司产品; TNF-α ELISA试剂盒为R&D公司产品. RNAout(Trizol RNA提取试剂)为天泽基因工程有限公司产品; ReverTra Ace-α-TM-RT-PCR Kit为自东洋纺(上海)生物科技有限公司产品. PCR引物为武汉博洁公司产品. DNA Marker DL2000(TaKaRa)为武汉亚法公司产品. Taq DNA聚合酶为MBI公司产品; 山羊抗人NF-κB多克隆抗体为SANTA CRUZ 公司产品, 兔抗山羊二抗为北京中杉生物公司产品. 葱白提取物由武汉中西结合医院制剂中心提供, 批号: 080304. 利用无菌的基础培养液稀释葱白提取物, 使其终浓度分别为0.05、0.1、0.25 g/L.
1.2.1 细胞培养: HepG2细胞以0.25%胰酶/0.02% EDTA消化传代, 以含100 mL/L FBS的高糖DMEM培养液在含50 mL/L CO2的37 ℃培养箱中培养.
1.2.2 造模及分组: HepG2细胞, 培养24-48 h, 细胞铺满80%-90%. 分设正常组、模型组、药物作用组(在前期无毒剂量范围确立3个剂量组). 其中, 模型组加入游离脂肪酸(油酸∶棕榈酸浓度为1∶0.5 mmol/L, 剂量参考文献[4]), 不同剂量药物作用组分别添加0.05、0.1、0.25 g/L的低、中、高剂量的葱白提取物与含游离脂肪酸的培养基进行混合培养细胞, 培养24 h后收集上清及细胞.
1.2.3 油红O染色观察细胞内脂滴变化: 同上, 取培养于6孔板培养内的各组盖玻片, 用PBS洗3次. 按油红O试剂说明书进行染色, 明胶封片, HPIAS-1000型图像分析系统收集图像.
1.2.4 细胞内TG的测定: 同上, 取培养于6孔板培养内的各组细胞. 反复冻融裂解细胞, 3 000 r/min离心10 min, 取上清, 送武汉中西结合医院检验科用全自动生化仪检测.
1.2.5 MTT细胞活性分析: 石分组处理后, 96孔培养板各孔加MTT液10 μL(5 g/L), 37 ℃孵育4 h, 倾去上清液, 然后每孔加入DMSO 150 μL, 振荡10 min, 在酶标仪上570 nm处吸光度(A)值.
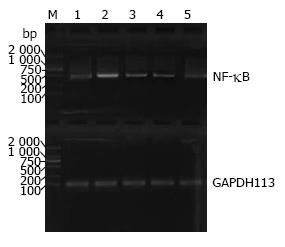
1.2.6 RT-PCR技术检测肝细胞核因子NF-κB mRNA的表达: 同上, 收集各组细胞. 按TRIzol试剂说明书提取各组细胞总mRNA电泳分析其完整性, 测纯度, 定量, -70 ℃保存. 根据NF-κB基因序列, 用primer 5.0软件设计扩增引物: NF-κB-F-sense: 5'-CCTTTTCGACTACGCGGTGAC-3', NF-κB-R-anti-sense: 5'-GAATGGCATTCAGACCGTCCC-3', 扩增片段大小为422 bp. 内参GAPDH113引物为: GAPDH113-sense: 5'-CATGAGAAGTATGACAACAGCCT-3', GAPDH113-anti-sense: 5'-AGTCCTTCCACGATACCAAAGT-3', 扩增片段大小为113 bp. 采用ReverTra Ace-α-TM-RT-PCR Kit逆转录试剂盒, 按操作说明将组织总RNA中的mRNA逆转录成cDNA, 再进行PCR扩增, 扩增参数: 95 ℃预变性5 min, 95 ℃ 20 s→57.5 ℃ 20 s→72 ℃ 30 s, 共35个循环, 72 ℃延长3 min. 电泳结果用Quantity One(美国Bio-Rad公司)分析系统进行电泳条带光密度分析, 计算目的产物NF-κB和内参照GAPDH113吸光光度值的比值来反映其相对含量.
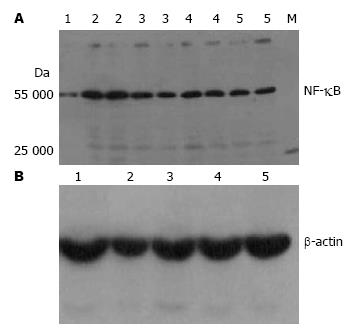
1.2.7 Western blot技术检测肝细胞NF-κB蛋白的表达: 同上, 提取各组细胞总蛋白, 细胞核裂解液裂解, 取20 μL裂解样品液, 进行SDS-PAGE蛋白电泳, 表达产物电转移至硝酸纤维素膜上, 进行Western blot反应, 通过BandScan 5.0软件对杂交图进行分析, 以β-actin作为定量Marker, 20 pmol为定量单位.
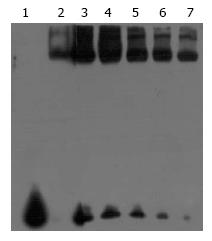
1.2.8 电泳迁移率改变分析检测NF-κB活性: 电泳迁移率改变分析(electrophoretic mobility shift assay, EMSA)检测参照试剂盒说明书进行, 提取细胞核内容物, 并检测NF-κB的活性. 同步检测上述各组细胞核蛋白与Biotin标记的NF-κB序列探针(sense 5'-BIOTIN-...TAGCATATGCTA...-3', anti-sense 3'-...ATCGTATACGAT...-BIOTIN-5', 各0.2 mol/L)的结合活性; 同时, 通过采用无标记的NF-κB(sense 5'-...TAGCATATGCTA...-3', anti-sense 3'-...ATCGTATACGAT...-5')的特异性竞争实验, 进行葱白提取物对NF-κB与DNA结合抑制作用的特异性分析. 应用BandScan 5.0对所形成的特异性产物条带计算积分光密度分析. 以葱白提取物作用组与阴性对照组的结合条带IA的比值表示葱白提取物作用组的相对结合活性.
1.2.9 检测各组培养上清中TNF-α含量: 收集各组在培养箱中培养24 h后的培养上清, 用人TNF-α ELISA试剂盒分别检测其中TNF-α的浓度.
统计学处理 所有数据均用SPSS14.0软件包进行统计学分析. 计量资料以mean±SD表示. 组间比较采用t检验.
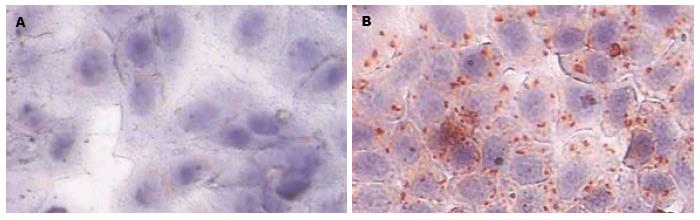
正常组细胞边缘清晰, 呈多角形排列呈铺路石样, 细胞间结合紧密, 无缝隙. 油红O染色示细胞边缘清晰, 核大, 细胞内少见橘红色脂滴聚集; 模型组细胞边缘清晰, 大部分多角形, 有些细胞变圆, 细胞间结合欠紧密. 油红O染色示细胞内橘红色脂滴较多, 部分细胞内脂滴成环状位于细胞膜内侧, 可见较大的脂滴. 表明成功建立了肝细胞脂肪变性模型(图1).
培养24 h后, 游离脂肪酸使细胞内TG含量明显增加(0.22 mmoL/L±0.03 mmoL/L vs 0.07 mmoL/L±0.05 mmoL/L, P<0.01).
模型组存活率较正常组明显降低(A值: 0.29±0.07 vs 0.56±0.10, P<0.01), 葱白提取物可减轻细胞内脂毒性; 加药物组细胞活性较模型组明显增高(A值: 0.35±0.04, 0.38±0.03, 0.43±0.07 vs 0.29±0.07, P<0.05或0.01), 高剂量组明显强于中、低剂量组(P<0.01).
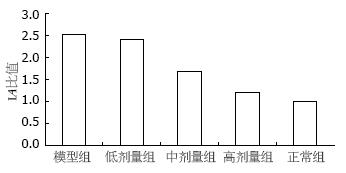
抽提各组细胞总RNA, 应用荧光半定量RT-PCR检测各组NF-κB mRNA水平变化(图2). 正常对照组, 模型组, 低、中、高浓度各剂量组CT值分别为0.67±0.06, 1.10±0.06, 0.97±0.05, 0.94±0.09, 0.88±0.08. 将各药物作用组与模型组、阴性对照组(以PBS代替模板DNA)比较差异有统计学意义(P<0.05或0.01), 表明葱白提取物能降低脂肪变性细胞NF-κB的mRNA的表达.
由图3可知, 各组均可见β-actin略下方清晰杂交带. 将杂交带进行BandScan 5.0软件分析, 正常对照组, 模型组, 低、中、高浓度各组CT值NF-κB分别为0.27±0.04, 0.41±0.03, 0.33±0.06, 0.24±0.06, 0.26±0.05, 将药物作用各组与模型组比较, 表明葱白提取物能降低脂肪变性细胞NF-κB的蛋白表达.
通过EMSA实验发现, 竞争性抑制实验中过量未标记的NF-κB冷探针可完全抑制NF-κB的DNA结合, 阳性对照出现特异的DNA结合条带, 提示该条带为NF-κB与DNA特异性探针结合而形成. 用葱白提取物处理组的DNA结合条带减弱, 说明其细胞核提取物NF-κB的DNA结合活性将低, 并随着药物浓度的增高而降低. 空白对照组在电泳图中部出现的一条较强的DNA结合条带, 说明HepG2细胞核提取物NF-κB的DNA结合活性较高(图4, 5).
经游离脂肪酸刺激后, 细胞上清TNF-α水平明显增高(76.92 ng/L±8.40 ng/L vs 51.80 ng/L±10.15 ng/L), 各剂量组能明显抑制TNF-α含量的升高(65.38 ng/L±9.55 ng/L, 59.93 ng/L±7.52 ng/L, 45.05 ng/L±9.22 ng/L vs 76.92 ng/L±8.40 ng/L, P<0.05), 以高剂量组降低最明显(P<0.01).
随着人们生活水平的提高, 饮食结构的变化, 检测手段的提高, 肥胖、糖尿病、高脂血症等多种疾病发病率增加, NAFLD发病率呈逐年上升趋势. NAFLD包括单纯性脂肪肝、非酒精性脂肪性肝炎、脂肪性肝纤维化和脂肪性肝硬化4个病理过程. NAFLD的发病机制较为复杂, 至今尚未完全明确, Day等[5]提出的以脂代谢异常、细胞因子、氧应激(oxidative stress)以及脂质过氧化为特色的"二次打击"学说已被大多数学者所接受.
本实验使用油酸软脂酸2∶1比例成功复制了非酒精性肝细胞脂变模型. 实验模型组通过游离脂肪酸刺激后TG显著高于正常组, 胞质内脂滴明显增多, 提示该模型存在脂肪变性、肝损伤. 葱白提取物能显著降低模型组细胞脂肪沉积, 提示其防治脂肪肝的作用机制与通过降低肝脏游离脂肪酸含量, 降低内源性TG的合成, 改善脂质代谢, 降低游离脂肪酸毒性有关. 在细胞活性实验中, 我们也发现葱白提取物可减轻细胞内脂毒性, 增强细胞的活性.
中医学中并无脂肪肝这一病名, 根据其形态特点属于"肝着"、"肝胀"、"肝积"一类, 根据其临床表现, 可将其归属于"胁痛"、"痞满"等范畴, 根据其病因病机则可命名为"痰浊"、"瘀血", 若有饮酒史, 还可根据病情发展归为"伤酒"、"酒瘀"等[6]. 武汉市第一医院张介眉教授在积累了长期的临床实践经验, 并进行了大量的理论研究之后, 在总结古今医家经验的基础上, 提出了"阳气不通"致病理论, 用"通阳"法治疗脂质代谢异常收到明显的效果, 为脂肪肝的防治提供了很好的研究思路. 以中医"阳气不通"理论指导下, 临床上运用通阳中药葱白制剂防治脂肪肝, 取得满意疗效. 前期研究表明[7], 葱白提取物对NAFLD模型大鼠具有降低TG、胆固醇, 改善肝脏活性氮的作用. 本研究结果显示, 鲜葱白提取物能显著抑制细胞内含量, 细胞内脂滴明显减少. 说明葱白提取物显著抑制了细胞内沉积, 明显改善细胞脂肪变性.
NF-κB是与氧化应激、细胞因子相关的真核细胞转录因子, 可调控多种促炎因子基因的表达, 作用十分广泛, 我们推测在其在NAFLD发病中发挥着重要作用. TNF-α和氧应激等细胞因子通过激活NF-κB抑制蛋白(inhibition NK-κB, IκB)激酶β(IκB kinase β, IKKβ)使IκB降解, 从而活化NF-κB和IKKβ-TNFα循环的自身增强, 促进胰岛素受体底物(insulin receptor substrate, IRS)、磷脂酰肌醇-3激酶信号障碍和慢性氧应激等损害[8-10]. 在我们室验中, 我们发现: 模型组中NF-κB表达增强, 伴TNF-α水平的增高. 在药物作用组中, 葱白提取物干预后的脂肪变性细胞脂肪沉积减轻, NF-κB表达及TNF-α水平也随着降低. 实验中我们还发现, 肝癌细胞NF-κB的基础表达较高, 而文献报道的正常细胞NF-κB 的基础表达活性较低[11,12]. 提示肝癌细胞的非正常生长可能与NF-κB信号通路的异常有关, 这有待进一步研究.
由此, 我们得出抑制NF-κB表达及TNF-α活化是葱白提取物防治脂肪肝和脂肪性肝炎的重要机制之一, 能够抑制游离脂肪酸的脂毒性, 从而抗肝细胞脂肪变性和改善细胞能量代谢障碍, 显著减轻机体内脂质过氧化损伤以及细胞因子损伤的程度, 保护肝细胞, 对脂肪肝具有良好的防治作用.
近年来, 随着我国饮食结构和生活习惯的改变, NAFLD的患病率呈现日渐增高的趋势, 成为仅次于慢性病毒性肝炎的第2大肝病, 其对人体健康的危害也越来越多. 因此, 有效地预防及治疗NAFLD具有重大意义.
黄恒青, 主任医师, 福建省第二人民医院消化内科
Day等提出的以脂代谢异常、细胞因子、氧应激以及脂质过氧化为特色的"二次打击"学说已被大多数学者所接受.
本课题通过体外实验, 揭示细胞能量代谢障碍与"阳气不通"的关系, 阐明葱白提取物抗NAFLD的通阳作用机制, 体现了中草药在防治脂肪肝上的优势.
本研究证实葱白提取物可通过抑制NF-κB表达降低其活性及TNF-α分泌来保护肝脏, 有助于进一步明确其作用范围, 推广其在临床上的应用.
本文方法新颖, 结论明确, 为治疗脂肪变性肝细胞提供了新的思路.
编辑 曹丽鸥 电编 李薇
| 1. | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-1395. [PubMed] [DOI] |
| 2. | Chitturi S, Farrell GC, George J. Non-alcoholic steatohepatitis in the Asia-Pacific region: future shock? J Gastroenterol Hepatol. 2004;19:368-374. [PubMed] [DOI] |
| 4. | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-1395. |
| 5. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 8. | Medina J, Fernández-Salazar LI, García-Buey L, Moreno-Otero R. Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis. Diabetes Care. 2004;27:2057-2066. [PubMed] [DOI] |
| 9. | Ribeiro PS, Cortez-Pinto H, Solá S, Castro RE, Ramalho RM, Baptista A, Moura MC, Camilo ME, Rodrigues CM. Hepatocyte apoptosis, expression of death receptors, and activation of NF-kappaB in the liver of nonalcoholic and alcoholic steatohepatitis patients. Am J Gastroenterol. 2004;99:1708-1717. [PubMed] [DOI] |
| 10. | Crespo J, Cayón A, Fernández-Gil P, Hernández-Guerra M, Mayorga M, Domínguez-Díez A, Fernández-Escalante JC, Pons-Romero F. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients. Hepatology. 2001;34:1158-1163. [PubMed] [DOI] |
| 11. | Perkins ND. The Rel/NF-kappa B family: friend and foe. Trends Biochem Sci. 2000;25:434-440. [PubMed] [DOI] |
| 12. | Mayo MW, Baldwin AS. The transcription factor NF-kappaB: control of oncogenesis and cancer therapy resistance. Biochim Biophys Acta. 2000;1470:M55-M62. [PubMed] |