修回日期: 2010-09-22
接受日期: 2010-09-27
在线出版日期: 2010-11-18
目的: 探讨结肠蛋白酶激活受体(PAR-2)活化与结肠黏膜低度炎症时小鼠内脏感觉过敏的关系.
方法: 36只C57B/6小鼠随机分为2组. A组(对照组), 18只, 给予无菌蒸馏水自由饮用; 慢性低度炎症(LGI)组(S组), 18只, 1.5%葡聚糖硫酸钠(DSS)溶液自由饮用5 d, 续以无菌蒸馏水10 d. 第15天时观察病理学改变、测定腹壁肌电、免疫组织化学染色腰膨大部(L6-S1)脊髓背角SP、CGRP表达和结肠组织PAR-2表达.
结果: 第15天时, S组(LGI组)结肠黏膜炎症评分为1.500±0.926. 结肠内压力为15 mmHg时, S组的腹壁肌电幅值与A组比较无统计学意义(27.958 μV±1.660 μV vs 26.947 μV±0.854 μV, P>0.05). 当结肠内压力为30、45、60 mmHg时, S组的腹壁肌电幅值均高于A组(33.455 μV±3.786 μV vs 31.253 μV±3.842 μV; 46.848 μV±4.038 μV vs 37.267 μV±2.542 μV; 47.207 μV±18.151 μV vs 33.798 μV±8.415 μV, 均P<0.05). S组结肠PAR-2和脊髓背角之SP、CGRP IA值均高于A组(40.769±8.422 vs 21.718±4.131; 30.288±13.530 vs 10.788±4.490; 46.829±26.261 vs 13.997±3.340, 均P<0.05); PAR-2的IA值与SP、CGRP IA值之间都有正相关关系(r = 0.622, P<0.05; r = 0.588, P<0.05); SP、CGRP、PAR-2 IA值与腹壁肌电幅值也都呈正相关(r = 0.439-0.835, P<0.05).
结论: 结肠黏膜低度炎症可增加小鼠结肠的内脏敏感性, 与结肠PAR-2的活化有关.
引文著录: 刘玮, 王承党. 结肠黏膜低度炎症对小鼠结肠PAR-2活化和内脏感觉过敏的诱发作用. 世界华人消化杂志 2010; 18(32): 3413-3419
Revised: September 22, 2010
Accepted: September 27, 2010
Published online: November 18, 2010
AIM: To detect the expression of protease-activated receptor-2 (PAR-2) in the colon and substance P (SP) and calcitonin gene-related peptide (CGRP) in the cornu dorsale medullae spinalis and to explore the relationship between the activation of PAR-2 and visceral hypersensitivity in mice with dextran sulfate sodium (DSS)-induced low-glade colonic mucosal inflammation (LGI).
METHODS: Thirty-six C57BL/6 mice were randomly divided into two groups: LGI group and control group. The LGI group was given 1.5% DSS solution for 5 d and distilled water for another 10 d, while the control group was given distilled water only. After treatment, the myoelectric activity of the abdominal wall at different levels of colorectal distension (CRD) was recorded. The expression of SP and CGRP in the cornu dorsale medullae spinalis and PAR-2 in the colonic mucosa was detected by immunohistochemistry.
RESULTS: After treatment, colonic histological index (HI) in the LGI group was 1.500 ± 0.926. When the colon was distended to a pressure of 15 mmHg, the myoelectric activity of the abdominal wall in the LGI group was comparable to that in the control group (27.958 μV ± 1.660 μV vs 26.947 μV ± 0.854 μV, P > 0.05). However, the myoelectric activity of the abdominal wall was significantly higher in the LGI group than in the control group when the colon was distended to a pressure of 30, 45 or 60 mmHg (33.455 μV ± 3.786 μV vs 31.253 μV ± 3.842 μV; 46.848 μV ± 4.038 μV vs 37.267 μV ± 2.542 μV; 47.207 μV ± 18.151 μV vs 33.798 μV ± 8.415 μV, all P < 0.05). The integrated optical density (IA) of PAR-2 staining in the distal colon was significantly higher in the LGI group than in the control group. The IA of SP and CGRP staining in the spine cord was also significantly higher in the LGI group than in the control group (40.769 ± 8.422 vs 21.718 ± 4.131; 30.288 ± 13.530 vs 10.788 ± 4.490; 46.829 ± 26.261 vs 13.997 ± 3.340, all P < 0.05). There is a positive correlation between the expression of PAR-2 and SP and between the expression of PAR-2 and CGRP in the LGI group (r = 0.622, P < 0.05, r = 0.588, P < 0.05). The expression of PAR-2, SP or CGRP was closely correlated with the myoelectric activity of the abdominal wall in the LGI group (r = 0.439-0.835, P < 0.05).
CONCLUSION: Low-grade mucosal inflammation induces visceral hypersensitivity in mice possibly by activating colonic PAR-2.
- Citation: Liu W, Wang CD. Low-grade mucosal inflammation induces colonic PAR-2 activation and visceral hypersensitivity in mice. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3413-3419
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3413.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3413
近年来研究[1]表明肠道感染或炎症(即使存在短暂性的轻微炎症)都可能是肠易激综合征(irritable bowel syndrome, IBS)内脏高敏感性的潜在激发因素[2]. 蛋白酶激活受体(protease-activated receptors, PARs)家族是一种跨膜受体7次的G蛋白耦联受体. PAR-2的激活在内脏高敏感性的发生中扮演着一个重要的角色. 大量的研究表明肠道内持续存在的炎症是使外周神经末梢致敏的重要原因[3]. 肥大细胞活化后脱颗粒自分泌类胰蛋白酶(tryptase)剪切激活神经细胞或炎症细胞上的PAR-2, 导致疼痛介质[5-HT、P物质(substance P, SP)、降钙素基因相关蛋白(calcitonin gene-related peptide, CGRP)等]从初级传入神经纤维末梢或炎症细胞等释放, 可直接作用于初级传入纤维, 或是间接经由肥大细胞, 启动活化和致敏机制的级联效应, 使附近的伤害性感受器产生继发性的过敏并产生广泛促炎效应, 破坏结肠黏膜屏障完整性, 肠黏膜对肠腔内细菌及各种蛋白酶通透性增加, 导致结肠炎症持续加重. 从目前文献资料推理, 结肠黏膜低度炎症可能通过PARs系统介导引起内脏感觉敏感, 那么如果减少或者消除这种炎症是否可以使敏感的内脏感觉恢复正常呢?因此, 本课题立足于研究肠道低度炎症时内脏敏感性的变化, 从而研究结肠黏膜低度炎症时是否通过PAR-2系统介导影响机体的内脏感觉功能, 为IBS的研究和治疗提供新的方向.
健康C57B/6小鼠, ♂, 清洁级, 体质量18-22 g, 共36只, 购于上海斯莱克实验动物中心, 混合配方饲料喂养, 自由进食饮水, 每日更换饮水、饲料, 定期更换垫料, 保持小鼠生活环境通风及清洁卫生. 葡聚糖硫酸钠(dextran sulfate sodium, DSS)为美国MP Biomedicals公司产品; 浓缩型兔抗小鼠SP多克隆抗体购自武汉博士德生物工程有限公司产品; 浓缩型兔抗小鼠CGRP多克隆抗体购自北京博奥森生物工程有限公司; 浓缩型山羊抗大鼠PAR-2多克隆抗体为美国Santa cruz公司产品; 二步法免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司. 生理信号记录仪(RM6240)为成都仪器厂出品.
1.2.1 造模及分组: 实验动物的建模参照张艳丽等[4]和Kim等[5]的方法: 小鼠通过饮用3% DSS溶液5 d+蒸馏水10 d 1个循环可以诱导出慢性结肠炎症, 此时肠炎症状消失, 动物进食及体质量恢复. 由于种属差异, 本实验让C57B/6大鼠自由饮用1.5% DSS溶液5 d+蒸馏水10 d建立慢性低度结肠炎症模型. 将36只随机分为2个组: A组(对照组, n = 18): 不予DSS溶液饮用, 给予蒸馏水自由饮用. 慢性低度炎症(low-grade inflammation, IGL)组(S组, n = 18): 予1.5% DSS溶液自由饮用5 d+蒸馏水饮用10 d.
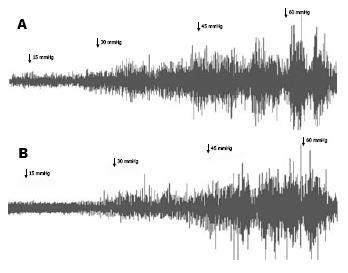
1.2.2 结肠扩张实验: 按照Kruschewski等[6]的方法并略作改进, 每组小鼠在实验结束后(第15天)分别进行腹壁肌电的检测. 电生理记录仪参数设置: 采集频率: 2 kHz, 扫描速度: 200 ms/div, 灵敏度: 200 μV, 时间常数: 0.001 s, 滤波频率: 3 kHz. 分别取15、30、45、60 mmHg的结肠扩张压力下10个腹壁放电幅值, 取其平均值, 然后再减去基础值, 即各个压力下腹壁放电幅值.
1.2.3 结肠和脊髓组织标本的处理: 结肠扩张实验结束后, 处死小鼠, 取腰膨大部(L6-S1)脊髓浸入40 g/L中性甲醛固定, 依次乙醇脱水, 二甲苯透明, 石蜡包埋, 切成4 μm厚度切片, SP和CGRP表达分别采用非生物素二步法进行免疫组织化学染色. 距肛门0.5 cm(称远端结肠DC)取结肠组织1 cm×0.5 cm, 以40 g/L甲醛固定, 石蜡包埋, 切片, HE染色, 并采用非生物素二步法免疫组织化学染色了解PAR-2表达情况(羊抗鼠PAR-2抗体工作浓度为1∶200). 结肠组织切片经HE染色后, 在高倍镜下观察(×400)并根据Kruschewski法进行组织学指数(histological index, HI)评分[6,19], HI 0分时为无炎症, 1-4分为轻度炎症, 5-8分为中度炎症; 9-12分为重度炎症. 每个组织块选取3张免疫组织化学切片, 每张切片随机选取3个视野, 采用IPP6.0图像分析系统测定所选图像的积分吸光度值(IA)进行计算, 3个视野IA的平均值为该组织块的IA.
统计学处理 所有实验数据用mean±SD表示, 结肠扩张实验的结果和内脏感觉神经递质的检测结果采用组间两两比较的方差分析进行处理. 同一参数各组间运用t检验, 不同参数间运用直线相关分析, 具体统计方法采用SPSS17.0医学统计软件计算. 设α= 0.05, P<0.05表示有显著差异.
本实验36只小鼠在建模的过程中均无死亡. S组小鼠在第3天出现进食减少, 第5天均出现体质量下降, 排稀便, 第5天停止饮用DSS改为饮用蒸馏水后, 小鼠进食恢复, 仍有部分小鼠排稀便. 第12天所有小鼠排便性状均恢复正常, 体质量有所增加. A组小鼠在整个过程中无进食减少、未排稀便、血便, 体质量有增加.
S组HI评分为1.500±0.926, A组HI评分为0.255±0.744, 二者差异有统计学意义(P = 0.005), 根据Kruschewski法则[6], S组的结肠黏膜炎症属于低度炎症模型.
各组数据经Levene方差齐性检验, 满足方差齐性要求, 组间比较采用LSD-t法进行比较分析: 当结肠扩张压力为15 mmHg时, 二组间腹壁肌电幅值的差异无统计学意义(P = 0.929); 结肠内压力为30、45、60 mmHg时, S组的腹壁肌电幅值均高于A组(均P = 0.000, 表1, 图1).
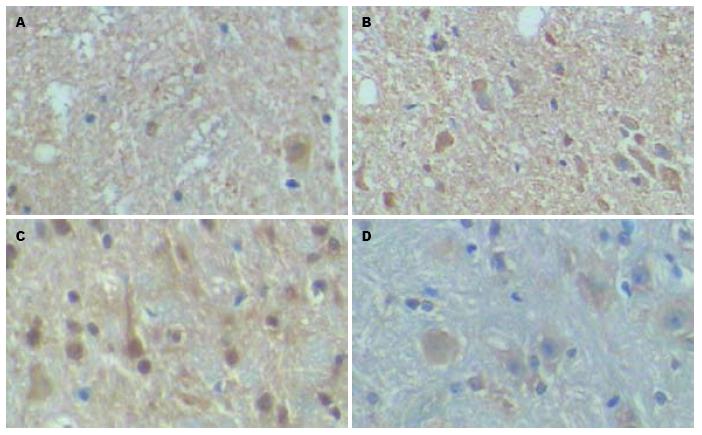
SP阳性神经纤维集中分布于脊髓的背角浅层, 呈棕黄色颗粒或细丝状, 呈对称分布. CGRP表达于脊髓背角浅层, 呈深褐色, 为胞质内致密均匀分布, 体积较大的神经元细胞(Φ>50 μm)染色较深, 体积较小的神经元细胞染色浅或不染色(图2). S组SP和CGRP的平均IA与A组的差异均有统计学意义(P = 0.000; P = 0.001, 表2).
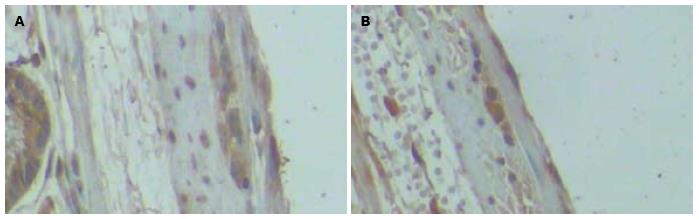
PAR-2表达于结肠肌间神经丛, 呈深褐色(图3), S组的PAR-2阳性细胞数较密集, IA值为40.769±8.422, 而A组为21.718±4.131, 二组间的差异有统计学意义(P = 0.000).
S组结肠肌间神经丛PAR-2阳性表达的IA值与脊髓背角SP、CGRP阳性表达的IA值之间呈正相关关系(PAR-2与CGRP: r = 0.622, P = 0.006; PAR-2与CGRP: r = 0.588, P = 0.014).
直肠内压力为30、45、60 mmHg时, PAR-2阳性表达的IA值与腹壁肌电幅值之间正相关(r = 0.622, P = 0.006; r = 0.550, P = 0.017; r =0.835, P = 0.000).
在本研究中, S组与A组病理评分比较有统计学差异(P<0.05), 且S组病理评分在低度炎症范围内, 说明肠道低度炎症造模是成功的. 腹外斜肌放电测量法评价内脏痛觉敏化是比较公认的[7]. 本研究结果显示: (1)结肠黏膜低度炎症可以使小鼠内脏感觉过敏; (2)结肠黏膜低度炎症可以使结肠肌间神经丛PAR-2表达上调, 这种变化与反应感觉敏化的指标SP、CGRP表达上调之间呈正相关关系. 因此, 结肠黏膜低度炎症通过诱发PAR-2活化可能在内脏感觉过敏中起一定的作用.
国内外研究表明, 肠道即使存在短暂性的低度炎症都可能是IBS内脏高敏感性的潜在激发因素[2]. IBS患者通常在某种肠道感染恢复后或黏膜炎症反应消失后仍有异常的肠道感觉及运动功能持续存在[8], 故而采用化学刺激物诱导结肠炎症来模拟上述临床特征是成熟可行的. 借鉴张艳丽等[4]和Kim等[5]的方法, 本研究显示采用1.5% DSS自由饮用5 d+自由饮用蒸馏水10 d后, S组小鼠结肠炎症评分为1.5分, 符合低度炎症标准, 故1.5% DSS自由饮用5 d+自由饮用蒸馏水10 d后制作出结肠黏膜低度炎症的小鼠模型, 且这种低度炎症可以导致小鼠内脏感觉过敏. DSS诱导的结肠炎症受浓度依赖, 个体差异小, 易于控制, 急性炎症期后有一稳定的慢性缓解过程, 能较好模拟慢性持续的轻微炎症, 所以本实验采用DSS建立小鼠结肠低度炎症模型是合适可行的.
肠道低度炎症是使外周神经末梢致敏的重要原因, 并被认为是IBS的发病机制, 致敏的肠道表现为疼痛阈值下降, 甚至正常生理状态下不引起痛觉的刺激也能诱发疼痛, 即所谓痛觉过敏. Al-Chaer等[9]认为正常的成年大鼠, 46 mmHg的扩张压力可作为区分非伤害性刺激与伤害性刺激的临界值, 也就是说在相对于正常成年大鼠的非伤害性刺激可引起低度炎症组大鼠的强烈反应. 由于动物种属不同, 本研究中发现, 在15 mmHg时S组腹外斜肌的放电幅值与对照组无明显差异, 我们推测在球囊压力为15 mmHg时还未达到S组小鼠的疼痛阈值, 故与A组相比无明显差别. 而在球囊压力为30 mmHg起, S组腹外斜肌的放电幅值较A组明显升高, 表现出较A组更高的敏感性. 而与本研究结果相似, 国外也有许多学者研究发现乙酸诱导的结肠炎大鼠[10]、曾经感染过巴西钩虫或旋毛形线虫的啮鼠类动物[11,12]都存在肠道动力改变和内脏敏感性增加, 这些变化类似于IBS患者的病理生理学变化, 均表明结肠炎症时机体内脏敏感性增加.
本实验中, S组小鼠脊髓SP、CGRP表达和结肠肌间神经丛上的PAR-2的表达均较A组显著增多. 两者之间存在明显相关性, 这表明PAR-2的表达增多可以引起脊髓背角神经元释放SP、CGRP增加, 可造成脊髓背角的兴奋性增高. S组结肠肌间神经丛PAR-2阳性表达的IA值与脊髓SP、CGRP阳性表达的IA值之间密切相关, 球囊压力为30、45、60 mmHg时, S组结肠肌间神经丛PAR-2阳性表达的IA值及S组脊髓CGRP、SP阳性表达的IA值均与腹壁肌电幅值之间密切相关, 上述结论表明: 结肠黏膜慢性炎症时肌间神经丛上PAR-2表达增多, 引起脊髓痛觉神经递质(SP、CGRP)释放增加, 从而引起内脏过敏表现为腹外斜肌的放电幅值增加. 因此我们推测PAR-2有可能是治疗内脏感觉异常的重要靶点.
PAR-2是肥大细胞分泌的类胰蛋白酶作用的一种G蛋白耦联受体, 类胰蛋白酶于肥大细胞脱颗粒时释放至细胞外, 能够激活多种组织及细胞的PAR-2, 结肠内广泛存在PAR-2阳性的神经元, 人工合成的PAR-2激动剂(SLIGRL-NH2)能剂量依赖性引起持久的整个神经细胞去极[13]. 这说明PAR-2的激活在内脏高敏感性的发生中扮演着一个重要的角色. 临床研究发现腹泻型IBS患者升结肠肥大细胞数量和类胰蛋白酶水平增加, 而且与IBS的症状有关[14], 把这些患者结肠活检组织培养上清液灌入小鼠结肠中可导致小鼠内脏感觉过敏[15]. 国外研究[16]也发现这类患者结肠活检组织培养上清液中的类胰蛋白酶可以刺激背根神经节神经元的钙信号释放, 将其注入小鼠脚掌, 可致其躯体感觉过敏, 而这种促伤害感受效应可被丝氨酸蛋白酶抑制剂和PAR-2拮抗剂所阻断, 提示IBS患者结肠黏膜释放的各种介质和蛋白酶可通过活化PAR-2使PAR-2阳性的神经元去极化, 导致内脏感觉过敏.
PAR-2通过细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)转导途径和激活腺苷环化酶, 引起钾通道的关闭、膜去极化, 继而开放电压敏感性钙通道. 随着Ca2+内流的增加, 继而激发其他在胃肠道运动和感觉方面起重要作用的神经递质如CGRP、SP和乙酰胆碱等的释放, 从而影响胃肠道动力及内脏感觉[13,16]. 另外, cAMP诱导的细胞内Ca2+水平的降低也可使胃肠道和血管松弛. PAR-2激活时可减少时相性收缩, 增加推进性运动, 缩短肠通过时间, 降低内脏痛阈.
IBS患者存在脊髓背角神经致敏主要表现为: (1)感觉刺激-反应曲线左移, 即较小的刺激即产生明显的感觉; (2)对刺激的高敏感性, 即对感觉刺激产生过度反应; (3)内脏-躯体牵涉痛的异常放大. 上述研究结果提示: 通过药物控制脊髓背角感觉神经元的痛觉处理过程可能会减少脊髓致敏的发生, 为IBS的治疗提供新方法.
SP[17,18]是脊髓水平传递伤害性信息的重要兴奋性神经递质. 而辣椒素敏感的神经纤维中80% CGRP免疫反应阳性, 这些神经元接受无髓鞘感觉神经纤维的投射, 是在外周感觉传入神经中与SP共存的一种神经肽, 除可以直接产生伤害性作用外, 还可能通过促进SP释放、抑制SP降解、延长SP的作用时间而参与炎症诱导的内脏伤害性感觉[19]. Bueno等[20]发现, SP升高的水平与炎症引起的腹痛程度密切相关, 在肠炎过程中和肠炎后, SP在引起背角神经元敏感性增高中起重要作用. 从本实验结果看, 内脏高敏感时小鼠脊髓后角SP、CGRP表达上调, 参与了内脏刺激信号的传入过程, 放大了外周疼痛刺激, 致使小鼠痛阈降低, 表现为腹外斜肌放电幅值增加.
PAR-2是神经免疫链条中的一个重要环节, 通过活化局部免疫细胞和神经末梢的PAR-2, 可把刺激的免疫反应信息传达到神经系统, 并可接受神经系统的调控, 对靶器官引起更进一步的免疫反应[3]. 国外研究[21]表明在小鼠中, 给予5 μg的SLIGRL-NH2肠腔内灌注就可以增加肠腔的渗透性, 而其余药物引起黏膜炎症所需的剂量为其十倍. 但是, 当传入神经完整时和γ-干扰素被用来引起黏膜髓过氧化物酶的增加时, 只有ML-7(一种肌球蛋白轻链激酶的选择性抑制剂)可以阻断低剂量SLIGRL-NH2引起的渗透性反应. 研究[22]发现预先给予全身性的辣椒素化和SP拮抗剂可以缩短炎症抗原诱导的持续性结肠运动功能改变的维持时间. 这表明SP和辣椒素敏感神经纤维在炎症抗原引起的结肠运动紊乱中扮演了重要角色. 因为肠肌间神经元的活化恰好出现在经辣椒素预处理后, 这似乎表明肠肌间神经元的PAR-2表达仅仅只是中枢神经系统介导的肌间神经元的活化反射的结果, 这就需要进一步研究肠肌间神经丛在肠道敏感中的作用. 综上所述, 结肠黏膜低度炎症可以增强胃肠道的内脏敏感性. 肠道肌间神经丛上的PAR-2表达增加可造成脊髓背角的兴奋性增高, 其在脊髓水平上表现为多种兴奋性神经递质, 尤其是传递痛觉信号的递质如(SP、CGRP)的表达增强. 但是增加的PAR-2如何导致内脏高敏感性、PAR-2的抑制剂是否能够降低内脏感觉过敏等还需要进一步深入研究, 这些研究可以为开发新的IBS治疗药物提供理论依据.
已经明确内脏感觉过敏、肠动力紊乱在IBS的发生中起重要作用, 但动力紊乱和内脏感觉过敏的机制还不清楚. 既往的研究发现IBS患者肠道黏膜存在低度炎症, 但这种炎症是怎样引起内脏感觉过敏还需要进一步研究.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化科
Bueno等发现, SP升高的水平与炎症引起的腹痛程度密切相关, 在肠炎过程中和肠炎后, SP在引起背角神经元敏感性增高中起重要作用.
本研究提示化学诱导的结肠黏膜低度炎症, 可以通过活化PAR-2受体, 引起内脏感觉过敏, 这为探讨IBS的发病机制提供了研究资料.
结肠黏膜低度炎症可以导致内脏感觉过敏, 在临床处置IBS患者时, 需要考虑这种因素的作用.
结肠黏膜低度炎症是指结肠黏膜中存在慢性炎症细胞, 但没有明显的腺体结构改变或破坏, 也无明显的增生性改变.
本文设计合理, 为IBS的研究和治疗提供了可能的新方向.
编辑 李军亮 电编 李薇
| 1. | Barbara G, De Giorgio R, Stanghellini V, Cremon C, Salvioli B, Corinaldesi R. New pathophysiological mechanisms in irritable bowel syndrome. Aliment Pharmacol Ther. 2004;20 Suppl 2:1-9. [PubMed] [DOI] |
| 2. | Adam B, Liebregts T, Gschossmann JM, Krippner C, Scholl F, Ruwe M, Holtmann G. Severity of mucosal inflammation as a predictor for alterations of visceral sensory function in a rat model. Pain. 2006;123:179-186. [PubMed] |
| 3. | Bueno L. Protease activated receptor 2: a new target for IBS treatment. Eur Rev Med Pharmacol Sci. 2008;12 Suppl 1:95-102. [PubMed] |
| 5. | Kim TW, Seo JN, Suh YH, Park HJ, Kim JH, Kim JY, Oh KI. Involvement of lymphocytes in dextran sulfate sodium-induced experimental colitis. World J Gastroenterol. 2006;12:302-305. [PubMed] |
| 6. | Kruschewski M, Foitzik T, Perez-Cantó A, Hübotter A, Buhr HJ. Changes of colonic mucosal microcirculation and histology in two colitis models: an experimental study using intravital microscopy and a new histological scoring system. Dig Dis Sci. 2001;46:2336-2343. [PubMed] [DOI] |
| 7. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 8. | Park H. [The pathophysiology of irritable bowel syndrome: inflammation and motor disorder]. Korean J Gastroenterol. 2006;47:101-110. [PubMed] |
| 9. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] [DOI] |
| 10. | La JH, Kim TW, Sung TS, Kang JW, Kim HJ, Yang IS. Visceral hypersensitivity and altered colonic motility after subsidence of inflammation in a rat model of colitis. World J Gastroenterol. 2003;9:2791-2795. [PubMed] |
| 11. | Gay J, Fioramonti J, Garcia-Villar R, Buéno L. Alterations of intestinal motor responses to various stimuli after Nippostrongylus brasiliensis infection in rats: role of mast cells. Neurogastroenterol Motil. 2000;12:207-214. [PubMed] [DOI] |
| 12. | Barbara G, Vallance BA, Collins SM. Persistent intestinal neuromuscular dysfunction after acute nematode infection in mice. Gastroenterology. 1997;113:1224-1232. [PubMed] [DOI] |
| 13. | Kayssi A, Amadesi S, Bautista F, Bunnett NW, Vanner S. Mechanisms of protease-activated receptor 2-evoked hyperexcitability of nociceptive neurons innervating the mouse colon. J Physiol. 2007;580:977-991. [PubMed] [DOI] |
| 16. | Cenac N, Andrews CN, Holzhausen M, Chapman K, Cottrell G, Andrade-Gordon P, Steinhoff M, Barbara G, Beck P, Bunnett NW. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest. 2007;117:636-647. [PubMed] [DOI] |
| 17. | Ohtori S, Takahashi K, Ino H, Chiba T, Yamagata M, Sameda H, Moriya H. Up-regulation of substance P and NMDA receptor mRNA in dorsal horn and preganglionic sympathetic neurons during adjuvant-induced noxious stimulation in rats. Ann Anat. 2002;184:71-76. [PubMed] [DOI] |
| 18. | Khasabov SG, Rogers SD, Ghilardi JR, Peters CM, Mantyh PW, Simone DA. Spinal neurons that possess the substance P receptor are required for the development of central sensitization. J Neurosci. 2002;22:9086-9098. [PubMed] |
| 19. | Robinson DR, McNaughton PA, Evans ML, Hicks GA. Characterization of the primary spinal afferent innervation of the mouse colon using retrograde labelling. Neurogastroenterol Motil. 2004;16:113-124. [PubMed] [DOI] |
| 20. | Bueno L, Fioramonti J. Effects of inflammatory mediators on gut sensitivity. Can J Gastroenterol. 1999;13 Suppl A:42A-46A. [PubMed] |
| 21. | Cenac N, Chin AC, Garcia-Villar R, Salvador-Cartier C, Ferrier L, Vergnolle N, Buret AG, Fioramonti J, Bueno L. PAR2 activation alters colonic paracellular permeability in mice via IFN-gamma-dependent and -independent pathways. J Physiol. 2004;558:913-925. [PubMed] [DOI] |
| 22. | Miampamba M, Tan DT, Oliver MR, Sharkey KA, Scott RB. Intestinal anaphylaxis induces Fos immunoreactivity in myenteric plexus of rat small intestine. Am J Physiol. 1997;272:G181-G189. [PubMed] |