修回日期: 2010-09-11
接受日期: 2010-09-25
在线出版日期: 2010-11-18
目的: 研究冬凌草甲素(Oridonin)对人胰腺癌SW1990细胞增殖的抑制作用并探究其可能的机制.
方法: 以不同浓度的冬凌草甲素作用于体外培养的SW1990细胞, MTT法检测细胞生长抑制率, 双重免疫荧光染色后激光共聚集显微镜观察细胞的形态学变化, 流式细胞仪检测细胞凋亡率.
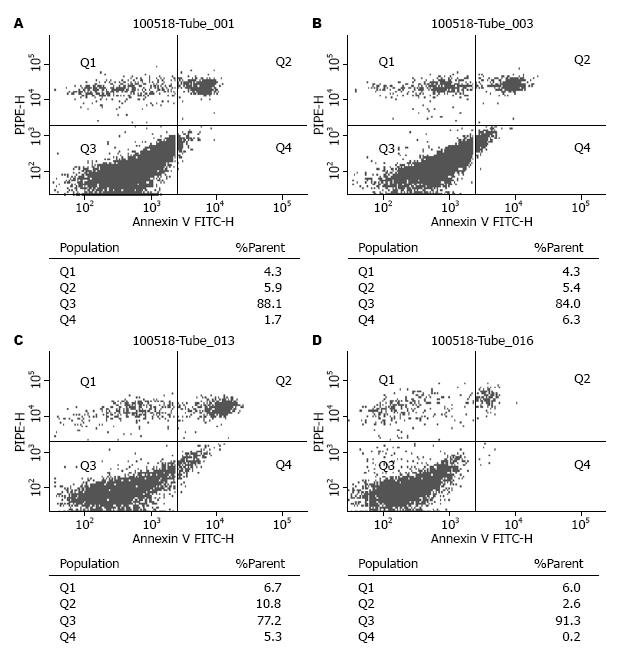
结果: 冬凌草甲素对人胰腺癌SW1990细胞具有明显增殖抑制作用. 给药组细胞核DAPI染色可见典型的凋亡形态学改变, 细胞质骨架蛋白β-肌动蛋白荧光染色增强, 尤其是细胞中央近细胞核处荧光染色明显增强. 12.5, 25.0, 50.0 μmol/L给药组早期凋亡率显著高于未给药组(2.17%±0.57%, 5.83%±0.57%, 4.43%±0.78% vs 0.30%±0.17%, 均P<0.05), 晚期凋亡和坏死细胞的百分率也显著高于未给药组(5.10%±0.98%, 7.03%±1.52%, 10.13%±0.70% vs 2.63%±0.06%, 均P<0.05).
结论: 冬凌草甲素可抑制胰腺癌SW1990细胞增殖, 促进肿瘤细胞凋亡, 其作用机制可能是药物干预后引起了β-肌动蛋白聚合/解聚状态的改变.
引文著录: 刘军楼, 汪悦, 徐力, 杨继兵, 孙志岭, 邓海山, 徐建亚. 冬凌草甲素对人胰腺癌细胞增殖的抑制作用及其机制. 世界华人消化杂志 2010; 18(32): 3407-3412
Revised: September 11, 2010
Accepted: September 25, 2010
Published online: November 18, 2010
AIM: To investigate whether oridonin has antiproliferation effects against human pancreatic carcinoma SW1990 cells and to explore possible mechanisms involved.
METHODS: SW1990 cells were treated with different concentrations of oridonin. Cell proliferation was measured by MTT assay. Cell morphological changes were observed by laser confocal microscopy after double immunofluorescence staining. Cell apoptosis was detected by flow cytometry (FCM).
RESULTS: Treatment with oridonin significantly inhibited the growth of SW1990 cells. After treatment with oridonin, apoptosis-related morphological changes, such as condensation of chromatin and nuclear fragmentation, were observed in SW1990 cells. The fluorescence intensity of β-actin in the cytoplasm was increased, especially in the perinuclear area. The early apoptotic rates of SW1990 cells treated with 12.5, 25.0 and 50.0 µmol/L oridonin were significantly higher than those of control cells (2.17% ± 0.57%, 5.83% ± 0.57%, 4.43% ± 0.78% vs 0.30% ± 0.17%, all P < 0.05). The late apoptotic and cell necrosis rates were also significantly higher in oridonin-treated cells than in control cells (5.10% ± 0.98%, 7.03% ± 1.52%, 10.13% ± 0. 70% vs 2.63% ± 0.06%, all P < 0.05).
CONCLUSION: Oridonin can significantly inhibit proliferation and induce apoptosis of SW1990 cells perhaps by altering β-actin depolymerization/polymerization.
- Citation: Liu JL, Wang Y, Xu L, Yang JB, Sun ZL, Deng HS, Xu JY. Oridonin suppresses the proliferation of human pancreatic carcinoma SW1990 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3407-3412
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3407.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3407
冬凌草系唇形科香茶菜属植物, 学名碎米亚, 在我国分布广泛. 通常取其干燥地上部分入药, 味苦甘、性微寒, 具有清热解毒、消炎止痛、健胃活血及抗肿瘤等作用. 冬凌草主要的化学成分为贝壳杉烯类的二菇, 包括冬凌草甲素、乙素、丙素、丁素、戊素等, 其中最重要的抗癌有效成分确定为冬凌草甲素(Oridonin). 研究表明, Oridonin对食管癌、肝癌、结肠癌、胃癌、宫颈癌、肺癌、鼻咽癌、白血病、人黑色素瘤、纤维肉瘤等具有一定的疗效[1-6]. 关于Oridonin治疗胰腺癌的实验研究, 少有文献报道, 新近研究提示其对人胰腺癌细胞株有生长抑制作用[7]. 本文研究Oridonin对人胰腺癌SW1990细胞增殖抑制作用并探究其可能机制, 为其进一步应用于临床治疗胰腺癌提供有力的实验依据.
Oridonin购自南京泽朗医药科技有限公司(纯度≥98%); 人胰腺癌SW1990细胞株为上海长海医院消化内科实验中心惠赠. SW1990细胞用含100 mL/L胎牛血清的DMEM培养基培养于25 mL塑料培养瓶中, 37 ℃, 50 mL/L CO2培养箱常规培养. Oridonin用1 mL DMSO溶解后加入三蒸水9 mL, 配制成含10% DMSO浓度为100 mmol/L的母液, -4 ℃保存, 应用时加培养基稀释成目标浓度(DMSO终浓度≤0.01%时, 无明显细胞毒作用). DMEM培养基(Gibco), MTT、DMSO(Sigma), DAPI试剂盒、抗β-肌动蛋白(β-actin)小鼠单克隆抗体、Alexa Fluor 488标记山羊抗小鼠IgG(H+L)的二抗、Annexin V-FITC 细胞凋亡检测试剂盒(碧云天公司), 小牛血清(PAA laboratories).
1.2.1 细胞生长抑制率的测定: 采用噻唑蓝(MTT)还原法进行检测. 取对数生长期的SW1990细胞, 调整细胞浓度为1×105/mL, 将细胞悬液接种于无菌96孔细胞培养板中, 每孔100 μL, 培养12 h细胞完全贴壁后弃上清分别加入含3.125、6.250、12.500、25.000、50.000、100.000 μmol/L Oridonin的DMEM培养基100 μL, 每种浓度均设6个平行孔; 对照组加入不含药物的培养液100 μL. 将培养板置于37 ℃, 饱和湿度, 50 mL/L CO2孵箱中常规培养至12, 24, 36, 48 h后, 于终止培养前4 h, 各孔均加入5 g/L MTT溶液20 μL, 继续培养4 h后弃上清, 各孔加入DMSO 150 μL, 振荡器上振荡5-10 min溶解蓝色结晶, 待孔内结晶完全溶解并色素均匀后以酶标仪于490 nm处读取各孔吸光度值(A490), 计算细胞生长抑制率与IC50. 细胞生长抑制率(%) = [对照组A值-实验组A值]/对照组A值×100%. 实验重复3次.
1.2.2 双重染色法后激光共聚集显微镜观察细胞的形态学变化: 本实验采用β-actin抗体免疫荧光染色法观察细胞质细胞骨架蛋白变化, DAPI染色法观察细胞核凋亡变化. 具体操作步骤为: (1)细胞爬片: 洁净的盖玻片消毒灭菌后放置到6孔板内, 取对数生长期细胞, 调整细胞浓度为2×108/L接种于6孔板中, 每孔2 mL, 培养12 h细胞完全贴壁后弃上清分别加入含12.5、25.0、50.0 μmol/L Oridonin的DMEM培养基2 mL, 培养24 h后弃上清; (2)固定: 用PBS分3次取代6孔板中的培液后, 移除PBS, 培养细胞爬片在4 ℃预冷的 4%多聚甲醛中固定30 min, 常温下PBS漂洗3遍, 每次5 min; (3)封闭: 加入免疫染色封闭液, 培养板放入湿盒, 4 ℃冰箱封闭60 min; (4)β-actin一抗孵育: 按照1∶100比例用免疫染色一抗稀释液稀释Actin抗体, 吸尽封闭液, 立即加入稀释好的一抗, 4 ℃冰箱孵育过夜后常温下PBS漂洗3次, 每次5 min; (5)二抗孵育: 按照1∶100比例用免疫荧光染色二抗稀释液稀释Alexa Fluor 488标记山羊抗小鼠IgG(H+L)的二抗, 吸尽PBS液, 立即加入稀释好的二抗, 4 ℃冰箱中孵育1 h后, 常温下PBS漂洗3次, 每次5 min; (6)DAPI染色: 加入DAPI染色稀释液, 室温染色3-5min, PBS漂洗3次, 每次5 min; (7)从培养板中取出盖玻片, 立即倒置于载玻片上方, 荧光封片剂封片, 室温放置1-2 h待封片剂凝固, 于激光共聚焦显微镜上观察并摄影.
1.2.3 流式细胞仪检测细胞凋亡: 用Annexin V-FITC细胞凋亡检测试剂盒. 取对数生长期细胞, 调整细胞浓度为2×108/L接种于6孔板中, 每孔2 mL, 培养12 h细胞完全贴壁后弃上清分别加入含12.5、25.0、50.0 μmol/L Oridonin的DMEM培养基2 mL, 培养24 h后弃上清. PBS洗涤贴壁细胞1次, 用胰酶细胞消化液(含有EDTA)消化细胞, 加入2 mL的DMEM培养基, 吹打细胞后转移到离心管内, 1 000 r/min离心5 min, 弃上清, 收集细胞, 用PBS轻轻重悬细胞并计数. 取5-10×104重悬的细胞, 1 000 r/min离心5 min, 弃上清, 加入195 μL Annexin V-FITC结合液轻轻重悬细胞. 加入5 μL Annexin V-FITC, 轻轻混匀. 室温(20 ℃-25 ℃)避光孵育10 min. 1 000 r/min离心5 min, 弃上清, 加入190 μL Annexin V-FITC结合液轻轻重悬细胞. 加入10 μL碘化丙啶染色液, 轻轻混匀, 冰浴避光放置. 随即进行流式细胞仪检测.统计学处理 统计分析应用SPSS16.0版统计软件, 实验数据mean±SD表示, 计量资料用方差分析两两比较组间差异性, 计算P值. 检验水准: α = 0.05.
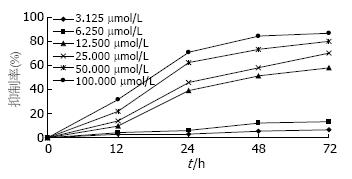
3.125 μmol/L、6.250 μmol/L的Oridonin对细胞的生长无明显的抑制作用, Oridonin处理后细胞增殖抑制率随给药浓度增加和作用时间延长而逐渐增加, 呈明显的时间-剂量依赖关系. 其中12.5、25.0、50.0 μmol/L的药物作用24 h的抑制率分别为38.9%、45.9%、62.1%, 24 h Oridonin作用的IC50值为35.43 μmol/L(图1).
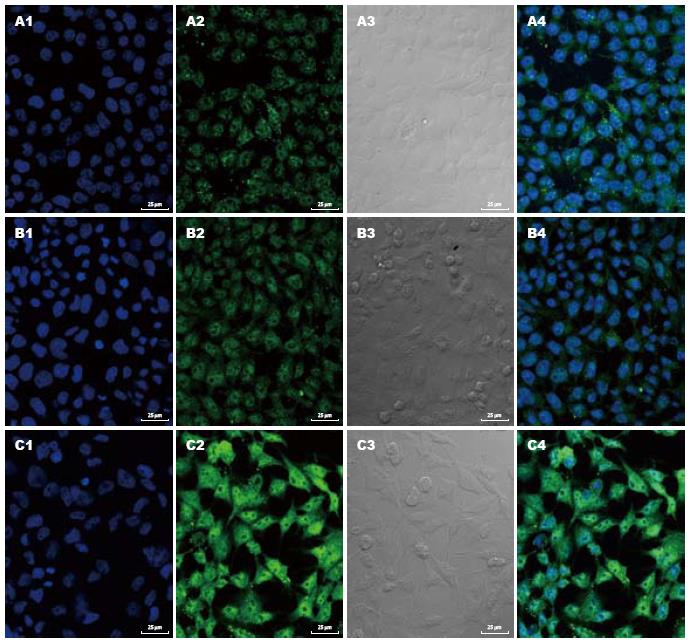
对细胞爬片进行扫描, 每次摄影形成DAPI染色细胞核图、β-actin抗体免疫荧光染色细胞质图、光学显微镜细胞分布图以及双重染色合成图. DAPI染色细胞核图显示, 对照组细胞核较大, 核大小及染色均匀, 染色较浅(图2A1); 给药组随浓度升高细胞数量减少, 部分细胞核体积变小, 荧光染色增强, 细胞出现典型的凋亡改变, 凋亡细胞主要表现为细胞核浓缩及细胞核碎裂等典型改变(图2B1, 2C1). β-actin抗体免疫荧光染色细胞质图显示, 对照组细胞质β-actin荧光染色分布均匀(图2A2); 给药组细胞质荧光染色增强(图2B2), 尤其是细胞中央近细胞核处荧光染色明显增强(图2C2). 经上述染色处理后, 光学显微镜细胞分布图显示, 对照组细胞呈椭圆形、梭形贴壁生长(图2A3), 经不同浓度Oridonin处理的实验组细胞生长受到不同程度的抑制, 随着浓度升高细胞数量减少(图2C3); 部分细胞形态逐渐变圆, 细胞体积缩小, 呈小类圆形细胞, 细胞内颗粒状物质增多, 另可见部分坏死崩解细胞(图2B3, 2C3). 双重染色合成图显示, 细胞核发出蓝色荧光, 细胞质发出绿色荧光, 结果与上述一致(图2A4, B4, C4).
胰腺癌是一病情凶险、治愈率低、预后极差的消化系恶性肿瘤. 近年来发病率有升高的趋势, 在美国已成为消化系肿瘤致死原因的第2位[8]. 世界范围的综合资料显示, 胰腺癌的5年生存率仅为5.0%或更低, 是预后最差的肿瘤. 目前胰腺癌治疗方法有手术治疗和非手术治疗. 根治性手术是最有效的治疗方法, 然而80%-85%的胰腺癌病例确诊时已届中晚期[9], 无法切除. 非手术治疗包括化疗、放疗、生物治疗、物理治疗、营养支持治疗、中医药治疗等. 现今中晚期胰腺癌主要以非手术治疗为主, 由于中医药治疗肿瘤不良反应低且疗效显著, 在防治胰腺癌有较大的潜力与优势, 正日益受到国内外医学界的关注[10].
本实验选择SW1900细胞株, 应用多种方法观察中草药Oridonin对肿瘤细胞的影响. MTT结果显示Oridonin处理细胞后抑制率随给药浓度增加和作用时间延长而逐渐增加, 呈明显的时间-剂量依赖关系, 这与文献报道一致[7]. 本实验光学显微镜细胞分布图进一步证实, 经不同浓度Oridonin处理的实验组细胞生长受到不同程度的抑制, 随着浓度升高细胞数量减少; 部分细胞呈小类圆形细胞, 另可见部分坏死崩解细胞. DAPI染色细胞核图显示给药组随浓度升高细胞数量减少, 细胞出现典型的凋亡改变. 流式细胞仪检测结果显示不同浓度组早期凋亡、晚期凋亡和坏死细胞、死亡细胞总数的百分率, 均高于对照组. 上述结果说明Oridonin可诱导细胞凋亡发生, 其抑制肿瘤细胞增殖作用可能与诱导肿瘤细胞凋亡有关.
细胞骨架是细胞内蛋白质成分组成的网络结构, 包括微管、微丝和中间纤维. 微丝是3种骨架结构中最细的, 主要由肌动蛋白(actin)组成, 以游离球状肌动蛋白(G-actin)或聚合纤维状肌动蛋白(F-actin)形式存在, 正常细胞微丝聚合/解聚的动态变化和平衡是细胞运动、附着、细胞分裂周期的重要调控因素[11-13]. 研究表明, G-actin和F-actin平衡状态的改变, 与肿瘤发生密切相关[14]. 关于actin改变与细胞癌变之间的关系, 研究认为可能是由于微丝的组装和分布发生了变化, 使微丝不能够和质膜相连, 不能受细胞的正常调控, 进而导致细胞生长与增殖的失控[13,15-18]. Rao等[19]表明actin聚合/解聚状态的改变, 即actin骨架重组, 对恶性肿瘤细胞的形态和表型有非常重要的调节作用, 认为干预细胞骨架微丝actin重组可作为抗癌药物的作用靶点, 也可作为研发新的抗肿瘤药物的依据. 进一步研究表明, 通过改变actin的聚合/解聚状态可以起到治疗肿瘤的作用[20-23].
关于Oridonin作用于细胞骨架蛋白actin的研究, 尚未见文献报道. 真核细胞骨架蛋白actin至少分为6种: 两个横纹肌型(α-心肌型, α-骨骼肌型), 两个平滑肌型(α-血管平滑肌型, γ-内脏平滑肌型)和两个细胞质型(β和γ亚型). β-actin为6种actin中的一种, 属于非肌肉细胞骨架actin. 本实验通过β-actin抗体免疫荧光染色法观察Oridonin对肿瘤细胞骨架蛋白影响, 激光共聚集显微镜观察发现细胞质发绿色荧光, 对照组胞质β-actin荧光染色分布均匀, 给药组胞质荧光染色增强, 提示药物干预后引起了β-actin聚合/解聚状态的改变, 可能是F-actin增加, 导致了细胞质荧光染色增强. 本实验同时发现细胞中央近细胞核处荧光染色明显增强, 可能是药物干预使微丝actin的分布发生了变化.
目前, 作用于细胞骨架蛋白actin的抗肿瘤药物, 按作用机制特点, 大致分为两类, 第1类是促进肌丝蛋白解聚并使肌丝蛋白处于不稳定状态, 以长春花生物碱类为代表. 第2类是促进肌丝蛋白聚合并稳定肌丝蛋白, 以紫杉醇为代表. 尽管作用机制不同, 但最终都可以抑制肿瘤细胞增殖和促进肿瘤细胞凋亡[12,21,24]. 细胞凋亡又称为程序性死亡, 是由基因控制的细胞自我消亡过程, 在多种组织中对于控制细胞的数量起到关键性的作用[25]. 诱导肿瘤细胞凋亡治疗逐渐成为国际肿瘤研究的一个热点. β-actin是主要的微丝组成成分, 研究已明确显示微丝结构的动态变化能调控细胞凋亡[13,26-29]. 本实验研究提示Oridonin引起了β-actin聚合/解聚状态的改变, 可能是F-actin增加, 导致肿瘤细胞增殖受到抑制. 本实验β-actin聚合/解聚状态的改变, 必然导致微丝结构的变化, 这可能是药物诱导肿瘤细胞凋亡的机制之一. 本实验结果也说明Oridonin是属于上述作用于细胞骨架的抗肿瘤药物中的第2类药物. 本实验没有进一步运用分子生物学技术检测细胞中G-actin和F-actin含量和比例, 这也是本研究不足之处, 故F-actin增加有待实验进一步证实.
总之, Oridonin可抑制胰腺癌SW1990细胞增殖, 促进肿瘤细胞凋亡, 其作用机制可能是药物干预后引起了β-actin聚合/解聚状态的改变. 我们研究结果提示, Oridonin作为一种有良好活性的抗胰腺癌中药制剂, 具有很好的临床应用和开发价值, 但其抗癌作用机制有待进一步深入研究.
感谢尚文斌、刘佳及赵娟在本实验中给予的大力帮助.
胰腺癌是一病情凶险、治愈率低、预后极差的消化系恶性肿瘤, 近年来发病率有升高的趋势. 目前中晚期胰腺癌主要以非手术治疗为主, 由于中医药治疗肿瘤毒不良反应低且疗效显著, 在防治胰腺癌有较大的潜力与优势, 日益受到国内外医学界的关注.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
细胞凋亡又称为程序性死亡, 是由基因控制的细胞自我消亡过程, 在多种组织中对于控制细胞的数量起到关键性的作用. 诱导肿瘤细胞凋亡治疗逐渐成为国际肿瘤研究的一个热点.
宋芳等2010年发现冬凌草甲素对人胰腺癌SW1990细胞有生长抑制作用, 认为冬凌草甲素通过诱导凋亡和G2/M期周期阻滞来抑制人胰腺癌SW1990细胞生长, 其分子机制可能与Survivin和P21调节的信号途径有关.
本研究采用双重免疫荧光染色法检测人胰腺癌细胞的形态学变化, 通过激光共聚集显微镜观察细胞核和细胞质骨架蛋白β-actin形态学变化, 首次探讨了冬凌草甲素对细胞骨架蛋白的影响.
本研究探讨了冬凌草甲素对细胞质细胞骨架蛋白β-actin和细胞核的影响, 显示该药是一种有良好活性的抗胰腺癌中药制剂, 为其进一步应用于临床治疗胰腺癌提供有力的实验依据.
本文设计合理, 方法得当, 结果可靠, 为进一步研究冬凌草甲素对胰腺癌的临床治疗打下了基础.
编辑 曹丽鸥 电编 何基才
| 1. | Kang N, Zhang JH, Qiu F, Chen S, Tashiro S, Onodera S, Ikejima T. Induction of G(2)/M phase arrest and apoptosis by oridonin in human laryngeal carcinoma cells. J Nat Prod. 2010;73:1058-1063. [PubMed] [DOI] |
| 2. | Cheng Y, Qiu F, Ye YC, Tashiro S, Onodera S, Ikejima T. Oridonin induces G2/M arrest and apoptosis via activating ERK-p53 apoptotic pathway and inhibiting PTK-Ras-Raf-JNK survival pathway in murine fibrosarcoma L929 cells. Arch Biochem Biophys. 2009;490:70-75. [PubMed] [DOI] |
| 3. | Zhang Y, Wu Y, Tashiro S, Onodera S, Ikejima T. Involvement of PKC signal pathways in oridonin-induced autophagy in HeLa cells: a protective mechanism against apoptosis. Biochem Biophys Res Commun. 2009;378:273-278. [PubMed] [DOI] |
| 4. | Zhu Y, Xie L, Chen G, Wang H, Zhang R. Effects of oridonin on proliferation of HT29 human colon carcinoma cell lines both in vitro and in vivo in mice. Pharmazie. 2007;62:439-444. [PubMed] |
| 5. | Zhou GB, Kang H, Wang L, Gao L, Liu P, Xie J, Zhang FX, Weng XQ, Shen ZX, Chen J. Oridonin, a diterpenoid extracted from medicinal herbs, targets AML1-ETO fusion protein and shows potent antitumor activity with low adverse effects on t(8; 21) leukemia in vitro and in vivo. Blood. 2007;109:3441-3450. [PubMed] [DOI] |
| 6. | Huang J, Wu L, Tashiro S, Onodera S, Ikejima T. Reactive oxygen species mediate oridonin-induced HepG2 apoptosis through p53, MAPK, and mitochondrial signaling pathways. J Pharmacol Sci. 2008;107:370-379. [PubMed] [DOI] |
| 8. | Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J Cancer. 2001;37 Suppl 8:S4-66. [PubMed] [DOI] |
| 9. | Sohn TA, Yeo CJ, Cameron JL, Koniaris L, Kaushal S, Abrams RA, Sauter PK, Coleman J, Hruban RH, Lillemoe KD. Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg. 2000;4:567-579. [PubMed] [DOI] |
| 10. | 孙 韬, 左 明焕. 胰腺癌的中医研究进展. 北京中医药大学学报(中医临床版). 2009;16:44-46. |
| 11. | Fridman R, Scott AF, Muller D, Reich R, Penno MB. The role of cell adhesion and migration in the in vitro invasiveness of mouse adrenal carcinoma cells. Invasion Metastasis. 1990;10:208-224. [PubMed] |
| 12. | Orr GA, Verdier-Pinard P, McDaid H, Horwitz SB. Mechanisms of Taxol resistance related to microtubules. Oncogene. 2003;22:7280-7295. [PubMed] [DOI] |
| 13. | Papakonstanti EA, Stournaras C. Cell responses regulated by early reorganization of actin cytoskeleton. FEBS Lett. 2008;582:2120-2127. [PubMed] [DOI] |
| 14. | Ruan W, Lai M. Actin, a reliable marker of internal control? Clin Chim Acta. 2007;385:1-5. [PubMed] [DOI] |
| 15. | Oshima RG. Intermediate filaments: a historical perspective. Exp Cell Res. 2007;313:1981-1994. [PubMed] [DOI] |
| 16. | Helfman DM, Flynn P, Khan P, Saeed A. Tropomyosin as a regulator of cancer cell transformation. Adv Exp Med Biol. 2008;644:124-131. [PubMed] [DOI] |
| 17. | Lindberg U, Karlsson R, Lassing I, Schutt CE, Höglund AS. The microfilament system and malignancy. Semin Cancer Biol. 2008;18:2-11. [PubMed] [DOI] |
| 18. | Samarakoon R, Goppelt-Struebe M, Higgins PJ. Linking cell structure to gene regulation: signaling events and expression controls on the model genes PAI-1 and CTGF. Cell Signal. 2010;22:1413-1419. [PubMed] [DOI] |
| 19. | Rao J, Li N. Microfilament actin remodeling as a potential target for cancer drug development. Curr Cancer Drug Targets. 2004;4:345-354. [PubMed] [DOI] |
| 20. | Jordan MA, Horwitz SB, Lobert S, Correia JJ. Exploring the mechanisms of action of the novel microtubule inhibitor vinflunine. Semin Oncol. 2008;35:S6-S12. [PubMed] [DOI] |
| 21. | Shi J, Orth JD, Mitchison T. Cell type variation in responses to antimitotic drugs that target microtubules and kinesin-5. Cancer Res. 2008;68:3269-3276. [PubMed] [DOI] |
| 22. | Ke H, Parron VI, Reece J, Zhang JY, Akiyama SK, French JE. BCL2 inhibits cell adhesion, spreading, and motility by enhancing actin polymerization. Cell Res. 2010;20:458-469. [PubMed] [DOI] |
| 23. | Liu T, Wu LY, Berkman CE. Prostate-specific membrane antigen-targeted photodynamic therapy induces rapid cytoskeletal disruption. Cancer Lett. 2010;296:106-112. [PubMed] [DOI] |
| 24. | Jordan MA, Wilson L. Microtubules and actin filaments: dynamic targets for cancer chemotherapy. Curr Opin Cell Biol. 1998;10:123-130. [PubMed] [DOI] |
| 25. | Zimmermann KC, Bonzon C, Green DR. The machinery of programmed cell death. Pharmacol Ther. 2001;92:57-70. [PubMed] [DOI] |
| 26. | Celeste Morley S, Sun GP, Bierer BE. Inhibition of actin polymerization enhances commitment to and execution of apoptosis induced by withdrawal of trophic support. J Cell Biochem. 2003;88:1066-1076. [PubMed] [DOI] |
| 27. | Wang H, Liu Y, Gao X, Carter CL, Liu ZR. The recombinant beta subunit of C-phycocyanin inhibits cell proliferation and induces apoptosis. Cancer Lett. 2007;247:150-158. [PubMed] [DOI] |
| 28. | Santra M, Santra S, Roberts C, Zhang RL, Chopp M. Doublecortin induces mitotic microtubule catastrophe and inhibits glioma cell invasion. J Neurochem. 2009;108:231-245. [PubMed] [DOI] |