修回日期: 2010-08-24
接受日期: 2010-09-07
在线出版日期: 2010-11-08
目的: 研究贵州世居少数民族-黔西、威宁彝族人群IL-10基因启动子区-819位点(IL10-819)和趋化因子受体5(chemokine receptor 5, CCR5)基因启动子区-59029位点(CCR5-59029)与HBV易感性的相关性.
方法: 对研究人群采用序列特异性引物-聚合酶链式反应(PCR-SSP)方法分析IL-10基因启动子区-819位点多态性和限制性片段长度多态性-聚合酶链式反应(PCR-RFLP)方法分析CCR5基因启动子区-59029位点.
结果: IL10-819基因型频率在贵州黔西彝族感染组与非感染组中的分布差异有统计学意义(P<0.05), 在贵州威宁彝族感染组与非感染组中的分布差异无统计学意义; CCR5-59029基因威宁彝族感染组与非感染组中的分布差异有统计学意义(P<0.05), 在贵州黔西彝族感染组与非感染组中的分布差异无统计学意义.
结论: IL10-819基因和CCR5-59029基因多态性与彝族乙肝感染情况可能存在相关性, IL10-819基因和CCR5-59029基因多态性可能是乙肝易感性的因素之一.
引文著录: 单可人, 王婵娟, 谭奎, 何燕, 张婷, 李毅, 赵艳, 吴昌学, 齐晓岚, 官志忠. 贵州黔西威宁彝族人群HBV感染与IL10-819及CCR5-59029多态性的相关性. 世界华人消化杂志 2010; 18(31): 3372-3377
Revised: August 24, 2010
Accepted: September 7, 2010
Published online: November 8, 2010
AIM: To investigate the distribution of chemokine receptor 5 gene 59029A/G (CCR5-59029) and interleukin 10 819 T/C (IL10-819) polymorphisms in two Yi minority populations in Guizhou Province, China, and to analyze their association with HBV infection.
METHODS: Blood samples were taken from 105 and 108 Yi ethic individuals in Qianxi and Weining, respectively. The CCR5-59029 polymorphism was genotyped by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP), while the IL10-819 polymorphism was genotyped by polymerase chain reaction-sequence-specific primer (PCR-SSP). DNA sequencing was performed to verify the above results.
RESULTS: The genotype frequency of IL10-819 polymorphism differed significantly between HBV-infected subjects and non-infected ones in the Qianxi Yi minority population (P < 0.05), but showed no statistical difference in the Weining Yi minority population (P > 0.05). In contrast, the genotype frequency of CCR5-59029 differed significantly between HBV-infected subjects and non-infected ones in the Weining Yi minority population (P < 0.05), but showed no statistical difference in the Qianxi Yi minority population (P > 0.05).
CONCLUSION: CCR5-59029 and IL10-819 polymorphisms are associated with susceptibility to HBV infection in the Yi minority population in Guizhou Province, China.
- Citation: Shan KR, Wang CJ, Tan K, He Y, Zhang T, Li Y, Zhao Y, Wu CX, Qi XL, Guan ZZ. Association of CCR5-59029 and IL10-819 polymorphisms with HBV infection in two Yi minority populations in Guizhou Province, China. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3372-3377
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3372.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3372
乙型肝炎病毒(hepatitis B virus, HBV)感染呈世界性流行, 估计全球有3.5亿慢性HBV感染者[1]. 中国是乙型肝炎的高流行区, 2005年中国≥3岁人群HBsAg阳性率为9.09%[2], 其中25%以上的携带者将发展为慢性肝炎, 并可能进展为肝硬化和肝癌[3]. 骆抗先等[4]对我国7个民族HBV感染调查, 结果显示HBsAg具有较高的阳性率: 汉族为15.3%, 藏族26.2%, 瑶族24.0%, 黎族7.0%, 维族5.3%, 且HBV感染在这些民族中存在着差异性. 2007年北京市人群乙型肝炎血清流行病学研究中报道[5], 北京人群HBsAg标化阳性率已降至3.02%. 2008年卫生部公布全国人群乙型肝炎血清流行病学调查结果为全国1-59岁人群乙型肝炎表面抗原携带率为7.18%. 西部地区人群乙型肝炎表面抗原携带率高于东部地区, 西部5-59岁人群乙型肝炎表面抗原携带率最高, 达8.57%[6]. HBV感染, 其临床表现多样而复杂, 乙型肝炎患者的发病、发展、治疗及预后亦因人而异, 除了与病毒因素(病毒含量、基因型等)、环境因素(如暴露人群的整体卫生状况、疫苗接种状况等)有关, 还与宿主的遗传因素有关, 考虑其疾病、宿主基因与环境因素三者间关系的复杂性, 并且涉及到遗传异质性、多基因相互作用等特征[7,8]. 随着人类基因组计划的完成, 遗传因素[9]逐渐成为慢性乙型肝炎致病机制研究的一个热点, 遗传因素在乙型肝炎发生、发展和致病作用中的研究受到更大重视. 贵州是一个多民族省份, 少数民族人口众多, 构成了极其珍贵的遗传资源. 贵州少数民族形成了遗传学上相对隔离的人群. 选用这样相对封闭的隔离自然人群为研究对象, 可以最大限度地排除基因流(gene flow)现象对该人群等位基因频率、基因型频率的影响, 对多基因疾病研究具有独特的优势. 本研究采用序列特异性引物-聚合酶链式反应(polymerase chain reaction-sequence-specific primer, PCR-SSP)方法和限制性片段长度多态性-聚合酶链式反应(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)方法对贵州世居少数民族-威宁和黔西彝族人群进行与乙型肝炎病毒感染相关的CCR5基因启动子区-59029位点和IL-10基因启动子区-819位点的多态性分析研究.
在知情同意的原则基础上, 选取贵州省少数民族中较封闭的隔离自然人群-黔西彝族105例、威宁彝族108例. 所选的研究对象3代内无族外通婚、彼此间无直接血缘关系、性别, 年龄匹配、未有乙型肝炎疫苗接种史.
1.2.1 乙型肝炎血液学的检测、DNA提取、定量以及分组: 采取血样后, 离心后取血浆, 采用酶联免疫试验(ELISA)检测乙型肝炎血清学标志, 即表面抗原(HBsAg)、表面抗体(抗-HBs)、e抗原(HBeAg)、e抗体(抗-HBe)以及核心抗体(抗-HBc). 按照上海实业科华生物技术有限公司生产的试剂盒(批号20011112)说明进行操作, 美国Bio-tec ELX 800酶标仪判断结果.
1.2.2 样本分组: 由于样本人群无乙型肝炎疫苗接种史, 乙型肝炎血液学指标判断标准为: HBsAg阳性: 标本A值/阴性对照标本平均A值≥2.1; 抗-HBs阳性: 标本A值/阴性对照标本平均A值≥2.1; 抗-HBc阳性: 标本A值<COV(原倍血浆阴性对照标本平均A值×0.3), 并对其样本分组为阳性感染组和阴性非感染组.
1.2.3 选取样本: 根据乙型肝炎血液学检测结果, 选取样本并进行人基因组DNA的常规酚/氯仿抽提法提取.
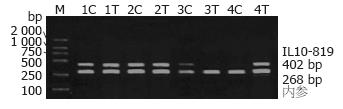
1.2.4 IL10-819位点的PCR-SSP分析: 采用PCR-SSP方法检测IL-10基因启动子区-819位点多态性. 根据GenBank报道的人类IL-10 DNA序列, 利用Primer Premier 5软件自行设计引物扩增IL10-819位点的两对引物序列以及内参照引物序列, 引物均由上海生工合成, 扩增产物片段的长度为402 bp. 内参照为人β-珠蛋白基因扩增片段, 长度为268 bp.
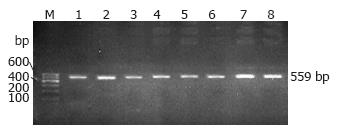
1.2.5 CCR5-59029位点的PCR-RFLP分析: 采用PCR-RFLP方法检测CCR5基因启动子区-59029位点多态性. 根据GenBank报道的人类CCR5 DNA序列, 利用Primer Premier 5软件自行设计扩增CCR5-59029位点的引物序列, 引物由上海生工合成, PCR扩增产物长度为559 bp.
1.2.6 PCR反应体系、循环条件及检测: IL10- 819位点: PCR反应体系总体积25 μL, 包含100 mmol/L Tris-HCl(pH8.3), 500 mmol/L KCL, 25 mmol/L MgCl2, 2.5 mol/L dNTPs, 10 μmol/L上下游引物, 10 μmol/L上下游内对照引物, 100 ng模板DNA, 1 U Taq DNA聚合酶(大连宝生物工程有限公司). PCR循环条件: 预变性94 ℃ 5 min, 94 ℃变性40 s, 63 ℃退火45 s, 72 ℃延伸1 min, 共35次循环, 终末延伸72 ℃ 7 min. 扩增产物用1.5%琼脂糖凝胶电泳检测.
1.2.7 CCR5-59029位点: PCR反应体系总体积25 μL, 包含10×PCR Buffer 2.5 μL, 25 mmol/L MgCl2 2.0 μL, 2.5 mol/L dNTPs 2.0 μL, 10.0 μmol/L上游和下游引物各0.5 μL, TaqDNA聚合酶(天根)(2.5 U/μL)0.4 μL, 模板DNA(100 μg/L)1 μL, 加水补足体积至25 μL. PCR循环条件: 预变性95 ℃ 5 min, 变性95 ℃ 30 s, 退火63.3 ℃ 30 s, 延伸72 ℃ 30 s, 循环30次, 终末延伸 72 ℃ 7 min. 扩增产物用1.5%琼脂糖凝胶电泳检测.
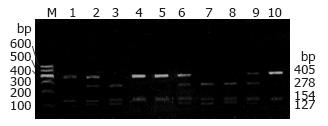
1.2.8 CCR5-59029位点酶切分析: 用限制性内切酶Bsp1286Ⅰ酶切PCR扩增产物的DNA片段, Bsp1286Ⅰ酶切识别位点: 5'...GGGCA↓C...3'; 3'...C↑CCGTG...5', 59029位点发生G→A, 使原来的限制性酶切位点消失, 这样电泳条带的数量和大小就会发生改变, 从而区分不同的基因型. Bsp1286Ⅰ酶切体系: 10×PCR Buffer 1 μL, 2.5 mmol/L BSA 0.4 μL, 模板DNA(100 μg/L)2 μL, Bsp1286Ⅰ(Promega)(10 U/μL)0.25 μL, 加高压灭菌ddH2O至10 μL, 经2.0%琼脂糖凝胶电泳, 在UVP凝胶成像仪上照相观察结果, 根据片段大小来区分不同的基因型.
统计学处理 使用SPSS14.0统计软件处理数据. 根据IL10-819位点的PCR-SSP结果和CCR5-59029位点的PCR-RFLP结果确定样本的基因型, 基因型频率和等位基因频率, 用直接计数法计算. 组间基因型频率和等位基因频率比较、基因型及等位基因频率与乙型肝炎易感性的关联性分析采用χ2检验, 定义P≤0.05时有统计学意义.
乙型肝炎血清学标志检测结果见表1, 贵州黔西彝族HBsAg阳性率为9.52%, HBV流行率42.86%, 威宁彝族HBsAg阳性率为20.37%, HBV流行率51.85%.
| 民族 | n | HBsAg | 抗-HBs | HBeAg | 抗-HBe | 抗-HBc | HBV流行率(%) |
| 黔西彝族 | 105 | 10(9.52) | 14(13.33) | 3(2.86) | 8(7.62) | 37(35.24) | 42.86 |
| 威宁彝族 | 108 | 22(20.37) | 18(16.67) | 2(1.85) | 9(8.33) | 34(31.48) | 51.85 |
IL10-819位点扩增产物片断的长度为402 bp, 内参照扩增产物片断长度为268 bp. 若样本基因型为野生型, -819位点为CC时, 引物1扩增, 在402 bp和268 bp处出现条带, 引物2不能扩增, 只在268 bp内对照处出现条带; 若样本基因型为纯合突变型, -819位点为TT时, 引物2扩增, 也在402 bp和268 bp处出现条带, 而引物1不能扩增, 只在268 bp处出现条带; 若样本基因型为杂合子CT时, 引物1与2均可扩增, 都在402 bp和268 bp处出现条带, 见图1.
2.3.1 CCR5-59029位点的PCR扩增结果: 经过PCR特异性扩增, 扩增产物长度559 bp(图2), 每例样本选择目的条带清晰的PCR产物进行酶切.
2.3.2 CCR5-59029的Bsp1286Ⅰ酶切结果: CCR5-59029扩增产物559 bp, 其片段中带有2个Bsp1286Ⅰ内切酶的酶切位点, 59029位点发生G→A, 片段中该酶切位点消失, 只有1个酶切位点发生酶切. 当为野生型GG时, 559 bp被酶切成278, 154, 127 bp; 当为突变型AA时, 559 bp被酶切成405 bp和154 bp; 当为杂合子GA时, 559 bp被酶切成405, 278, 154, 127 bp(图3).
根据乙型肝炎血液学标志检测结果将样本分为HBV阳性感染组和阴性非感染组两组, 比较两组IL10基因-819基因型和CCR5基因-59029基因型分布的差别. IL10基因-819等位基因频率和基因型频率在贵州黔西彝族人群感染组与非感染组中的分布有显著性差异(P<0.05); 贵州威宁彝族人群等位基因频率和基因型频率在感染组与非感染组中的分布无显著性差异(P>0.05, 表2). CCR5-59029等位基因频率在贵州威宁彝族人群感染组与非感染组中的分布有显著性差异(P<0.05); 黔西彝族等位基因频率和基因型频率在感染组与非感染组中的分布无显著性差异(P>0.05, 表3).
| 分组 | n | 基因型频率n(%) | 基因频率n(%) | |||
| TT | CT | CC | T | C | ||
| 威宁彝族 | 108 | 44(40.7) | 44(40.7) | 20(18.5) | 132(61.1) | 84(38.9) |
| HBV感染组 | 56 | 25(44.6) | 23(41.1) | 8(14.3) | 73(65.2) | 39(34.8) |
| HBV非感染组 | 52 | 19(36.5) | 21(40.4) | 12(23.1) | 59(56.7) | 45(43.3) |
| Sig. = 0.458, P>0.05 | Sig. = 0.203, P>0.05 | |||||
| 黔西彝族 | 105 | 47(44.8) | 52(49.5) | 6(5.7) | 146(69.5) | 64(30.5) |
| HBV感染组 | 45 | 13(28.9) | 28(62.2) | 4(8.9) | 54(60.0) | 36(40.0) |
| HBV非感染组 | 60 | 34(56.7) | 24(40.0) | 2(3.3) | 92(76.7) | 28(23.3) |
| Sig. = 0.014, P<0.05 | Sig. = 0.027, P<0.05 | |||||
| 分组 | n | 基因型频率n(%) | 基因频率n(%) | |||
| GG | GA | AA | G | A | ||
| 威宁彝族 | 105 | 25(23.81) | 42(40.00) | 38(36.19) | 92(43.81) | 118(56.19) |
| HBV感染组 | 45 | 11(24.44) | 17(37.78) | 17(37.78) | 39(43.33) | 51(56.67) |
| HBV非感染组 | 60 | 14(23.33) | 25(41.67) | 21(35.00) | 53(44.17) | 67(55.83) |
| χ2 = 0.165, Sig. = 0.921, P>0.05 | χ2 = 0.015, Sig. = 0.904, P>0.05 | |||||
| 黔西彝族 | 108 | 42(38.89) | 46(42.59) | 20(18.52) | 130(60.19) | 86(39.81) |
| HBV感染组 | 56 | 18(32.14) | 24(42.86) | 14(25.00) | 60(53.57) | 52(46.43) |
| HBV非感染组 | 52 | 24(46.15) | 22(42.31) | 6(11.54) | 70(67.31) | 34(32.69) |
| Sig. = 0.258, P>0.05 | Sig. = 0.039, P<0.05 | |||||
与HBV感染者有密切接触的高危人群感染HBV的机会不均一, 一部分人很容易被感染, 另一部分人虽长期与患者接触却未被感染. HBV感染者中有人很快发展到肝硬化、肝癌阶段, 而一些患者在感染后很多年未经治疗, 其仍维持在最初感染状态. 这与个体基因易感性和基因多态性以及免疫状态有密切关系.
越来越多的实验结果表明, HBV感染的肝脏病理改变是针对于这种病毒的肝内免疫反应的直接结果, 记忆和激活T淋巴细胞的浸润已成为HBV的炎症特征, 而趋化因子/趋化因子受体在T淋巴细胞游走中起重要作用. 蒲春文等[10]研究发现: 肝内CCR5阳性细胞在慢性肝炎中高度表达, 且其表达程度与炎症程度平行, 提示CCR5在HBV的病理损伤进展过程中起重要作用. Shieh等[11]发现CCR5-59029 A/A基因型的个体中CD4+ T淋巴细胞上表达更多的CCR5受体. 因此认为CCR5-59029 G/G基因型的作用是降低CCR5受体的功能, 而CCR5-59029 A/A基因型的作用是增加CCR5受体的表达. 而且研究发现CCR5 promoter 59029 G/G基因型个体可以通过降低CCR5的作用而减轻肝脏的炎症反应[12]. 由此我们可以推想CCR5-59029位点的基因多态性与细胞CCR5的表达有关, 而其表达程度又与肝炎的炎症程度平行, 这些证据提示我们CCR5-59029 G/G基因型可能是HBV感染的保护性基因型.
Chang等[13]对CCR5启动子基因多态性与HBV感染的相关性进行研究, 发现CCR5-59029 G等位基因型与HBV感染的自发清除显著相关, CCR5基因59029位点基因多态性可能在HBV感染的清除中起重要作用. 本研究显示, 威宁彝族CCR5基因-59029 G等位基因频率在非感染组中显著高于感染组, 这提示我们59029 G等位基因可能与HBV感染的清除有关, 这与Chang等的结果一致; 而黔西彝族等位基因频率和基因型频率在感染组与非感染组中的分布无显著性差异(P>0.05), 与Cheong等[14]的研究中显示CCR5-59029位点与HBV的感染没有相关性的结果一致.
IL-10是人体内重要的具有抗炎和免疫调节作用的细胞因子, IL-10基因的启动子区具有高度多态性, 有多个多态性位点, 与很多疾病相关. 已有研究[15,16]显示IL-10基因多态性能影响IL-10的转录、翻译和分泌过程, 与IL-10的分泌水平有关, 而IL-10在体内的分泌水平将直接影响机体对HBV的免疫反应, 进而影响其对乙型肝炎的易感性[15,17-18], 所以说IL-10基因多态性与HBV感染密切相关, 在抗病毒免疫中发挥着重要的作用, 直接影响其易感性和严重程度.
Miyazoe等[19]的研究发现, IL-10基因启动子区-819 T等位基因在慢性无症状乙型肝炎携带者中的频率显著高于慢性进展性肝病患者, 研究提示携带IL10-819 T基因的人群乙型肝炎病情发展较其他慢. 在本研究中, 结果显示IL10-819基因型频率在贵州黔西彝族感染组与非感染组之间分布差异有统计学意义, 黔西彝族非感染组IL10-819 TT基因型频率显著高于感染组, IL10-819 T等位基因频率在非感染组中显著高于感染组, 提示IL10-819 T突变基因可能在HBV感染中起到保护作用, 这与Miyazoe等的研究结果一致; 而贵州威宁彝族人群等位基因频率和基因型频率在感染组与非感染组中的分布无显著性差异(P>0.05).
特别有意义的是, 两个与HBV感染相关的基因在本研究中不同民族出现了不同的结果, 这可能与样本量、地域、种族及族群有一定关系. 在不同地域、种族、族群其基因多态性表现并不完全相同, 而HBV感染与机体许多基因有关, 许多作用机制还有待于进一步的证实和探索.
我国7个民族HBV感染调查, 结果显示HBsAg具有较高的阳性率: 汉族为15.3%, 藏族26.2%, 瑶族24.0%, 黎族7.0%, 维族5.3%, 且HBV感染在这些民族中存在着差异性.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
随着人类基因组计划的完成, 遗传因素逐渐成为慢性乙型肝炎致病机制研究的一个热点, 遗传因素在乙型肝炎发生、发展和致病作用中的研究受到更大重视.
Chang等对CCR5启动子基因多态性与HBV感染的相关性进行研究, 发现CCR5-59029 G等位基因型与HBV感染的自发清除显著相关, CCR5基因59029位点基因多态性可能在HBV感染的清除中起重要作用.
IL10-819基因和CCR5-59029基因多态性与彝族乙肝感染情况可能存在相关性, IL10-819基因和CCR5-59029基因多态性可能是乙肝易感性的因素之一.
本文选题较好, 对于揭示该地区少数民族乙型肝炎病毒感染的分子机制, 有重要的理论指导价值.
编辑 曹丽鸥 电编 何基才
| 1. | Alvarado Mora MV, Romano CM, Gomes-Gouvêa MS, Gutierrez MF, Carrilho FJ, Pinho JR. Molecular epidemiology and genetic diversity of hepatitis B virus genotype E in an isolated Afro-Colombian community. J Gen Virol. 2010;91:501-508. [PubMed] [DOI] |
| 2. | 梁 晓峰, 陈 园生, 王 晓军, 贺 雄, 陈 丽娟, 王 骏, 林 长缨, 白 呼群, 严 俊, 崔 钢. 中国3岁以上人群乙型肝炎血清流行病学研究. 中华流行病学杂志. 2005;26:655-658. |
| 6. | 吴 疆, 张 卫, 韩 莉莉, 林 长缨, 林 晖, 邢 玉兰, 高 培, 龚 晓红, 刘 立荣, 黄 芳. 北京市人群乙型肝炎血清流行病学研究. 中华流行病学杂志. 2007;28:555-557. |
| 9. | Chen DQ, Zeng Y, Zhou J, Yang L, Jiang S, Huang JD, Lu L, Zheng BJ. Association of candidate susceptible loci with chronic infection with hepatitis B virus in a Chinese population. J Med Virol. 2010;82:371-378. [PubMed] [DOI] |
| 11. | Shieh B, Liau YE, Hsieh PS, Yan YP, Wang ST, Li C. Influence of nucleotide polymorphisms in the CCR2 gene and the CCR5 promoter on the expression of cell surface CCR5 and CXCR4. Int Immunol. 2000;12:1311-1318. [PubMed] [DOI] |
| 13. | Chang HY, Ahn SH, Kim DY, Shin JS, Kim YS, Hong SP, Chung HJ, Kim SO, Yoo WD, Han KH. [Association between CCR5 promoter polymorphisms and hepatitis B virus infection]. Korean J Hepatol. 2005;11:116-124. [PubMed] |
| 14. | Cheong JY, Cho SW, Choi JY, Lee JA, Kim MH, Lee JE, Hahm KB, Kim JH. RANTES, MCP-1, CCR2, CCR5, CXCR1 and CXCR4 gene polymorphisms are not associated with the outcome of hepatitis B virus infection: results from a large scale single ethnic population. J Korean Med Sci. 2007;22:529-535. [PubMed] [DOI] |
| 15. | Truelove AL, Oleksyk TK, Shrestha S, Thio CL, Goedert JJ, Donfield SM, Kirk GD, Thomas DL, O'Brien SJ, Smith MW. Evaluation of IL10, IL19 and IL20 gene polymorphisms and chronic hepatitis B infection outcome. Int J Immunogenet. 2008;35:255-264. [PubMed] [DOI] |
| 16. | Xie HY, Wang WL, Yao MY, Yu SF, Feng XN, Jin J, Jiang ZJ, Wu LM, Zheng SS. Polymorphisms in cytokine genes and their association with acute rejection and recurrence of hepatitis B in Chinese liver transplant recipients. Arch Med Res. 2008;39:420-428. [PubMed] [DOI] |
| 17. | Yan Z, Tan W, Zhao W, Dan Y, Wang X, Mao Q, Wang Y, Deng G. Regulatory polymorphisms in the IL-10 gene promoter and HBV-related acute liver failure in the Chinese population. J Viral Hepat. 2009;16:775-783. [PubMed] [DOI] |
| 18. | Gao QJ, Liu DW, Zhang SY, Jia M, Wang LM, Wu LH, Wang SY, Tong LX. Polymorphisms of some cytokines and chronic hepatitis B and C virus infection. World J Gastroenterol. 2009;15:5610-5619. [PubMed] [DOI] |
| 19. | Miyazoe S, Hamasaki K, Nakata K, Kajiya Y, Kitajima K, Nakao K, Daikoku M, Yatsuhashi H, Koga M, Yano M. Influence of interleukin-10 gene promoter polymorphisms on disease progression in patients chronically infected with hepatitis B virus. Am J Gastroenterol. 2002;97:2086-2092. [PubMed] [DOI] |