修回日期: 2010-08-17
接受日期: 2010-08-24
在线出版日期: 2010-11-08
目的: 探讨VEGF过表达与中国胃癌患者临床病理特征间的关系及其临床意义.
方法: 收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 选择资料完整的胃腺癌病例775例进行研究, 采用EliVisionTM plus免疫组织化学染色方法检测775例胃癌标本VEGF蛋白的表达.
结果: 775例胃癌组织中VEGF阳性表达197例, 表达率为25.42%(197/775); VEGF蛋白表达与患者性别、年龄、肿瘤部位、TNM分期及组织类型、分化程度无相关性(均P>0.05); 而与浸润深度、淋巴结转移、远处转移相关(P<0.05); 经多因素分析, 浸润深度、淋巴结转移、远处转移均会影响VEGF的表达(P<0.05).
结论: VEGF检测可以作为评估胃癌生物学行为及预后的指标, 并为靶向治疗提供理论依据.
引文著录: 刘伟, 余英豪, 欧阳学农, 王烈, 武一曼, 陈娟, 熊喜生. VEGF在胃癌中的表达及其临床意义. 世界华人消化杂志 2010; 18(31): 3366-3371
Revised: August 17, 2010
Accepted: August 24, 2010
Published online: November 8, 2010
AIM: To investigate the correlation between the expression of vascular endothelial growth factor (VEGF) protein and clinicopathological characteristics of gastric cancer.
METHODS: The surgical specimens from 775 patients with gastric cancer who were treated at Fuzhou General Hospital of Nanjing Military Command of Chinese PLA were used in this study. VEGF protein expression in these specimens was examined by immunohistochemistry.
RESULTS: The rate of VEGF protein overexpression was 25.42% (197/775). VEGF protein overexpression was associated with depth of invasion, lymph node metastasis and distant metastasis (all P < 0.05), but not with sex, age, tumor site, TNM stage, histopathologic type and differentiation (all P > 0.05). Multivariate analysis demonstrated that depth of invasion, lymph node metastasis and distant metastasis were significant predictors of VEGF protein overexpression in gastric cancer (all P < 0.05).
CONCLUSION: Detection of VEGF protein expression may be used to assess the malignant biological behavior and prognosis of gastric cancer.
- Citation: Liu W, Yu YH, Ouyang XN, Wang L, Wu YM, Chen J, Xiong XS. Clinical significance of VEGF expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3366-3371
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3366.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3366
胃癌是最常见的恶性肿瘤之一, 居消化系肿瘤之首[1]. 大部分胃癌患者在诊断时已属晚期, 手术后辅以化疗, 治疗效果不明显. 影响胃癌预后最重要的因素就是肿瘤的侵袭及转移, 而血管生成在肿瘤的侵袭转移中发挥着重要作用. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是迄今发现的最重要的促血管生成因子, 其通过促进血管内皮细胞增殖、增加血管通透性, 在诱导肿瘤血管生成, 促进肿瘤细胞转移中起关键作用[2]. 目前, 国内尚未见大宗胃癌病例VEGF表达的报道, 本研究采用免疫组织化学方法检测775例胃癌病例组织中VEGF的表达, 探讨VEGF过表达与胃癌发生发展、浸润转移等临床病理特征及预后的关系, 以期为针对VEGF过表达胃癌的靶向治疗提供理论参考依据.
收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 选择资料完整的胃腺癌病例775例进行研究, 手术标本经10%中性甲醛固定, 石蜡包埋, 3 μm厚连续切片, 分别进行HE和免疫组织化学染色; 所有病例术前均未行放化疗. 患者中男576例, 女199例, 年龄27-85(平均58.2)岁. 胃癌TNM分期采用AJCC标准(2002). 组织分型采用Lauren分型标准, 分为肠型、弥漫型、混合型. 另外, 在775例胃腺癌病例中随机抽取100例癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜作为对照. 试剂均购自福州迈新生物技术开发公司, 一抗为鼠抗人单克隆抗体VEGF. 试剂盒选用EliVisionTM plus试剂盒. 石蜡切片机(LEICA RM2245)、显微镜(OLYMPUS BX51)、电热恒温干燥箱(上海-恒科技有限公司). 所有标记均设阳性对照并用PBS缓冲液代替一抗做阴性对照.
1.2.1 EliVisionTM plus免疫组织化学染色: 石蜡切片脱蜡、水化, PBS冲洗3×3 min; 高温高压抗原修复; 加3%过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3×3 min; 加第一抗体, 室温下孵育60 min; PBS冲洗3×5 min; 加聚合物增强剂, 室温下孵育20 min; PBS冲洗3×3 min; 再加酶标抗鼠聚合物, 室温下孵育30 min; PBS冲洗3×3 min; 加新配制的DAB显色液, 显微镜下观察3-10 min, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化; 自来水冲洗, PBS冲洗返蓝; 梯度酒精脱水干燥, 中性树脂封片.
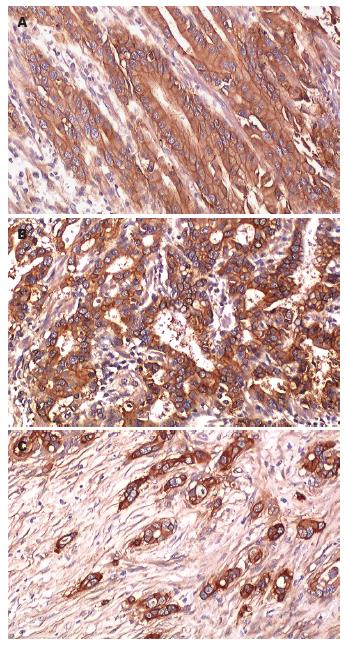
1.2.2 VEGF过表达分析: 阳性染色呈棕黄色颗粒, 定位于细胞质. 肿瘤细胞不着色/<10%的肿瘤细胞着色为阴性(-), ≥10%的肿瘤细胞着色为阳性[3,4], 并根据肿瘤阳性细胞数所占比例分为: 10%-25%(+), 26%-50%(++), 50%-75%(+++), >75%(++++).
统计学处理 采用SPSS16.0软件进行χ2检验分析. 通过多因素分析, 对各个因素之间的关系进行分析.
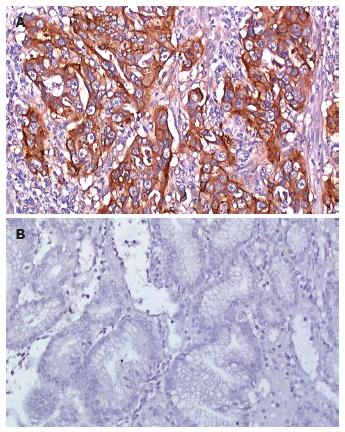
胃癌组织中VEGF阳性反应, 定位于细胞质, 其表达呈明显的异质性, 不同分化程度的癌组织均有表达(图1, 2A). 癌旁非肿瘤性胃黏膜未见VEGF的过表达(图2B).
775例胃癌组织中VEGF阳性表达197例, 表达率为25.42%. VEGF蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、组织类型及分化程度无相关性(P>0.05), 而与浸润深度、淋巴结转移及远处转移相关(P<0.05). 经多因素分析, 浸润深度、淋巴结转移及远处转移均会影响VEGF的表达(P<0.05, 表1).
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | VEGF阳性率n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 432 | 46 | 41 | 30 | 27 | 144(25.0) | >0.50 |
| 女 | 199 | 146 | 13 | 15 | 14 | 11 | 53(26.6) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 271 | 37 | 21 | 19 | 15 | 92(25.3) | >0.50 |
| ≥60 | 412 | 307 | 37 | 26 | 19 | 23 | 105(25.5) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部胃癌 | 324 | 237 | 25 | 26 | 17 | 19 | 87(26.9) | >0.10 |
| 胃部胃癌 | 451 | 341 | 32 | 30 | 28 | 20 | 110(24.4) | |
| 浸润深度 | ||||||||
| Tis | 2 | 2 | 0 | 0 | 0 | 0 | 0(0.0) | <0.05 |
| T1 | 51 | 46 | 1 | 3 | 1 | 0 | 5(9.8) | |
| T2 | 314 | 234 | 25 | 20 | 21 | 14 | 80(25.5) | |
| T3 | 385 | 283 | 29 | 31 | 19 | 23 | 102(26.5) | |
| T4 | 23 | 13 | 2 | 2 | 4 | 2 | 10(43.5) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 209 | 24 | 16 | 20 | 16 | 76(26.7) | >0.50 |
| 弥漫型 | 313 | 238 | 23 | 23 | 17 | 12 | 75(24.0) | |
| 混合型 | 177 | 131 | 14 | 13 | 9 | 10 | 46(26.0) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 344 | 38 | 25 | 28 | 26 | 117(25.4) | >0.50 |
| 低、未分化 | 314 | 234 | 25 | 24 | 17 | 14 | 80(25.5) | |
| TNM分期 | ||||||||
| 0、Ⅰ、Ⅱ | 351 | 264 | 27 | 20 | 23 | 17 | 87(24.8) | >0.50 |
| Ⅲ、Ⅳ | 424 | 314 | 31 | 36 | 21 | 22 | 110(25.9) | |
| 淋巴结转移 | <0.005 | |||||||
| N0 | 251 | 193 | 19 | 11 | 19 | 9 | 58(23.1) | |
| N1 | 322 | 238 | 22 | 26 | 16 | 20 | 84(26.1) | |
| N2 | 168 | 130 | 12 | 15 | 5 | 6 | 38(22.6) | |
| N3 | 70 | 53 | 3 | 6 | 6 | 2 | 17(24.3) | |
| 远处转移 | <0.005 | |||||||
| 有 | 89 | 55 | 11 | 13 | 6 | 4 | 34(38.2) | |
| 无 | 686 | 523 | 38 | 51 | 40 | 34 | 163(23.8) |
本课题组前期对同组胃癌病例进行了Her-2和表皮生长因子受体(epidermal growth factor receptor, EGFR)蛋白检测, 发现胃癌组织中存在Her-2和EGFR蛋白过表达[5,6], 将本研究中胃癌VEGF蛋白表达与前期同组胃癌病例Her-2、EGFR蛋白表达进行关联性检验分析发现, VEGF与Her-2、EGFR蛋白的过表达均无相关性(P>0.05, 表2, 3).
| Her-2 | VGFR | 合计 | |
| + | - | ||
| + | 23 | 65 | 88 |
| - | 174 | 513 | 687 |
| 合计 | 197 | 578 | 775 |
| EGFR | VGFR | 合计 | |
| + | - | ||
| + | 40 | 92 | 132 |
| - | 157 | 486 | 643 |
| 合计 | 197 | 578 | 775 |
VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(placenta growth factor, PLGF), 其中VEGF-A是最主要的血管生成因子, 能增加血管通透性, 促进血管内皮细胞分裂增殖, 抑制凋亡, 诱导蛋白酶降解细胞外基质和细胞间连接, 促进肿瘤细胞转移[7,8]. VEGF-C和VEGF-D可与VEGFR-3结合, 诱导VEGFR-3酪氨酸酶磷酸化, 导致新生淋巴管生成, 促进肿瘤细胞通过淋巴道转移[9]. 研究发现胃癌中存在VEGF-A、VEGF-C和VEGF-D的过表达, 并与癌组织血管密度增高、血管侵犯、淋巴结转移、及远处转移有关[10-13].
本研究显示胃癌组织VEGF阳性表达率为25.42%, VEGF蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、组织类型及分化程度无相关性, 这与相关报道基本一致[14,15]. 国内外研究显示, VEGF过表达和胃癌血管生成、淋巴结转移以及胃癌发展密切相关, 并且VEGF表达阳性患者较阴性患者的预后差[14,16]; Fondevila等[14]研究显示, VEGF的阳性表达与TNM分期、组织类型、浸润深度、淋巴结转移、远处转移等预后参数相关, VEGF的阳性表达患者的复发率明显高于阴性患者(40% vs 20%), 并且VEGF的阳性表达与微血管密度(microvessel density, MVD)密切相关. 赵向阳等[16]报道VEGF的表达不但与肿瘤的分化程度、TNM分期、淋巴结的转移、浸润程度有关, 而且与MVD和基质金属蛋白酶-10(matrix metalloproteinase 10, MMP-10)的过表达呈正相关. Lieto等[3]研究发现, VEGF的表达与浸润深度、TNM分期、淋巴结转移及远处转移密切相关, 并且VEGF阳性表达患者5年生存率较阴性表达患者低(30% vs 79%); 同组病例EGFR阳性表达患者5年生存率较阴性表达患者低(40% vs 73%); VEGF与EGFR表达均阳性的患者较VEGF或EGFR之一阳性或均阴性的患者预后差. 我们的研究证实胃癌组织VEGF、EGFR及Her-2过表达与浸润深度、淋巴结转移等密切相关, 那么VEGF与EGFR、Her-2蛋白的表达是否具有相关性? 关联性检验分析显示VEGF与EGFR、Her-2蛋白的表达并无相关性, 这可能是由于三者通过不同的作用机制在胃癌的发生发展、浸润转移中发挥作用, 从而使两者在胃癌中的过表达无相关性, 具体机制尚需进一步研究. 以上临床资料显示VEGF、EGFR及Her-2在胃癌中均存在过表达且与淋巴结转移等临床预后相关参数密切相关, 初步表明VEGF、EGFR及Her-2促进了胃癌的浸润转移, 是胃癌患者预后的独立参考指标.
VEGF可诱导血管内皮细胞增殖, 促进新生血管形成, 增加血管通透性, 为肿瘤的侵袭、转移提供了条件[17], 同时针对VEGF为靶点的靶向药物也为胃癌治疗提供了新的思路. 以VEGF为靶点的靶向治疗药物主要包括: 人源化抗VEGF单克隆抗体, 如贝伐单抗(bevacizumab); 嵌合性抗VEGF受体(vascular endothelial growth factor receptor, VEGFR)胞外区的单克隆抗体, 如 IMC-1C11; 以及针对VEGFR的酪氨酸激酶抑制剂, 如SU5416, SU6668和ZD6474.
贝伐单抗为重组人源化抗VFGF单克隆抗体, 2004年获美国食品药品管理局批准上市, 对VEGF的识别和结合有高度特异性, 与VEGF结合可阻止或减弱VEGF与血管内皮细胞受体(Fit-1和KDR)的结合, 从而抑制内皮细胞增生和新生血管形成, 起到抗肿瘤作用. 目前, 贝伐单抗在转移性结肠、直肠癌中配合化学治疗已作为一线治疗药物[18], 而贝伐单抗在胃癌方面的研究尚处Ⅱ期临床试验阶段. Shah等[19]进行了贝伐单抗联合伊立替康、顺铂治疗晚期胃癌及贲门癌患者的Ⅱ期临床试验, 在34例可评疗效的患者中治疗的总缓解率为65%, 中位生存期为12.3 mo, 而且与顺铂、依立替康联合用药并未增加化学治疗相关的不良反应. Su5416是一种新合成的VEGFR FLK-1/KDR酪氨酸激酶抑制物, 可明显抑制酪氨酸激酶活化, 阻止肿瘤新生血管形成, 在Su5416联合依立替康治疗晚期结直肠癌的Ⅰ期临床试验中获得一定的临床疗效[20], 但关于Su5416在胃癌中的治疗尚未见临床报道. 另外, SU6668与ZD6474在临床前期的研究中也显示出一定的效果[21,22].
胃癌患者靶向药物如贝伐单抗的应用可能成为趋势, 而靶向药物的应用有赖于可靠的筛选方法. 免疫组织化学法是最常用于检测VEGF蛋白表达的方法, 但免疫组织化学法往往受到抗体浓度, 抗原修复方式、显色方式等方面的影响; 目前, 荧光原位杂交(fluorescence in situ hybridization, FISH)方法已成为病理学新的诊断工具, 使得病理学家能够在形态学背景上清晰地观察到基因扩增, 从而获得与组织形态学相融合的基因表达谱[23]. 与免疫组织化学法相比, FISH具有高稳定性、高准确性和高灵敏性的特点, 能避免假阳性和假阴性结果的出现, 因而应用FISH检测基因扩增被公认为检测基因表达的金标准. 目前, FISH已应用于检测乳腺癌、肝细胞肝癌等肿瘤组织Her-2、VEGF基因扩增情况[24,25]. 在本课题组后续研究中, 我们拟将经免疫组织化学法证实VEGF蛋白表达阳性的病例, 应用FISH检测VEGF基因扩增情况, 并分析与免疫组织化学法检测的相关性, 进一步探索胃癌VEGF过表达的机制, 并为临床选取针对VEGF抗体的靶向药物提供更直接的理论依据.
胃癌是最常见的恶性肿瘤之一, 居消化系肿瘤之首. 大部分胃癌患者在诊断时已属晚期, 治疗效果不理想, 需寻求新的治疗方法以提高疗效是临床的迫切需要.
王鲁平, 主任医师, 中国人民解放军北京军区总医院病理科
关于VEGF与肿瘤的关系, 多数研究集中在转移性结直肠癌上, 目前国内未见有关VEGF与胃癌关系的大宗病例研究.
Fondevila等研究显示, VEGF的阳性表达与TNM分期、组织类型、浸润深度、淋巴结转移、远处转移等预后参数相关, VEGF的阳性表达患者的复发率明显高于阴性患者(40% vs 20%).
本文采用大宗病例研究, 综合分析了VEGF与胃癌生物学行为及预后的关系, 以期为胃癌靶向治疗提供理论依据.
本研究采用免疫组织化学的方法检测VEGF蛋白在胃癌组织的表达情况, 拟为临床治疗胃癌选取针对EGFR的靶向药物和预后判断提供参考依据.
本文新颖性一般, 材料丰富, 对治疗胃癌有一定的临床指导意义.
编辑 曹丽鸥 电编 何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Yancopoulos GD, Davis S, Gale NW, Rudge JS, Wiegand SJ, Holash J. Vascular-specific growth factors and blood vessel formation. Nature. 2000;407:242-248. [PubMed] [DOI] |
| 3. | Lieto E, Ferraraccio F, Orditura M, Castellano P, Mura AL, Pinto M, Zamboli A, De Vita F, Galizia G. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008;15:69-79. [PubMed] [DOI] |
| 4. | 段 伦喜, 钟 德午, 胡 辅珍, 赵 华, 杨 竹林, 易 文君, 舒 国顺, 华 颂文. 胃癌组织VEGF, Flt1, bFGF, p53表达与胃癌预后的关系. 世界华人消化杂志. 2004;12:546-549. [DOI] |
| 5. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 6. | 刘 伟, 余 英豪, 陈 娟, 熊 喜生, 欧阳 学农, 王 烈, 武 一曼. EGFR在中国胃癌患者中的表达及其临床意义. 世界华人消化杂志. 2010;18:2648-2653. [DOI] |
| 7. | Pan Q, Chanthery Y, Liang WC, Stawicki S, Mak J, Rathore N, Tong RK, Kowalski J, Yee SF, Pacheco G. Blocking neuropilin-1 function has an additive effect with anti-VEGF to inhibit tumor growth. Cancer Cell. 2007;11:53-67. [PubMed] [DOI] |
| 8. | Roskoski R. Vascular endothelial growth factor (VEGF) signaling in tumor progression. Crit Rev Oncol Hematol. 2007;62:179-213. [PubMed] [DOI] |
| 9. | Su JL, Yen CJ, Chen PS, Chuang SE, Hong CC, Kuo IH, Chen HY, Hung MC, Kuo ML. The role of the VEGF-C/VEGFR-3 axis in cancer progression. Br J Cancer. 2007;96:541-545. [PubMed] [DOI] |
| 10. | Gretschel S, Astrosini Ch, Vieth M, Jöns T, Tomov T, Höcker M, Schlag PM, Kemmner W. Markers of tumour angiogenesis and tumour cells in bone marrow in gastric cancer patients. Eur J Surg Oncol. 2008;34:642-647. [PubMed] [DOI] |
| 11. | Miyamoto N, Yamamoto H, Taniguchi H, Miyamoto C, Oki M, Adachi Y, Imai K, Shinomura Y. Differential expression of angiogenesis-related genes in human gastric cancers with and those without high-frequency microsatellite instability. Cancer Lett. 2007;254:42-53. [PubMed] [DOI] |
| 12. | Yonemura Y, Endo Y, Tabata K, Kawamura T, Yun HY, Bandou E, Sasaki T, Miura M. Role of VEGF-C and VEGF-D in lymphangiogenesis in gastric cancer. Int J Clin Oncol. 2005;10:318-327. [PubMed] [DOI] |
| 13. | Onogawa S, Kitadai Y, Amioka T, Kodama M, Cho S, Kuroda T, Ochiumi T, Kimura S, Kuwai T, Tanaka S. Expression of vascular endothelial growth factor (VEGF)-C and VEGF-D in early gastric carcinoma: correlation with clinicopathological parameters. Cancer Lett. 2005;226:85-90. [PubMed] [DOI] |
| 14. | Fondevila C, Metges JP, Fuster J, Grau JJ, Palacín A, Castells A, Volant A, Pera M. p53 and VEGF expression are independent predictors of tumour recurrence and survival following curative resection of gastric cancer. Br J Cancer. 2004;90:206-215. [PubMed] [DOI] |
| 17. | Harlozinska A. Progress in molecular mechanisms of tumor metastasis and angiogenesis. Anticancer Res. 2005;25:3327-3333. [PubMed] |
| 18. | Koyama M, Murata A, Kimura Y, Sakamoto Y, Morohashi H, Kimura N, Gasa F, Sato J, Terui K, Awatsu A. [Bevacizumab in combination with mFOLFOX6 or FOLFIRI for previously treated metastatic colorectal cancer]. Gan To Kagaku Ryoho. 2010;37:1069-1073. [PubMed] |
| 19. | Shah MA, Ramanathan RK, Ilson DH, Levnor A, D'Adamo D, O'Reilly E, Tse A, Trocola R, Schwartz L, Capanu M. Multicenter phase II study of irinotecan, cisplatin, and bevacizumab in patients with metastatic gastric or gastroesophageal junction adenocarcinoma. J Clin Oncol. 2006;24:5201-5206. [PubMed] [DOI] |
| 20. | Hoff PM, Wolff RA, Bogaard K, Waldrum S, Abbruzzese JL. A Phase I study of escalating doses of the tyrosine kinase inhibitor semaxanib (SU5416) in combination with irinotecan in patients with advanced colorectal carcinoma. Jpn J Clin Oncol. 2006;36:100-103. [PubMed] [DOI] |
| 21. | Tokuyama J, Kubota T, Saikawa Y, Yoshida M, Furukawa T, Otani Y, Kumai K, Kitajima M. Tyrosine kinase inhibitor SU6668 inhibits peritoneal dissemination of gastric cancer via suppression of tumor angiogenesis. Anticancer Res. 2005;25:17-22. [PubMed] |
| 22. | McCarty MF, Wey J, Stoeltzing O, Liu W, Fan F, Bucana C, Mansfield PF, Ryan AJ, Ellis LM. ZD6474, a vascular endothelial growth factor receptor tyrosine kinase inhibitor with additional activity against epidermal growth factor receptor tyrosine kinase, inhibits orthotopic growth and angiogenesis of gastric cancer. Mol Cancer Ther. 2004;3:1041-1048. [PubMed] |
| 23. | 官 兵, 周 晓军. 个体化医疗时代诊断病理学面临的机遇和挑战. 临床与实验病理学杂志. 2010;26:255-257. |
| 24. | Schoppmann SF, Tamandl D, Roberts L, Jomrich G, Schoppmann A, Zwrtek R, Dubsky P, Gnant M, Jakesz R, Birner P. HER2/neu expression correlates with vascular endothelial growth factor-C and lymphangiogenesis in lymph node-positive breast cancer. Ann Oncol. 2010;21:955-960. [PubMed] [DOI] |
| 25. | Chiang DY, Villanueva A, Hoshida Y, Peix J, Newell P, Minguez B, LeBlanc AC, Donovan DJ, Thung SN, Solé M. Focal gains of VEGFA and molecular classification of hepatocellular carcinoma. Cancer Res. 2008;68:6779-6788. [PubMed] [DOI] |